Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.21 no.2 Ciudad de México abr. 2010
Química en microescala
Un clásico de Química Orgánica en microescala y con fricción: la reacción de Cannizzaro
A Classic of Organic Chemistry in microscale and with friction: Cannizzaro reaction
Álvaro Melgar, Cristina Enríquez, Grethel Mendoza, Lilia Fernández, María E. Elorza1
1 Universidad Autónoma Metropolitana Unidad Azcapotzalco, Departamento de Ciencias Básicas, División de C.B.I. Av. San Pablo No 180, Col. Reynosa Tamaulipas, 02200 Azcapotzalco, DF. Correo electrónico: lili1104@hotmail.com
Fecha de recepción: 13 de enero 2009.
Fecha de aceptación: 13 de julio 2009.
Resumen
El objetivo de este trabajo es presentar una reacción orgánica con una técnica no convencional como lo es la triboquímica en fase heterogénea libre de disolvente y en microescala. No se utilizaron disolventes y el tiempo de reacción se redujo de una hora, en el procedimiento tradicional, a únicamente un minuto. En la reacción de Cannizzaro el uso de la triboquímica (mecanoquímica), la técnica de Microescala y la síntesis libre de disolvente presentan ventajas con respecto a la técnica tradicional.
Abstract
In this work, the Cannizaro reaction was performed using friction (tribochemistry) and microscale techniques. No solvent was needed and the reaction time was lowered from 1 h for the traditional procedure to 1 minute. The reaction described here proceeds simply by stirring, the products form a gel of sodium benzoate and benzylic alcohol, which are separated using a non-chlorinated solvent in the same system of reaction, increasing the recovery. The crystals of the benzoic acid produced are dried in a household-type microwave oven for 1 minute. As in all the processes in small scale, there is a savings of supplies and reduction of residues. The tribochemical procedure used led to solvent savings, procedural simplification, lowering of costs and making a more ecological process.
Keywords: microscale, tribochemistry, Cannizzaro reaction, microwave oven, green chemistry.
Introducción
El objetivo de este trabajo es presentar una reacción orgánica con una técnica no convencional como lo es la triboquímica en fase heterogénea libre de disolvente y en microescala. La reacción de Cannizzaro es un clásico de oxidación-reducción en aldehídos sin hidrógenos alfa, en donde los productos tradicionalmente se obtienen después de refluir los reactivos inmiscibles por ejemplo hidróxido de sodio acuoso y benzaldehído líquido durante 1 hora (Tapia, 1993). La inmiscibilidad ocasiona un área de contacto pobre entre los reactivos y por consiguiente un largo tiempo de reacción que resulta un problema en los cursos de química experimental en donde los estudiantes cuentan con un determinado tiempo para realizar el trabajo.
La experimentación de "Química Verde en Microescala" de Kenneth Doxsee y María del Carmen Doria en la Universidad Iberoamericana Unidad Santa Fe (Doxsee, 2003), dio la idea a los autores de este artículo a realizar alguna síntesis efectuada en los laboratorios de la Universidad Autónoma Metropolitana Azcapotzalco, aplicando los principios de la Química Verde (Anastas, 1998), considerando disminuir el tiempo de reacción y se seleccionó la reacción de Cannizzaro. La metodología desde entonces desarrollada ha seguido adaptándose (Mendoza, 2007) para dar los resultados de la tabla 1, en el apartado de datos y resultados.
Antecedentes
La reacción de Cannizzaro se encuentra descrita en la literatura con procedimientos de síntesis diferentes. Técnicas recientes utilizan ultrasonido (Entezari, 2000; Ahluwalia, 2006), catalizadores (Pourjavadi, 2002) y/u horno de microondas (Rajender, 1998; Subba, 2002).
Sin embargo la reacción aquí descrita puede prescindir de catalizadores, ultrasonido, microondas, disolvente o calor haciendo el proceso barato y sencillo (Phonchaiya, 2009; Kazuhiro, 2001) si se aplica un proceso triboquímico el cual puede disminuir el tiempo de reacción (Hixson, 1931) al poner en contacto intenso las fases inmiscibles. La reacción tradicional tiene el inconveniente de poner a los reactivos en fases inmiscibles acuosa (hidróxido de sodio acuoso) y orgánica (benzaldehído líquido), con poca superficie de contacto, lo cual hace la síntesis lenta (1 h). Los reactivos emulsionados pasan a formar un gel como producto a través de un proceso de sustitución nucleofílica (mediante un mecanismo tetraedral) para formar el intermediario de la reacción de Cannizzaro.
En este proceso triboquímico no se emplea disolvente. Los reactivos forman una suspensión de partículas de hidróxido de sodio pulverizado en la fase líquida benzaldehído, dando con la agitación los productos gelificados (figura 1).

En la separación de los productos con la técnica convencional se parte de un matraz tipo pera, equipo de vidrio con gran superficie, observándose que una cierta cantidad de producto gelificado queda en el matraz. Esto lleva a proponer la síntesis y extracción de los productos en un tubo de ensayo (sistema de reacción en microescala) con el objetivo de aumentar la recuperación. En la extracción se utilizará un disolvente no clorado, el acetato de etilo, menos tóxico en su manejo y más compatible con el cuidado del medio ambiente que los disolventes clorados.
El secado de material de vidrio Pyrex y de sólidos cristalinos en el laboratorio de química con un horno de microondas común (Ensástiga, 2008), llevó a proponer el secado del ácido benzoico producido después de acidificar (y opcionalmente recristalizado) de la misma manera, para reducir a 1 o 2 minutos el tiempo empleado en una estufa tradicional.
Triboquímica
En los inicios del siglo pasado, W. Nernst clasificó los diferentes campos de la Química de acuerdo con el tipo de energía suministrada al sistema: termoquímica, electroquímica, fotoquímica, etc., y se le dio el nombre de mecanoquímica al campo en que la energía mecánica es la que promueve las reacciones. Dentro de este campo encontramos las reacciones triboquímicas —del griego fricción o frotamiento (Brostow, 2003)—, que son las que tienen lugar cuando los sólidos se someten a procesos de molienda y agitación de las fases. Estas reacciones pueden realizarse a temperatura ambiente. En una mezcla heterogénea sólido-líquido, la pulverización del reactivo sólido crea pequeñas partículas cuyas áreas superficiales sumadas forman una gran superficie, que a través de una agitación con la fase inmiscible, se dispersan en ella aumentando el área interfacial o índice de mezclado (Hixson, 1944); con ello logran una buena transferencia de masa y calor, por lo que la reacción procede entonces a una gran velocidad (Hixson, 1931). Este aumento de velocidad se atribuye a la formación de estructuras de alta energía por la fricción entre las interfases deslizantes provocando estiramientos cuasiestáticos (reversibles) de los enlaces y una alta energía de vibración de los átomos de los reactivos en contacto, lo que propicia la ruptura de los enlaces activos para la formación de los enlaces de los productos (Muratov, 1998). En las reacciones exotérmicas la agitación propicia el desprendimiento de calor y, por ende, el aumento en su velocidad de reacción.
Procedimiento experimental
En un tubo de ensayo poner 1 mL (1.05 g) de benzaldehído, colocarlo en un baño de hielo y añadir un poco más de 0.2 g de hidróxido de sodio no muy pulverizado, agitar lentamente con una varilla de vidrio, aproximadamente un minuto. Se forma un sólido blanco (gel), añadir 1 mL de agua y 1 mL de acetato de etilo, agitar y dejar reposar. Con una pipeta Beral separar el alcohol bencílico que se encuentra en la capa superior (fase orgánica) y colocar en un segundo tubo de ensayo, realizar dos extracciones más con 1 mL de acetato de etilo cada vez.
Recuperación del alcohol bencílico
Adicionar sulfato de sodio anhidro al segundo tubo con la fase orgánica, agitar y dejar reposar. Decantar la fase orgánica a un tercer tubo con tapón y tubo en ángulo2 (Obendrauf, 2002) (figura 2).Agregar una perla de ebullición y evaporar el acetato usando un baño de aire caliente (parrilla o pistola de aire caliente).
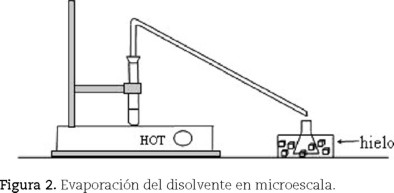
El acetato destila antes que el alcohol bencílico (Tob = 77.1oC y 179oC, respectivamente). Medir el volumen del alcohol bencílico (crudo).
Recuperación del ácido benzoico
Agregar al primer tubo con la fase acuosa, 14 gotas de HCl concentrado (o más si es necesario) hasta la precipitación total del ácido benzoico (pH = 4). Recristalizar y filtrar sobre papel filtro previamente pesado. Doblar el papel filtro como un sobre (para evitar proyecciones), colocarlo en un vidrio de reloj, introducirlo en el horno (en la menor potencia) con un vaso de 500 mL invertido sobre el vidrio, activar el microondas durante 15 segundos, esperar un poco para repetir el secado tres veces más o las necesarias para el secado total en períodos de 15 segundos; el secado continuo puede quemar el papel filtro. O secar al vacío. Pesar, registrar el peso y calcular el rendimiento.
Caracterización del ácido benzoico
A) Tomar el punto de fusión que debe ser de 122°C.3
B) Determinación por cromatografía en capa fina. Disolver unos cristales del ácido benzoico obtenido en 1 mL de acetato de etilo, obtener otra solución con ácido benzoico comercial. Correr una placa con una solución 7:3 de hexano-acetato de etilo y revelar en cámara de yodo o con luz UV. Registrar el Rf ≈ 0.35.
Caracterización del alcohol bencílico
A) Determinación por cromatografía en capa fina. Disolver unas gotas de alcohol bencílico en 1 mL de acetato de etilo. Correr una placa contra benzaldehído y alcohol bencílico comercial, usando como fase móvil una solución 7:3 de hexanoacetato. Revelar con luz UV o cámara de yodo. Registrar el Rf ≈ 0.52.
Datos y resultados
En la tabla 1 se registran los datos y resultados de la reacción de Cannizzaro realizada con benzaldehído e hidróxido de sodio.
Discusión de resultados
Por el método no convencional de síntesis triboquímica, mezclando el benzaldehído con hidróxido de sodio pulverizado, sin disolvente y agitando a temperatura ambiente la reacción ocurre en 1 minuto; esto se debe al gran aumento del contacto de la fase sólida pulverizada con la fase líquida del benzaldehído ya que no hay disolvente de por medio.
La agitación que establece una fricción entre las fases inmiscibles tiene dos funciones:
a) propiciar estiramientos en los enlaces para su apertura al ataque nucleofílico de la base y el rompimiento del enlace carbono-hidrógeno a una gran velocidad.
b) la agitación ayuda a liberar el calor producido por la reacción exotérmica. Realizar la reacción de Cannizzaro a temperatura ambiente favorece la velocidad de la reacción con respecto a la técnica donde se suministra calor para refluir los reactivos, lo que desfavorece el proceso exotérmico.
En la técnica triboquímica y en microescala se obtiene un rendimiento aproximado del 80%, superior al de la técnica tradicional,que es de 20% (principio 2 de la Química Verde), ya que la técnica aquí descrita permite una mejor y más simple separación de los productos in situ.
El cambio de cloruro de metileno por acetato de etilo en la extracción hace al proceso menos contaminante a la salud y al ambiente (principio 5 de la Química Verde). Las placas cromatográficas se corrieron con eluyente hexano-acetato en lugar del cloroformo, que se sospecha cancerígeno y daña la capa de ozono (principios 1 y 5 de la Química Verde).
Casi no se percibe el olor del benzaldehído durante la síntesis como en la técnica tradicional. Se emplean menos materiales y reactivos.
El proceso triboquímico elimina gasto energético y de costo en la síntesis ya que se lleva a cabo a temperatura ambiente y sin disolvente; también hay ahorro de energía y de tiempo en el secado de los cristales del ácido benzoico al emplear el horno de microondas (principios 5 y 6 de la Química Verde).
La reducción del tiempo de reacción de 60 a 1 minuto puede ser aprovechada para lograr una mejor purificación y caracterización de los productos, así como para discutir los resultados y alcanzar los objetivos de la práctica en el tiempo establecido. El alumno podrá reportar los rendimientos en la misma sesión y no esperar a que los productos sequen para una clase posterior.
El tiempo de reacción es menor que el reportado por Phonchaiya et al. (2009), que es de 30 minutos, ya que usan la base en lentejas (pellets) y no pulverizada, por lo que el índice de mezclado es menor y la reacción más lenta. Además, los compuestos clorados 2-clorobenzaldehído y los productos ácido 2-clorobenzoico y alcohol 2-clorobencílico son más contaminantes al medio ambiente y de mayor riesgo a la salud (corrosivos) que los no clorados 8-benzaldehído, alcohol bencílico y ácido benzoico), los cuales ocurren en la naturaleza (The Merck Index, 1989). La Química Verde recomienda utilizar materias primas y/o obtener sustancias de menor impacto ambiental en las síntesis (principio 10 de la Química Verde).
Es posible que el aumento en la velocidad de reacción al pulverizar la base se deba a que la reacción es de orden 2, de acuerdo con la propuesta de March. El grupo carbonilo puede sufrir adición con una base OH-, a través de un mecanismo bimolecular (tetraedral) o unimolecular (Sn1) (March,1985); en la tabla 1 el tiempo de reacción en la experiencia 3 es de 4 minutos y la base fue usada en lentejas; en las experiencias 4 y 5 el tiempo es de 1 minuto y la base fue pulverizada. El aumento en la superficie de contacto en la reacción heterogénea y la disminución del tiempo de reacción (aumento de rapidez), confirma que la base forma parte de la ley de velocidad (Brown, 1998) en la reacción de Cannizzaro.
La similitud con el gel alcohol sólido (acetato de calcio y alcohol etílico), hace suponer que los productos forman un gel, en donde la fase dispersante es el benzoato de sodio y la dispersa el alcohol bencílico. En la figura 3 se muestra el mecanismo de la formación del gel de la reacción de Cannizzaro.
Observaciones
El ácido benzoico (Estrada, 2000) y el alcohol producido en la reacción de Cannizzaro pueden utilizarse como reactivos en otras prácticas de laboratorio.
El uso de un horno de microondas común en el secado de algunos sólidos cristalinos es una técnica útil en laboratorios en donde no se cuenta con sistema de vacío y el secado se logra en menos tiempo que en una estufa, es necesario usar el microondas en la más baja potencia.
Los procesos triboquímicos no sólo son aplicables a síntesis de laboratorio (microescala o escala convencional), sino que pueden ser empleados en procesos industriales haciéndolos más económicos y ecológicos.
Entre los procesos que han sido estudiados mecanoquímicamente pueden mencionarse los siguientes:
1. Transformaciones de fases en sólidos polimórficos.
2. Formación de soluciones sólidas.
3. Intercambios iónicos.
4. Formación de complejos.
5. Reacciones de oxidación–reducción.
6. Reacciones ácido–base.
7. Amorfización de polímeros.
Con la reacción de Cannizzaro presentada en este artículo la lista de reacciones triboquímicas puede ampliarse a nueve procesos al incluir las:
8. Reacciones de sustitución y adición en el grupo carbonilo.
9. Reacciones triboquímicas para la obtención de un gel.
Conclusiones
En la reacción de Cannizzaro el uso de la triboquímica (mecanoquímica), la técnica de microescala y la síntesis libre de disolvente presentan ventajas con respecto a la técnica tradicional.
Bibliografía
Ahluwalia, V. K., Sonochemistry: The Use of Ultrasound in Organic Synthesis.In:Ahluwalia,V.K.y Aggarwal,R.(editors), Organic Synthesis: Special Technique (pp. 136), San Rafael, CA, USA: Alpha Science International Ltd, 2006. [ Links ]
Anastas, P.T., Warner, J.C., Green Chemistry: Theory and Practice; New York, U.S.A.: Oxford University Press, 1998. [ Links ]
Brostow, W., Deborde, J-L., Jaklewicz, M. y Olszynski, P., Tribología con énfasis en polímeros: Fricción, Resistencia al rayado y al desgaste, Journal of Materials Education, 24 (4-6),119-132, 2003. [ Links ]
Brown, T. L., Cinética Química: El área superficial de los reactivos o catalizadores sólidos o líquidos. En: Brown, T. L., Le-May, H. E., Jr., y Bursten, B. E. (editores), Química: La Ciencia Central (pp. 491), Naucalpan de Juárez, México: Pearson Educación, 1998. [ Links ]
Doxsee, M. K. y Doria, M. C., Manual de Prácticas de Química Verde, Taller de Química Verde, Universidad Iberoamericana Unidad Santa Fe. Julio 2003. [ Links ]
Doxsee, M. K. y Hutchison, E. J., Green Organic Chemistry, Strategies, Tools and Laboratory Experiments,Oregon,USA: Ed. Thompson, 2003. [ Links ]
Ensástiga, Á. C., Fernández, S. L. y Corral L. E., Secado de material de vidrio Pyrex y sustancias químicas cristalinas, en un horno de microondas común, Memorias de la XXI Semana de la Docencia e Investigación en Química, 6ª sesión técnica, Universidad Autónoma Metropolitana Azcapotzalco, México, D.F., octubre 2008. [ Links ]
Entezari, M. H. y Shameli, A. A., Phase-transfer catalysis and ultrasonic waves Cannizzaro reaction, Ultrasonics Sonochemistry, 7(4), 169-172, 2000. [ Links ]
Estrada, G. D., Prácticas 3. Equilibrio Líquido-Vapor y 7. Solubilidad. En: Estrada, G. D., Múgica, A. V., Barceló, Q. I., Solís, C. H., Holguín, Q. S. y Torres R. M. (editores), Prácticas de Laboratorio de Fisicoquímica de los Materiales (pp. 21-29 y 59-66), México, Méx.: Universidad Autónoma Metropolitana Azcapotzalco, Departamento de Ciencias Básicas, 2008, [versión electrónica] en Ciencias Básicas e Ingeniería,Curso CBI091-6 Laboratorios de Química, Manual-Fisicoquímica de los Materiales, consultada por última vez en julio 11, 2009, en la URL http://aulavirtual.azc.uam.mx [ Links ]
Hixson, A. W. y Crowell, J. H., Dependence of Reaction Velocity upon Surface and Agitation, Industrial and Engineering Chemistry, 23, 923-931, 1931. [ Links ]
Hixson, A. W., Agitation and Mixing-Nature and Measure of Agitation, Industrial and Engineering Chemistry, 36(6), 487-496, 1944. [ Links ]
Kazuhiro, Y., Shinji, T. y Fumio, T., Solvent-Free Claisen and Cannizzaro reactions, Tetrahedron Letters, 42(45), 79-83, 2001. [ Links ]
March, J., Reactions. In: March, J. (editor), Advanced organic chemistry: reactions, mechanisms, and structure (pp. 334-336), New York, U.S.A.: Wiley-Interscience, 1985. [ Links ]
Mendoza, G. G.; Elorza, G. M. E.; Enriquez, R. C.; Fernández, S. L. y Melgar, C. A., Un clásico de Química Orgánica a microescala y con la técnica de fricción "La Reaccion de Cannizaro", Memorias de la XX Semana de la Docencia e Investigación en Química, 4ª sesión técnica, Universidad Autónoma Metropolitana Azcapotzalco, México, D.F., octubre 2007. [ Links ] Versión electrónica en: Vinculación, I Semana Nacional y XXII Semana de la Docencia e Investigación en Química-UAM, Memorias del Evento, Memoria-2007 (pp. 272-277), consultada por última vez en julio 11, 2009, de la URL http://ecolaboracion.azc.uam.mx [ Links ]
Muratov, V. A., Luangvaranunt, T., y Fischer, T. E., The tribochemistry of silicon nitride: effects of friction, temperature and sliding velocity, Tribology Internacional, 31(10), 601-611, 1998. [ Links ]
Obendrauf, V., Taller de Química Instantánea, Universidad Iberoamericana Unidad Santa Fe, mayo de 2002. [ Links ]
Phonchaiya, S., Panijpan, B., Rajviroongit, S., Wright, T. y Blanchfield, J. T., A facile Solvent-Free Cannizzaro Reaction, Journal of Chemical Education, 86(1), 85-86, 2009. [ Links ]
Pourjavadi, A., Soleimanzadeh, B. y Bagheri, M.G., Microwave-induced Cannizzaro reaction over neutral γ-alumina as a polymeric catalyst, Reactive and Functional Polymers, 51(1), 49-53, 2002. [ Links ]
Rajender, S. V., Kannan, P. N. y Per, J. L., Microwave-accelerated crossed Cannizzaro reaction using barium hydroxide under solvent-free conditions, Tetrahedron Letters, 39(46), 8437-8440, 1998. [ Links ]
Subba Reddy B. V., Srinivas R., Yaday J. S. y Ramalingam T., KF-Al2O3 Mediated Cross-Cannizzaro Reaction Under Microwave Irradiation, Synthetic Communications, 32(2), 219-223, 2002. [ Links ]
Tapia, C. J., Práctica 7. Reacción de Cannizzaro. En: Tapia, C. J. (editor), Laboratorio de Química Orgánica II (pp. 30-33), México, Méx.: Universidad Autónoma Metropolitana Azcapotzalco, Departamento de Ciencias Básicas, 1993. Versión electrónica en: Ciencias Básicas e Ingeniería, Curso CBI091-6 Laboratorios de Química, Manual-Química Orgánica II, consultada por última vez en julio 11, 2009, en la URL http://aulavirtual.azc.uam.mx [ Links ]
The Merck Index, An Encyclopedia of Chemicals, Drugs and Biological, Rahway, N.J., U.S.A.: Merck & CO., Inc., 1989. [ Links ]
Notas
2 Somerset Educational, The MicroScience Catalogue 2000. Este catálogo vende equipo para microescala y en él se pueden ver los equipos de destilación o evaporación. Contacto: Somerset Educational. Teléfono: +27 (0) 42 243 2030. http://www.scienceinafrica.co.za/somerset.htm Correo electrónico: microscince@isat.co.za.
3 Aparato de punto de fusión de capilar y digital. Melt-Temp.














