Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Educación química
versión impresa ISSN 0187-893X
Educ. quím vol.19 no.4 Ciudad de México oct. 2008
Cómo se sintetiza
Síntesis sencilla de óxido de tungsteno(VI) a partir del filamento de un foco
Simple synthesis of tungsten(VI) oxide starting from a light bulb's filament
Valentín Dorantes-García,1 Joel Díaz-Reyes2 y Aarón Pérez-Benítez3
1 Preparatoria "Simón Bolívar". Benemérita Universidad Autónoma de Puebla.
2 CIBA-IPN. Ex-Hacienda de San Juan Molino, km. 1.5. Tepetilta, Tlaxcala. C.P. 90700.
3 Autor a quien debe dirigirse la correspondencia. Facultad de Ciencias Químicas. Benemérita Universidad Autónoma de Puebla. 14 Sur y Av. San Claudio. Col. San Manuel. 72570, Puebla, Pue. Buzón electrónico: aronper@siu.buap.mx
Recibido: 3 de julio de 2007;
aceptado: 23 de julio de 2008.
Abstract
Tungsten(VI) oxide can be easily synthesized starting from a standard light bulb. The reaction consists in the oxidation at high temperatures (T » 2000 - 3000° C) of a tungsten filament in presence of air; conditions which can be easily achieved by connecting a broken light bulb (but with its intact filament) to an AC-power supply of 110 volts. The vapor of WO3 is condensed into a beaker in a quantity enough to be characterized by infrared spectroscopy. The experiment is very funny, inexpensive and allows to the teacher to link several topics in current chemistry and physics of the tungsten oxides, such as their nomenclature and technological applications (i.e. electrochromic devices, gasochromic sensors, superalloys or as it is used in home: As a "simple" emisor of light!).
Key words: WO3, tungsten trioxide, tungsten(VI) oxide, wolfram(VI) oxide, electrical synthesis, light bulb, IR characterization.
Introducción
Hasta antes de la década de 1880, el tungsteno o wolframio, W, era muy poco conocido, pero se hizo muy común en la vida cotidiana a raíz del invento de la bombilla eléctrica por Tomás Alva Edison (figura 1).4
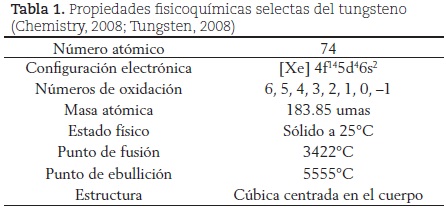
El tungsteno es un metal de color blanco grisáceo acerado y lustroso; es muy duro y denso, por lo que se usa en soldaduras, en aleaciones con diferentes metales, en bujías de encendido y en las puntas de algunos bolígrafos (Wolframio, 2008). No obstante, su principal aplicación es como emisor de luz en los focos, pues por sus propiedades fisicoquímicas (tabla 1) es el material idóneo para ser utilizado como resistencia en las bombillas eléctricas, pues tiene el punto de fusión más alto de todos los metales puros, la presión de vapor más baja a temperaturas altas y es inerte a los gases de llenado de la bombilla, a las temperaturas de operación del foco (Karukstis, 2000).
En la naturaleza se encuentra formando óxidos y sales; se encuentra por ejemplo en la wolframita (FeWO4/MnWO4), en la scheelita (CaWO4), en la ferberita (FeWO4) y la hubnerita (MnWO4) y escasamente en el sol, en los meteoritos y en el agua de mar (Tungsten - Wikipedia, 2008). Su importancia biológica ha quedado establecida en los últimos 10 años, pues se han descubierto enzimas que contienen tungsteno (L'vov, 2002; Seiffert, 2007; Sigel, 2002), y su importancia química se debe a la facilidad que tienen sus compuestos de coordinación para intercambiar ligantes, por lo que se han empleado como catalizadores en la síntesis de olefinas por metátesis (Astruc, 2005).
El tungsteno reacciona a temperaturas muy altas con muchos no-metales como el flúor, el cloro, el bromo, el boro, el carbono, el silicio, el nitrógeno y el oxígeno, formando principalmente aquellos derivados en los que el tungsteno tiene número de oxidación VI. Además, se han encontrado compuestos con enlaces intermetálicos W-W sencillos, dobles, triples y cuádruples, cuyas longitudes de enlace son 2.7, 2.6, 2.3 y 2.2 Å, respectivamente (Wiberg, 2001). Así, dada su gran importancia económica e industrial, es necesario mencionar que el mayor productor de tungsteno, con más de 75% de la producción a nivel mundial es China (Greenwood, 1997).
La nomenclatura del elemento químico número 74: ¡Una asignatura pendiente!
Los dos nombres que recibe este metal están directamente relacionados con el origen de su descubrimiento (Goya, 2005; Goya, 2008; Schufle, 1975; Weeks, 2003): En 1781, C.W. Scheele y T. O. Bergman aislaron el óxido de tungsteno(VI), WO3, a partir del mineral conocido como scheelita, pero no aislaron el metal puro. Ellos lo llamaron tungsten, un nombre que proviene de las palabras suizas tung y sten que significan piedra pesada.
Dos años más tarde, los españoles Juan José y Fausto De Elhuyar (figura 2a) lo aislaron a partir de la wolframita y lo denominaron wolframio (palabra que proviene del alemán wolfh's rahm que significa baba de lobo, que era como los mineros sajones llamaban a la wolframita5 (Wolframio, 2008)) o mejor dicho volframio, ya que hasta antes de 1914 no existía la letra w en el alfabeto español (Goya, 2005). No obstante que no existe ninguna duda en cuanto a la autoría del aislamiento del wolframio en forma pura, los ingleses y los franceses de esa época adoptaron el nombre de tungsteno para nombrarlo, en tanto que los alemanes respetaron el nombre de wolframio; hecho que ha traído hasta nuestros días, una doble nomenclatura para este elemento (Greenwood, 1997). Al respecto, en 1949 la IUPAC tomó la determinación de no aceptar el nombre de wolframio sino el de tungsteno y de mantener el símbolo W (figura 2b) (Holden, 2004). Esta "decisión salomónica" ha sido, por supuesto, justamente impugnada por los químicos españoles (Goya, 2005).
Tratando de investigar cuál de los dos nombres era el más usado por nuestros estudiantes, aplicamos un reactivo de exploración a 43 estudiantes de tercer cuatrimestre de licenciatura, de las carreras de QFB, químico y farmacia de la Facultad de Ciencias Químicas de la BUAP, consistente de dos preguntas abiertas que contestaron en un tiempo de 5-10 minutos. El objetivo de pedirles el nombre del óxido mismo en la pregunta 1 y su naturaleza química en la pregunta 2 fue el de distraer su atención del verdadero motivo del reactivo:
1. Escriba el nombre sistemático (IUPAC) del compuesto WO3.
2. Indique si el compuesto anterior puede clasificarse como un óxido ácido o como un óxido básico.
No obstante que se pidió a los alumnos que no hicieran uso de su tabla periódica, notamos que algunos de ellos sí lo hicieron, razón por la cual después de una rápida supervisión de los resultados arrojados por dicho reactivo (tabla 2) en los que apareció un tercer nombre: el de volframio, procedimos a verificar la fuente del mismo. Encontramos, para nuestra sorpresa, que los estudiantes poseen tablas periódicas en las que aparecen indistintamente uno de los tres nombres; es decir, tungsteno, wolframio y volframio, correspondiendo esta última opción al nombre originalmente publicado por los hermanos De Eluyhar en 1783 (De Eluyhar, 1783), lo cual significa evidentemente, que la decisión tomada por la IUPAC no ha resuelto la controversia y que deberíamos participar en el de bate que han abierto los españoles para llegar a un acuerdo internacional sobre el nombre de este elemento (Goya, 2005b). En la tabla 3 se presentan los nombres que los alumnos encuestados dieron al WO3, encontrándose tanto opciones de nomenclatura trivial como de nomenclatura sistemática en las que el estado de oxidación del tungsteno no es el correcto (ca. el 50%).
El funcionamiento de un foco y las causas de degradación de su filamento
En un foco o bombilla eléctrica ordinaria, la luz se genera cuando se hace pasar una corriente eléctrica que calienta el filamento de tungsteno hasta una temperatura cercana a los 3000° C. A esa temperatura, el tungsteno se calienta hasta el rojo vivo emitiendo corrientes termoiónicas (electrones que se desprenden de la superficie del metal) que percibimos en forma de luz y calor (Rajput, 2002).
El calentamiento y la emisión termoiónica del material se pueden explicar considerando las imperfecciones de su red cristalina, las cuales se deben a impurezas y/o defectos del cristal y a que la agitación térmica produce vibraciones (ondas mecánicas o fonones) y leves movimientos de las partículas que componen el sólido (Martínez, 2006). Los electrones que tratan de pasar por el sólido se friccionan y se colisionan con esas irregularidades provocando que el material se caliente y al mismo tiempo que se afecte la velocidad de translación de los electrones. A esa transformación de la energía eléctrica en energía calórica como producto de dicha interacción se le conoce como efecto Joule (Freites, 2006).
La emisión termoiónica no puede tener lugar por mucho tiempo en presencia de aire a presión atmosférica, pues el metal caliente tiende a combinarse químicamente con el oxígeno, provocando que el filamento se oxide, se degrade y se rompa rápidamente. Este problema se evita encerrando el filamento dentro de una bombilla de vidrio de boro silicato al vacío; pero esta solución tiene el inconveniente de que al disminuir la presión de los alrededores del filamento también se favorece su evaporación. Este nuevo problema se resuelve llenando ahora la bombilla con un gas o una mezcla de gases que no se combinan químicamente con el filamento a la temperatura de operación del foco; de hecho, en los focos comunes actuales se utiliza una mezcla de 15% de nitrógeno y 85% de argón porque son muy baratos; en cambio, en los focos de los semáforos se usa kriptón porque alarga muchísimo la vida útil de la lámpara aunque es mucho más caro.
A la emisión termoiónica en estas nuevas condiciones es a lo que se le conoce como incandescencia (figura 3a) o efecto Edison y de toda la energía irradiada sólo un 10-15% corresponde a luz visible y la restante cae en el rango de la región infrarroja. Este hecho que hace altamente ineficiente a la bombilla eléctrica estándar como emisora de luz, se aprovecha en ocasiones para calentar los refugios de las aves y de los reptiles domésticos.
Así, la investigación y el desarrollo tecnológico de la lámpara incandescente se han concentrado principalmente en el filamento y en la atmósfera interior de la bombilla. Por ejemplo, la forma en espiral del filamento ayuda a reducir la longitud que éste ocuparía en su forma extendida6 y al mismo tiempo concentra el calor y favorece la condensación de gran parte del tungsteno evaporado en el interior de la espiral. Sin embargo el tungsteno no se condensa en el mismo lugar del que se evaporó, sino que va formando cristales de tungsteno puro (figura 3d) en diferentes sitios de la superficie del filamento dejando otras partes más delgadas en las que la resistencia del filamento disminuye y a la postre se rompe, interrumpiendo con ello el paso de la corriente eléctrica y la vida útil del foco (Kamlesh, 2006).
Otra parte del tungsteno que se evapora es acarreada por las corrientes de convección del gas de llenado, hasta la pared interna de la bombilla, en donde se condensa ennegreciendo la pared (figura 3b-derecha) y disminuyendo la luminosidad del foco. La degradación del filamento se incrementa por la presencia de trazas de oxígeno, hidrógeno y vapor de agua que no alcanzan a eliminarse del interior de la bombilla y que reaccionan con el tungsteno a temperaturas altas. También reaccionan con el tungsteno, los óxidos y las grasas que contengan las partes internas del foco y el filamento mismo.
La reacción con agua da lugar a lo que se le conoce como el ciclo del agua, mediante el cual el vapor de agua que entra en contacto con el filamento caliente produce hidrógeno y óxidos de tungsteno. Los óxidos de tungsteno que son volátiles a la temperatura de operación del foco se condensan en las zonas más frías. Cabe señalar que el tipo de óxido formado depende de la temperatura de reacción. Por ejemplo a temperaturas entre 700° C y 1200° C se forma WO2; por arriba de 900°C ocurre la volatilización vía el trióxido de tungsteno monohidratado, WO3·H2O; a temperaturas entre 1580 y 3200° C se forman WO, WO2, WO3, (WO3)2, (WO3)3 y (WO3)4; de los cuales el trímero y el tetrámero se forman entre 2200° C y 3200° C (Lassner, 1999, p. 88). Por otro lado, los mecanismos de formación de los óxidos de tungsteno y de su reducción son bastante complejos pues involucran especies no estequiométricas como el WO2.9 (Lassner, 1999, p. 91)7. Los óxidos de tungsteno formados en el interior del foco se reducen con el hidrógeno proveniente de la descomposición del agua, formando tungsteno puro y agua que entra de nuevo al ciclo (Kane, 2001).
Por cierto que el filamento de los focos se elabora comprimiendo polvo de tungsteno y sinterizándolo (calentándolo sin fusión y compactándolo a presión), para formar barras que luego se transforman en alambres muy finos que son enredados en una bobina para rizarlos; así, el filamento de un foco de 60 watts, que es de 0.045 mm de diámetro por 200 mm de largo, por efectos del enroscado se reduce a 25-40 mm de longitud (Jardine, 1989; Kalpakjian, 2002). Las características físicas del filamento deben ser muy controladas, pues si el diámetro del alambre es de tan sólo 1% menor que el especificado la vida media de la lámpara puede reducirse hasta en 25% (Kalpakjian, 2002); en contraste, una lámpara de 130 voltios trabajando a 120 voltios tiene una vida media de casi el triple que la de una de 120 trabajando a120. Bajo condiciones normales de operación, los focos estándar de 60, 75 ó 100 watts tienen un tiempo de vida media de 750-1000 h (IN-VSEE, 2008).
Síntesis de óxido de WO3 a partir del filamento de un foco: el experimento
El que un foco se funda es un inconveniente en la vida cotidiana, aun a pesar de que los focos estándar son muy baratos, pues su costo oscila entre tres y cinco pesos mexicanos. En contraste, la oxidación intencional del filamento de un foco estándar, por calentamiento eléctrico a 110 voltios en presencia de aire es un experimento muy interesante y permite obtener el óxido de tungsteno(VI) a partir de materiales comunes y a un costo muy bajo, siempre y cuando se requiera en pequeñas cantidades.8 Afortunadamente el WO3 obtenido a partir de un solo foco (entre 5-10 mg) es más que suficiente para caracterizar el compuesto por IR, pues en la mayoría de los espectrómetros de infrarrojo modernos se pueden obtener los espectros hasta con un miligramo de muestra o menos.
El WO3 es un polvo amarillo limón prácticamente insoluble en agua. Funde a 1473° C formando un líquido amarillo oscuro. Exhibe naturaleza ácida cuando interactúa con álcalis en caliente, formando los correspondientes tungstatos, los cuales existen en forma anhidra y como cristalohidratos (Bard, 1985). Al óxido de tungsteno(VI) monohidratado, WO3H2O, también se le conoce como ácido túngstico, ácido wolfrámico o ácido ortotúngstico. Se usa en la industria textil, en la industría de los plásticos y en la manufactura de productos metálicos hechos a base de tungsteno. Puede ser reducido en presencia de hidrógeno a temperaturas de 600-1000° C. No obstante, el proceso es bastante complejo pues pasa por varias etapas en las que la eliminación del agua formada juega un papel muy importante en las propiedades físicoquímicas del material; por ejemplo en su conductividad eléctrica y en el tamaño de grano del producto final y de los productos intermedios de reacción. Algunas de las especies que han podido caracterizarse son:

La estructura cristalina del WO3 es un arreglo tridimensional de octaedros que comparten vértices; los tungstenos se ubican en el centro de los octaedros y los oxígenos en los vértices, de manera tal que forman enlaces W-O-W (figura 4). El WO3 presenta al menos siete estructuras polimórficas a temperatura ambiente, siendo la monoclínica la más estable (Christian, 1975; Greenwood, 1997, p. 1173). A temperaturas más altas ésta se transforma a la fase ortorrómbica o a la tetragonal (Depero, 1996).
Objetivos del experimento
1. Sintetizar el óxido de tungsteno(VI) por calentamiento resistivo a 110 V del filamento de tungsteno de un foco en presencia de aire.
2. Dar a conocer a los alumnos el óxido de un elemento de transición obtenido mediante un método de síntesis poco usual en el laboratorio.
3. Caracterizar por infrarrojo al WO3 obtenido.
Reacción general
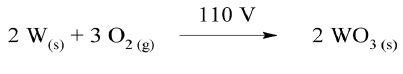
Parte experimental
Materiales y equipo
1) Un dispositivo eléctrico consistente de dos focos conectados en paralelo y provistos de un apagador (figura 5). El primer foco es de 7.5 watts y sirve como testigo, en tanto que el segundo foco es de 60 watts; 2) Unas pinzas de punta con protección aislante; 3) Una toma de corriente alterna de 110 volts; 4) Una espátula; 5) Un vaso de precipitados de 600 mL; 6) Un espectrómetro de infrarrojo.
Procedimiento
1) Conecte el dispositivo eléctrico a una toma de 110 volts y marque la posición de encendido del apagador; 2) El foco de 7.5 watts le permitirá saber si hay flujo de corriente eléctrica, en cuyo caso no deberá intentar manipular el foco de 60 watts; 3) Por comodidad y mayor seguridad puede conectar el foco de 60 watts al sistema mediante un ladrón; 4) Ponga el interruptor en apagado y retire el ladrón con el foco; 5) Sin desconectar el foco del ladrón, introdúzcalo en una bolsa de plástico, apoye el foco lateralmente sobre una superficie dura y con las pinzas dele un golpe de manera firme pero con impulso controlado para no romper el filamento; 6) Saque el ladrón con la bombilla rota de la bolsa y colóquelo en el soquet del sistema; 7) Coloque el vaso de precipitados boca abajo encapsulando a la bombilla rota y dispóngase a observar la reacción; 8) Al poner el apagador en posición de encendido, notará una luz brillante, la ruptura del filamento y la formación de una nubecilla de polvo dentro del vaso; 9) Espere 3 minutos para que se condense todo el WO3 formado. Note que la mayoría de éste se deposita sobre las paredes del vaso; 10) Coloque el apagador en la posición de apagado; 11) Retire el vaso, recolecte cuidadosamente el producto con la espátula y prepare su muestra para IR según los requerimientos de su espectrómetro; 12) Deposite los desechos del foco en un recipiente debidamente etiquetado como material punzo-cortante (o vidrio roto de laboratorio); 13) Dado que el óxido es muy estable y de bajo riesgo y se obtienen pocos miligramos del producto, el material puede lavarse normalmente con agua y jabón.
Consejos de seguridad
Use bata y lentes de seguridad durante todo el experimento; para la manipulación del dispositivo eléctrico use guantes de carnaza y pinzas con mango aislante; para manipular el producto y lavar el material use guantes de látex. La reacción debe realizarse bajo campana de extracción de gases o en un sitio bien ventilado. El tungsteno metálico es toxicológicamente inerte aun si se han ingerido cantidades pequeñas, en cuyo caso se recomienda tomar una buena cantidad de agua e inducir el vómito. Sin embargo, si el tungsteno se encuentra en forma de polvo puede causar irritación en los ojos o la piel debido a su acción abrasiva.
El WO3 puede ser dañino por ingestión o inhalación. Puede ser irritante para los ojos, la piel y las vías respiratorias. En caso de ingestión lávese la boca con agua o si se ha inhalado salga a respirar al aire libre; si el sujeto no respira administre respiración artificial y si respira con dificultad administre oxígeno. En caso de exposición ocular enjuáguese los ojos con bastante agua durante 15 minutos, separando los párpados con los dedos para asegurar un buen enjuague. Aunque la cantidad en la que se sintetiza el material en este experimento es menor al 1% de la dosis letal oral en rata (LD50 = 1059 mg/Kg) deben observarse las medidas de seguridad recomendadas. Para mayor información consulte las hojas de seguridad del WO3 en: ScienceLab.com, 2008 y 95410-Tungsten, 2008.
Resultados y discusión
Como producto de reacción se obtuvieron ca. 7.5 mg de un polvo amarillo limón. La apariencia física del material hace suponer que el producto principal de la reacción es WO3. Esta suposición se confirmó al tomar su espectro de infrarrojo (figura 6) en una pastilla hecha únicamente con el polvo obtenido, en un espectrómetro de infrarrojo Vertex 70 de Brucker, en modo de reflectancia difusa (DR).
El espectro muestra una banda muy intensa en la región de 500 - 1100 cm-1 (banda A), la cual se expandió en la figura 6b para modelar su descomposición en los picos A1-A5 con máximos en 528, 700, 893, 962 y 1041 cm-1. La banda en 528 cm-1 se asigna al fuerte acoplamiento de la red del óxido cuando está hidratado (WO3.nH2O), lo cual indica que el material adsorbe agua del medio al condensarse (Wright, 1977; Daniel, 1987). La banda en 1433 cm-1 que ha sido asignada a grupos OH fuertemente enlazados a moléculas de agua o a los átomos de oxígeno de la superficie de la red refuerzan esta suposición (Atanassor, 1993; Raougier, 1999), lo mismo que la banda de estiramiento simétrico localizada en 3454 cm-1 (Delichere, 1988; Pfeifer, 1995). Nótese que la intensidad de los picos de la zona de 2100-4000 cm-1 fue quintuplicada y modelada su descomposición. Estos y otros picos importantes se hayan listados en la tabla 4.
La caracterización por IR en modo de reflexión total atenuada (ATR) y por espectroscopia Raman serán presentados en otra revista (Díaz-Reyes, 2008a). Cabe mencionar que el espectro de difracción de rayos-X en polvo mostró que el WO3 obtenido mediante esta técnica es una mezcla de las fases ortorrómbica y monoclínica (Díaz-Reyez, 2008b).
Conclusión
La nomenclatura del elemento químico número 74 es un tema digno de ser discutido en una clase de química general o inorgánica. El tema puede ser traído a colación al poner en práctica la síntesis del WO3 por oxidación a altas temperaturas, del filamento de una simple bombilla eléctrica.
La realización de este experimento es interesante no sólo por las aplicaciones tecnológicas del óxido de tungsteno(VI), sino también porque es importante conocer la química y la física involucradas en el funcionamiento de un simple foco, ¡porque son fenómenos que traen luz a nuestras vidas!
Referencias
95410-Tungsten(VI) oxide powder puriss., 99%. En línea: <http://www.sigmaaldrich.com/catalog/search/ProductDetail/FLUKA/95410>. Última consulta: 5 de mayo de 2008. [ Links ]
Atanassor, G.; Thielsch, R.; Popor, D., Thin Solid Films, 223, 288, 1993. [ Links ]
Astruc, D., The metathesis reactions: from a historical perspective to recent developments, New J. Chem., 29, 42, 2005. [ Links ]
Bard, A.J.; Parsons, R.; Jordan, J. Standard potentials in aqueous solutions. International Union of Pure and Applied Chemistry. Marcel-Dekker. New York, 1985, p. 485. [ Links ]
Chemistry: Periodic Table: Tungsten: Key information. En línea: <http://www.webelements.com/webelements/elements/text/W/key.html>. Última consulta: 5 de mayo de 2008. [ Links ]
Christian, J.W. The theory of transformations in metals and alloys. Pergamon Press, Oxford, 1975. [ Links ]
Daniel, F.; Desbat, B.; Lassegues, J.C.; Gerand, B.; Figlarz, M., J. Solid State Chem., 67, 235, 1987. [ Links ]
De Luyhar, J.J.; De Luyar, F. Extractos de las Juntas Generales celebradas por la Real Sociedad Bascongada de los Amigos del País. Vitoria, Septiembre, 1783, pp. 46-88. [ Links ]
Depero, L.E.; Groppelli, S.; Natali-Sora, I.; Sangaletti, L.; Sberveglieri, G.; Tondello, E., J. Solid State Chem., 121, 379, 1996. [ Links ]
Delichere, P.; Falaras, P.; Froment, M.; Hugot-Le Goff, A., Thin Solid Films, 161, 35, 1988. [ Links ]
Díaz-Reyes, J.; Solíz-Sánchez, M.A.; Dorantes-García, V.; Pérez-Benítez, A., Superficies y Vacío, 2008a: en prensa; 2008b: En preparación. [ Links ]
Edison, T. A. Electric Lam. United Status Patent Office. Patente núm. 223898 del 27 de enero de 1880. En línea en: <http://www.pat2pdf.org/patents/pat0223898.pdf>. Última consulta: 5 de mayo de 2008. [ Links ]
Freites, M. A.; Martínez-Riachi, S., Física y Química Aplicadas a la Informática. Thompson. Buenos Aires, Arg., 2006, p. 185. [ Links ]
Giral, F., Ciencia española en el exilio, 1939-1989 el exilio de los científicos españoles. Memoria rota, 35. Barcelona: Anthropos Editorial del Hombre, 1994, p. 114. [ Links ]
a). Goya, P. y Román, P., Wolfram vs. Tungsten, Chem. Int., 27(4), 2005; [ Links ] b). Goya, P., Noticias científicas: Debate sobre el wolframio, Anales de la Real Sociedad Española de Química. 2a época, abril-junio de 2005, p. 67. En línea en: <http://www.ehu.es/reviberpol/pdf/JUN05/goya.pdf>. Última consulta: 5 de mayo de 2008. [ Links ]
Goya, P. y Román, P. Wolfram vs. Tungsten. En línea en: Chemistry Internacional - Newsmagazine for IUPAC: <http://www.iupac.org/publications/ci/2005/2704/ud_goya.html#1>. Última consulta: 5 de mayo de 2008. [ Links ]
Greenwood N. N.; Earnshaw, E. Chemistry of the Elements. (2nd edition). Ed. Butterworth-Heinemann. Oxford, 1997, p. 1002. [ Links ]
Hargittai, I.; Hargittai, M.; Spiridonov, V.P.; Erokhin, E.V.J., Mol. Struct., 8, 31, 1971. [ Links ]
Holden, N.E., Atomic Weights and the International Committee—A Historical Review, Chem. Int., 26(1), 2004. En línea en: <http://www.iupac.org/publications/ci/2004/2601/1_holden.html>. Última consulta: 5 de mayo de 2008. [ Links ]
Incandescent light bulb - Wikipedia, the free encyclopedia. En línea en: <http://en.wikipedia.org/wiki/Incandescent_light_bulb#History_of_the_light_bulb>. Última consulta: 5 de mayo de 2008. [ Links ]
IN-VSEE: Interactive Nano Visualization in Science and Engineering Education. Why does a light bulb burn out? En línea en: <http://invsee.asu.edu/Invsee/listmod.htm>. Última consulta: 5 de mayo de 2008. [ Links ]
Jardine, J.; Ken S., Physics Through Applications. Oxford University Press, 1989, p. 50. [ Links ]
Kakani, S.L.; Kakani, A., Material science. New Age. Delhi, India, 2006, p. 431. [ Links ]
Kalpakjian, S. Manufactura, ingeniería y tecnología. México: Pearson, 2002, p. 7. [ Links ]
Kamlesh, R., Illuminating Engineering. Firewall Media. Nueva Delhi, India, 2006, p. 25. [ Links ]
Kane, R. and Heinz, S., Revolution in Lamps. A Chronicle of 50 Years of Progress. Lilburn, GA: Fairmont Press, 2001, p. 4. [ Links ]
Karukstis, K.K.; Van Hecke, G.R., Chemistry Connections: The Chemical Basis of Everyday Phenomena. San Diego: Academic Press, 2000, p. 110. [ Links ]
L'vov, N. P.; Nosikov, A. N.; Antipov, A. N. Tungsten-Containing Enzymes. Biochemistry (Moscow), 67(2), 196, 2002. [ Links ]
Lassner, Erik, and Wolf-Dieter Schubert. Tungsten Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. New York: Kluwer Academic/Plenum Publishers, 1999. [ Links ]
Lynch, C. T.; Summitt, R.; Sliker, A. CRC Handbook of Materials Science. Vol. I: General properties. CRC Press, Inc. Boca Ratón, Florida. 1974, p. 53. [ Links ]
Martínez Riachi, S.; Adela Freites, M. Física y química aplicadas a la informática. Thompson, Buenos Aires, 2006, p. 185. [ Links ]
Opara Krasovec, U.; Surca Vuk, A.; Orel, B. Electrochimica Acta, 46, 1921-1929, 2001. [ Links ]
Pfeifer, J.; Guifang, C.; Tekula-Buxbaum, P.; Kiss, B. A.; Farkas-Jahnke, M.; Vadasdi, K., J. Solid State Chem., 119, 90, 1995. [ Links ]
Rajput, R. K., Electrical Engineering Materials. New Delhi: Satya Prakashan, 2002, p. 106. [ Links ]
Raougier, A.; Portemer, F.; Quede, A.; EI Marssi, M., Applied Surface Science, 153, 1-9, 1999. [ Links ]
Reich, S.; Leitus, G.; Tssaba, Y.; Levi, Y.; Sharoni, A.; Millo, O. Localized High-Tc Superconductivity on the Surface of Na-Doped WO3, J. Superconductivity, 13(5), 855, 2000. [ Links ]
Saez, J.A. 2008. Guipuzkoa (Guipúzcoa) en los sellos postales (1981-1985). En línea en: <http://www.ingeba.euskalnet.net/liburua/sellos/sel8185.htm> Última consulta: 5 de mayo de 2008. [ Links ]
ScienceLab.com. Tungsten oxide MSDS. En línea en: <http://www.sciencelab.com/msds.php?msdsld=9925359>. Última consulta: 5 de mayo de 2008. [ Links ]
Schufle, J.A. Juan Jose D'Elhuyar: Discoverer of Tungsten (SBS), J. Chem. Educ., 52, 325, 1975. [ Links ]
Seiffert, G.B.; Ullmann, G. M.; Messerschmidt, A.; Schink, B.; Kroneck, P.M.H.; Einsle, O. Structure of the non-redox-active tungsten/[4Fe:4S] enzyme acetylene hydratase. Proceedings of the National Academy of Sciences of the United States of America PNAS, 104, 3073-3077, 2007. [ Links ]
Sigel, A; Sigel, H. Metals Ions in Biological System: Their Roles in Biological Processes: Molybdenum and Tungsten: Their Roles in Biological Processes, vol. 39. CRC Press. USA, 2002, p. 187. [ Links ]
Tungsten-Wikipedia, the free encyclopedia. En línea en: <http://en.wikipedia.org/wiki/Tungsten>. Última consulta: 5 de mayo de 2008. [ Links ]
Van der Krogt, P. Elementymology and elements Multidict: 74 Tungsten. En línea en: <http://elements.vanderkrogt.net/images/portret/elhuyar_stamp.jpg>. Última consulta: 5 de mayo de 2008. [ Links ]
Weeks, M. E. The Discovery of the Elements. Kessinger Publishing's rare reprints. Whitefish, Mont: Kessinger Pub, 2003, p. 50. [ Links ]
Wiberg, E.; Wiberg, N.; Holleman, A.F. Inorganic chemistry. San Diego: Academic Press, 2001, p. 1384. [ Links ]
Willis, H.A.; Van der Maas J.H.; Miller, R.G.J. Laboratory Methods in Vibrational Spectroscopy, 3a ed., John Wiley & Sons: Nueva York, 1987. [ Links ]
Wolframio-Wikipedia, la enciclopedia libre. En línea: <http://es.wikipedia.org/wiki/Wolframio>. Última consulta: 5 de mayo de 2008. [ Links ]
Wright, C.J., J. Solid State Chem., 20, 89, 1977. [ Links ]
4 La invención de la bombilla eléctrica fue disputada por Heinrich Gobel, quien reclamó haber inventado la primera bombilla eléctrica en 1854, usando un filamento de bambú carbonizado (Incandescent, 2008).
5 El nombre de wolframio se debe a Peter Woulfe, quien en 1779 supuso que el mineral conocido hoy como wolframita debía contener un nuevo elemento químico (Lynch, 1974; Saez, 2008).
6 El filamento de una lámpara de 100 watts es de 40 micrones de diámetro y 90 cm de longitud, que al ser enrollado en espiral se reduce a 2.5 cm (Kamlesh, 2006, p. 69).
7 La relación no estequiométricas se debe a la existencia de una mezcla de óxidos en los que el tungsteno presenta distintos estados de oxidación debida, por ejemplo, a la reducción de una parte de la muestra.
8 El precio del WO3 de Aldrich (en polvo de aprox. 20 µm de tamaño de partícula y pureza ≥ 99 %) es de cuarenta y cinco dólares por 100 g.