Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Mexicana de Medicina Crítica y Terapia Intensiva
versión impresa ISSN 0187-8433
Rev. Asoc. Mex. Med. Crít. Ter. Intensiva vol.29 no.4 Ciudad de México oct./dic. 2015
Tema de revisión
Ventilación pulmonar ultraprotectora en insuficiencia respiratoria aguda, un nuevo concepto
Ultra-protective lung ventilation in acute respiratory failure, a new concept
Raúl Carrillo-Esper,* Ángel Augusto Pérez Calatayud‡
* Academia Nacional de Medicina. Academia Mexicana de Cirugía. Jefe de la UTI.
‡ Medicina del Enfermo en Estado Crítico.
Fundación Clínica Médica Sur.
Fecha de recepción: 09 de enero 2015
Fecha de aceptación: 29 de marzo 2015
RESUMEN
El síndrome de insuficiencia respiratoria aguda (SIRA) es una afección grave que presenta el enfermo en estado crítico, esto es condicionado a la respuesta inflamatoria del agente etiológico en la barrera endotelio-epitelial pulmonar inducida por inflamación, cuyo resultado condiciona aumento de la permeabilidad vascular y disfunción del agente tensoactivo con lo que se producen grados variables de colapso y consolidación alveolar. Con la finalidad de disminuir el daño inducido por ventilación mecánica, se han elaborado diferentes estrategias. La estrategia más aceptada y avalada por evidencia científica es la ventilación de protección pulmón. En los últimos años, la presencia de removedores de CO2 extracorpóreos sin el uso de bombas arteriovenosas se han desarrollado y probado para su uso clínico, su uso permite la remoción de CO2 con una mejoría moderada de la oxigenación. Una estrategia con ventilación mecánica con volumen corriente ultrabajo (3 mL/kg de peso predicho) en combinación con los dispositivos de extracción de CO2 podrían reducir la lesión pulmonar asociada con la ventilación en comparación con el manejo protector actual. Aún se debe determinar si esta estrategia mejorara la sobrevida de los enfermos con SIRA.
Palabras clave: Insuficiencia respiratoria aguda, ventilación mecánica, volumen pulmonar ultrabajo.
ABSTRACT
Acute respiratory distress syndrome (ARDS) is a severe and frequent affection in critically ill patients. Damage of the lung endothelial barrier induce from inflammation which results in a capillary leak and surfactant dysfunction thereby varying degrees of alveolar consolidation may occur. In order to reduce lung injury from mechanical ventilation, different strategies have been created. The accepted strategy with strong scientific evidence is lung protective ventilation. In recent years the presence of CO2 removers without the use of extracorporeal arterio-venous pumps have been developed and tested for clinical use, it's use allows the removal of CO2 with moderate improvement in oxygenation. A strategy with ultralow tidal volume in mechanical ventilation (3 mL/kg of predicted weight) in combination with CO2 removers devices could reduce CO2 extraction of lung injury associated with ventilation compared to the current protector management, yet to be determined whether this strategy will improve the survival of patients with ARDS.
Key words: Acute respiratory distress syndrome, mechanical ventilation, ultralow tidal volume.
INTRODUCCIÓN
El síndrome de insuficiencia respiratoria aguda (SIRA) es una afección grave que presenta el enfermo en estado crítico. El daño de la barrera endotelio-epitelial pulmonar inducida por inflamación, cuyo resultado condiciona aumento de la permeabilidad vascular y disfunción del agente tensoactivo, con lo que se producen grados variables de colapso y consolidación alveolar. Desde su identificación por Ashbaugh en 1967 hasta la definición de Berlín en el 2013, se han logrado múltiples avances en el conocimiento de la fisiopatogenia de este síndrome, y se han realizado avances en su tratamiento. En la actualidad uno de los tratamientos consiste en el uso de estrategias de ventilación mecánica con protección alveolar; el determinar si esta estrategia de ventilación mecánica es capaz de minimizar la lesión producida por el ventilador y a procurar un intercambio gaseoso adecuado. La evidencia muestra que debería ventilarse a los pacientes con volumen corriente entre 6-8 mL/kg, peso predicho con presión meseta de 30 cmH2O. El manejo con presión positiva al final de la expiración (PPFE) no ha demostrado reducir la mortalidad. Es por eso que actualmente se encuentra en desarrollo un nuevo concepto en ventilación mecánica el término de ultraprotección pulmonar con el uso de volúmenes ultrabajos (3 mL/kg de peso predicho) con remoción de CO2.
ANTECEDENTES
La ventilación mecánica es un sistema de apoyo fundamental en el manejo de los pacientes críticos que cursan con insuficiencia respiratoria aguda. Sin embargo, esta medida de soporte vital no está exenta de complicaciones.1 Los enfermos tratados con esta medida tienen riesgo de sufrir lesión pulmonar inducida por ventilación, que involucra varios mecanismos complejos relacionados con el incremento de presión inspiratoria (barotrauma), por variaciones de volumen (volutrauma), una respuesta inflamatoria local y sistémica que contribuye al daño pulmonar (biotrauma), o por apertura y colapso alveolar con volumen corriente bajo (atelectrauma).1-3 Este tipo de lesión es especialmente relevante en el SIRA.2 Es importante conocer los mecanismos de lesión inducida por ventilación para minimizar sus efectos con el uso de estrategias de ultraprotección pulmonar. Por lo cual debemos entender dos fenómenos físicos. El primero es el estrés (stress) que se refiere a la distribución de fuerzas internas por unidad de área. El segundo, la distensión (strain) es la deformación de un material con propiedades elásticas cuando se le aplica una fuerza. Aplicado a la fisiología pulmonar, el estrés es la tensión aplicada a las estructuras del fibroesqueleto pulmonar, y el strain es la deformación generada por esta tensión mecánica.4 En otros términos, el equivalente clínico de estrés en el pulmón es la presión transpulmonar (presión de la vía aérea menos presión pleural) así mismo, el equivalente clínico de la distención es la proporción entre el cambio de volumen (ΔV) y la capacidad residual funcional (CRF), el cual es el volumen pulmonar de reposo, de ahí que a menor volumen pulmonar inicial, mayor será el porcentaje de deformación, dicho de modo directo a menor volumen inicial mayor strain para cada volumen corriente.4
Al aplicar una fuerza en un material heterogéneo, la distribución de esta fuerza es heterogénea a través de este material. En el caso del SIRA, la consolidación de regiones colapsadas se comportan como un material heterogéneo, ocasionando una resistencia en estas zonas elevando la tensión hacia las zonas no consolidadas, esto multiplicará la fuerza mecánica 2 a 3 veces en una zona sana del pulmón generando sobredistensión y daño. Por este motivo, el aumento del volumen pulmonar ocurre principalmente a expensas de un incremento en el radio alveolar de las unidades sanas, lo que favorece esta sobredistensión.5,6 Son dos los mecanismos de lesión inducida por ventilación. El primero ocurre al final de la inspiración, y se asocia al volumen corriente (Vc), o a la presión inspiratoria elevada lo que provoca sobredistensión alveolar, proceso relacionado con el riesgo de lesión alveolar en las regiones no dependientes (R-ND) del pulmón. El segundo, se desarrolla esencialmente en las regiones dependientes (R-D), que están expuestas a estrés significativo cuando la vía aérea y los alvéolos se abren en inspiración y colapsan en espiración. Éste se asocia principalmente con el uso de presión positiva al final de la espiración (PPFE) insuficiente para evitar el colapso-reapertura alveolar cíclico. Ambos fenómenos pueden superponerse, ya que la PPFE innecesariamente elevada puede condicionar sobredistensión y la reducción del Vc podría limitar el colapso-apertura alveolar cíclico. Sin embargo, la verdadera causa de la distensión no es la presión de la vía aérea, sino la presión transpulmonar (PTP), que corresponde a la diferencia entre las presiones alveolar (PALV) y pleural (PPL). Si superamos la PTP fisiológica, se produce el estrés o tensión mecánica.7,8
ESTRATEGIAS DE VENTILACIÓN PROTECTORA
Con la finalidad de disminuir el daño inducido por ventilación mecánica, se han elaborado diferentes estrategias. La estrategia más aceptada y avalada por evidencia científica es la ventilación de protección pulmonar.9 Esta estrategia se basa en el empleo de volumen corriente bajo, en torno a 6 mL/kg de peso ideal, y PPFE, garantizando presiones medias en la vía aérea por debajo de 30 cmH2O.10 Lo anterior como resultado de varios estudios, dentro de éstos, el de la ADRS Network en el que se comparó un volumen de 12 mL/kg predicho con 6 mL/kg de peso predicho. Esta estrategia demostró una sobrevida relativa de 22% (mortalidad de 39 versus 31%) en el grupo de estudio de Vc bajo (6 mL/kg).11 Uno de los inconvenientes de la PPFE alta es que incrementa la tensión y la distensión alveolar al final de la inspiración.10 Recientemente se ha demostrado que también el volumen corriente es un determinante importante en el colapso-reapertura alveolar cíclico, y el incremento de este puede inducir atelectrauma.12 Terragni demostró que aun con volúmenes de 6 mL/kg de peso predicho puede aparecer atelectrauma, además de provocar hiperinflación, que es un relevante marcador de lesión pulmonar asociada a ventilación. Una alternativa puede ser optimizar la ventilación convencional protectora al disminuir más el VC por debajo de 6 mL/kg de peso predicho a 4 mL/kg de peso predicho, que ha demostrado reducir la apertura-colapso alveolar cíclica, pero además, en contraste con el aumento de la PPFE, un VC bajo puede disminuir el riesgo de sobredistensión.13 Éste es el principio del concepto de volúmenes corrientes ultrabajos con remoción de CO2.
Los datos mencionados anteriormente sugieren que puede haber un beneficio en el uso de un volumen corriente aún menor, pero en casos graves la implementación de dichas estrategias puede estar limitada por la presencia de hipercapnia y acidosis respiratoria grave, el impacto de la hipercapnia en la lesión pulmonar o sus efectos sistémicos incluyendo el daño a órganos remotos (insuficiencia miocárdica, lesión renal aguda, o isquemia intestinal y/o hepática);14,15 lo cual retrasa la implementación de estrategias de protección pulmonar adecuadas.16
VOLÚMENES CORRIENTE ULTRABAJO CON REMOCIÓN DE CO2 (VENTILACIÓN ULTRAPROTECTORA)
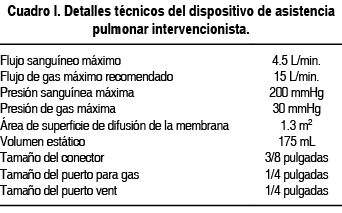
En los últimos años, la presencia de removedores de CO2 extracorpóreos sin el uso de bombas arteriovenosas se ha desarrollado y probado para su uso clínico, Bein demostró que su uso permite la remoción de CO2 con una mejoría moderada de la oxigenación.17 El concepto se describe por primera vez por Ohtake.18 Este dispositivo de ECMO sin bomba, también conocido como asistencia pulmonar intervencionista (iLA por sus siglas en inglés) utiliza una membrana de baja resistencia para el intercambio de gases (dispositivo de asistencia pulmonar) que se encuentra interpuesto entre dos cánulas que se conectan por vía de un tubo corto, el cual establece el corto circuito arteriovenoso. Los detalle técnicos se describen en el cuadro I. Las cánulas heparinizadas se insertan por técnica de Seldinger a los vasos femorales. El intercambiador de gases por unidad, mide 14 x 14 cm con un área de superficie de 1.3 m2 y consiste en una fibra hueca de polimetilpenteno (PMP) heparinizada.19 La fase gaseosa está localizada por dentro del sistema, mientras la sangre pasa por afuera del sistema de fibra hueca. El intercambio del CO2 se realiza a través de una membrana semipermeable; es llevado por una gradiente de presión parcial del CO2 y O2 entre la sangre y la fase de gas, la cual está conectada a una toma de oxígeno (10 a 12 L/min.). El flujo sanguíneo a través del sistema está determinado únicamente por la diferencia de presiones arterial y venosa.20,21 Para medir el flujo sanguíneo a través del dispositivo se puede usar un catéter de medición ultrasonográfico al tubo conector. Los rangos de flujo son entre 1.0 a 2.5 L/min. pero requiere de una diferencia de presión de 60 a 80 mmHg. El gasto cardiaco y el flujo sanguíneo determinan la eficacia de este dispositivo, por lo que es necesario el monitoreo del gasto cardiaco por métodos invasivos o mínimamente invasivos para guiar la terapia inotrópica y vasopresora.22
En comparación con el ECMO convencional, la ventaja principal del iLA (Figura 1) es la reducción de la superficie de contacto, evita las complicaciones relacionadas con la bomba y la reducción de los costos operacionales. Las complicaciones derivadas del uso del iLA se enlistan en el cuadro II.


La ventilación de ultraprotección pulmonar inició en un estudio comparativo de ventilación de 6 mL/kg y otra de 3 mL/kg + iLA en un modelo de lesión pulmonar experimental.23 Los autores no encontraron diferencia en cuanto a la presencia de disfunciones orgánicas o al grado de lesión en este modelo. Una de las debilidades del estudio fue la PPFE (de 5 cmH2O) que se aplicó en ambos grupos, ésta no fue ajustada durante el manejo ventilatorio, lo cual resultó en un desreclutamiento más alto en el grupo de volumen corriente de 3 mL/kg.23 En contraste, Iglesias demostró en un modelo animal postneumonectomía una mejor protección pulmonar con esta estrategia. El uso del iLA en conjunto con una ventilación casi estática (2.3 mL/kg, PPFE de 15 cmH2O) reduce la lesión pulmonar, esto se demostró con la disminución de citocinas, la recuperación de la función pulmonar residual en el pulmón lesionado y la supervivencia al final del estudio.24
Muellenbach realizó un análisis retrospectivo en 22 pacientes con SIRA en los que se implementó una estrategia con un volumen corriente ultrabajo (menor de 4 mL/kg) y una PPFE alta y el apoyo del iLA. El dispositivo fue utilizado con una media de cinco días de uso, mientras que la oxigenación fue asegurada por una estrategia de ventilación con liberación de presión de vía aérea (APRV por sus siglas en inglés) o con ventilación de alta frecuencia oscilatoria. En este estudio se logró la corrección de la hipoxemia y la hipercapnia en todos los enfermos excepto uno en las primeras 24 horas y 72% de los enfermos fueron egresados de la Unidad de Terapia Intensiva (UTI). Sin embargo, se debe tomar en cuenta que durante el estudio, un número de pacientes no fue seleccionado debido a la severidad de la hipoxemia o a la presencia de inestabilidad hemodinámica grave.25
En el estudio Xtravent realizado por Bein26 se seleccionaron de manera randomizada a 79 pacientes. Posterior a la estabilización (un periodo de 24 horas con una PPFE alta y una terapia optimizada) se asignó un grupo a una ventilación con volumen corriente bajo (3 mL/kg) combinado con un equipo de asistencia circulatoria pulmonar y otro grupo a la estrategia del ARDSNet sin apoyo de un equipo de asistencia circulatoria pulmonar. No hubo diferencia entre los dos grupos de días libres de ventilación mecánica a los 28 días (33.2 ± 20 en el grupo de estudio versus 29.2 ± 21 en el grupo control con una p = 0.469), sin embargo, en el subgrupo de enfermos con una PaO2/FiO2 menor de 150 (SIRA grave) se demostró una mejoría significativa en los días libres de ventilación mecánica a los 60 días (40.9 ± 12.8 del grupo de estudio versus 28.2 ± 16.4 del grupo control con una p = 0.033). La mortalidad fue baja (16.5%) y no hubo diferencias entre grupos.
En este estudio también se reporta el comportamiento de las citocinas con esta estrategia, mostrando que los niveles de IL6 disminuyeron en el grupo de estudio, los niveles de IL8 no aumentaron en este grupo a diferencia del grupo control y el factor de necrosis tumoral tuvo el mismo comportamiento en ambos grupos.
DISCUSIÓN
Durante los últimos años se han desarrollado diversas medidas para limitar el daño pulmonar inducido por ventilación mediante una ventilación prácticamente "estática" maniobra que permite la reparación pulmonar y limita la lesión.27
La aparición de dispositivos extracorpóreos de diversas características como la membrana de oxigenación extracorpórea (ECMO), los dispositivos de extracción de CO2, y otros recientemente diseñados abren la puerta a protección pulmonar con un volumen corriente aún más bajos, a la vez que intentan evitar riesgos e inconvenientes como la hipercapnia grave, la acidosis incontrolable y las alteraciones hemodinámicas frecuentes en pacientes críticos con SIRA.28,29
Por tanto, este tipo de dispositivos de asistencia permiten utilizarse con un doble objetivo posible:
1) Implementar una ventilación de protección extrema con volumen corriente mucho más bajo disminuyendo el daño pulmonar asociado con la VM.
2) Mejorar el intercambio de gases en situaciones extremas en la que la ventilación mecánica convencional fracasa.30
CONCLUSIONES
Una estrategia con ventilación mecánica con volumen corriente ultrabajo (3 mL/kg de peso predicho) en combinación con los dispositivos de extracción de CO2 podrían reducir la lesión pulmonar asociada a la ventilación en comparación con el manejo protector actual. Aún se debe determinar si esta estrategia mejorará la sobrevida de los enfermos con SIRA. La evidencia con la que contamos actualmente demuestra que puede ser un procedimiento seguro y es posible que en un futuro esta estrategia sea implementada como una alternativa en el manejo del SIRA.
REFERENCIAS
1. Tremblay LN, Slutsky AS. Ventilator-induced lung injury: from the bench to the bedside. Intensive Care Med. 2006;32:24-33. [ Links ]
2. Pinheiro de Oliveira R, Hetzel MP, dos Anjos-Silva M, Dallegrave D, Friedman G. Mechanical ventilation with high tidal volume induces inflammation in patients without lung disease. Crit Care. 2010;14:R39. [ Links ]
3. Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369:2126-2136. [ Links ]
4. Chiumello D, Carlesso E, Cadringher P, Caironi P, Valenza F, Polli F, et al. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med. 2008;178:346-355. [ Links ]
5. Roan E, Waters CM. What do we know about mechanical strain in lung alveoli? Am J Physiol Lung Cell Mol Physiol. 2011;301:625-635. [ Links ]
6. Chiumello D, Carlesso E, Cadringher P, Caironi P, Valenza F, Polli F, et al. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med. 2008;178:346-355. [ Links ]
7. Protti A, Cressoni M, Santini A. Lung stress and strain during mechanical ventilation: any safe threshold? Am J Respir Crit Care Med. 2011;183:1354-1362. [ Links ]
8. Gattinoni L, Protti A, Caironi P, Carlesso E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit Care Med. 2010;38:539-548. [ Links ]
9. Needham DM, Colantuo E, Mendez-Tellez PA, Dinglas VD, Sevransky JE, Dennison-Himmelfarb CR, et al. Lung protective mechanical ventilation and two year survival in patients with acute lung injury: prospective cohort study. BMJ. 2012;344:e2124. [ Links ]
10. Kilpatrick B, Slinger P. Lung protective strategies in anaesthesia. Br J Anaesth. 2010;105 Suppl 1:i108-116. [ Links ]
11. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342:1301-1308. [ Links ]
12. Retamal J, Libuy J, Jiménez M, Delgado M, Besa C, Bugedo G, et al. Preliminary study of ventilation with 4 ml/kg tidal volume in acute espiratory distress syndrome: feasibility and effects on cyclic recruitment derecruitment and hyperinflation. Crit Care. 2013;17:R16. [ Links ]
13. Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2007;175:160-166. [ Links ]
14. Azzam ZS, Sharabi K, Guetta J, Bank EM, Gruenbaum Y. The physiological and molecular effects of elevated CO2 levels. Cell Cycle. 2010;15:1528-1532. [ Links ]
15. Peltekova V, Engelberts D, Otulakowski G, Otulakowski G, Uematsu S, Post M, et al. Hypercapnic acidosis in ventilator-induced lung injury. Intensive Care Med. 2010;36:869-878. [ Links ]
16. Rubenfeld GD, Cooper C, Greg-Carter RT, Thompson BT, Hudson LD. Barriers to providing lung-protective ventilation to patients with acute lung injury. Crit Care Med. 2004;32:1289-1293. [ Links ]
17. Bein TH, Weber F, Philipp A, Prasser C, Pfeifer M, Schmid FX. A new pumpless extracorporeal interventional lung assist in critical hypoxemia/hypercapnia. Crit Care Med. 2006;4:1372-1379. [ Links ]
18. Ohtake S, Kawashima Y, Hirose H, Matsuda H, Nakano S, Kaku K, et al. Experimental evaluation of pumpless arteriovenous ECMO with polypropylene hollow-fiber membrane oxygenator for partial respirator y support. Trans Am Soc Artif Intern Organs. 1983;29:237-241. [ Links ]
19. Novalung-GmbH iLA membrane ventilator® compendium of evidence. 2009. [ Links ]
20. Jayroe JB, Alpard SK, Wang D, Deyo DJ, Murphy JA, Zwischenberger JB. Hemodynamic stability during arteriovenous carbon dioxide removal for adult respiratory distress syndrome: a prospective randomized outcomes study in adult sheep. Asaio J. 2001;47:211-214. [ Links ]
21. Conrad SA, Zwischenberger JB, Grier LR, Alpard SK, Bidani A. Total extracorporeal arteriovenous carbon dioxide removal in acute respirator y failure: a phase I clinical study. Intensive Care Med. 2001;27:1340-1351. [ Links ]
22. von Mach MA, Kaes J, Omogbehin B, Sagoschen I, Wiechelt J, Kaiser K, et al. An update on interventional lung assist devices and their role in acute respirator y distress syndrome. Lung. 2006;184:169-175. [ Links ]
23. Dembinski R, Hochhausen N, Terbeck S, Uhlig S, Dassow C, Schneider M, et al. Pumpless extracorporeal lung assist for protective mechanical ventilation in experimental lung injury. Crit Care Med. 2007;35:2359-2366. [ Links ]
24. Iglesias M, Jungebluth P, Petit C, Matute MP, Rovira I, Martínez E, et al. Extracorporeal lung membrane provides better lung protection than conventional treatment for severe postneumonectomy non cardiogenical acute respirator y distress syndrome. J Thorac Cardiovasc Surg. 2008;135:1362-1371. [ Links ]
25. Muellenbach RM, Kredel M, Wunder C, Küstermann J, Wurmb T, Schwemmer U, et al. Arteriovenous extracorporeal lung assist as integral part of a multimodal treatment concept: a retrospective analysis of 22 patients with ARDS refractory to standard care. Eur J Anaesthesiol. 2008;25:897-904. [ Links ]
26. Bein T, Weber-Carstens S, Goldmann A, Müller T, Staudinger T. Lower tidal volume strategy (≈3 ml/kg) combined with extracorporeal CO2 removal versus conventional protective ventilation (6 ml/kg) in severe ARDS: the prospective randomized Xtravent-study. Intensive Care Med. 2013;39:847-856.
27. Costa E, Amato M. Ultra-protective tidal volume: how low should we go? Crit Care. 2013;17:127. [ Links ]
28. Young D, Lamb SE, Shah S, MacKenzie I, Tunnicliffe W, Lall R, et al. High-frequency oscillation for acute respiratory distress syndrome. N Engl J Med. 2013;368:806-813. [ Links ]
29. Moerer O, Quintel M. Protective and ultra-protective ventilation: using pumpless interventional lung assist (iLA). Minerva Anestesiol. 2011;77:537-544. [ Links ]
30. Gattinoni L, Carlessoa E, Langer T. Towards ultraprotective mechanical ventilation. Curr Opin Anesthesiol. 2012;25:141-147. [ Links ]
Correspondencia:
Dr. Raúl Carrillo Esper
Unidad de Terapia Intensiva.
Fundación Clínica Médica Sur.
Puente de Piedra Núm. 150,
Col. Toriello Guerra, 14050,
Del. Tlalpan, México, D.F.
E-mail: revistacma95@yahoo.com.mx
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/medicinacritica














