Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Mexicana de Medicina Crítica y Terapia Intensiva
versión impresa ISSN 0187-8433
Rev. Asoc. Mex. Med. Crít. Ter. Intensiva vol.29 no.4 Ciudad de México oct./dic. 2015
Tema de investigación
Efecto profiláctico de la pravastatina en la incidencia de neumonía asociada al ventilador (NAV)
Prophylactic effect of pravastatin in the incidence of ventilator-associated pneumonia (VAP)
Adriana González Andujo,* Leticia Rodríguez López,‡ Cesar Iván Elizalde Barrera,‡ Carlos Alberto Delgado Quintana,§ Ariana Román Flores,* José Ricardo Garrido García‡
* Residente de cuarto año de Medicina Interna. Hospital General Ticomán. Secretaría de Salud del Distrito Federal.
‡ Médico adscrito de Medicina Interna. Hospital General Ticomán. Secretaría de Salud del Distrito Federal.
§ Jefe de Servicio del Servicio de la Unidad de Cuidados Intensivos del Hospital de Infectología del Centro Médico Nacional "La Raza".
Fecha de recepción: 31 de mayo 2015
Fecha de aceptación: 14 de septiembre 2015
RESUMEN
Objetivo: Determinar si la profilaxis con pravastatina en comparación con el placebo disminuye el riesgo de neumonía asociada al ventilador (NAV). Material y métodos: Se realizó un ensayo clínico controlado, doble ciego, en el Servicio de Medicina Interna del Hospital General Xoco, México, D.F., en 44 pacientes que cumplieron los criterios de inclusión y se les asignó de manera aleatoria a recibir pravastatina 40 mg (o 10 mg en caso de lesión renal) (n = 22) o placebo (n = 22). Ambos grupos se siguieron durante 10 días o hasta el fallecimiento del paciente. Resultados: Catorce (32.5%) de los 44 pacientes desarrollaron NAV, 8 (36.3%) en el grupo de pravastatina y 6 (28.7%) en el grupo placebo (p = 0.51). La mortalidad global fue de 39% (17/44 pacientes). Por grupo de tratamiento, ocurrió en 36.3% (8/22) de los pacientes que recibieron pravastatina y en el 42.8% (9/22) del grupo placebo (p = 0.53). Conclusiones: No se observó beneficio de la administración profiláctica de pravastatina en la incidencia de NAV. Consideramos necesario investigar un posible efecto benéfico de las estatinas en la supervivencia de pacientes con neumonía establecida.
Palabras clave: Incidencia, neumonía asociada al ventilador, mortalidad, pravastatina.
ABSTRACT
Objective: To determine whether prophylactic pravastatin compared to placebo reduces the risk of ventilator-associated pneumonia (VAP). Material and methods: A double-blind controlled clinical trial, was conducted at the Internal Medicine Service, Xoco General Hospital, Mexico City in 44 intubated patients who met the inclusion criteria and were randomly assigned to receive pravastatin 40 mg (or 10 mg in case of kidney failure) (n = 22) or placebo (n = 22). Groups were followed for 10 days or until the patient's death. Results: Fourteen (32.55%) of the 44 patients developed VAP, eight (36.3%) in the pravastatin group and 6 (28.7%) in the placebo group (p = 0.51). Overall mortality was 39% (17/44), and by treatment group, ocurred in 36.3% (8/22) patients in the pravastatin group and 42.8% (9/22) in the placebo group (p = 0.53). Conclusions: No benefit of prophylactic administration of pravastatin in the incidence of VAP was observed. We consider necessary to investigate a possible beneficial effect of statins on survival of patients with established infection.
Key words: Incidence, ventilator-associated pneumonia, mortality, pravastatin.
INTRODUCCIÓN
La neumonía asociada a ventilador (NAV) es la segunda causa de infección nosocomial más común en la Unidad de Cuidados Intensivos con incidencia entre 9 y 27%.1 En México, existen estudios que la reportan entre 4.3 y 48.4%.2,3 El desarrollo de esta complicación infecciosa representa un incremento de 7-9 días/paciente en la estancia hospitalaria, así como en los costos de la atención médica y la mortalidad, siendo esta última entre 24 y 50%.1-4
La llave en la patogenia de la NAV es la colonización de las vías respiratorias altas con microorganismos potencialmente patógenos como: Acinetobacter sp., Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y Staphylococcus aureus, particularmente meticilino resistente (MRSA), entre otros.4,5
Para que se produzca NAV, el delicado equilibrio entre las defensas del huésped y la colonización microbiana debe cambiar en favor de la capacidad de los patógenos a persistir e invadir las vías respiratorias inferiores.1 La intubación provoca que finalmente los microorganismos que colonizan la orofaringe se aspiren hacia las vías respiratorias bajas y se desarrolle NAV.5-7 Debido a esto, durante los últimos 25 años se han realizado diversos estudios sobre la prevención de NAV mediante el uso de la ventilación no invasiva en los pacientes en estado crítico, sin embargo, este tipo de soporte ventilatorio sólo ha demostrado utilidad en número reducido de patologías, lo cual impide su generalización.8
En la actualidad existen opciones para prevenir la aspiración de microorganismos en los pacientes que se encuentran con intubación orotraqueal, las más importantes son: a) la prevención de la transmisión cruzada de microorganismos entre los pacientes y el personal de salud; b) la posición supina con elevación de la cabecera de 30 a 45 grados; c) el uso de sondas orogástricas en comparación con las nasogástricas; d) la aspiración de secreciones subglóticas; e) mantener la presión del globo del tubo endotraqueal entre 20 y 30 cmH2O para evitar la inoculación del tracto respiratorio inferior con bacterias patógenas y f) la implementación de protocolos de extubación temprana, siempre que las condiciones del paciente lo permitan.9-11
Las estatinas (inhibidoras de la 3-hidroxi-3 metilglutaril-coenzima A reductasa) constituyen un grupo farmacológico que fue introducido al campo clínico por su propiedad hipolipemiante al disminuir las concentraciones séricas de colesterol. Poseen actividades ateroprotectoras independientes de lípidos al mejorar la disfunción endotelial mediante la inhibición, la inflamación vascular, la trombosis y el estrés oxidativo.12-14 Adicionalmente, disminuyen la producción de citocinas inflamatorias principalmente IL-1, IL-6, TNF-alfa e interferón gamma, interfieren con el reconocimiento de productos bacterianos por las células del sistema inmune y es así como suprimen la cascada inflamatoria.15 Se ha demostrado que las estatinas tienen propiedades antiapoptóticas y antioxidantes conocidas como "efectos pleiotrópicos" que podrían ser relevantes en la patogénesis de la sepsis,16-18 además de propiedades antimicrobianas directas y regulatorias de la respuesta inmune antiviral que aún se encuentran en investigación.19,20
En resumen, la neumonía asociada a ventilador es una complicación frecuente con repercusiones en términos de morbilidad y mortalidad en los pacientes hospitalizados. A pesar de las medidas actuales de prevención, esta entidad continúa afectando a más de 40% de los pacientes en algunas series reportadas. Se requiere de nuevas estrategias de profilaxis que puedan reducir la incidencia de NAV y mejorar así la calidad de la atención en los pacientes críticamente enfermos.
Realizamos una investigación para determinar la eficacia de la profilaxis con pravastatina en la reducción de la incidencia de neumonía asociada a ventilador.
PACIENTES Y MÉTODOS
Se realizó un estudio prospectivo, comparativo, aleatorizado y doble ciego de enero de 2013 a diciembre de 2014 en el Servicio de Medicina Interna del Hospital General Xoco de los servicios de salud pública del Distrito Federal, previo registro y aprobación del Comité de Ética de la Dirección de Educación e Investigación de la institución.
Se reclutó a los pacientes mediante la aplicación de los criterios de selección, proponiendo a sus familiares la participación en el estudio mediante la firma del consentimiento informado para proceder a la asignación aleatoria de alguna de las dos maniobras:
A. Pravastatina 40 mg cada 24 horas por sonda nasogástrica u orogástrica o 10 mg cada 24 horas en caso de lesión renal aguda (LRA) o depuración de creatinina < 30 mL/min./m2 calculada por la fórmula del estudio Modification of diet in renal disease (MDRD) más tratamiento estándar.
B. Tabletas placebo más tratamiento estándar.
La aleatorización de los pacientes se llevó a cabo mediante una tabla de números aleatorios y sobres cerrados numerados con la maniobra asignada.
Criterios de selección:
Inclusión:
• Pacientes mayores a 18 años.• Apoyo ventilatorio mecánico invasivo a través de intubación orotraqueal por alguno de los siguientes motivos: deterioro del estado de alerta, insuficiencia cardiaca, status epiléptico, postoperatorio, broncoespasmo o hipoxemia.
• Duración del apoyo ventilatorio mecánico mayor o igual a 48 horas.
• Primer evento de intubación durante su hospitalización.
Exclusión:
• Evidencia o sospecha de proceso infeccioso de vías respiratorias superiores o inferiores.• Enfermedad hepática activa conocida.
• Enfermedad muscular conocida (p. ej. polimiositis, dermatomiositis, distrofias, distonías, etc.).
• Elevación de la enzimas transaminasa glutámico oxalacética (TGP) y transaminasa glutámico pirúvica (TGP) al menos dos veces por encima del valor normal por cualquier causa.
• Pacientes con valores séricos de creatincinasa (CK) tres veces superior al límite normal superior.
• Hipersensibilidad a la estatinas.
• Tratamiento con estatinas previo al ingreso al estudio.
• Embarazo.
Eliminación:
• Retiro voluntario de la investigación.• Desarrollo durante el estudio de alguna de las siguientes condiciones:
- Miopatía: dolor y debilidad muscular con elevación de la CK mayor a 10 veces su valor normal.21- Rabdomiólisis: elevación de la CK cinco veces su valor normal, con concentraciones generalmente mayores a 5,000 U/L, en presencia de lesión renal aguda y acidosis metabólica.22
- Elevación de aminotransferasas al menos tres veces el valor basal de ingreso al estudio.23
MÉTODO
La profilaxis o el placebo fueron administrados desde el ingreso al estudio y durante los 10 días posteriores, siendo suspendidos en caso de presentarse neumonía asociada a ventilación mecánica. El doble cegamiento del estudio se mantuvo mediante la vigilancia de los tratamientos por un médico del Servicio de Medicina Interna, independiente al equipo de investigación.
Un caso de NAV se definió según las guías de la American Thoracic Society (ATS) como la presencia de infiltrados radiológicos nuevos o que han progresado en conjunto con dos hallazgos clínicos sugerentes de infección como fiebre, esputo purulento, leucocitosis o descenso en la oxigenación.1
Seguimiento
Clínico: se efectuó cada 24 horas a partir del ingreso y comprendió la revisión de los registros de enfermería para la verificación de signos vitales y curva térmica e identificar signos de respuesta inflamatoria sistémica o inestabilidad hemodinámica así como la consulta del expediente clínico con atención a los diagnósticos consignados por el equipo médico a cargo del paciente.
Radiológico: en todos los casos se realizó radiografía de tórax portátil al ingreso al estudio y cada 72 horas de manera programada.
Laboratorio: el día de ingreso al estudio y cada 48 horas se solicitaron concentraciones séricas de glucosa, urea, creatinina, bilirrubina total, directa e indirecta, TGO, TGP, gamma-glutamil transpeptidasa (GGT) y creatincinasa (CK) además de citometría hemática completa.
En caso necesario, se efectuaron radiografías de tórax y exámenes de laboratorio adicionales a criterio de los médicos tratantes.
Todas las variables y desenlaces clínicos fueron consignados en un formato de recolección de datos diseñado para la investigación.
Análisis estadístico
Se integró una base de datos con el software Excel para Windows XP 2003, para su posterior análisis con el programa Stata 10.0 para Mac OS.
Se utilizó media y desviación estándar para describir las variables cuantitativas con distribución normal, aquéllas con distribución no paramétrica se resumieron con mediana y rango intercuartilar 25-75. Las variables cualitativas fueron expresadas en proporciones.
Las comparaciones de variables continuas entre grupos se realizaron con la prueba t de Student para variables con distribución normal y con U de Mann-Whitney en el caso de distribución no paramétrica.
Para comparar proporciones entre grupos se utilizó chi cuadrada (χ2).
El cálculo de riesgo relativo para los desenlaces neumonía y mortalidad se realizó con el método de tabla de 2 x 2, reportando sus intervalos de confianza al 95%.
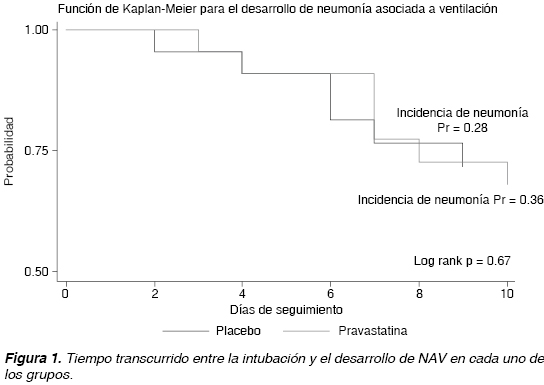
Se construyeron curvas de Kaplan y Meier para el desarrollo de neumonía en los grupos de profilaxis con pravastatina y placebo, la diferencia entre ambas funciones fue establecida con χ2 de log rank. Adicionalmente, se calcularon los hazard ratios de la profilaxis con pravastatina para los desenlaces neumonía y mortalidad.
En todos los casos se consideró significancia estadística con p < 0.05, con hipótesis matemática a dos colas.
RESULTADOS
Se incluyó una muestra de 44 pacientes, 59.1% fueron mujeres (n = 26). Cada grupo de tratamiento (pravastatina o placebo) se integró por 22 pacientes. El cuadro I muestra las variables demográficas y clínicas de la población.

El peso corporal fue significativamente mayor en el grupo placebo respecto a los pacientes que recibieron pravastatina (72.9 ± 18.2 kg versus 62.6 ± 9.7 kg, p = 0.02).
Se observó que 32.55% (n = 14) de los pacientes eran fumadores, no observándose diferencias estadísticas respecto a esta variable entre los grupos (p = 0.53).
Treinta y seis de los 44 pacientes (81.81%) del estudio presentaron comorbilidades. Las principales fueron hipertensión arterial sistémica en 58% (26/44), diabetes mellitus tipo 2 en 44% y enfermedad renal crónica en 10/44 pacientes (23%). La comparación por grupos no mostró diferencias (p = 0.51).
El cuadro II muestra los motivos de intubación de los pacientes durante el desarrollo del estudio donde se encontró al deterioro del estado de alerta como causa principal (72%). No se apreciaron diferencias estadísticas entre ambos grupos.

Durante la hospitalización, 77.27% de los pacientes del estudio (34/44) recibieron antibiótico, 72.7% en el grupo de pravastatina y 81.8% en el grupo placebo (p = 0.47).
La incidencia global de NAV fue de 32.55% (14/44), mientras que en el grupo de profilaxis con pravastatina ésta fue de 36.3% (8/22), en comparación al 28.57% (6/22) del grupo placebo (p = 0.51).
En términos de mortalidad, ésta se presentó en 39.5% de los pacientes del estudio (17/44) y respecto al análisis por grupos, en 36.3% (8/22) del grupo de pravastatina y en 42.8% (9/22) del grupo placebo (p = 0.53).
El riesgo relativo (RR) para el desarrollo de neumonía en función de la exposición a la profilaxis con pravastatina fue de 1.33 (IC 95% 0.55-3.22). Esta medición para el desenlace mortalidad mostró RR = 0.8 (IC 95% 0.31-1.99).
Los hazard ratios calculados para el desarrollo de neumonía y mortalidad en función de la profilaxis con pravastatina se reportan en 1.24 (IC 95% 0.43-3.6) y 0.78 (IC 95% 0.31-1.99) respectivamente. En la figura 1 se muestran las curvas de Kaplan y Meier para el desarrollo de neumonía.
El comportamiento de la creatincinasa mostró concentraciones similares en los grupos de pravastatina y placebo en tres determinaciones consecutivas a lo largo del estudio. Ningún paciente desarrolló elevaciones enzimáticas superiores al valor referido en los criterios de eliminación (Figura 2).

No se apreció diferencia estadística en las concentraciones de TGO y TGP entre los respectivos grupos (Figuras 3 y 4).


DISCUSIÓN
La neumonía asociada a la ventilación mecánica incrementa la morbilidad y el riesgo de mortalidad en los pacientes en estado crítico.5
Realizamos un estudio para evaluar el efecto de la profilaxis con pravastatina en la incidencia de neumonía asociada a ventilación mecánica observando mayor frecuencia de ésta en el grupo de intervención respecto a placebo (36.3 versus 28.5%, p = 0.51), sin embargo, dicha diferencia no fue estadísticamente significativa.
Los resultados rechazan nuestra hipótesis de trabajo en la que se consideró que la administración de pravastatina modificaría la incidencia de esta complicación.
En el 2006, Majumdar y colaboradores24 compararon la incidencia de neumonía adquirida en la comunidad entre un grupo de pacientes que recibía tratamiento regular con estatinas y un grupo control sin encontrar diferencias estadísticas en la frecuencia así como en la necesidad cuidados intensivos o en la mortalidad. La población de estudio y la variable dependiente son diferentes a los contemplados en nuestra investigación, sin embargo, sus resultados se encuentran en la misma tendencia clínica.
Frost y cols. en 2007 evaluaron a pacientes con enfermedad pulmonar obstructiva crónica e infección pulmonar activa por el virus de la influenza, reportando menor mortalidad en los usuarios de estatinas al compararlos con el grupo control, en particular cuando éstas se administraron en dosis moderadas (mayor a 4 mg/día).25
En 2011, Makris y colaboradores utilizaron pravastatina como un agente profiláctico de NAV comparándola con placebo. El grupo que recibió pravastatina mostró una reducción de 12% (p = 0.11) en la incidencia de esta complicación y disminución significativa de la mortalidad global (15%).20
En un estudio de casos y controles, Gunnar y su grupo encontraron que los pacientes que recibían estatinas presentaron menor riesgo de hospitalización por neumonía comunitaria así como menor mortalidad a los 30 días después del evento de neumonía.26
De forma similar, en nuestra investigación, el grupo que recibió pravastatina presentó menor mortalidad respecto a placebo (36.3 versus 42.8%, p = 0.53).
Consideramos que las estatinas pudiesen participar en la reducción de la mortalidad de estos pacientes debido a que ayudan a mejorar la función endotelial, participan en la estabilización de placas ateroscleróticas, disminuyen el estrés oxidativo y la inflamación, además de inhibir la respuesta trombogénica.16
Consideramos que existieron factores que influyeron en los desenlaces de nuestra investigación. En primer lugar, los pacientes de ambos grupos recibieron antibiótico como parte del manejo médico durante la hospitalización, lo cual pudo modificar el desarrollo de NAV. Adicionalmente, el tiempo de profilaxis con estatina en nuestro estudio (10 días) fue menor en comparación con otras investigaciones en las que la intervención se mantuvo hasta por 30 días.
Finalmente, el tamaño muestral (n = 44) pudo afectar la significancia matemática, lo cual limita la generalización de los resultados.
Nuestros datos se encuentran en tendencia con la información científica disponible en este campo, es necesario contar con ensayos clínicos controlados de mayores poblaciones para determinar un posible beneficio de las estatinas en la sobrevida de pacientes con neumonía asociada a ventilación mecánica.
CONCLUSIÓN
En nuestro estudio no se observó beneficio de la administración profiláctica de pravastatina en la incidencia de neumonía asociada a la ventilación.
Consideramos necesario investigar un posible efecto benéfico de las estatinas en la sobrevida de pacientes con neumonía establecida.
AGRADECIMIENTOS
Agradezco profundamente la aportación a este trabajo de la Dra. Ana Karen Garro Almendaro.
REFERENCIAS
1. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416. [ Links ]
2. Consenso Mexicano de Diagnóstico y Tratamiento de la Neumonía. Neumonías: Un Consenso Nacional de Expertos. México: Dresde Editorial Médica; 2002. [ Links ]
3. Chaires R, Palacios A. Neumonía asociada a la ventilación mecánica: cómo prevenirla y situación en México. Rev Asoc Mex Med Crit y Ter Int. 2013;27(3):138-145. [ Links ]
4. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care. 2002;165:867-903. [ Links ]
5. Su LX, Meng K, Zhang X. Diagnosing ventilator-associated pneumonia in critically ill patients with sepsis. Am J Crit Care. 2012;21:e110-e119. http://dx.doi.org/10.4037/ajcc2012732 [ Links ]
6. Meduri GU. Diagnosis and differential diagnosis of ventilator-associated pneumonia. Clin Chest Med. 1995;16:61-93. [ Links ]
7. Grap MJ, Munro CI, Unoki T. Ventilator associated pneumonia: the potential critical role of emergency medicine in prevention. J Emerg Med. 2012;42(3):353-362. [ Links ]
8. Maheshwari V, Paioli D, Rothaar R, Hill NS. Utilization of noninvasive ventilation in acute care hospitals: a regional survey. Chest. 2006;129:1226-1233. [ Links ]
9. Klompas M. Prevention of ventilator-associated pneumonia. Expert Rev Anti Infect Ther. 2010;8(7):791-800. [ Links ]
10. Palomar M, Rodríguez P. Prevención de la infección nosocomial en pacientes críticos. Med Int. 2010;34(8):523-533. [ Links ]
11. Schultz MJ, Haas LE. Antibiotics or probiotics as preventive measures against ventilator-associated pneumonia: literature review. Crit Care. 2011;15(1):R18. http://dx.doi.org/10.1186/cc9963 [ Links ]
12. Pan HY, DeVault AR, Swites BJ, Whigan D, Ivashkiv E, Willard DA, et al. Pharmacokinetics and pharmacodynamics of pravastatin alone and with cholestyramine in hypercholesterolemia. Clin Pharmacol Ther. 1990;48:201-207. [ Links ]
13. Joo SJ. Anti-inflammatory effects of statins beyond cholesterol lowering. Korean Circ J. 2012;42(9):592-594. [ Links ]
14. Hauacuja F, Gómez M. Efectos de las estatinas más allá del colesterol. Rev Endocr y Nut. 2008;14(2):73-88. [ Links ]
15. Mennicket S, Bravo M. Efectos pleiotrópicos de las estatinas. Rev Med Chile. 2008;136:775-782. [ Links ]
16. Rohilla A, Rohilla S, Kumar A. Pleiotropic effects of statins: a boulevard to cardioprotection. Arab J Chem. 2011. http://dx.doi.org/10.1016/j.arabjc.2011.06.025 [ Links ]
17. Otvos JD, Shalaurova I, Freedman DS, Rosenson RS. Effects of pravastatin treatment on lipoprotein subclass profiles and particle size in the PLAC-I trial. Atherosclerosis. 2002;160:41-48. [ Links ]
18. Albert MA, Danielson E, Rifai N, et al. Effect of statin therapy on C-reactive protein levels: the pravastatin inflammation/CRP evaluation (PRINCE): a randomized trial and cohort study. JAMA. 2001;286:64-70. [ Links ]
19. Jerwood S, Cohen J. Unexpected antimicrobial effect of statins. J Antimicrob Chemother. 2008;61:362-364. [ Links ]
20. Makris D, Manoulakas E, Komnos A. Effect of pravastatin on intensive care unit: open label, randomized study. Crit Care Med. 2011;39(11):2440-2446. [ Links ]
21. Armitage J. The safety of statins in clinical practice. Lancet. 2007;370:1781-1790. [ Links ]
22. Melli G, Chaudhry V, Cornblath DR. Rhabdomyolysis: an evaluation of 475 hospitalized patients. Medicine. 2005;84:377-385. [ Links ]
23. Pfeffer MA, Keech A, Sacks FM, et al. Safety and tolerability of pravastatin in long-term clinical trials: prospective pravastatin pooling (PPP) project. Circulation. 2002;105:2341-2346. [ Links ]
24. Majumdar SR, McAlister FA, Eurich DT, Padwal RS, Marrie TJ. Statins and outcomes in patients admitted to hospital with community acquired pneumonia: population based prospective cohort study. BMJ. 2006;333(7576):999. [ Links ]
25. Frost FJ, Petersen H, Tollestrup K, et al. Influenzae and COPD mortality protection as peliotropic, dose-depent effects of statins. Chest. 2007;131:1006-1012. [ Links ]
26. Gunnar A, Beck R, Hammerich A. The impact of statin use on pneumonia risk and outcome: a combined population-based case-control and cohort study. Crit Care. 2012;16(4):R122. http://dx.doi.org/10.1186/cc11418 [ Links ]
Correspondencia:
Dra. Adriana González Andujo
Calle Magdalena Núm. 410 int. 403,
Colonia Del Valle, 03100,
Delegación Benito Juárez,
México, Distrito Federal.
E-mail: adryandujo@gmail.com
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/medicinacritica














