Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Mexicana de Medicina Crítica y Terapia Intensiva
versión impresa ISSN 0187-8433
Rev. Asoc. Mex. Med. Crít. Ter. Intensiva vol.29 no.3 Ciudad de México jul./sep. 2015
Tema de revisión
Ferritina y síndrome hiperferritinémico. Su impacto en el enfermo grave; conceptos actuales
Ferritin and hiperferritinemic syndrome. Its impact on the seriously ill; current concepts
Raúl Carrillo Esper,* Carlos Peña Pérez,‡ Adriana Denise Zepeda Mendoza,§ José Martín Meza Márquez,§ Rosalinda Neri Maldonado,§ Cynthia Margarita Meza Ayala,§ Dulce María Carrillo Córdova,II Carlos Alberto Carrillo CórdovaII
* Academia Nacional de Medicina. Academia Mexicana de Cirugía. Unidad de Terapia Intensiva. Fundación Clínica Médica Sur.
‡ Adscrito al Servicio de Medicina Intensiva. Fundación Clínica Médica Sur.
§ Residentes de Medicina Intensiva. Fundación Clínica Médica Sur.
II Facultad de Medicina. UNAM.
Fecha de recepción: 09 de enero 2015
Fecha de aceptación: 06 de febrero 2015
RESUMEN
La ferritina es una molécula fijadora de hierro que lo almacena para que esté disponible para varias funciones celulares, pero que también es importante en otras funciones de las que destacan la inflamación, y las enfermedades neurodegenerativas y malignas. Niveles elevados de ferritina se presentan en varias enfermedades asociadas a gran inflamación, de las que destacan la enfermedad de Still del adulto, el síndrome de activación de macrófagos, la sepsis y el choque séptico y el síndrome de anticuerpos antifosfolípido catastrófico. La hiperferritinemia se asocia con incremento de mortalidad y disfunción orgánica múltiple en pacientes críticamente enfermos, por lo que los síndromes hiperferritinémicos deben de ser conocidos por el intensivista. El objetivo de este trabajo es presentar conceptos actuales relacionados a la ferritina y al síndrome hiperferritinémico.
Palabras clave: Ferritina, síndrome hiperferritninémico, sepsis.
ABSTRACT
Ferritin is an iron-binding molecule that stores iron for vital cellular processes, but also plays a role in a large number of other conditions, including inflammatory, neurodegenerative and malignant diseases. A markedly elevated serum ferritin has been associated with inflammatory conditions such as adult-onset Still's disease, macrophage activation syndrome, Sepsis and Septic shock and catasthrophic antiphospholipid syndrome. Hyperferritinemia is associated with increased mortality, multiple organ dysfunction syndrome and critical illness so the hyperferritinemic syndrome must be kown by the intensivist. The aim of this paper is to present current concepts related to ferritin and hyperferritinemic syndrome.
Key words: Ferritin, hyperritinemic syndrome, sepsis.
Los niveles de ferritina sérica se incrementan en procesos inflamatorios agudos, por lo cual se considera un reactante de fase aguda que no se ha considerado como parte de los procesos fisiopatológicos y marcador en el enfermo grave.1 Existen diversas enfermedades que cursan con niveles de ferritina elevados que comparten diferentes características y que se han incluido en el síndrome hiperferritinémico (SH). El objetivo de este trabajo es revisar los conceptos actuales relacionados a la ferritina y al SH y resaltar su importancia en el enfermo grave.
FERRITINA
La ferritina es una proteína de almacenamiento tisular de hierro con un peso molecular superior a 440,000 Dalton. Se compone de una capa proteica (apoferritina), constituida por 24 subunidades, y un núcleo férrico con aproximadamente 2,500 iones de hierro, en las isoformas básicas. Su estructura se caracteriza por dos subunidades distintas, la subunidad ácida del tipo H (heavy) y la ligeramente básica del tipo L (light). Las últimas son causales del depósito de hierro a largo plazo y aparecen principalmente en el hígado, el bazo y la médula ósea. Las isoferritinas ácidas se encuentran particularmente en el músculo cardiaco, la placenta, el tejido tumoral y, en cantidades inferiores en los órganos de depósito.1-3 La subunidad H posee la actividad ferroxidasa necesaria para la captación del hierro y la subunidad L cataliza la formación del núcleo férrico en el interior de la molécula (Figura 1).2,3
La ferritina, además de fijar y almacenar el hierro de una forma biológicamente disponible para procesos celulares vitales, protege a las proteínas, lípidos y al ADN de la toxicidad de este elemento metálico.4 La ferritina también juega un papel importante en otras condiciones como la inflamatoria, neurodegenerativa y en enfermedades malignas.5
La cantidad de ferritina citoplasmática es regulada por la trascripción de ARNm de ferritina H y L en respuesta a una reserva intracelular de hierro "quelable" o "lábil". Además del hierro, la síntesis de ferritina es regulada por citoquinas en distintos niveles (transcripcional, postranscripcional, y traslacional) durante el desarrollo, diferenciación y proliferación celular, así como en la inflamación.6
La expresión de la ferritina también está regulada por el estrés oxidativo, la respuesta hormonal (hormona tiroidea), factores de crecimiento, segundos mensajeros, hipoxia-isquemia e hiperoxia.1 Los lipopolisacáridos (LPS), un componente de la membrana externa de las bacterias Gram negativas, inducen una variedad de reacciones que involucran a la ferritina. En modelos animales, la administración de LPS pueden aumentar expresión de ferritina. Además, las prostaglandinas de ciclopentenona, que están involucradas en la respuesta inflamatoria y febril, así como en la replicación viral, inducen la formación de L-ferritina en monocitos humanos (Figura 2).6

El papel de la ferritina como molécula de señalización requiere la presencia de un receptor específico. Sólo los receptores de ferritina expresados en las células hepáticas se unen a la H y L-ferritina, mientras que los expresados en los otros tejidos se unen sólo a la cadena H. En un modelo murino experimental, la inmunoglobulina de células T y el dominio mucina TIM-2 fue identificado como un receptor para H-ferritina en células B y T, en hígado y riñón. TIM-2 es un miembro de la familia de genes TIM de células T, que es una familia de células con moléculas de superficie implicadas en la regulación de la respuesta inmune. Recientemente, otro receptor de superficie celular para ferritina fue identificado, el Scara5 es un receptor eliminador que puede unirse a diversos ligandos, y en contraste a TIM-2, que se une preferentemente a L-ferritina. Es evidente que pueden existir receptores de ferritina adicionales y tener funciones específicas en diferentes poblaciones de células.6
La vía secretora detallada de ferritina sérica no es completamente entendida. Los hepatocitos, macrófagos y las células de Kupffer secretan ferritina. La ferritina sérica es pobre en hierro y principalmente consiste en subunidades L aunque existe una paradoja, ya que hay evidencia de que sus receptores tienen mayor afinidad para la H-ferritina. La incorporación de hierro es la única función de la L-ferritina establecida por estudios in vitro, pero los estudios más recientes han mostrado que la L-ferritina puede tener un efecto estimulante sobre la proliferación celular, independientemente de la disponibilidad de hierro. Estos hallazgos sugieren que la L-ferritina puede afectar a algunas vías celulares que aún no son identificadas.7
Los valores normales de ferritina dependen de diversos factores, como el género, la edad y la raza. La ferritina tiende a presentar una concentración más elevada en varones, en raza negra, y se incrementa con la edad. No obstante, suelen aceptarse como valores normales entre 30 y 300 mg/L en hombres y entre 15 y 200 mg/L en mujeres.8
FERRITINA E INMUNIDAD
La hiperferritinemia se asocia con varias condiciones inflamatorias, tales como sepsis, síndrome de respuesta inflamatoria sistémica (SRIS), el síndrome de disfunción multiorgánica (SDMO), síndrome de activación de macrófagos, entre otros.9 Por lo tanto, la ferritina es considerada un reactante de fase aguda, que se define como proteínas que, en presencia de inflamación, elevan su concentración en sangre 25% como mínimo.10 En los pacientes críticos, la hiperferritinemia se asocia con la gravedad de la enfermedad subyacente. Los niveles demasiado altos de ferritina (> 3,000 ng/mL) se asocian con mayor mortalidad de una manera exponencial.11
La H-ferritina tiene efectos inmunomoduladores importantes, además de ser una proteína de fase aguda durante la infección sistémica posterior a su activación por sistema inmunitario innato; la ferritina retrasa y modula la producción de anticuerpos por los linfocitos B, disminuye la fagocitosis y regula la granulo monocitopoyesis. Esto se ha demostrado en modelos in vitro con moléculas similares a H-ferritina como es la cadena quimérica humana clonada de la placenta ((PLIF) ferritina inmunomoduladora de la placenta) la cual ha demostrado que suprime la mielopoyesis y activación células T, comprobando que la H-ferritina tiene efectos inmunomoduladores importantes.12
Los mecanismos por los que condiciona esta inmunomodulación aún son desconocidos pero se cree que están relacionados de forma directa o indirecta con la vía de señalización de receptores de H-ferritina en los linfocitos y la disminución de la activación de CD2, el cual actúa como cofactor para estimulación de linfocitos. Estudios recientes sugieren que la H-ferritina puede suprimir la respuesta inmunitaria por su capacidad de inducir la producción de citocinas antiinflamatorias como IL-10 en los linfocitos.13
Además de este efecto de supresión y diferenciación sobre las células hematopoyéticas existe también evidencia de que la H-ferritina juega un papel importante en la señalización de receptores de citocinas y migración celular; la H-ferritina, tiene un receptor de retroalimentación negativa para citocina 4 (CXCR4) el cual al formar el complejo H-ferritina/CXCR4 impide la señalización y evita la activación de proteínas quinasa activadoras de mitogénesis (MAPK) y esta actividad quinasa es indispensable en la proliferación, diferenciación y migración celular.14
La H-ferritina actúa como una molécula de señalización inflamatoria al activar la TIM-2 como una vía independiente, que inicia la fosforilación por medio de proteína quinasa y activación de MAPK, que activa el factor nuclear kappa Beta (FN-κβ) cuya vía final es expresar IL-1B, óxido nítrico sintetasa inducible y otros mediadores inflamatorios. Es importante señalar el hecho de que esta función es independiente del contenido de hierro en la ferritina, lo que sugiere que la ferritina exógena puede tener alguna función independiente de su papel clásico como una proteína de unión y almacenamiento del hierro. Se ha demostrado que en tejidos con predominio de L-ferritina tienen la capacidad de activar las vías de señalización siendo un importante mediador inflamatorio. También se ha propuesto que la ferritina tiene un importante papel en el desarrollo de estados fibrogénicos e inflamatorios crónicos de órganos como corazón, pulmón, riñón y páncreas, ya que todos ellos tienen un tipo celular parecido al de los hepatocitos que tienen una respuesta de fibrogénesis a la inflamación (Figura 3).15-17
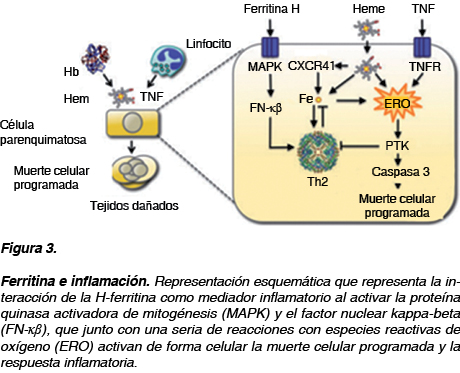
Es bien conocida la asociación de hiperferritinemia y enfermedades autoinmunes como lupus eritematoso sistémico (LES), artritis reumatoide (AR), esclerosis múltiple (EM) y síndrome antifosfolípidos (SAF). La importancia de la ferritina se ha corroborado con el descubrimiento de autoanticuerpos contra la ferritina en diferentes enfermedades autoinmunes (Cuadro I).18
En modelos experimentales murinos se ha descrito una asociación con el gen familiar TIM en el mismo locus que regula la hipersensibilidad de vías respiratorias y la producción de citocinas por Th2. Algunos de estos polimorfismos de los genes TIM están asociados con enfermedades autoinmunes como AR.19
En estudios experimentales in vitro se ha demostrado que específicamente el gen TIM-2 es un regulador negativo para la respuesta inmune de Th2. Lo que ha demostrado que la ferritina actúa como inmunosupresor y el gen TIM-2 es un receptor específico de ferritina por lo que se ha propuesto que la H-ferritina puede tener un papel específico para la inmunidad por medio de diferentes mecanismos e interacción directa del complejo H-ferritina/TIM-2, por lo que se sugiere que al inhibir la H-ferritina se podría mediar la supresión en los procesos infecciosos. Por lo tanto, cuando se pierde este equilibrio se puede favorecer el desarrollo de enfermedades autoinmunes.20
La ferritina también tiene un papel fundamental en el control de la inmunidad a través de su efecto sobre el CXCR4, provocado una retroalimentación negativa y como se ha mencionado este receptor de citocina es conocido por su capacidad de activar monocitos, neutrófilos, células B y células plasmáticas en modelos murinos con enfermedades reumatológicas como nefritis lúpica. Por lo cual, en estos estudios experimentales el tratamiento específico con antagonistas de CXCR4 ha disminuido la afectación a órgano blanco de esta patología.21
Como se describió previamente, las citocinas infamatorias pueden inducir la expresión de ferritina y la ferritina induce la producción de mayor citocinas antiinflamatorias como la IL-10; por lo tanto, la ferritina es un mecanismo inmunosupresor importante, por medio de lo que parece ser una compleja interacción entre ferritina y citocinas en el control de mediadores inflamatorios y antiinflamatorios, así que la ferritina es una molécula que tiene efectos tanto inmunosupresores como inflamatorios. Sus efectos dependen probablemente de la activación de diferentes vías, receptores y efectores (H o L-ferritina) según el contexto. Esta idea se basa en la hipótesis de los dos hits, la cual en modelos in vivo con altos niveles de ferritina para ser patogénicos requieren de este segundo hit como puede ser un proceso infeccioso agudo o predisposición genética para su activación. Esto puede explicar por qué en el síndrome hereditario de hiperferritinemia y cataratas existen altos niveles de ferritina sin una respuesta inflamatoria.15
SÍNDROMES HIPERFERRITINÉMICOS
Síndrome de activación de los macrófagos (MAS)
El síndrome hemofagocítico, también conocido como linfohistiocitosis hemofagocítica (HLH), representa una condición grave y de elevada mortalidad (8-22%), en la cual se produce una respuesta inmune incontrolada e inefectiva que condiciona inflamación grave y se caracteriza por proliferación de histiocitos y hemofagocitosis.22,23
Existen dos formas de síndrome hemofagocítico:
a) Genética: son autosómicas recesivas o ligadas a cromosoma X y se presentan con mayor prevalencia en adolescentes.24 Las causas familiares se originan debido a mutaciones en el gen de la perforina o en genes importantes para la exocitosis de gránulos citotóxicos. Los gránulos contienen perforinas y granzimas que inducen apoptosis de las células diana infectadas y la perforina regula la respuesta inflamatoria inhibitoria.Para el diagnóstico se requiere la presencia de mutaciones genéticas e historia familiar (Cuadro II).22,23
b) Adquirida: se encuentran asociadas principalmente con infecciones virales (citomegalovirus, Epstein-Barr) bacterias, parásitos (Leishmaniasis) y hongos; así como en relación con enfermedades autoinmunes, neoplasias, medicamentos (metotrexate, anti-TNF-α, sulfasalazina) y estados de inmunodeficiencia adquirida.
El síndrome de activación de macrófagos (MAS) es una forma adquirida de HLH que puede presentarse en niños y adultos. Se asocia con enfermedades autoinmunes con mayor frecuencia a la artritis idiopática juvenil sistémica (8%) y su mortalidad oscila entre 10-22%.25 Con mayor asociación en los pacientes con LES, AOSD, RA y con menos frecuencia en la espondiloartropatía y vasculitis.23,24
Las características clínicas de la HLH son fiebre prolongada, hepatoesplenomegalia, citopenias, alteraciones neurológicas y altos niveles de ferritina, triglicéridos, transaminasas, bilirrubinas y coagulopatía con hipofibrinogenemia.22-24 La hemofagocitosis no se presenta cuando la enfermedad inicia pero por lo general se encuentra presente conforme progresa la enfermedad.24
Patogenia
Tanto en la genética como en la adquirida hay una función ausente o inapropiada de las células asesinas naturales (NK) y de las células T citotóxicas.24,25 Existe una pérdida de la interacción macrófago-linfocito con los consiguientes aumentos de citocinas derivadas de células T y macrófagos, en particular TNF-α, interleucina (IL)-1, IL-6, interferón gamma (IFN-γ), receptor soluble de IL-2 (sIL-2R), y receptores de TNF solubles (sTNFR). Esta disregulación conduce a una reacción inflamatoria sistémica intensa. El receptor soluble de IL-2 es un marcador muy importante puesto que aumenta consistentemente durante el HLH activo.24
A pesar de la estrecha relación del MAS con otra formas de HLH, existen importantes diferencias clínicas, de laboratorio y terapéuticas que inclusive conducen a una propuesta de modificar los criterios para el MAS.24-26 En contraste con otras formas de HLH, en el MAS las citopenias son menos severas, de forma inicial se reduce la eritropoyesis, se incrementa la granulopoyesis, aparece un deterioro cardiaco grave y la coagulopatía es más pronunciada. Los macrófagos activados no sólo secretan ferritina, también factor activador del plasminógeno con aumentos de plasmina e hiperfibrinólisis. La proteína C reactiva tiende a ser mayor y cuando se compara el perfil de citosinas, la IL-β proinflamatoria es elevada y las concentraciones de IL-6 y TNF-α tienden a ser más elevadas.25-27 Además, la respuesta al tratamiento es diferente y la mayoría de los casos MAS responden a terapias menos agresivas en comparación con la respuesta de las formas genéticas de HLH.24
Enfermedad de Still de inicio en el adulto (ESA)
Es un trastorno inflamatorio sistémico, raro de etiología desconocida y diagnóstico difícil. Fue descrito por George Still en 1987; tiene mayor prevalencia en el sexo femenino y población joven.28
Su etiología es desconocida pero se plantea la hipótesis de que puede ser un síndrome de reactivación donde diversos agentes infecciosos desencadenan la enfermedad en un huésped genéticamente predispuesto. Numerosos estudios han relacionado esta entidad con HLA como B17, B18, B35 y DR2, DR4, DRw6, DRB1.28
Las causas infecciosas que se han asociado con la enfermedad de Still son virus (citomegalovirus, Epstein-Barr, rubeola, parotiditis, parainfluenza, influenza, coxsackievirus B4, hepatitis B, C, parvovirus B19) y bacterias como Mycoplasma pneumoniae, Chlamydia pneumoniae, Yersinia enterocolítica, Brucella abortus y Borrelia burgdorferi). Reciente literatura ha presentado casos de ESA-like asociado a neoplasias, 60% secundaria a tumores sólidos de pulmón y mama, y 40% a neoplasias hematológicas.28
Se caracteriza por fiebre generalmente mayor de 39 oC, de predominio vespertina; artritis simétrica que afecta principalmente rodillas, muñecas y tobillos; rash evanescente (lesiones maculopapulares no pruriginosa, color rosa-salmón en tronco y extremidades) que se relaciona con fiebre diurna. Puede haber hepatomegalia e ictericia.28,29
Hallazgos de laboratorio incluyen leucocitosis (predominantemente neutrófilos), anemia, trombocitosis, VSG elevada, y altos niveles de ferritina.30,31 La validez de la hiperferritinemia como una herramienta de diagnóstico se evaluó en un estudio retrospectivo francés con 49 pacientes en los que un aumento de cinco veces en la ferritina sérica tenía 80% de sensibilidad y 41% de especificidad; de manera similar, en un estudio japonés con 82% de sensibilidad y 46% de especificidad.32,33
Uppal y cols. observaron que hasta en 89% de estos pacientes presentaban niveles elevados de ferritina, cerca de 50% presentan valores de ferritina cinco veces del valor normales. Valores tan altos como 4,000-30,000 ng/mL no son poco frecuentes. Se ha relacionado el incremento de la ferritina sérica con el grado de actividad de la enfermedad.29,30
Un marcador de diagnóstico más específico que la ferritina es su fracción glicosilada. En la ESA, la glicosilación de la ferritina sufre un colapso encontrando valores inferiores al 20%.28,32 Fautrel y cols. utilizaron la ferritina glicosilada (GF) en combinación con un aumento de cinco veces de la ferritina sérica alcanzando una especificidad 92.9% y una sensibilidad de 43%.32
En un estudio reciente que comparó cuatro grupos de criterios diagnósticos en una población china, el conjunto Yamaguchi tenía la más alta sensibilidad (78.57%) y 87.14% mejor exactitud; sin embargo, en este estudio no se incluyó a la GF como herramienta diagnóstica. La clasificación de Fautrel incluye a la ferritina glucosidasa y alcanza 80.6 y 98.5% de sensibilidad y especificidad correspondientemente (Cuadro III).28
La ferritina sérica se incrementa por ser un reactante de fase aguda en procesos inflamatorios y por incremento de su liberación desde las células hepáticas dañadas; así mismo, la hipercitocinemia (IL 1β, IL 18, TNFα e IL6) aumentan su producción.29 Similar al síndrome de activación de macrófagos, la activación de macrófagos y neutrófilos tiene un papel importante en hiperferritinemia así como en la patogénesis de la ESA.28,34 En la enfermedad de Still se observan predominantemente citocinas de Th1 en sangre periférica y en tejidos. La respuesta inmune de Th1 se caracteriza por incremento de IL-2, TNF-α e INF-γ las cuales estimulan a las células B que producen IgG2a que estimula a los macrófagos, monocitos y células NK que generan incrementos de IL-6, IL-8, TNF-α e INF-γ.29,35 La IL-1β se produce por los macrófagos y ésta se eleva en pacientes con enfermedad de Still en la fase aguda y crónica, se considera un indicador de la severidad de la enfermedad,23 al igual la elevación receptor soluble de IL-2 es un marcador de la activación de las células T por tanto de la actividad de la enfermedad.36,37 Sin embargo, existe controversia sobre la importancia de IL-1b como distintiva de ESA de otros diagnósticos.23 Las células NK-T son numérica y funcionalmente deficiente en ESA, similar a lo observado en lupus eritematoso y artritis reumatoide.28,38
Síndrome antifosfolípido catastrófico (SAFC)
También llamado síndrome de Asherson, éste es una variante de síndrome antifosfolípidos (SAF), caracterizado por daño multiorgánico desarrollando, en periodos cortos de tiempo, alteraciones en la coagulación, con evidencia histopatológica de trombosis en venas de pequeño calibre y confirmación por laboratorios de anticuerpos antifosfolípido con niveles muy elevados.38
Dependen de la gravedad del cuadro, usualmente desencadenado por trauma o infección, con estrecha relación con el síndrome de respuesta inflamatoria sistémica (SIRS).38,39
El síndrome de antifosfolípido catastrófico representa sólo 1% de los casos de síndrome de anticuerpos antifosfolípidos (SAF), con una mortalidad mayor al 50%, siendo las complicaciones cardiacas la causa más frecuente y cursando en la mayoría de los casos con evolución tórpida e ingreso a Unidad de Terapia Intensiva (UTI).39
Las microangiopatías trombóticas son un grupo de entidades caracterizadas por la presencia de hemólisis y esquitocitos con presentaciones tales como: púrpura trombocitopénica trombótica (PTT), síndrome urémico-hemolítico, síndrome de HELLP (hemólisis, enzimas hepáticas elevadas y disminución de recuento plaquetario), hipertensión maligna, crisis de escleroderma renal, cáncer diseminado, infección por virus de la inmunodeficiencia humana (VIH), y se precipita también por fármacos como ciclosporina A, ticlopidina y clopidogrel.40
Aproximadamente 55% de los casos están asociados con un factor desencadenante desconocido (90%) el resto a infección (40%), trauma (28%) y neoplasias (5.5%) principalmente.41,42 Las primeras manifestaciones suelen ser pulmonares en 24%, neurológicas en 18% y renales 18%, siendo causa de mal pronóstico la asociación de complicaciones cardiacas y pulmonares.42 En este tipo de pacientes se ha encontrado una importante asociación con hiperritinemia, ya que se presenta en 71% de los pacientes con niveles por arriba de 100 ng/mL.43
Las manifestaciones clínicas dependen principalmente de complicaciones tromboembólicas y de las manifestaciones del síndrome de respuesta inflamatoria sistémica.44 El mecanismo no está bien establecido, pero se tiene la teoría basada en una inflamación multisistémica causado por activación de citocinas como factor de necrosis tumoral alfa, IL-1, IL-6, IL-18 y factor inhibidor de migración de macrófagos, siendo la actividad incrementada de éstos la causa principal de todas las complicaciones.42,44
Los hallazgos por laboratorio se caracterizan por un conteo plaquetario menor a 100 109/L, anemia hemolítica en 35% y en muchas ocasiones acompañada de esquistocitos y en 15% con coagulación intravascular diseminada. La IgG de anticuerpos anticardiolipina se ha reportado en 83% de los casos.44
En cuanto al tratamiento se han usado anticoagulantes en 87%, esteroides 86%, recambio plasmático 39%, ciclofosfamida 36%, inmunoglobulina intravenosa 22%, y más frecuentemente una combinación de los anteriores.38,43,44
Esta entidad representa una manifestación inmunológica muy grave que pone en peligro la vida por lo cual se debe mantener especial cuidado en el diagnóstico temprano y diferencial de esta entidad para evitar la complicaciones que cursan con una elevada mortalidad.41,44
Sepsis grave y choque séptico
El choque séptico inicialmente cursa con las manifestaciones de síndrome de respuesta inflamatoria sistémica (SIRS) asociado a una infección activa; dentro de su definición se incluye sepsis e hipotensión inducida por sepsis.45
La hiperferritinemia ha estado asociada a estados de respuesta inflamatoria y sepsis y se ha encontrado que niveles más elevados de ferritina inducen mayor mortalidad; la hipercitocinemia pro y antiinflamatoria juegan el papel más importante en la fisiopatología de la sepsis alterando la regulación del sistema inmune y su respuesta inflamatoria y en la coagulación.46 Niveles disminuidos de la actividad de células asesinas naturales se han encontrado en este tipo de pacientes y se han asociado con sepsis neonatal.47
En este tipo de pacientes la hiperferritinemia ha sido tratada con recambio plasmático, inmunoglobulina intravenosa y metilprednisolona con resultados no concluyentes en cuanto a cuál es el fármaco ideal, siendo las tres intervenciones de primera línea.46
Los corticosteroides con sus efectos antiinflamatorios tienen la capacidad de inhibir la actividad inmunomoduladora de los factores de transcripción como las células natural killer NFκβ y la actividad de los activadores de proteínas (AP-1). Son citotóxicos para los linfocitos e inhiben la expresión de citocinas y diferenciación de las células dendríticas.47
La inmunoglobulina intravenosa (IgIV) ha sido benéfica con efectos antitóxicos directos y una actividad inmunomoduladora indirecta que le permite ser útil en casos de infecciones que ponen en peligro la vida y estados hiperinflamatorios.
El intercambio plasmático es capaz de eliminar varios mediadores proinflamatorios, toxinas y niveles de ferritina. La ciclosporina ha demostrado mantener una remisión a nivel genético con resultados de bajo impacto si se aplica sola, y con mejoría si se usa con corticoides.48-50
CONCLUSIONES
La ferritina es una proteína pleiotrópica relacionada no sólo al metabolismo del hierro sino que también juega un papel importante como reguladora de la inmunidad y como mediadora de inflamación y disfunción microcirculatoria. Se han descrito diversas entidades clínicas que se incluyen dentro del término de síndromes hiperferritinémicos que se caracterizan por su gravedad y disfunción multiorgánica, por lo que deben de ser manejados en la Unidad de Terapia Intensiva. Por lo anterior es prioritario que el intensivista conozca a fondo estas entidades, su diagnóstico, tratamiento y a una de las moléculas centrales de su fisiopatología molecular, la ferritina.
REFERENCIAS
1. Rosário C, Zandman-Goddard G, Meyron-Holtz EG, D'Cruz DP, Shoenfeld Y. The Hyperferritinemic Syndrome: macrophage activation syndrome, Still's disease, septic shock and catastrophic antiphospholipidsidrome. BMC Medicine. 2013;11:185. [ Links ]
2. Elizabeth CT. Ferritin: at the crossroads of iron and oxygen metabolism. J Nutr. 2003;133:1549-1553. [ Links ]
3. Gozzelino R, Soares MP. Coupling Heme and Iron Metabolism via Ferritin H Chain. Antioxid Redox Signal. 2014;10:1754-1769. [ Links ]
4. Knovich MA, Storey JA, Coffman LG, Torti SV, Torti FM. Ferritin for the clinician. Blood Rev. 2009;23:95-104. [ Links ]
5. Wang W, Knovich MA, Coffman LG, Torti FM, Torti SV. Serum ferritin: past, present and future. Biochim Biophys Acta. 2010;1800:760-769. [ Links ]
6. Recalcati S, Invernizzi P, Arosio P, Cairo G. New functions for an iron storage protein: the role of ferritin in immunity and autoimmunity. J Autoimmun. 2008;30:84-89. [ Links ]
7. Cohen LA, Gutierrez L, Weiss A, Leichtmann-Bardoogo Y, Zhang DL, Crooks DR, et al. Serum ferritin is derived primarily from macrophages through a nonclassical secretory pathway. Blood. 2010;116:1574-1584. [ Links ]
8. Zacharski LR, Ornstein DL, Woloshin S, Schwartz LM. Association of age, sex, and race with body iron stores in adults: Analysis of NHANES III data. Am Heart J. 2000;140:98-104. [ Links ]
9. Demirkol D, Yildizdas D, Bayrakci B, Karapinar B, Kendirli T, Koroglu TF, et al. Hyperferritinemia in the critically ill child with secondary hemophagocyticlymphohistiocytosis/sepsis/multiple organ dysfunction syndrome/macrophage activation syndrome: what is the treatment? CritCare. 2012;16:R52. [ Links ]
10. Orbach H, Zandman-Goddard G, Amital H, Barak V, Szekanecz Z, Szucs G, et al. Novel biomarkers in autoimmune diseases: prolactin, ferritin, vitamin D, and TPA levels in autoimmune diseases. Ann NY Acad Sci. 2007;1109:385-400. [ Links ]
11. Bennett TD, Hayward KN, Farris RW, Ringold S, Wallace CA, Brogan TV. Very high serum ferritin levels are associated with increased mortality and critical care in pediatric patients. Pediatr Crit Care Med. 2011;12:233-236. [ Links ]
12. Morikawa K, Oseko F, Morikawa S. H- and L-rich ferritins suppress antibody production, but not proliferation, of human B lymphocytes in vitro. Blood. 1994;83:737-743. [ Links ]
13. Gray C, Franco A, Arosio P, Hersey P. Immunosuppressive effects of melanoma derived heavy chain ferritin are dependent on stimulation of IL-10 production. Int J Cancer. 2001;92:843-850. [ Links ]
14. Li R, Luo C, Mines M, Zhang J, Fan G. Chemokine CXCL12 induces binding of ferritin heavy chain to the chemokine receptor CXCR4, alters CXCR4 signaling, and induces phosphorylation and nuclear translocation of ferritin heavy chain. J Biol Chem. 2006;281:37616-37627. [ Links ]
15. Wang W, Knovich MA, Coffman LG, Torti FM, Torti SV. Serum ferritin: past, present and future. Biochim Biophys Acta. 2010;1800:760-769. [ Links ]
16. Cohen L, Gutierrez L, Weiss A, Leichtmann Y, Zhang D, Crooks D, et al. Serum ferritin is derived primarily from macrophages through a nonclassical secretory pathway. Blood. 2010;116:1574-1584. [ Links ]
17. Cozzi A, Corsi B, Levi S, Santambrogio P, Biasiotto G, Arosio P. Analysis of the biologic functions of H- and L-ferritins in HeLa cells by transfection with siRNAs and cDNAs: evidence for a proliferative role of L-ferritin. Blood. 2004;103:2377-2383. [ Links ]
18. Mewar D, Moore D, Young S, Bertolaccini M, Khamashta M, Watson P, et al. Antiferritin antibodies discovered by phage display expression cloning are associated with radiographic damage in rheumatoid arthritis. Arthritis Rheum. 2005;52:3868-3872. [ Links ]
19. Meyers J, Sabatos C, Chakravarti S, Kuchroo V. The TIM gene family regulates autoimmune and allergic diseases. Trends Mol Med. 2005;11:362-369. [ Links ]
20. Recalcati S, Invernizzi P, Arosio P, Cairo G. New functions for an iron storage protein: the role of ferritin in immunity and autoimmunity. J Autoimmun. 2008;30:84-89. [ Links ]
21. Chong BF, Mohan C. Targeting the CXCR4/CXCL12 axis in systemic lupus erythematosus. Expert Opin Ther Targets. 2009;13:1147-1153. [ Links ]
22. Janka GE. Familial and acquired hemophagocyticlymphohistiocytosis. Annu Rev Med. 2012;63:233-246. [ Links ]
23. Atteritano M, David A, Bagnato G, Beninati C, Frisina A, Laria C, et al. Haemophagocytic syndrome in rheumatic patients. A systematic review. Eur Rev Med Pharmacol Sci. 2012;16:1414-1424. [ Links ]
24. Janka GE. Hemophagocytic syndromes. Blood Rev. 2007;21:245-253. [ Links ]
25. Schneider EM, Lorenz I, Müller-Rosenberger M, Steinbach G, Kron M, Janka-Schaub GE. Hemophagocytic lymphohistiocytosis is associated with deficiencies of cellular cytolysis but normal expression of transcripts relevant to killer-cell-induced apoptosis. Blood. 2002;100:2891-2898. [ Links ]
26. Ravelli A, Magni-Manzoni S, Pistorio A, Besana C, Foti T, Ruperto N, et al. Preliminary diagnostic guidelines for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis. J Pediatr. 2005;146:598-604. [ Links ]
27. Janka GE. Familial and acquired hemophagocytic lymphohistiocytosis. Eur J Pediatr. 2007;166:95-109. [ Links ]
28. Efthimiou P, Paik PK, Bielory L. Diagnosis and management of adult onset Still's disease. Ann Rheum Dis. 2006;65:564-572. [ Links ]
29. Uppal SS, Al-Mutairi M, Hayat S, Abraham M, Malaviya A. Ten years of clinical experience with adult onset Still's disease: is the outcome improving? Clin Rheumatol. 2007;26:1055-1060. [ Links ]
30. Mathieu GV, Jamilloux Y, Iwaz J, Sève P. Adult-onset Still's disease. Autoimmunity Rev. 2014;13:708-722. [ Links ]
31. Mavragani CP, Spyridakis EG, Koutsilieris M. Adult-onset Still's disease: from pathophysiology to targeted therapies. Int J Inflamm. 2012;879-890. [ Links ]
32. Fautrel B, Le Moel G, Saint-Marcoux B, Taupin P, Vignes S, Rozenberg S, et al. Diagnostic value of ferritin and glycosylated ferritin in adult onset Still's disease. J Rheumatol. 2001;28:322-329. [ Links ]
33. Yamaguchi M, Ohta A, Tsunematsu T, Kasukawa R, Mizushima Y, Kashiwagi H, et al. Preliminary criteria for classification of adult Still's disease. J Rheumatol. 1992;19:424-430. [ Links ]
34. Fujii T, Nojima T, Yasuoka H, Satoh S, Nakamura K, Kuwana M, et al. Cytokine and immunogenetic profiles in Japanese patients with adult Still's disease. Association with chronic articular disease. Rheumatology. 2001;40:1398-1404. [ Links ]
35. Kato T, Kobayashi T, Nishino H, Hidaka Y. Double-filtration plasmapheresis for resolution of corticosteroid resistant adult onset Still's disease. Clin Rheumatol. 2006;25:579-582. [ Links ]
36. Choi JH, Suh CH, Lee YM, Suh YJ, Lee SK, Kim SS, Nahm DH, Park HS. Serum cytokine profiles in patients with adult onset Still's disease. J Rheumatol. 2003;30:2422-2427. [ Links ]
37. Rau M, Schiller M, Krienke S, Heyder P, Lorenz H, Blank N. Clinical manifestations but not cytokine profiles differentiate adult-onset Still's disease and sepsis. J Rheumatol. 2010; 37:2369-2376. [ Links ]
38. Lee SJ, Cho YN, Kim TJ, Park SC, Park DJ, Jin HM, et al. Natural killer T cell deficiency in active adult-onset Still's Disease: correlation of deficiency of natural killer T cells with dysfunction of natural killer cells. Arthritis Rheum. 2012;64:2868-2877. [ Links ]
39. Castillo L, Carcillo J. Secondary hemophagocytic lymphohistiocytosis and severe sepsis/systemic inflammatory response syndrome/multiorgan dysfunction syndrome/macrophage activation syndrome share common intermediate phenotypes on a spectrum of inflammation. Pediatr Crit Care Med. 2009;10:387-392. [ Links ]
40. Moller H, Moestrup S, Weis N, Wejse C, Nielsen H, Pedersen S. Macrophage serum markers in pneumococcal bacteremia: prediction of survival by soluble CD163. Crit Care Med. 2006;34:2561-2566. [ Links ]
41. Sciascia S, Lopez-Pedrera C, Roccatello D, Cuadrado M. Catastrophic antiphospholipid syndrome (CAPS). Best Pract Res Clin Rheumatol. 2012;26:535-541. [ Links ]
42. Cervera R, Bucciarelli S, Plasin M, Gomez-Puerta J, Plaza J, Pons-Estel G. Catastrophic antiphospholipid syndrome (CAPS) registry project group (European forum on antiphospholipid antibodies: catastrophic antiphospholipid syndrome (CAPS): descriptive analysis of a series of 280 patients from the "CAPS Registry". J Autoimmun. 2009;32:240-245. [ Links ]
43. Cervera R. Update on the diagnosis, treatment, and prognosis of the catastrophic antiphospholipid syndrome. Curr Rheumatol Rep. 2010;12:70-76. [ Links ]
44. Espinosa G, Bucciarelli S, Cervera R, Gomez-Puerta J, Font J. Laboratory studies on pathophysiology of the catastrophic antiphospholipid syndrome. Autoimmun Rev. 2006;6:68-71. [ Links ]
45. Asherson R. The catastrophic antiphospholipid (Asherson's) syndrome in 2004 - a review. Autoimmun Rev. 2005;4:48-54. [ Links ]
46. Garcia P, Longhi F, Branco R, Piva J, Lacks D, Tasker R. Ferritin levels in children with severe sepsis and septic shock. Acta Paediatr. 2007;96:1829-183. [ Links ]
47. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med. 2008;36(1):296-327. [ Links ]
48. Cinel I, Opal S. Molecular biology of inflammation and sepsis: a primer. Crit Care Med. 2009;37:291-304. [ Links ]
49. Gogos CA, Drosou E, Bassaris H, Skoutelis A. Pro-versus anti-inflammatory cytokine profile in patients with severe sepsis: a marker for prognosis and future therapeutic options. J Infect Dis. 2000;181:176-180. [ Links ]
50. Lvovschi V, Arnaud L, Parizot C, Freund Y, Juillien G, Ghillani-Dalbin P. Cytokine profiles in sepsis have limited relevance for stratifying patients in the emergency department: a prospective observational study. PLoS One. 2011;6:e28870. [ Links ]
Correspondencia:
Dra. Adriana Denise Zepeda Mendoza
Unidad de Terapia Intensiva,
Fundación Clínica Médica Sur.
E-mail: adrianadzm@gmail.com
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/medicinacritica















