Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Asociación Mexicana de Medicina Crítica y Terapia Intensiva
versión impresa ISSN 0187-8433
Rev. Asoc. Mex. Med. Crít. Ter. Intensiva vol.29 no.2 Ciudad de México abr./jun. 2015
Tema de revisión
Evaluación de la precarga y respuesta a volumen mediante ultrasonografía de la vena cava
Assessment and response preload volume by ultrasonography of the vena cava
Raúl Carrillo Esper,* Rafael Tapia Velasco,‡ Yazmín Galván Talamantes,‡ Eduardo Garrido Aguirre‡
* Academia Nacional de Medicina. Academia Mexicana de Cirugía. Jefe de la UTI.
‡ Unidad de Terapia Intensiva. Diplomado de Ultrasonografía Avanzada en el Paciente Crítico.
Fundación Clínica Médica Sur.
Fecha de recepción: 28 de noviembre 2014
Fecha de aceptación: 19 de enero 2015
RESUMEN
La evaluación ultrasonográfica de la vena cava inferior (VCI) se ha posicionado como una técnica no invasiva, segura, de fácil ejecución a la cabecera del enfermo que proporciona de manera indirecta datos sobre el estado de volumen intravascular efectivo, respuesta a la administración de líquidos, provee datos hemodinámicos del ventrículo derecho y se relaciona de manera dinámica con las presiones intratorácicas. El uso de esta herramienta tecnológica en el abordaje de pacientes críticamente enfermos es de gran utilidad ya que identifica sensibilidad a la precarga, de tal manera conforma una guía fundamental en la toma de decisiones. El objetivo de esta revisión es dar a conocer a la comunidad médica la relevancia de la implementación de la ultrasonografía de la VCI en el control de la volemia, describir la técnica ultrasonográfica y reportar la evidencia científica disponible.
Palabras clave: Ultrasonografía, vena cava inferior, colapsabilidad, precarga.
ABSTRACT
Ultrasound assessment of the inferior vena cava (IVC) has emerged as a noninvasive reliable technique, easily performed at the bedside that indirectly provides information on the status of effective intravascular volume, input volume response provides hemodynamic data of the right ventricle and is associated strongly with intrathoracic pressures. Use of this technological tool in dealing with critically ill patients is useful because it identifies sensitivity to preload, so forms a fundamental guide in decision making. The aim of this review is to inform the medical community the importance of implementing the VCI ultrasonography in the control of blood volume, describing ultrasound technique and report scientific evidence.
Key words: Ultrasound, inferior vena cava, collapsibility, preload.
INTRODUCCIÓN
La presión venosa central (PVC) y la presión de oclusión de la arteria pulmonar (POAP), fueron utilizadas durante muchos años como parámetros que reflejaban las presiones de llenado ventriculares y precarga derecha e izquierda, respectivamente. Numerosos estudios e incluso revisiones del tema han demostrado que la PVC y POAP no predicen la respuesta a una prueba de volumen, y no son capaces de detectar a los pacientes que se beneficiarán del aporte de volumen incrementando el gasto cardiaco, de aquéllos que no se beneficiarían de dicho aporte.1
Es importante recordar que la primera causa de falla circulatoria es el choque hipovolémico, seguido del origen cardiaco, séptico y obstructivo, y que una prueba de aporte de volumen en individuos sin comorbilidades casi siempre produce un aumento del volumen sistólico, no obstante, en pacientes con falla circulatoria aguda, el índice de respuesta adecuada a la prueba de volumen se reduce marcadamente alrededor de 50%.2,3
Debido a esto, se han desarrollado en los últimos años indicadores más precisos, como la ultrasonografía realizada por el clínico, considerada actualmente como el primer método de evaluación cardiaca en el paciente con inestabilidad hemodinámica, permitiendo evaluar la precarga derecha e izquierda y detectar de manera confiable la respuesta al aporte del volumen, optimizando el manejo de líquidos y la toma de decisiones a la cabecera del paciente, evitando el aporte innecesario de volumen y sus efectos deletéreos, toda vez que ha sido demostrado ampliamente en la literatura médica, el incremento de la mortalidad en pacientes con choque séptico y síndrome de distrés respiratorio agudo, derivado del aumento del agua extravascular.4-6
La vena cava inferior (VCI) es una estructura dinámica cuyo diámetro varía con cambios de presión intravascular e intratorácica, en consecuencia, la VCI colapsa con la inspiración debido a la presión negativa creada por la expansión del tórax. En pacientes sanos con respiración espontánea, los cambios cíclicos en la presión torácica, resultan en colapso del diámetro de la VCI en aproximadamente 50%. Aunque se requiere unificación de criterios, los puntos de corte aceptados en individuos sanos para el diámetro de la VCI en la inspiración va desde 0 a 14 mm en reposo y en espiración de 15 a 20 mm en reposo. Debido a las modificaciones en diámetro durante la inspiración aumentan la presión negativa intratorácica que se traduce en presión negativa intraluminal favoreciendo el retorno venoso cardiaco, esto provoca una disminución del calibre de la VCI durante la inspiración normal, mientras que en espiración el calibre es mayor.7,8
PRECARGA
La precarga es uno de los determinantes principales del gasto cardiaco, los otros componentes son: la postcarga, contractilidad, distensibilidad e interdependencia ventricular. Clásicamente, se define precarga como la magnitud del estiramiento máximo o tensión de las fibras miocárdicas antes del inicio de la contracción ventricular y es determinada por la longitud media de los sarcómeros al final de la diástole. Clínicamente es sustituida con frecuencia por medidas más accesibles de llenado ventricular, como las presiones intracavitarias o los volúmenes telediastólicos. Si bien, ninguno de estos parámetros refleja con exactitud la elongación de las fibras musculares cardiacas, representan una aproximación del valor real de precarga, de modo que el volumen telediastólico ventricular se acepta como sinónimo de ésta, y las presiones intracardiacas, en condiciones normales, como sustituto de los volúmenes intracardiacos.
De acuerdo con la ley de Frank-Starling, existe una relación positiva entre la precarga y el volumen sistólico, de tal modo, cuanto mayor es la precarga ventricular (y, por lo tanto, el grado de estiramiento de sus fibras miocárdicas), mayor es el volumen sistólico. Sin embargo, esta relación no es lineal, sino curvilínea. Por lo que, una vez alcanzado un valor concreto de precarga, incrementos posteriores no tienen traducción significativa en el volumen sistólico y se traducen en efectos deletéreos para el paciente.
La representación gráfica de este comportamiento se denomina curva de Frank-Starling o curva de función ventricular, en la que se pueden delimitar dos zonas: una pendiente, donde cambios mínimos de la precarga originan un marcado incremento del volumen sistólico (zona de precarga-dependencia), y otra plana, donde el volumen de eyección apenas varía con las modificaciones de la precarga (zona de precarga-independencia). Este comportamiento determina que, para que se produzca un aumento del volumen sistólico izquierdo, ambos ventrículos deben operar en la parte pendiente o zona de precarga-dependencia de la curva de Frank-Starling. En caso contrario, cualquier medida terapéutica dirigida a incrementar la precarga (como la administración de líquidos) ocasionará tan sólo un aumento de las presiones intracardiacas sin beneficio hemodinámico alguno.
Es importante reconocer que en una prueba de aporte de volumen la respuesta depende no solamente del estatus del volumen del ventrículo, sino también de la adaptabilidad venosa, adaptabilidad ventricular, y función ventricular. Debido a que el paciente grave generalmente presenta alteraciones en la capacitancia venosa, adaptabilidad ventricular, y contractilidad, no es de sorprender que los indicadores de volumen ventricular realizados con los métodos convencionales pudieran ser poco predictivos de la respuesta a la prueba de volumen.
La relación entre los cambios de precarga y volumen sistólico dependen de la morfología y el grado de pendiente de la curva de Frank-Starling, que está determinada por la capacidad contráctil del corazón y la postcarga ventricular. Por lo que, para un mismo incremento de precarga, se producirá un aumento variable del volumen sistólico dependiendo de la morfología y la zona en la que funcionan ambos ventrículos en la curva de Frank-Starling. Por último, es importante resaltar que en cada paciente puede existir una familia de curvas de función ventricular, que depende de los cambios en la postcarga o la contractilidad cardiaca. De esta manera, un enfermo cuya función ventricular se encuentre en la parte plana de la curva de Frank-Starling y sin respuesta a la administración de volumen, puede situarse en la parte pendiente, con respuesta ahora favorable, al mejorar su contractilidad con la administración de inotrópicos. Por lo tanto, la precarga-dependencia es la capacidad del corazón de modificar el volumen sistólico ante cambios de la precarga, y dependerá del valor basal de precarga y de la zona de la curva de Frank-Starling en la que operan ambos ventrículos. Para considerar, por lo tanto, a un paciente como precarga-dependiente no debemos conformarnos con estudiar tan sólo el valor absoluto de la precarga, sino que debemos establecer en qué zona de la curva de función ventricular opera.9,10
VENTILACIÓN MECÁNICA
La ventilación mecánica impacta de manera significativa la función cardiovascular. Su efecto dependerá, en gran medida, de la situación hemodinámica basal del paciente (volemia y función cardiaca) y de la magnitud de los cambios en la presión intratorácica, lo que hace más difícil la interpretación de parámetros de evaluación de la precarga y su correcta interpretación en la toma de decisiones para la administración de líquidos.
Recientemente se ha propuesto una evaluación basada en medidas funcionales que cuantifican de forma dinámica el rendimiento cardiovascular, y no en variables fisiológicas estáticas. Ya sea aprovechando los cambios inducidos por la ventilación mecánica o alterando la precarga mediante maniobras posturales, estos parámetros han demostrado ser más eficaces a la hora de decidir qué pacientes se beneficiarán del aporte de volumen, o en los que, por el contrario, sería recomendable el uso de inotrópicos.9-11
La ventilación mecánica con presión positiva induce cambios cíclicos en el volumen sistólico del ventrículo izquierdo. Durante la inspiración, el incremento en la presión intratorácica ocasionado por la insuflación mecánica disminuye la precarga del ventrículo derecho al dificultar el retorno venoso, originando una disminución en su volumen de eyección. Por otra parte, el volumen sanguíneo contenido en el circuito pulmonar es empujado hacia el ventrículo izquierdo incrementando su precarga y su volumen de eyección durante la fase inspiratoria. Posteriormente, tras completar el tiempo del tránsito pulmonar, la disminución del volumen sistólico del ventrículo derecho se traduce en un descenso en el llenado ventricular izquierdo y en una reducción de su volumen de eyección durante la fase espiratoria. Por lo tanto, la ventilación mecánica con presión positiva produce cambios cíclicos en el volumen sistólico del ventrículo izquierdo caracterizados por un incremento durante la fase inspiratoria y una disminución durante la fase espiratoria.
PARÁMETROS ESTÁTICOS Y DINÁMICOS DEPRECARGA
Los parámetros estáticos de precarga-dependencia proporcionan un valor absoluto de precarga, comprendiendo todas las medidas clásicas de precarga, tanto volumétricas como de presión. No se ha encontrado relación significativa entre los pacientes respondedores y los no respondedores a la expansión de volumen y los valores estáticos de precarga.10,11
Numerosos estudios han reportado que las presiones intravasculares pueden sobrestimar la presión transmural (la presión que distiende las cavidades cardiacas y define la precarga) en pacientes con hiperinsuflación pulmonar, ventilados con PEEP o con hipertensión intrabdominal.11,12
La respuesta cardiovascular a la administración de volumen estará determinada no sólo por el valor inicial o la magnitud del incremento de la precarga, sino también por la función ventricular del paciente. Por lo que, para un mismo valor de precarga, se producirá un incremento variable del gasto cardiaco dependiendo de la función ventricular. De tal manera que una medida aislada, estática de precarga, ya sea volumétrica o de presión, independientemente de la exactitud y precisión del método empleado para su obtención, no permite predecir de forma fiable la respuesta del gasto cardiaco si previamente se desconoce cuál es su curva de función ventricular y en qué zona de ésta se encuentra.
A diferencia de las medidas estáticas, los parámetros dinámicos de precarga-dependencia proporcionan una valoración funcional del rendimiento cardiaco ante modificaciones transitorias de la precarga, otorgándonos una respuesta instantánea del funcionamiento cardiaco. Los parámetros dinámicos, por lo tanto, no estiman la precarga ni proporcionan información acerca de la volemia, sino que cuantifican la respuesta cardiaca ante variaciones de la precarga, permitiendo determinar en qué zona de la curva de Frank-Starling operan ambos ventrículos.
Sea cual sea el método empleado, los parámetros dinámicos de precarga-dependencia se caracterizan por ser la expresión transitoria en el gasto cardiaco o el volumen sistólico de un cambio, generalmente reversible y de escasa duración, de la precarga cardiaca. La magnitud de este cambio permite, además, una cuantificación del grado de precarga-dependencia, de tal manera que, cuanto mayor sea esta variación, mayor es el grado de precarga-dependencia y, por consiguiente, mayor el incremento esperado con la administración de volumen y viceversa.2,9
Derivado de lo anterior, se han utilizado ampliamente estas variaciones dinámicas en el volumen sistólico y gasto cardiaco, para detectar a los pacientes respondedores a volumen, definiéndose como paciente respondedor a volumen, aquél que logra un incremento de 10-15% en el gasto cardiaco posterior a la expansión de volumen (aproximadamente 500-1,000 mL de cristaloides o 7 mL/kg de coloide, los volúmenes más estudiados) (Figura 1).13
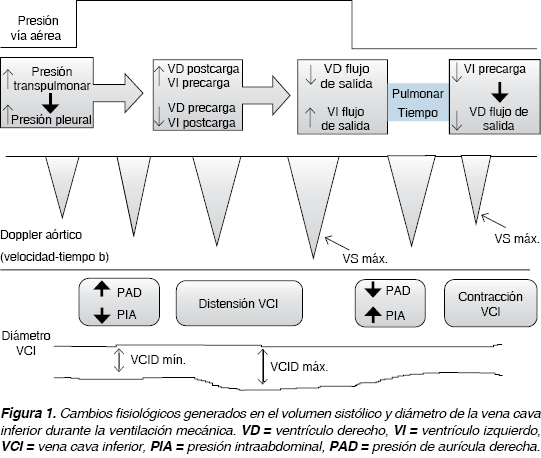
EVALUACIÓN DE LA VENA CAVA INFERIOR (VCI)
Técnica
El transductor recomendado para la evaluación de la VCI, es el sectorial, con superficie de contacto pequeña y de baja frecuencia, con rangos de 2-5 MHz, y seleccionando en la máquina de ultrasonografía modo bidimensional (2D), y el perfil de cardiología, si se cuenta con el mismo. El paciente deberá encontrarse idealmente en decúbito dorsal y se localizará la ventana acústica subxifoidea o subcostal, colocando el transductor inmediatamente por debajo y ligeramente hacia la derecha del apéndice xifoides, dirigiendo el transductor hacia el hombro izquierdo del paciente aproximadamente a 15o, con la marca del transductor hacia la izquierda del paciente en sentido horario a las dos o tres, y con una profundidad de 16-20 cm o mayor, a fin de localizar al corazón, para posteriormente realizar un giro continuo en sentido antihorario del transductor de las 3 a las 12 y ligero desplazamiento hacia la izquierda (Figuras 2 y 3). Realizando los movimientos del transductor descritos se apreciará la vena cava en su trayecto por el hígado, en su sitio de unión al atrio derecho, la glándula hepática y la vena hepática (Figura 4). Una vez localizada la vena cava deberá realizarse la medición en modo M (monodimensional) a 2 cm distal de su unión con el atrio derecho, incluso las guías americanas de ecocardiografía recomiendan su medición perpendicular al eje largo, justo proximal a la unión de la vena hepática, que es aproximadamente de 0.5 a 3 cm de la aurícula derecha. Deberán realizarse medidas del diámetro máximo de un ciclo respiratorio en inspiración y espiración (Figura 5).11,14




La evaluación del diámetro máximo de la vena cava inferior y su correlación con la PVC en pacientes bajo ventilación espontánea, ha sido reportada por numerosos estudios, quedando resumidos los valores de PVC, diámetro y su porcentaje de colapso con la respiración, en el esquema emitido por la Asociación Americana de Ecocardiografía (Cuadro I).15

Durante la fase inspiratoria de la ventilación mecánica, el incremento de la presión pleural es transmitido hacia la aurícula derecha, reduciendo el retorno venoso y dilatando la VCI. Por el contrario, durante la espiración, la reducción de la presión intratorácica favorece el retorno venoso y disminuye el diámetro de la VCI. Estas variaciones en el diámetro de la VCI son más evidentes en pacientes hipovolémicos y parecen estar disminuidas en pacientes hipervolémicos cuando la VCI es menos distensible. Es importante recordar que en pacientes bajo ventilación mecánica particularmente aquéllos con presiones meseta de más de 27 cmH2O, pueden desarrollar cor pulmonale agudo y dificultar su evaluación para determinar en qué parte de la curva de Frank-Starling se encuentran e incluso los pacientes con falla ventricular aguda derecha pueden imitar a un paciente hipovolémico, sin beneficiarse del aporte de volumen o incluso sufrir deterioro con el aporte de volumen, ante lo cual deberá utilizarse la mayor cantidad de datos hemodinámicos disponibles y emplear otros parámetros dinámicos a fin de valorar respuesta a volumen tales como VVS: variabilidad de volumen sistólico, velocidad máxima de flujo aórtico, VTI, entre otros.14
En pacientes bajo ventilación mecánica existe evidencia que respalda la utilidad del índice de colapsabilidad de la VCI para determinar qué pacientes responderán adecuadamente al aporte de volumen, sin olvidar que estos valores pueden estar alterados por la presencia de disfunción aguda ventricular derecha, otras entidades que cursan con incremento de presiones en cavidades derechas (tamponade cardiaco, neumotórax a tensión), aumento de presión intraabdominal, y valores elevados de presión positiva al final de la espiración (PPFE) sin establecerse hasta el momento un valor de PPFE que impida su evaluación.
Dos estudios son los más representativos de la evaluación ultrasonográfica de la VCI para determinar respuesta a volumen, Barbier16 y colaboradores incluyeron pacientes bajo ventilación mecánica sin esfuerzo respiratorio y obtuvieron el índice de distensibilidad, mediante el diámetro de la VCI máximo y mínimo obtenidos justo distalmente a la vena hepática y expresando este valor como un porcentaje indexado de acuerdo con lo siguiente:

Con un punto de corte de 18% (estableciendo como respondedor a volumen, valores por encima de 18%) y una sensibilidad y especificidad reportadas de 90%. Por otra parte, Feissel y colaboradores17 incluyeron en su estudio a pacientes bajo ventilación mecánica obteniendo el índice de distensibilidad de acuerdo con lo siguiente:

Reportando un punto de corte de 12% (estableciendo como respondedor a volumen, valores por encima de 12%) con un valor predictivo positivo de 93% y valor predictivo negativo de 92%.
Recientemente Duwat18 reportó una sensibilidad de 80.7% y especificidad de 93.7% para un índice de distensibilidad de VCI, de 30% o mayor.
En pacientes con ventilación espontánea, existen revisiones que han correlacionado el diámetro máximo de la VCI con la presión venosa central y la presencia de hipovolemia. Muller19 desarrolló el índice de colapsabilidad de la VCI en pacientes con ventilación espontánea obtenido mediante la siguiente ecuación:

Reportando un punto de corte de 40%, con una sensibilidad de 70% y especificidad de 80%.
Existen varios estudios sobre la utilidad de pruebas exploratorias como la elevación pasiva de las piernas que consiste en la elevación de las piernas en 30-45o, por 1-3 minutos, lo cual ocasiona incremento del retorno venoso en aproximadamente 150-300 cm3 hacia la aurícula derecha, generando un cambio en el gasto cardiaco en pacientes respondedores a volumen, ante lo cual se deberán hacer mediciones antes e inmediatamente después de la maniobra, con la ventaja de ser pruebas totalmente reversibles.20,21
Monnet y Lamia14 han reportado sensibilidad de 93% y especificidad de 94% para detectar variaciones en el flujo máximo aórtico e incremento del gasto cardiaco con esta maniobra, ante lo cual se sugiere la utilidad de esta maniobra en la variación de la VCI, en pacientes con presencia de ventilación espontánea o arritmias cardiacas.
En relación con la vena cava superior existe un estudio con 66 pacientes con choque séptico en el que Vieillard-Baron y colaboradores demostraron que un índice de colapsabilidad de la VCS > 36%, obtenido mediante ecocardiografía transesofágica, permitía discriminar a los pacientes respondedores (definidos aquéllos que mostraron un incremento ≥11% del índice cardiaco tras la expansión de volumen) con una sensibilidad de 90% y una especificidad de 100%.22 Con base en la evidencia científica anterior se ha propuesto un algoritmo de abordaje para el paciente en estado de choque con el fin de orientar el uso adecuado de líquidos (Figura 6).14

CONCLUSIONES
La ultrasonografía realizada por el clínico es un método no invasivo que ha demostrado ampliamente en la evidencia científica actual, ser una herramienta de utilidad para el monitoreo y seguimiento del paciente crítico con falla circulatoria aguda. La evaluación de la VCI constituye un parámetro de monitoreo dinámico en el paciente crítico, capaz de detectar a los pacientes respondedores a volumen de una manera no invasiva y confiable, toda vez que la evidencia científica apoya su uso en la evaluación de su diámetro e índices de distensibilidad y colapsabilidad, para detectar aquellos pacientes que se beneficiarán del aporte de volumen, disminuyendo de esta manera la mortalidad, al evitar el aporte innecesario del mismo. Es importante recordar que la evaluación de la VCI forma parte del monitoreo hemodinámico no invasivo básico, sin olvidar sus fortalezas y las condiciones que pueden modificar la interpretación de su evaluación.
REFERENCIAS
1. Marik PE, Cavallazzi R. Does the central venous pressure predict fluid responsiveness? An updated meta-analysis and a plea for some common sense. Crit Care Med. 2013;41:1774-1781. [ Links ]
2. Pinsky MR, Payen D. Monitoreo hemodinámico funcional. Bogotá: Distribuna; 2011: p. 538. ISNB: 978-958-8379-36-4 [ Links ]
3. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med. 2006;34:344-453. [ Links ]
4. Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39:259-265. [ Links ]
5. Sakka SG, Klein M, Reinhart K, Meier-Hellmann A. Prognostic value of extravascular lung water in critically ill patients. Chest. 2002;122:2080-2086. [ Links ]
6. Lyon M, Verma N. Ultrasound guided volume assessment using inferior vena cava diameter. Open Emerg Med Journal. 2010;3:22-24. [ Links ]
7. Pinsky MR, Brochard L, Mancebo J. Applied physiology in intensive care medicine. 2nd ed. New York: Springer-Verlag; 2009. [ Links ]
8. Field JM, Bresler MJ. The textbook of emergency cardiovascular care and CPR. Philadelphia: Lippincott; 2009. [ Links ]
9. Sabatiera C, Mongeb I, Maynarc J, Ochagavia A. Valoración de la precarga y la respuesta cardiovascular al aporte de volumen. Med Intensiva. 2012;36:45-55. [ Links ]
10. Levitov A, Marik PE. Echocardiographic assessment of preload responsiveness in critically ill patients. Cardiol Res Pract. 2012;2012:819696. [ Links ]
11. Mandeville JC, Colebourn CL. Can transthoracic echocardiography be used to predict fluid responsiveness in the critically ill patient? A systematic review. Crit Care Res Pract. 2012;2012:513480. [ Links ]
12. Malbrain ML. Is it wise not to think about intraabdominal hypertension in the ICU? Curr Opin Crit Care. 2004;10:132-145. [ Links ]
13. Kitakule M, Mayo P. Use of ultrasound to assess fluid responsiveness in the intensive care unit. The Open Critical Care Medicine Journal. 2010;3:33-37. [ Links ]
14. Monnet X, Teboul JL. Assessment of volume responsiveness during mechanical ventilation: recent advances. Crit Care. 2013;17:217. [ Links ]
15. Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr. 2010;23:685-713. [ Links ]
16. Barbier C, Loubières Y, Schmit C, Hayon J, Ricôme JL, Jardin F, et al. Respiratory changes in inferior vena cava diameter are helpful in predicting fluid responsiveness in ventilated septic patients. Intensive Care med. 2004;30:1740-1746. [ Links ]
17. Feissel M, Michard F, Faller JP, Teboul JL. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med. 2004;30:1834-1837. [ Links ]
18. Duwat A, Zogheib E, Guinot P, Levy F, Trojette F, Diouf M, et al. The gray zone of the qualitative assessment of respiratory changes in inferior vena cava diameter in ICU patients. Crit Care. 2014;18:R14. [ Links ]
19. Muller L, Bobbia X, Toumi M, Louart G, Molinari N, Ragonnet B, et al. Respiratory variations of inferior vena cava diameter to predict fluid responsiveness in spontaneously breathing patients with acute circulatory failure: need for a cautious use. Crit Care. 2012;16:R188. [ Links ]
20. Prekker ME, Scott NL, Hart D, Sprenkle MD, Leatherman JW. Point-of-care ultrasound to estimate central venous pressure: a comparison of three techniques. Crit Care Med. 2013;41:833-834. [ Links ]
21. Charbonneau H, Riu B, Faron M, Mari A, Kurrek MM, Ruiz J, et al. Predicting preload responsiveness using simultaneous recordings of inferior and superior vena cava diameters. Crit Care. 2014;18:473. [ Links ]
22. Vieillard-Baron A, Chergui K, Rabiller A, Peyrouset O, Page B, Beauchet A, et al. Superior vena caval collapsibility as a gauge of volume status in ventilated septic patients. Intensive Care Med. 2004;30:1734-1739. [ Links ]
Correspondencia:
Dra. Yazmín Galván Talamantes
Unidad de Terapia Intensiva
Fundación Clínica Médica Sur
E-mail: yazmingalvan21@gmail.com
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/medicinacritica














