Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.20 no.1 México ene./mar. 2007
Revisión
Tratamiento de la hipertensión arterial sistémica en pacientes con asma y enfermedad pulmonar obstructiva crónica
Treatment of systemic hypertension in patients with asthma and chronic obstructive pulmonary disease
Carlos Cobo Abreu* María Guadalupe Fabián San Miguel*
* Clínica de Síndrome Metabólico y Enfermedades Respiratorias, Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas.
Correspondencia:
Dra. Ma. Guadalupe Fabián San Miguel.
Clínica de Síndrome Metabólico y Enfermedades Respiratorias,
Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas.
Calzada de Tlalpan 4502, Colonia Sección XVI.
México, DF. 14080.
Teléfono directo 54241413; conmutador 56664539, extensión 301.
Correo electrónico: lupitafabian@gmail.com
RESUMEN
Se desconoce la prevalencia de la hipertensión arterial sistémica en el paciente neumópata, pero es probable que sea similar al resto de la población; sin embargo, el tratamiento pudiera ser diferente pues, por ejemplo, los betabloqueadores pueden estar contraindicados en pasión pacientes con asma bronquial y enfermedad pulmonar obstructiva crónica (EPOC), y los inhibidores de la enzima convertidora de angiotensina pueden producir tos. El objetivo de esta revisión es dar información para identificar el o los medicamentos ideales en el neumópata, sobre todo en el que padece asma bronquial y EPOC.
Palabras clave: Asma, enfermedad pulmonar obstructiva crónica, hipertensión arterial sistémica, terapéutica.
ABSTRACT
The prevalence of systemic arterial hypertension in patients with pulmonary disease is unknown, but it could be similar to the rest of the population. However, treatment could be different, as beta blockers are generally contraindicated in patients with bronchial asthma and COPD, and the angiotensin–converting enzyme inhibitors can induce cough. This paper reviews the different classes of antihypertensive drugs that can be used in patients with pulmonary diseases, with focus in bronchial asthma and chronic obstructive pulmonary disease.
Key words: Asthma, chronic obstructive pulmonary disease, systemic arterial hypertension, therapeutics.
INTRODUCCIÓN
Se calcula que existen más de 50 millones de hipertensos arteriales en los Estados Unidos, con un costo estimado en ese país de alrededor de 24 billones de dólares1. Asimismo, existen más de 14 millones de individuos con bronquitis crónica, 2 millones con enfisema pulmonar2 y 13 millones con asma bronquial3.
La prevalencia de enfermedad pulmonar obstructiva crónica (EPOC) en pacientes con hipertensión arterial sistémica (HAS) fue reportado en el estudio MOS (del inglés, Medical Outcome Study)4, encontrando una prevalencia de HAS del 37.3% como entidad aislada. Al cruzarlo en pacientes con EPOC, la prevalencia de ambas enfermedades fue del 7.4% y la asociación con asma e hipertensión arterial del 7.8%,
En el estudio HOT (del inglés, Hypertension Optimal Treatment)5 en donde fueron estudiados 19,196 pacientes con HAS entre 50 y 80 años de edad se encontró una prevalencia de 3.4%, coincidiendo con enfermedad pulmonar no especificada.
Por tanto, si actualmente hay alrededor de 50 millones de estadounidenses con HAS y de ellos el 5% tiene EPOC, se calcula entonces que hay por lo menos 2.5 millones de pacientes con EPOC que, además, son hipertensos arteriales. Sin embargo, estudios recientes6 en 5,648 pacientes mayores con EPOC, media de edad 73.5 años, 54% hombres y seguimiento a cuatro años se encontró una prevalencia de HAS del 45%. Probablemente un número similar a éste sea de pacientes con asma bronquial7.
Por otro lado, el tabaquismo es un factor de riesgo claro para la EPOC y sería muy importante estratificar al paciente fumador con o sin EPOC en el tratamiento de la HAS como una manifestación de daño a órgano blanco.
Dos grandes estudios (SYST–EUR y un estudio en veteranos de guerra)8,9 demostraron una prevalencia entre 25 y 43% de pacientes fumadores o exfumadores. El tabaquismo y la HAS potencian el riesgo de cardiopatía isquémica; incluso, estudios epidemiológicos demuestran que la limitación del flujo aéreo es un indicador independiente de eventos cardiovasculares futuros10.
De acuerdo con el Séptimo Comité Conjunto del Estudio de la Hipertensión Arterial (JNC Vil, por sus siglas en inglés), existen en Estados Unidos aproximadamente 50 millones de hipertensos y se calcula alrededor de un billón en todo el mundo. Datos recientes del estudio de Fra–mingham sugieren que un individuo normotenso de 55 años tiene un 90% de riesgo de desarrollar HAS a lo largo del resto de su vida11.
Debido a la evidencia expuesta, consideramos pertinente revisar cuál puede ser el mejor tratamiento de la HAS en el neumópata, con énfasis en EPOC y asma.
USO DE MEDICAMENTOS ANTIHIPERTENSIVOS Y NEUMOPATÍAS
Diuréticos (Tabla I)

Recomendados como de primera línea en el JNC Vil en el tratamiento de la HAS en la población abierta.
Puede haber algunas ventajas teóricas de su uso en algunos pacientes; por ejemplo, en el edema periférico secundario a insuficiencia cardíaca derecha el uso de furosemide es útil, y como adyuvante en pacientes con asma bronquial. En pacientes hemoconcentrados, los diuréticos pueden favorecer el aumento del hematócrito y por tanto, se tendrá precaución con ellos; en dosis elevadas pueden favorecer hiperglicemia, hiperuricemia y trastornos electrolíticos. Las tiazidas en pequeñas dosis tienen muy buen efecto antihipertensivo y poco efecto diurético y metabólico.
Aunque los diuréticos están recomendados como tratamiento de primera línea en pacientes hipertensos no complicados, no existen estudios clínicos dirigidos a evaluar su uso en pacientes hipertensos con EPOC o asma.
Calcioantagonistas (Tabla II)
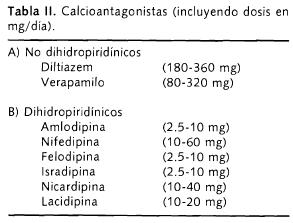
Tampoco existen estudios que demuestren los efectos de los calcioantagonistas en el tratamiento de la HAS en pacientes con EPOC. No sólo reducen la presión arterial sistémica sino también regresan la hipertrofia ventricular izquierda; son neutros en el perfil metabólico del paciente, es decir, no empeoran el perfil de lípidos y particularmente en el diabético no aumentan las cifras de glucosa.
En pacientes con asma bronquial, el verapamilo fue menos efectivo que los inhibidores de la enzima convertidora de angiotensina (ECA) para reducir la presión arterial12; la nifedipina fue igualmente efectiva que los diuréticos y los inhibidores de ECA para disminuir las presiones sistólica y diastólica en pacientes con EPOC.13
En el Estudio Europeo de Hipertensión Arterial Sistólica8, en donde fueron aleatorizados 4,625 pacientes con hipertensión arterial sistólica aislada, con cifras sistólicas > de 160 y diastólicas < de 90 utilizando nitrendipino vs placebo, después de dos años de tratamiento se encontró una reducción de 42% de eventos vasculares cerebrales y un 26% de eventos cardiovasculares comparados con el placebo; no se comparó su efecto en pacientes con EPOC, pero indudablemente que el grupo de edad en donde aparece la hipertensión sistólica aislada corresponde a la misma edad en la que se observan los grados avanzados de EPOC (> de 60 años).
El uso de calcioantagonistas por vía sublingual, fundamentalmente nifedipina, no afecta el tono de árbol bronquial en condiciones de reposo; sin embargo, por esta vía pudiera producirse broncoespasmo en algunos sujetos que practiquen ejercicio físico. Verapamilo y nifedipino, los dos calcioantagonistas más utilizados, no empeoran los síntomas pulmonares después de un año de tratamiento12,13.
Los calcioantagonistas, en general, producen una reducción insignificante de los niveles plasmáticos de teofilina14. En el manejo de la HAS asociado con apnea del sueño, un estudio demostró que isradipina produjo menor patrón obstructivo comparado contra metoprolol; sin embargo, no hubo diferencias estadísticamente significativas entre ambos grupos en relación con el control de las cifras tensionales15.
Hasta ahora no hay datos suficientes para recomendar el uso de calcioantagonistas en el paciente con EPOC, asma o apnea del sueño. Aunque hay estudios que han demostrado que reducen modestamente la reactividad bronquial, no los convierten en el tratamiento ideal en este grupo de pacientes.
Inhibidores de la enzima convertidora de angiotensina (inhibidores de la ECA) (Tabla III)

Los inhibidores de la ECA han sido piedra angular en el tratamiento de la HAS, insuficiencia cardiaca y de la nefropatía diabética, por lo que son considerados tratamientos de primera línea de la HAS, según el JNC Vil;11 no obstante, pueden producir efectos adversos como tos, hiperpotasemia, deterioro de la insuficiencia renal, edema angioneurótico, disgeusia y anomalías fetales si se usan durante la gestación.
La tos es el síntoma más frecuente; fue reportado por primera vez hace casi 25 años16; ocurre del 10 al 20% de los pacientes17, es seca y se produce por una sensación de comezón en la garganta; rara vez se acompaña de broncoespasmo.
En relación con el mecanismo de la tos existen varias hipótesis, pero parece ser que la inhibición de la ECA induce elevación los niveles de cininas en el tejido pulmonar porque la ECA es una cininasa que bloquea bradicininas, sustancia P y neurocinina A; al desaparecer el bloqueo se elevan sus niveles y se produce la tos. Las bradicininas son vasodilatadoras, lo que es favorable en el hipertenso. Asimismo, es más frecuente en los neumópatas que en la población general, probablemente por mayor sensibilidad de la vía aérea, lo que habrá de tomarse en consideración en pacientes con EPOC y asma bronquial, pues incluso hay reportes18,19 de empeoramiento de la disnea en asmáticos y ataques de asma severa.
Los efectos de los inhibidores de ECA sobre la función pulmonar en pacientes con EPOC y asma no parecen mostrar diferencias estadísticamente significativas; sólo existen dos estudios en asmáticos que relacionan el uso de los inhibidores de la ECA con empeoramiento de la función pulmonar19.
En general, la evaluación de los inhibidores de la ECA en los asmáticos es difícil, sobre todo en los asmáticos inestables en quienes el uso continuo de glucocorticoides y broncodilatadores pueden enmascarar los efectos del antihipertensivo, lo que ameritaría semanas o meses de observación en ausencia de fármacos contra el asma para evaluar correctamente este aspecto.
Se ha reportado la ausencia de hiperreactividad bronquial en 16 pacientes asmáticos después del uso de captopril por cuatro semanas20; se les midió FEV1 y dosis–respuesta a la metacolina antes y después del tratamiento; ninguno de estos pacientes tuvo tos. Otro estudio21 reportó ausencia de hiperreactividad bronquial en 19 pacientes con HAS y EPOC, con o sin hipertensión arterial pulmonar tratados con captopril. Se encontró disminución de la presión capilar pulmonar, arterial pulmonar y de las resistencias periféricas pulmonares totales, sin trastornos en la vía aérea antes ni después del tratamiento; ninguno presentó tos.
La OMS y el Comité de Eventos Adversos de Suecia mencionan que dentro de los efectos adversos directamente relacionados con los inhibidores de ECA, los más frecuentes fueron los del aparato respiratorio (34.9%), presentándose tos en el 88–90% de los casos en ambas estadísticas, seguido por disnea7.
Desde 1987 varios estudios clínicos prospectivos, aleatorizados, controlados con placebo demostraron la efectividad de los inhibidores de la ECA en la reducción de la morbimortalidad en pacientes con insuficiencia cardíaca congestiva y disfunción ventricular izquierda22–24. En los dos primeros22,23 no se encontró mayor incidencia de tos; en el otro24, 37% de los pacientes que recibieron enalapril tuvieron tos, comparados al grupo de hidralazina más dinitrato de isosorbide que la presentaron en el 29%.
Así pues, parece ser que el uso de inhibidores de la ECA en los neumópatas con HAS y/o insuficiencia cardíaca es seguro, tomando en consideración la posibilidad de que puedan presentar tos, no siendo este síntoma más frecuente que en la población general sin neumopatía; además, en la gran mayoría de ellos, la tos desaparecerá en los siguientes 15 días a la suspensión del inhibidor de ECA.
Antagonistas de los receptores de angiotensina II (Tabla IV)

Previenen la liberación de angiotensina II sin afectar la función de las bradicininas (cinasas); es decir, actúan más distalmente en la cascada renina–angiotensina–aldosterona. Con estos medicamentos no hay acumulo de bradicininas o de sustancia P y, en teoría, no producen tos.
Existen dos estudios25,26que comparan la incidencia de tos en pacientes con HAS que habían tenido tos por inhibidores de ECA; se compararon valsarían y losartán vs lisinopril e hidroclorotiazida o t/smetolazona. En el estudio con valsartán por 6 semanas, la incidencia de tos fue del 18%; con metolazona del 21 % y con lisinopril del 97% (p < 0.001). En el estudio con losartán la incidencia de tos fue del 57, 62% con hidroclorotiazida y del 87% con lisinopril.
La conclusión de estos estudios fue que los inhibidores de los receptores de angiotensina II constituyen una alternativa en pacientes con enfermedad pulmonar, broncorreactividad o insuficiencia cardíaca congestiva que previamente tuvieron tos con los inhibidores de ECA.
Betabloqueadores (Tabla V)

Se pretende evitar el uso de los betabloqueadores en pacientes con EPOC porque la activación de los receptores beta 2 produce broncoconstricción y bloqueo de la vía aérea, hecho demostrado hace más de 40 años en asmáticos, en quienes el propranolol produjo disminución muy importante de FEV27. A pesar de esta asociación, se comunicó que de 3,170 asmáticos, el 1.4% de ellos (45) recibió betabloqueadores, siendo este uso más frecuente en ancianos. Sólo dos tuvieron empeoramiento del asma y ameritaron hospitalización para tratamiento con diversos fármacos28.
¿Vale la pena emplear betabloqueadores en el asmático, dada la gran cantidad de medicamentos antihipertensivos con los que se cuenta? La pregunta surge porque existen betabloqueadores altamente selectivos a los receptores beta 1, cardioselectivos, que deberían tener diferencias sobre los no selectivos en pacientes con asma.
Hay estudios clínicos empleando atenolol, bisoprolol, celiprolol y metoprolol. En uno de ellos29 se comparó propranolol en pacientes con EPOC vs metoprolol o celiprolol (cardioselectivos), disminuyendo la FEN1con propranolol en un 16%, y mucho menos con los otros dos betabloqueadores, pero sin significancia estadística. Otro estudio30 en pacientes hipertensos, comparando propranolol vs metoprolol o atenolol por tres semanas, encontró mayor reducción de la FEV1 y menor respuesta al broncodilatador (salbutamol) comparado con metoprolol o atenolol, otra vez sin significancia estadística. Un tercer estudio31 mostró que la cardioselectividad del betabloqueador se pierde cuando se utilizan dosis altas; 17 pacientes hipertensos y asmáticos fueron evaluados prospectivamente a dos dosis diferentes de metoprolol y practolol (ambos beta 1) por un poco más de dos semanas, encontrando que a dosis de 100 mg de metoprolol o 200 de practolol no hubo efecto de reducción de la FEV1 dosis mayores, metoprolol 200 mg/día o practolol 400 mg/día, produjeron reducción de la FEV1 e incluso cuatro pacientes presentaron empeoramiento del asma bronquial.
Por tanto, la literatura es consistente en aceptar que los betabloqueadores cardioselectivos tienen menor acción sobre la vía aérea que los no selectivos, acción que se pierde cuando se utilizan dosis altas, por lo que se acepta, en general, que todos los betabloqueadores están contraindicados en pacientes con EPOC o asma.
La excepción será, poniendo en la balanza el binomio riesgo–beneficio, en asmáticos con angor severo que no responden a calcioantagonistas ni nitratos, no candidatos a intervencionismo coronario ni revascularización quirúrgica del miocardio.
Los alfa y betabloqueadores como nebivolol o carvedilol no inducen broncoconstricción; su uso en neumópatas también puede ser cuestionado y, de usarse, será con gran cautela.
Bloqueadores alfa (Tabla VI)

Su uso en HAS se ha limitado a pacientes con hiperplasia prostática, por sus efectos favorables en las manifestaciones de prostatismo. Son efectivos para reducir la presión sistólica y diastólica en forma similar a las tiazidas y son seguros en pacientes con asma bronquial o EPOC dado que no producen broncoconstricción.
COMENTARIO Y CONCLUSIONES
Dada la alta prevalencia de HAS, hay que considerar la subpoblación de varios millones de pacientes con enfermedad pulmonar como co–morbilidad y, por tanto, evaluar el uso correcto de medicamentos antihipertensivos.
Los diuréticos son efectivos en los pacientes neumópatas al igual que en la población general, pero no existen estudios clínicos que demuestren o nieguen su seguridad y eficacia en este grupo de enfermos.
Los calcioantagonistas son efectivos para controlar la HAS en pacientes con asma o EPOC, y por su acción sobre el músculo liso pueden producir una disminución modesta de la reactividad bronquial.
Los inhibidores de ECA se asocian en el 10 a 20% de los casos con tos, que puede ser desde leve hasta severa, sobre todo en aquéllos con aumento en la sensibilidad de la vía aérea, función pulmonar disminuida o con insuficiencia cardiaca congestiva.
Los antagonistas de los receptores de angiotensina II son seguros y deben ser considerados en pacientes que previamente tuvieron tos con los inhibidores de ECA siendo, además, muy útiles en pacientes con insuficiencia cardíaca congestiva o enfermedad pulmonar.
Los betabloqueadores aumentan la resistencia a la vía aérea y es preferible evitarlos en pacientes con asma o EPOC; su uso probablemente deba estar restringido a pacientes con cardiopatía isquémica que no respondan a los tratamientos habituales.
Algunos estudios reportan que los betabloqueadores cardioselectivos (beta 1) tienen menor efecto deletéreo sobre la vía aérea que los no selectivos, por lo que su uso será con precaución, evitando dosis altas que los haría comportarse igual que los no cardioselectivos.
Los bloquedores alfa son seguros, pero cada vez se usan menos, excepto en el enfermo con HAS y prostatismo.
En conclusión, el tratamiento del paciente hipertenso con neumopatía debe ser individualizado tomando en cuenta el perfil específico de cada enfermo y otras comorbilidades, manteniendo una vigilancia aún más estrecha que la habitual.
REFERENCIAS
1. Burt VL, Whelton P, Roccella EJ, et al. Prevalence of hypertension in the US adult population. Results from the Third National Health and Nutrition Examination Survey, 1988–1991. Hypertension 1995;25:305–313. [ Links ]
2. The National Lung Health Education Program Executive en Committee. Strategies in preserving lung health and preventing COPD and associated diseases. Chest 1998; 113(2 Suppl):123–159. [ Links ]
3. Adams PF, Marano MA. Current estimates from the National Health Interview Survey, 1994. Vital Health Stat 1995;10(193 Pt 1):1–260. [ Links ]
4. Stewart AL, Greenfield S, Hays RD, et al. Functional status and well–being of patients with chronic conditions. Results from the Medical Outcomes Study. JAMA 1989;262:907–913. [ Links ]
5. Hansson L, Zanchetti A, Carruthers SG, et al. Effects of intensive blood–pressure lowering and low–dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomized trial. HOT Study Group–. Lancet 1998;351:1755–1762. [ Links ]
6. Huiart L, Ernst P, Suissa S. Cardiovascular morbility and mortality in COPD. Chest 2005; 128:2640–2646. [ Links ]
7. Dart RA, Gollub S, Lazar J, Nair C, Schroeder D, Woolf SH. Treatment of systemic hypertension in patients with pulmonary disease: COPD and asthma. Chest 2003; 123:222–243. [ Links ]
8. Staessen JA, Fagard R, Thijs L, et al. Randomized double–blind comparison of placebo and active treatment for older patients with isolated systolic hypertension. The Systolic Hypertension in Europe (SYST–EUR) Trial Investigators. Lancet 1997; 350:757–764. [ Links ]
9. Materson BJ, Reda DJ, Cushman WC, et al. Single–drug therapy for hypertension in men. A comparison of six antihypertensive agents with placebo. The Department of Veterans Affairs Cooperative Study. Group on Antihypertensive Agents. N Engl J Med 1993; 328:914–921. [ Links ]
10. Higgins M, Keller JB, Wagenknecht LE, et al. Pulmonary function and cardiovascular risk factor relationships in black and in white young men and women. The CARDIA Study. Chest 1991; 99:315–322. [ Links ]
11. Chobanian AV, Bakris CL, Black HR, et al; and the National High Blood Pressure Education Program Coordinating Committee. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. The JNC 7 report. JAMA 2003; 289:2560. [ Links ]
12. Riska H, Sovijarvi AR, Ahonen A, Salorinne Y, Sundberg S, Stenius–Aarniala B. Effects of captopril on blood pressure and respiratory function compared to verapamil in patients with hypertension and asthma. J Cardiovasc Pharmacol 1990; 15:57–61. [ Links ]
13. Lin M, Yang YF, Lee D, Chiang HT. Comparisons of long–term effects of lisinopril vs nifedipine vs conventional therapy in the treatment of mild–to–moderate hypertension in patients with chronic obstructive pulmonary disease. Zhonghua Yi Xue Za Zhi (Taipei) 1996; 57:392–400. [ Links ]
14. Yilmaz E, Canberk A, Eroglu L. Nifedipine alters serum theophylline levels in asthmatic patients with hypertension. Fundam Clin Pharmacol 1991; 5:341–345. [ Links ]
15. Kantola I, Rauhala E, Erkinjuntti M, Mansury L. Sleep disturbances in hypertension: a double–blind study between isradipine and metoprolol. J Cardiovasc Pharmacol 1991; 18 Suppl 3:41–45. [ Links ]
16. Havelka J, Vetter H, Studer A, et al. Acute and chronic effects of the angiotensin–converting enzyme inhibitor captopril in severe hypertension. Am J Cardiol 1982; 49:1467–1474. [ Links ]
17. Simon SR, Black HR, Moser M, Berland WE. Cough and ACE inhibitors. Arch Intern Med 1992;152:1698–1700. [ Links ]
18. Semple PF, Herd GE. Cough and wheeze caused by inhibitors of angiotensin–converting enzyme. N Engl J Med 1986: 314:61. [ Links ]
19. Popa V. Captopril–related (and –induced?) asthma. Am Rev Respir Dis 1987; 136:999–1000. [ Links ]
20. Sala H, Abad J, Juanmiguel L, et al. Captopril and bronchial reactivity. Postgrad Med J 1986: 62 Suppl 1:76–77. [ Links ]
21. Bertoli L, Fusco M, LoCicero S, Micallef E, Busnardo I. Influence of ACE inhibition on pulmonary hemo–dynamics and function in patients in whom beta–blockers are contraindicated. Postgrad Med J 1986; 62 Suppl 1:47–51. [ Links ]
22. The CONSENSUS Trial Study Croup. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987:316:1429–1435. [ Links ]
23. The SOLVS Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991: 325:293–302. [ Links ]
24. Conn JN, Johnson G, Ziesche S, et al. A comparison of enalapril with hydralazine–isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325:303–310. [ Links ]
25. Benz J, Oshrain C, Henry D, Avery C, Chiang YT, Gatlin M. Valsarían, a new angiotensin II receptor antagonist: a double–blind study comparing the incidence of cough with lisinopril and hydrochlorothiazide. J Clin Pharmacol 1997: 37:101–107. [ Links ]
26. Chan P, Tomlinson B, Huang TY, Ko JT, Lin TS, Lee YS. Double–blind comparison of losartan, lisinopril, and metolazone in elderly hypertensive patients with previous angiotensin–converting enzyme inhibitor–induced cough. J Clin Pharmacol 1997:37:253–257. [ Links ]
27. McNeill RS. Effect of a beta–adrenergic–blocking agent, propranolol, on asthmatics. Lancet 1964;13: 1101–1102. [ Links ]
28. Graft DF, Fowles J, McCoy CE, Lager RA. Detection of beta–blocker use in people with asthma. Ann Allergy 1992, 69:449–453. [ Links ]
29. Fogari R, Zoppi A, Tettamanti F, Poletti L, Rizzardi G, Fiocchi G. Comparative effects of celiprolol, propranolol, oxprenolol, and atenolol on respiratory function in hypertensive patients with chronic obstructive lung disease. Cardiovasc Drugs Ther 1990: 4:1145–1149. [ Links ]
30. Lawrence DS, Sahay JN, Chatterjee SS, Cruickshank JM. Asthma and beta– blockers. Eur J Clin Pharmacol 1982; 22:501–509. [ Links ]
31. Formgren H. The effect of metoprolol and practolol on lung function and blood pressure in hypertensive asthmatics. Br J Clin Pharmacol 1976: 3:1007–1014. [ Links ]














