Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.20 no.1 México ene./mar. 2007
Original
Correlación directa entre FEF25–75 y la actividad de la paraoxonasa plasmática en pacientes asmáticos adultos1
Direct correlation between FEF25–75 and plasmatic paraoxonase activity in adult patients with asthma
Martha Patricia Sierra Vargas* Margarita Fernández Vega Yessica Dorin Torres Ramos* Juan José Hicks Gómez*,1
Yessica Dorin Torres Ramos* Juan José Hicks Gómez*,1
* Bioquímica y Medicina Amblental.
 Atención Médica. Instituto Nacional de Enfermedades Respiratorias. México, D.F.
Atención Médica. Instituto Nacional de Enfermedades Respiratorias. México, D.F.
Correspondencia:
Dr. Juan José Hicks Gómez
Departamento de Bioquímica y Medicina Ambiental Unidad de Investigación.
Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas
México, D.F.
Calzada de Tlalpan 4502 Col. Sección 16, 14080.
e mail:jhicks@iner.gob.mx
Trabajo recibido: 25–1–2007
Aceptado: 27–11–2007
RESUMEN
Introducción: El incremento en la actividad de mieloperoxidasa (AAPO) (EC 1.11.1.7) plasmática ha sido relacionada con la evolución de diferentes patologías destacando las enfermedades crónico–degenerativas que tienen en común el cursar con un estado de estrés oxidativo (EO) concomitante a un proceso inflamatorio persistente. Este es el caso del asma. La enzima paraoxonasa (PON–1) (EC 3.1.1.2), es una arilesterasa que forma parte de la APO A–I de laa HDL. Su función catalítica le permite hidrolizar hidroperóxidos formados durante la lipoperoxídación de lipoproteínas y membranas como consecuencia de un EO. A la PON–1 se ha considerado como protectora de las lipoproteínas al interrumpir la oxidación de las LDL y disminuir el daño a estructuras celulares. Es una actividad enzimática que representa a la defensa antiestrés oxidativo.
Objetivos: Demostrar que el estrés oxidativo del paciente asmático puede ser evaluado por el incremento de MPO como marcador de daño oxidante y que la función respiratoria adecuada puede ser relacionada con la capacidad de defensa antioxidante representada por la actividad de la PON–1.
Métodos: La actividad de ambas enzimas fue determinada en el plasma de un grupo de pacientes con asma leve a moderada comparado con un grupo control formado por individuos clínicamente sanos.
Resultados: En el grupo de pacientes con asma, la actividad de MPO se incrementó en un 42% (57.31 ± 7.2 U vs 33.34 ± 4.7 U p<0.05), mientras que se observó un decremento del 52% (0.09 ±0.1 nmol p–nitrofenol/mg prot vs 0.05 ± 0.01 nmol p–nitrofenol/mg prot p<0.01) en la actividad de la PON–1. La actividad de la MPO mostró una correlación inversamente proporcional con el FEV1 con una r de Spearman de –0.57 y la PON–1 mostró una correlación directamente proporcional con el FEF25-75 con una r de Spearman de 0.64.
Conclusiones: Se demuestra por primera vez que los pacientes con asma, en los que se presenta un estado de estrés oxidativo que afecta la función pulmonar, la determinación de la PON1 puede servir como predictor de una mejor función pulmonar, mientras que el incremento en la actividad de MPO podría asociarse a un proceso inflamatorio activo con el concomitante daño celular. * U = U/mg de proteína–1.
Palabras clave: MPO, PON–1, estrés oxidativo, asma, función respiratoria.
ABSTRACT
Introduction: Plasma myeloperoxidase activity (MPO) (EC 1.11.1.7) has been related to several chronic–degenerative diseases such as asthma, which have in common a chronic inflammatory process. Paraoxonase (PON–1) (EC 3.1.1.2), is an arylesterase enzyme that has a hydroperoxide catalytic function. This enzyme is a component of APO A–l located in HDL. PON1 is has been considered to protect lipoproteins, because it interrupts the oxidation process of LDL, conducive to the atherosclerotic process.
Objectives: To demonstrate that, a) oxidative stress in asthmatic patients correlates with the MPO activity, and b) demonstrate the role of PON 1 activity as a biomarker of their pulmonary function.
Methods: The activity of both enzymes was measured in plasma of patients with asthma and compared to a control group of healthy subjects.
Results: In the group of patients with asthma, MPO activity increased 42% (57.31 ± 7.2 U vs 33.34 ± 4.7 U p<0.05), while PON–1 activity decreased 52% (0.09 ±0.1 nmol p–nitrophenol/mg prot vs 0.05 ± 0.01 nmol p–nitrophenol/mg prot p<0.01). MPO activity showed an inverse correlation with FEV, with a Spearman r of –0.57, while PON–1 activiy showed a direct correlation with FEF25-75, Spearman r of0.64.
Conclusions: In this study we show, for the first time, that asthma patients, in whom there is a state of oxidative stress that affects the pulmonary function, PON–1 determination can be useful as a predictor of a better pulmonary function, whereas an increment in MPO activity could be associated to an acute inflammatory process, implicating cellular damage. * U = U/mg of protein'.
Key words: MPO, PON–1, oxidative stress, asthma, respiratory function.
INTRODUCCIÓN
En el asma, un estado inflamatorio crónico se asocia al estrés oxidativo (EO), que es definido como el desbalance entre la producción de especies reactivas del oxígeno y la producción y actividad de antioxidantes a favor de los primeros, lo que conduce a una mayor predisposición de daño y alteración de la homeostasis intracelular. El EO favorece el desarrollo de otros procesos patológicos incluyendo al daño endotelial y la aterosclerosis, por lo que se ha sugerido que el asmático tiene un riesgo adicional para presentar riesgo cardiovascular asociado a hipertensión, enfermedad coronaria y embolia1–3. Las enzimas paraoxonasa (PON–1) y mieloperoxidasa (MPO) se encuentran vinculadas directamente con este proceso, ya que la MPO se relaciona con el proceso inflamatorio, generación de especies reactivas del oxígeno (ERO) por los leucocitos y en consecuencia daño del endotelio vascular y otras estructuras. En contraste, la PON se relaciona con la protección del daño inducido por las ERO durante el EO existente.
La mieloperoxidasa (MPO) (EC 1.11.1.7), es producida en los granulos azurófilos de los leucocitos polimorfonucleares y liberada de la célula durante el estallido respiratorio; utiliza como sustrato al peróxido de hidrógeno (H2O2) generando varios productos oxidantes que incluyen al ácido hipocloroso (HClO) que es un potente bactericida. La activación de los leucocitos o estallido respiratorio puede ser tan intensa que incluso puede autodestruir la célula permitiendo la liberación de diversas enzimas líticas que dañan a estructuras vecinas. La participación de la MPO ha sido asociada al asma4–6, al síndrome de insuficiencia respiratoria aguda7,8, a la bronconeumonía8, a la fibrosis pulmonar idiopática9 y a la enfermedad pulmonar obstructiva crónica10,11, razón por la que ha sido considerada como un marcador de riesgo de disfunción endotelial y cardiovascular12,13.
Por otro lado, la paraoxonasa (PON1) (EC 3.1.1.2) es una arilesterasa que hidroliza hidroperóxidos formados por la lipoperoxidación como consecuencia del daño ocasionado por la persistencia de un estado de EO; se encuentra localizada en la APO A–I de las HDL, por lo que concentraciones adecuadas o altas de esta lipoproteína se han considerado como benéficas ya que se le considera como protector de las lipoproteínas al interrumpir la oxidación de las LDL, y en consecuencia disminuir la formación de las placas de ateroma. La PON–1, adicionalmente, evita el daño a membranas y otras estructuras. Se ha demostrado una relación inversa entre el daño endotelial y una actividad disminuida de esta enzima, hecho que agrava las consecuencias del EO
El objetivo de este trabajo fue determinar la actividad de la MPO y de la PON–1 en plasma de pacientes con asma analizando su relación con la función respiratoria teniendo como grupo control sujetos clínicamente sanos.
SELECCIÓN DE PACIENTES Y MÉTODOS
Este estudio forma parte del protocolo C03–04 y fue aprobado por el Comité de Investigación del Instituto. Todos los procedimientos realizados se efectuaron en estricto apego a las recomendaciones que aparecen en la Declaración de Helsinki de 1975, así como con los lincamientos que dicta el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud en su Título Segundo Capítulo I Artículo 17 Categoría II.
Pacientes. Se seleccionaron de la consulta externa del Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas (INER), previa aceptación por medio de carta de consentimiento informado con las siguientes características: Uno u otro sexo, mayores de 35 años, con diagnóstico de asma leve a moderada, de acuerdo a los criterios de la GINA14. Se les realizaron exámenes de laboratorio, así como pruebas de función respiratoria por un técnico calificado, de acuerdo a ios lincamientos de la ATS (American Thoracic Society, por sus siglas en inglés)15. Se excluyeron aquellos pacientes con triacilgliceridemia y colesterolemia mayor a 250 mg/dL
Obtención de las muestras. Se obtuvo una muestra de 10 mL sangre por venopunción en tubos a! vacío con heparina adicionados con hidroxitolueno butilado 2 mM en etanol.
Actividad de MPO. Para la determinación de la MPO se siguió el método de Bozeman16 con las siguientes modificaciones: se utilizaron 10µL de plasma a los que se les agregó un amortiguador de acetato–sacarosa 0.3 M con un pH de 5.4; 100 wL de 3,3',5,5'–Tetrametilbenzidina (Sigma) 1.4 mM y 100µL de peróxido de hidrógeno 0.3 mM. Se incubó durante 10 minutos a 37° C y se adicionaron 10/¿Ldecatalasaa una concentración final de 1300 U/mLy 100 µL de ácido acético 0.2 M. La muestra se centrifugó a 3000 rpm durante 5 min. El sobrenadante se leyó en un espectrofotómetro marca Beckman Coulter DU 800 a una longitud de onda de 655 nm. Se definió una unidad de actividad de MPO como la cantidad de enzima necesaria para catalizar un incremento en la absorbencia de 0.1 a 655 nm por minuto a 25ºC. La actividad específica de MPO se expresó en U/mg de proteína–1.
Actividad de PON–1. Para la determinación de la PON se siguió el método de Abbott et al.17, utilizando 25 µL de plasma adicionado con eserina 5x10–6 M y 10 minutos de incubación en ausencia de luz, transcurrido el tiempo señalado se tomaron 20 µL de la muestra y se les agregaron 480 µL de una solución Tris HCI 90 mM pH 8.5, que contenía CaCI21.9 mM, NaCI 3.6 mM y Paraoxon 2.5 mM, se mezcló por inversión y se leyó en un espectrofotómetro marca Beckman Coulter DU®800 a una longitud de onda de 405 nm durante 5 min. La actividad específica de la PON–1 se expresó en nmol p–nitrofenol/mg de proteína1.
Para el tratamiento estadístico se realizó la U de Mann–Whitney para la comparación entre los grupos y la correlación de Spearman para las variables de función respiratoria y actividad enzimática.
RESULTADOS
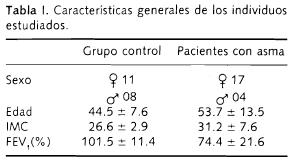
En la Tabla I se muestran las características generales de los individuos estudiados.
En la Figura 1, se muestran los resultados de la actividad de la MPO en donde se observa que la actividad de la enzima fue 42% mayor en el grupo de pacientes con asma comparado con el grupo de sujetos clínicamente sanos (57.31 ± 7.2 U vs 33.34 ± 4.7 U p<0.05). En la Figura 2 se presenta la actividad de la PON–1 que fue 52% mayor que en el grupo control (0.09 ± 0.1 nmol p–nitrofenol/mg prot vs 0.05 ± 0.01 nmol p–nitrofenol/mg prot p<0.01). En la Figura 3 se presentan los valores para establecer una correlación inversa entre el FEV1 y la actividad de la enzima MPO con una r de Spearman de –0.57, mientras que la actividad de la PON mostró una correlación directamente proporcional (Figura 4) con el FEF25 75 con una r de Spearman de 0.64.




DISCUSIÓN
En este trabajo se demuestra, por primera vez, que las enzimas implicadas tanto en la producción de ERO como en la protección del daño a lípidos por estas especies, como son la MPO y la PON–1 respectivamente, se encuentran alteradas en los pacientes con asma. Se ha demostrado que la generación intermitente de las ERO como consecuencia de una activación constante de los leucocitos debido a una inflamación crónica, puede modificar la respuesta de las vías aéreas al reto con acetilcolina y bradicinina18,19, y que las células leucocitarias obtenidas por lavado bronquioalveolar de estos pacientes producen una mayor producción de ERO, comparadas con las de sujetos sanos20, respuesta que es inversamente relacionada con el volumen espiratorio forzado del primer segundo (FEV^ así como con el flujo espiratorio pico (PEF)en los pacientes asmáticos21. Por otro lado, se ha mostrado la existencia de un incremento en la concentración de marcadores de lipoperoxidación en el aire espirado de los pacientes con asma21–23. Los leucocitos residentes en la vía aérea de estos pacientes manifiestan una mayor producción de ERO; de manera similar a los neutrófilos circulantes que también incrementan la generación de radicales libres in vitro cuando están en contacto con contaminantes ambientales como es el caso del material particulado, y en especial las PM<2524. Las nano–partículas (PM<0.01) son capaces de atravesar la barrera alveolocapilar e ingresar al torrente circulatorio induciendo la activación de las células leucocitarias con la consecuente producción de especies reactivas del oxígeno a nivel periférico provocando daño a otros órganos de la economía. Este hecho es muy importante ya que la generación de estas especies no está confinada al compartimiento pulmonar, y en consecuencia puede ejercer daño sistémico afectando la evolución del asma y de otros padecimientos en el caso de existir comorbilidad como es el caso de la frecuente asociación asma–diabetes, asma–hipertensión.
Debido a la importancia de los hallazgos que se presentan en esta comunicación, se están ampliando para generar otras publicaciones.
CONCLUSIONES
La actividad de MPO fue 45% mayor y la PON–1 45% menor en los pacientes con asma, comparados con el grupo control. Estos resultados representan evidencia de que estos pacientes se encuentran cursando con un EO que se expresa por el aumento en la actividad de la MPO y un decremento en la actividad de la PON–1, lo que tiene un impacto negativo en su función pulmonar traduciéndose en un inadecuado control. Este estado de EO puede verse agravado o acentuado por la exposición a los contaminantes ambientales, implicando un mayor riesgo para la evolución y adecuado control de este padecimiento.
REFERENCIAS
1. Salako, BL, Ajayi, SO. Bronchial asthma: a risk factor for hypertension? Afr J Med Sci 2000; 29:47–50. [ Links ]
2. De Catherina R, Zampolli A. From asthma to Atherosclerosis 5–Lipoxygenase, leukotrienes and inflammation. N Engl J Med 2004; 350 (1):4–7. [ Links ]
3. Wannamethee C, Shaper AG, Ebrahim S. Respiratory function and risk of stroke. Stroke 1995; 26:2004–2001. [ Links ]
4. Barnes PJ. Reactive oxigen species and airway inflammation. Free Radie Biol Med 1990; 9:235–43. [ Links ]
5. Nadeem A, Chhabra SK, Masood A, Raj KG. Increased oxidative stress and altered levels of antioxidants in asthma. J Allergy Clin Immunol 2003; 111 (1):72–8. [ Links ]
6. Monteseirin J, Bonilla I, Camacho J, Conde J, Sobrino F. Elevated secretion of myeloperoxidase by neutrophils from asthmatic patients: the effect of immunotherapy. J Allergy Clin Immunol 2001 ;107 (4):623–6. [ Links ]
7. Abul H, Abul A, Khan I, Mathew TC, Ayed A, Al–Athary E. Levels of IL–8 and myeloperoxidase in the lungs of pneumonia patients. Mol Cell Biochem 2001; 217 (1–2):107–12. [ Links ]
8. Mathy–Hartert M, Damas P, Nys Art, et al. Nitrated proteins in bronchoalveolar lavage fluid of patients at risk of ventilator–associated bronchopneumonia. Eur Respir J 2000; 16 (2):296–301. [ Links ]
9. Cantin AM, North SL, Fells GA, Hubbard RC, Crital RG. Oxidant–mediated epithelial cell injury in idiopathic pulmonary fibrosis. J Clin Invest 1987; 79:1665–1673. [ Links ]
10. Ricciardolo FL, Caramori G, Ito K, et al. Nitrosative stress in the bronchial mucosa of severe chronic obstructive pulmonary disease. J Allergy Clin Immunol 2005; 116 (5):1028–35. [ Links ]
11. Keatings VM, Barnes NC. Cranulocyte activation markers in induced sputum: comparisons between chronic obstructive pulmonary disease, asthma, and normal subjects. Am J Respir Crit Care Med 1997; 155:449–453. [ Links ]
12. Vita JA, Brennan M–L, Gokce Noyan, Mann SA, Goormastic M, Shishehbor. Serum Myeloperoxidase Levels Independently Predict Endothelial Dysfunction in Humans. Circulation 2004; 110:1134–1139. [ Links ]
13. Baldus S, Heeschen C, Meinertz T, Zeiher AM, Eiserich JP, Münzel T, et al. Myeloperoxidase Serum Levels Predict Risk in Patients With Acute Coronary Syndromes. Circulation 2003; 108:1440–1445. [ Links ]
14. National Asthma Education and Prevention Program. Expert panel report: guidelines for the diagnosis and management of asthma: update on selected topics–2002. Bethesda, Md.: U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health, National Heart, Lung, and Blood Institute, 2003; NIH publication no. 02–5074. [ Links ]
15. American Thoracic Sociert. Standarization of spirometry. 1994 update. Am J Respir Crit Care Med 1995; 152:1107–1136. [ Links ]
16. Bozeman PC, et al. Assay of the human leukocyte enzymes myeloperoxidase ano sosinophil peroxidase. Journal of Immunological Methods 1960; 126:125–133. [ Links ]
17. Abbott CA, Mackness Ml, Kumar S, Boulton AJ, Durrington PN. Serum paraoxonase activity, concentration and phenotype distribution in diabetes mellitus and its relationship to serum lipids and lipoproteins. Arteriosclerosis, Thrombosis and Vascular Biology 1995; 15:1812–1818. [ Links ]
18. Tsukagoshi H, Robbins RA, Barnes PJ, Cheng KF. Role of nitric oxide and sueroxide anión in interleukin– 1b–induced airway hyperresponsiveness to bradykinin. Am J Respir Crit Care Med 1994; 150:1019–1025. [ Links ]
19. Asano T, Hattori T, Tada T, Kajíkuri J, Kamiya T, Saitoh M, Yamada Y, Itoh M, Itoh T. Role of the epithelium in opposing H2O2–induced modulation of acetylcholine–induced contractions in rabbit intrapulmonar/bronchiole. Br J Pharmacol 2001,132:1271–1280. [ Links ]
20. Jarjour NN, Calhoum WJ. Enhanced production of oxygen radicals in asthma. J Lab Clin Med 1994; 123: 131–137. [ Links ]
21. Antczak A, Nowak D, Shariati B, Krol M, Piasecka G, Kurmanowska Z. Increased hydrogen peroxide and thiobarbituric acid–reactive products in expired breath condensate of asthmatic patients. Eur Respir J 1997; 10:1235–1241. [ Links ]
22. Olopade CO, Zakker M, Swedler Wl, Rubenstein I. Exhaled pentane levels in acute asthma. Chest 1997; 111:862–865. [ Links ]
23. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Increased 8 isoprostane, a maker of oxidative stress, in exhaled condensate of asthma patients. Am J Respir Crit Care Med 1999; 160:216–220. [ Links ]
24. Sierra–Vargas MP, Torres–Ramos YD, Bernabé–Cabanillas RM, Bianco–Jimenez S, Cebados G, Hicks JJ. Air pollutant material from three different places (Mexico City) increase free radicals generation in vitro by circulating leukocytes from asthmatics. Enviado para publicación. Environ Health Perspectives. [ Links ]
Apoyo CONACYT: 2004–0027














