Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.19 no.4 México oct./dic. 2006
Original
Resultados de la timectomía máxima en miastenia gravis. Experiencia de 20 años en el Servicio de Neumología y Cirugía de Tórax en el Hospital General de México. Influencia de la timectomía en dosis de piridostigmina y tres variables espirométricas en miastenia gravis
Results of maximal thymectomy in myasthenia gravis. A 20 year experience at The Pulmonology and Thoracic Surgery Department of Mexico's General Hospital. The influence of thymectomy over the dose of pyridostigmine and three spirometric variables in myasthenia gravis.
Francisco Navarro–Reynoso* Alfredo Pérez–Romo* León Green* Rafael Páramo–Arroyo* Raúl Cicero–Sabido*
• Servicio de Neumología y Cirugía de Tórax Alejandro Celis.
Hospital General de México y Facultad de Medicina.
Universidad Nacional Autónoma de México.
Correspondencia:
MASS, Dr. Francisco Navarro–Reynoso,Director General Adjunto Médico.
Hospital General de México, SSA.
Dr. Balmis 148, colonia Doctores. Delegación Cuauhtemoc.
Apdo. Postal 11–789.México, DF., 06101
Correo electrónico: miroivo@prodigy.net.m
Trabajo recibido: 14–VIII–2006;
aceptado: 27–X–2006
RESUMEN
La miastenia gravis (MG) es una enfermedad de la placa neuromuscular, caracterizada por debilidad y fatiga muscular. Puede estar relacionada con casos de timoma y más frecuentemente con hiperplasia del timo. La MG se trata con medicamentos como la piridostigmina; cuando no se controla a pesar de altas dosis, o aparecen efectos secundarios indeseables, se indica la timectomía que permite disminuir o suspender la medicación. En este trabajo se presenta la experiencia de 20 años en 126 pacientes con MG que han sido sometidos a timectomía máxima; hubo una defunción postoperatoria inmediata y otra tardía, ambas relacionadas con falta de recuperación de fuerza muscular. Después de la timectomía máxima se observó disminución postoperatoria en las dosis de piridostigmina y mejoría de las pruebas de función respiratoria, con valores estadísticamente significativos.
Palabras clave: Miastenia gravis, piridostigmina, pruebas de función respiratoria, timectomía máxima.
ABSTRACT
Myasthenia gravis (MG) is a disease of the neuromuscular plaque characterized by weakness and fatigue. It can be related to thymic tumors or hyperplasia of the gland. MG is treated with pyridostigmine; if medical control can not be achieved or unpleasant symptoms appear, thymectomy is indicated. We present our 20 year experience with 126 cases of transternal maximal thymectomy for the treatment of MG; there were two postoperative deaths related to respiratory muscle weakness. Statistically significant improvements in pyridostigmine dosage, tidal volume, vital capacity and maximal inspiratory force were seen after surgery.
Key words: Maximal thymectomy, myasthenia gravis, pyridostigmine, pulmonary function tests.
INTRODUCCIÓN
La miastenia gravis (MG) es una enfermedad autoinmune de la placa neuromuscular, que se caracteriza por debilidad y fatiga progresivas de uno o vahos músculos estriados1–4. Ocurre con mayor frecuencia entre la segunda y tercera década de la vida en el sexo femenino, y entre la sexta y séptima en el sexo masculino3,4.
En la MG existe un deterioro de la transmisión neuromuscular por autoanticuerpos producidos por el timo y las células de la médula ósea, que bloquean progresivamente los receptores nicotínicos de la acetilcolina de la membrana postsináptica en la unión neuromuscular, dando como resultado un déficit de estimulación de los músculos estriados y a una disminución progresiva de la fuerza muscular, ya que el efecto de la acetilcolina se reduce,3,4 condición que puede llevar al enfermo a insuficiencia respiratoria por disfunción de los músculos respiratorios, por lo que es una enfermedad incapacitante y de alta morbilidad, aun cuando se trate adecuadamente.3–6 Entre los pacientes con MG, el 25–30% tiene timoma, en tanto sólo el 8 al 12% de los que tienen timoma llegan a desarrollar MG1–3,5–7.
El diagnóstico de MG se establece observando la respuesta a fármacos colinérgicos durante la realización de una electromiografía; algunos pacientes tienen niveles elevados de anticuerpos contra los receptores de acetilcolina6–8.
El tratamiento se inicia con la administración progresiva de piridostigmina a dosis respuesta, lo que puede producir efectos colaterales indeseables; entonces, la administración de esteroides y ciclofosfamida, la plasmaféresis y la resección del timo están indicados5–8.
Para evaluar la severidad de la MG, Osserman propuso una clasificación que lleva su nombre y se basa en las características clínicas de los diferentes tipos de MG, lo que permite valorar a los pacientes comparativamente antes y después de realizada la timectomía (Tabla I)6.
La resección del timo o sus restos, sea con hiperplasia o con timoma benigno o maligno, ayuda al control de los pacientes con MG permitiendo la disminución o suspensión de los medicamentos1,3,5,7–9.
Este trabajo comunica la experiencia del Servicio de Neumología "Alejandro Celis" del Hospital General de México en el manejo de pacientes con MG sometidos a timectomía, con y sin timoma, su manejo pre, trans y postquirúrgico, así como su seguimiento, tratando de comparar los resultados con los reportados en la literatura, incluyendo una comunicación previa de nuestro grupo7.
MATERIAL Y MÉTODOS
Se seleccionaron 126 enfermos consecutivos con diagnóstico de MG en los que se realizó resección del timo y la grasa desde la parte baja del cuello, todo el mediastino hasta la parte más baja del pericardio, timectomía máxima, desde enero de 1985 a enero de 20051–3,7–11; el postoperatorio de todos se controló en la Unidad de Cuidados Intensivos Respiratorios (UCIR). A todos se les realizaron historia clínica, radiografías posteroanterior y lateral del tórax, prueba de piridostigmina, medición de anticuerpos, edrofonio, tomografía computada de tórax (TC) y, en 27 casos, resonancia magnética nuclear (RMN). También se efectuaron pruebas de función respiratoria (PFR) determinando capacidad vital (CV), volumen corriente (VC), flujo espiratorio del primer segundo (FEV1) y capacidad inspiratoria máxima (CIM); las PFR se realizaron 3 días antes, 4 y 8 semanas después de la operación.
Se determinaron las dosis de piridostigmina pre y postoperatorias y se correlacionaron con los valores espirométricos. Se registraron las complicaciones postoperatorias y los eventos observados en el seguimiento de cada caso por un lapso hasta de 15 años. Se realizó la prueba de t de Student para muestras pareadas, comparando el estado preoperatorio y postoperatorio en relación con la dosis de bromuro de piridostigmina requerida y la función pulmonar, específicamente con el VC, CV y fuerza muscular inspiratoria máxima (FIM) observadas.
RESULTADOS
Se estudiaron 126 enfermos, 111 mujeres (88.09%) y 15 (11.9%) hombres, edad promedio 32.5 años, rango de 16 a 62 años. El tiempo de evolución previo a la cirugía fue de 18.2 meses, rango de 8 a 26 meses. El resultado histopatológico de tejido resecado fue el de hiperplasia tímica en 98 (77.77%), timo en involución en 5 (3.96%), timoma maligno en 11 (8.73%) y timoma benigno en 12 (7.14%).
Se realizó RMN en 27 casos en que la TC mostró una lesión mayor de 2 cm, o había duda sobre el involucro de vasos u otras estructuras vitales del mediastino, o de las relaciones anatómicas del timo; en los casos de MG en que la TC mostró hallazgos de probable hiperplasia tímica, se realizó solamente TC.
La diferencia de las dosis de piridostigmina pre y postquirúrgica resultó con un 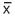 = 234, rango de 120–360 mg y un error estándar de 15.0 x = 56.5 mg, rango de 7.5 a 240 mg y error estándar de 15.98. La dosis de piridostigmina se redujo a un promedio de 189.0 mg que equivale a un 79.84% de la dosis preoperatoria, p < 0.0001.
= 234, rango de 120–360 mg y un error estándar de 15.0 x = 56.5 mg, rango de 7.5 a 240 mg y error estándar de 15.98. La dosis de piridostigmina se redujo a un promedio de 189.0 mg que equivale a un 79.84% de la dosis preoperatoria, p < 0.0001.
Los resultados de las PFR dependen directamente de la fuerza muscular. El resultado fue de un VC pre quirúrgico de 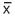 = 236.68 mL, rango de 150 a 300 mL, error estándar de 11.41; VC postquirúrgicoa las 4 semanas de
= 236.68 mL, rango de 150 a 300 mL, error estándar de 11.41; VC postquirúrgicoa las 4 semanas de 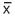 = 299.33 mL rango de 200 a 400 mL, error estándar 12.74; a las 8 semanas, VC de
= 299.33 mL rango de 200 a 400 mL, error estándar 12.74; a las 8 semanas, VC de 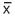 = 310.80 mL rango de 200 a 400 mL, error estándar 18.74. Hubo mejoría postoperatoria del 21 % con relación al VC preoperatorio, p < 0.0001. La CV prequirúrgica,
= 310.80 mL rango de 200 a 400 mL, error estándar 18.74. Hubo mejoría postoperatoria del 21 % con relación al VC preoperatorio, p < 0.0001. La CV prequirúrgica, 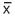 = 64.2% rango de 55 a 75%, error estándar de 1.42; x = 73.93%, rango de 65–85 % y error estándar de 1.62 y postquirúrgica a las 4 semanas de
= 64.2% rango de 55 a 75%, error estándar de 1.42; x = 73.93%, rango de 65–85 % y error estándar de 1.62 y postquirúrgica a las 4 semanas de 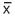 = 68.3 %, rango de 55–75%, error estándar de 1.62; a las 8 semanas de x = 73.93%, rango de 65–85%, error estándar de 1.62, respectivamente, p < 0.0001. Hubo mejoría de la CV en 9.73 % con relación al nivel preoperatorio, p < 0.0001. La FIM prequirúrgica resultó con una
= 68.3 %, rango de 55–75%, error estándar de 1.62; a las 8 semanas de x = 73.93%, rango de 65–85%, error estándar de 1.62, respectivamente, p < 0.0001. Hubo mejoría de la CV en 9.73 % con relación al nivel preoperatorio, p < 0.0001. La FIM prequirúrgica resultó con una 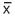 = – 8.53 ± 1.2 cm H2O, rango de –6 a–12 cm. H2O, error estándar 0.41; la postquirúrgica a las 4 semanas de x < 14.6 ± 2.3 cm H2O, rango de –10 a –18 cm H2O, error estándar 0.55. A las 8 semanas presentaron una mejoría de –14.50 ± 2.4 cm H2O que equivale a 70.96% de mejoría en relación con la cifra basal, p < 0.0001.
= – 8.53 ± 1.2 cm H2O, rango de –6 a–12 cm. H2O, error estándar 0.41; la postquirúrgica a las 4 semanas de x < 14.6 ± 2.3 cm H2O, rango de –10 a –18 cm H2O, error estándar 0.55. A las 8 semanas presentaron una mejoría de –14.50 ± 2.4 cm H2O que equivale a 70.96% de mejoría en relación con la cifra basal, p < 0.0001.
En el postoperatorio, todos menos uno se lograron decanular dentro de las primeras 48 h, el 92% en las primeras 24 h. Uno, con timoma maligno, permaneció intubado por no haber recuperado fuerza muscular a pesar de tratamiento médico agresivo, cursó con neumonía recidivante, insuficiencia respiratoria dependiente del ventilador que ameritó traqueotomía y falleció 20 días después en la UCIR. Otro enfermo presentó recidiva de los síntomas de MG, reingresó a la UCIR en dos ocasiones y se reintubó en ambas, falleciendo a los 13 meses de la timectomía. Un caso presentó mediastinitis con choque séptico y neumonía de focos múltiples; se resolvió con antimicrobianos y otras medidas durante una estancia de doce días en la UCIR.
Se hizo plasmaféresis en sólo 46 casos, ya que nuestro Servicio sólo cuenta con los recursos necesarios para su realización desde hace 7 años.
En un análisis de regresión lineal se encontró una pobre correlación (r = 0.09) entre tiempo de evolución y respuesta al tratamiento, aumentando ligeramente (r = 0.24) entre edad y respuesta postoperatoria, evaluada con el porcentaje de la dosis utilizada en el postoperatorio vsla preoperatoria.
La evolución postoperatoria se ha seguido en el Servicio de Neurología y en el nuestro, excepto en 34 pacientes que viven fuera de la ciudad de México y se controlan en otras instituciones. Los 90 restantes han tenido buena evolución; no ha habido fallecimientos. En 89 pacientes (70.6%) la reducción de la dosis de piridostigmina ha sido muy evidente, suspendiéndose en 14 de manera definitiva.
DISCUSIÓN
La morbimortalidad de la MG varía del 5 al 10%, y es fundamentalmente de origen respiratorio, por la falta de fuerza muscular para expectorar satisfactoriamente, lo que lleva a retención de secreciones, atelectasia, neumonía, etc7,9–12. La mortalidad ocurre de 4 a 7 años después del inicio de los síntomas; en otros, la enfermedad tiende a estabilizarse y se puede controlar, incluso, únicamente con tratamiento médico2,7,12–19.El tratamiento de la MG con timectomía máxima busca obtener la remisión permanente de la enfermedad y requiere de un grupo interdisciplinario formado por neurólogos, neumólogos clínicos, cirujanos de tórax, nutriólogos, neumólogos intensivistas, un psicólogo y enfermeras intensivistas dedicadas las 24 horas, sobre todo las primeras 72 horas del postoperatorio, en donde el paciente puede requerir de reintubación7–12. La timectomía temprana es recomendable, desde el inicio de los síntomas y una vez que se ha hecho el diagnóstico de MG, ya que modifica favorablemente el curso de la enfermedad. Cuando se realiza la cirugía de manera temprana se puede obtener un mejor estado funcional respiratorio, con la dosis mínima posible de los agentes anticolinesterásicos o anticolinérgicos y una mejor evolución postoperatoria12,13,19–25. Sin embargo, en algunos pacientes sólo se obtiene una mejoría parcial, pero permite la disminución de las dosis de los medicamentos3,7,14,26,27.
La timectomía puede realizarse desde la pubertad hasta los 60 años3,14. En esta serie la timectomía se realizó en promedio 18.2 meses después del inicio de los síntomas; el 80% de los pacientes tenían menos de 60 años. Además, se observó la reducción de la dosis de bromuro de piridostigmina, así como la mejoría estadísticamente significativa de los parámetros de función respiratoria dependientes de la fuerza muscular, como el VC, la CV y la FIM, posterior a la resección del timo. La evolución de 90 casos ha sido buena, sin fallecimientos, aparte de los dos ya consignados. En 89 pacientes (70.6%) la reducción de la dosis de piridostigmina ha sido muy evidente, pudiéndose suspender en 14 de manera definitiva, tal como se ha referido en la literatura>5,7,23–25,27–29.Se ha mencionado que los mejores resultados se obtienen en los casos cuya histología es no neoplásica, pero en los malignos la timectomía puede prevenir las metástasis y en algunos casos proporciona un mejor control de los síntomas de enfermedad. Se dice que la timectomía mejora el curso de la MG en un tercio de los enfermos con timoma y en más de la mitad de los pacientes con timo no neoplásico5–8,14–17. De los timomas, los más frecuentes son los linfoepiteliales y representan el 8.5–15% de los pacientes con MG; de este grupo, el 43% son malignos, con hallazgos quirúrgicos que sugieren invasión directa o presencia de nodos linfáticos mediastinales positivos5,7,8,14–17.
La vía transesternal es la de elección, ya que permite la exploración completa desde la base del cuello, hasta el pericardio a la altura del apéndice xifoides y a los lados, hasta los frénicos o aún más atrás, lo que permite remover todo el tejido tímico y la grasa mediastinal en lo que se le llama timectomía máxima5,7–9,14,18,23.
Es obligada la valoración de los enfermos con MG, meses y años después. Nosotros hemos seguido la evolución de enfermos operados desde 1987, pero algunos se controlan en su lugar de origen; pocos casos se han perdido por completo. La evolución de los nuestros ha sido mejor para los que tuvieron hiperplasia tímica que para los que presentaron timoma; la mejoría de los casos con hiperplasia tímica, puede ser de entre 3 y 5 años y la curación permanente se ha visto en el 35% vs el 15% para los de timoma benigno. Cuando el tumor ha invadido los tejidos adyacentes, la remisión es menor al 9% y la sobrevida menor al 23%5,7–9,18.Algunas series proponen la realización rutinaria de plasmaféresis preoperatoria y timectomía. Nosotros la hacemos de rutina en los últimos siete años, 46 casos, con lo que los resultados del postoperatorio inmediato fueron mejores, por lo que estamos de acuerdo con que el procedimiento se realice en todos los enfermos6,7,19,20,25,27–30.
La timectomía no es una cirugía de urgencia; debe de tenerse al paciente en las mejores condiciones de función respiratoria, libre de infecciones, suspenderse el tratamiento inmunosupresor y con una dosis mínima de esferoides en caso de que los reciba, así como un manejo anestésico adecuado21,22,28. Un buen parámetro de control clínico es la clasificación de Osserman, que se debe aplicar en el preoperatorio para poder medir y comparar con los datos objetivos del postoperatorio. Los pacientes en estadios I, IIa y IIIb en el preoperatorio, presentan mejores resultados que los de los estadios III y IV5,7,23–30.
CONCLUSIONES
Se realizaron 126 timectomías máximas por vía transesternal en otros tantos pacientes consecutivos con MG.
Se observó mayor frecuencia del sexo femenino (88.09%), con un promedio de edad de 32.5 años.
El diagnóstico histopatológico más frecuente fue el de hiperplasia folicular linfoide, con una mejoría clínica postquirúrgica evidente.
Se observó la reducción de la dosis de bromuro de piridostigmina así como la mejoría de los parámetros de función respiratoria dependientes de la fuerza muscular, como el VC, CV y FIM con valores estadísticamente significativos antes y después de la cirugía.
El manejo de los pacientes con MG, debe de ser multidisciplinario y el equipo quirúrgico debe de tener experiencia en estos casos para obtener mejores resultados. Se considera que el tratamiento de elección de la MG que no responde a manejo médico óptimo debe ser la plasmaféresis seguida de timectomía máxima.
REFERENCIAS
1. Davis RD Jr, Oldham HN Jr, Sabiston DC Jr. The mediastinum. In: Sabiston DC, Spencer FC, editors. Surgery of the chest. 5a ed. New York: Saunders; 1990. p. 498–535. [ Links ]
2. Kim LH, Sabiston DC Jr. Neoplasiasy quistes primarios del mediastino. En: Fishman A, editor. 2a ed. Tratado de neumología. México: McGraw–Hill; 1983. p. 1938–1962. [ Links ]
3. Adams RD, Victor M. Principles of neurology. 5th ed. New York: McGraw–Hill; 1993. p. 1252–1270. [ Links ]
4. Drachman DB. Myasthenia gravis. N Engl J Med 1994;330:1797–1810. [ Links ]
5. Marchevsky AM, Kaneko M. Surgical pathology of the mediastinum. New York: Raven Press;1984. [ Links ]
6. Osserman KE, Genkins G. Studies on myasthenia gravis; a reference for health care professionals. In: Myasthenia Gravis Foundation of America. HYPERLINK http://www.myasthenia.org November, 2003. [ Links ]
7. Navarro RF, Pérez–Romo A, Escosura–Romero G, Lorenzo–Silva JM, Cicero–Sabido R. Timectomía y miastenia gravis. Rev Inst Nal Enf Resp Mex 1997;10:286–293. [ Links ]
8. Navarro RF, Lorenzo SJ. Tratamiento de los tumores gigantes del mediastino. Gac Med Mex 2001;137:117–124. [ Links ]
9. Slater G, Papatestas AE, Genkins G, Kornfeld P, Horowitz SH, Bender A. Thymomas in patients with myasthenia gravis. Ann Surg 1978;188:171–174. [ Links ]
10. Jaretzki A, Wolff M. "Maximal" thymectomy for myasthenia gravis. Surgical anatomy and operative technique. J Thorac Cardiovasc Surg 1988;96:711–716. [ Links ]
11. Gibbon's F. Cirugía del mediastino. En: Gibbon's F, editor. Cirugía de tórax. Barcelona: Salvat;1983. p. 250–278. [ Links ]
12. Blalock A, Mason MF, Morgón HJ, Riven SS. Myasthenia gravis and tumors of the thymic region: report of a case in which the tumor was removed. Ann Surg 1939;110:544–561. [ Links ]
13. Genkins G, Papatestas AE, Horowitz SH, Kornfield P. Studies in myasthenia gravis: early thymectomy. Electrophysiologic and pathologic correlations. Am J Med 1975;58:517–524. [ Links ]
14. Hatton PD, Diehl JT, Daly BD, et al. Trans–sternal radical thymectomy for myasthenia gravis: a 15–year review. Ann Thorac Surg 1989;47:838–840. [ Links ]
15. Hatcher CR Jr, Abbott OA, Logan WD Jr, Symbas PN. Current status of thymectomy for myasthenia gravis. Ann Thorac Surg 1967;3:132–135. [ Links ]
16. Mulder DG, Graves M, Herrmann C. Thymectomy for myasthenia gravis: recent observations and comparisons with past experience. Ann Thorac Surg 1989;48:551–555. [ Links ]
17. Mulder DG, Herrmann C Jr, Keesey J, Edwards H. Thymectomy for myasthenia gravis. Am J Surg 1983;146:61–66. [ Links ]
18. Kirschner PA. Myasthenia gravis. In: Roth JA, Ruckdeschel JC, Weisenburger TH, editors. Thoracic oncology. New York: McGraw–Hill; 1989. p. 237–259. [ Links ]
19. Huang MH, King KL, Hsu WH, et al. The outcome of thymectomy in nonthymomatous myasthenia gravis. Surg Gynecol Obstet 1988;166:436–440. [ Links ]
2O. Dau PC, Lindstrom JM, Cassel CK, Denys EH, Shev EE, Spitler LE. Plasmapheresis and immunosuppressive drug therapy in myasthenia gravis. N Engl J Med 1977;297:1134–1140. [ Links ]
21. Perlo VP, Arnason B, Castleman B. The thymus gland in elderly patients with myasthenia gravis. Neurology 1975;25:294–295. [ Links ]
22. Lindberg C, Andersen O, Larsson S, Oden A. Remission rate after thymectomy in myasthenia gravis when the bias of immunosuppressive therapy is eliminated. Acta Neural Scand 1992;86:323–328. [ Links ]
23. Scadding GK, Havard CW, Lange MJ, Domb I. The long term experience of thymectomy for myasthenia gravis. J Neural Neurosurg Psychiatry 1985;48:401–406. [ Links ]
24. Nussbaum MS, Rosenthal GJ, Samaha FJ, et al. Management of myasthenia gravis by extended thymectomy with anterior mediastinal dissection. Surgery 1992;112:681–687. [ Links ]
25. Sanders DB, editor. Neurologic clinics. Myasthenia gravis and myasthenic syndromes. Philadelphia: Saunders;1994. p. 120–122. [ Links ]
26. Batra P, Herrmann C Jr, Mulder D. Mediastinal imaging in myasthenia gravis: correlation of chest radiography, CT, MR, and surgical findings. AJR 1987;148:515–519. [ Links ]
27. Vincent A, Palace J, Hilton–Jones D. Myasthenia gravis. Lancet 2001 ;357:2122–2128. [ Links ]
28. Reyes ERE, Olivares MH. Espíritu MS. Manejo anestésico del paciente con miastenia gravis. An Med Asoc Med Hosp ABC 2003;48:156–161. [ Links ]
29. Jaretzki A, Baroh RJ, Ernstoff RM, et al. Myasthenia gravis: recommendations for clinical research standards. Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Neurology 2000;55:16–23. [ Links ]
30. Weder–Cisneros N, Téllez–Zenteno JF, Velásquez–Paz A, et al. Respuesta de la timectomía en pacientes con timoma y miastenia gravis. Rev Invest Clin 2003;55:629–634. [ Links ]














