Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.19 no.3 México jul./sep. 2006
Original
Marcadores plasmáticos de estrés oxidante en población mexicana sana de 31 a 60 años de edad
Plasma markers of oxidative stress in healthy 31–60 year old mexican population
Yessica Dorin Torres–Ramos* Martha Patricia Sierra–Vargas* Ivonne María Olivares–Corichi‡ Juan José Hicks Gómez*
• Laboratorio de Bioquímica Inorgánica. Departamento de Bioquímica y Medicina Ambiental, INER Ismael Cosío Villegas.
‡ Laboratorio Multidisciplinario de la Unidad de Posgrado de la Escuela Superior de Medicina. IPN.
Correspondencia:
M. en C. Yessica Dorin Torres–Ramos, Dr. Juan José Hicks.
Departamento de Bioquímica y Medicina Ambiental. Laboratorio de Bioquímica Inorgánica.
Unidad de Investigación. Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas.
Calzada de Tlalpan 4502, colonia Sección XVI. México, DF., 14080.
Teléfono: 56 66 45 39, extensión 327.
Correo electrónico: toye_dorin@yahoo.com.mx
Trabajo recibido: 01–VIII–2006;
aceptado: 12–IX–2006
RESUMEN
Introducción: Patologías como asma, enfermedad pulmonar obstructiva crónica, diabetes mellitus, neuropatías y el síndrome de Alzheimer, entre otros, están asociados al estrés oxidante, condición metabóllca por la cual las personas que sufren estos padecimientos presentan modificaciones y rompimiento de biomoléculas en plasma; es importante conocer sus valores básales en personas sanas para poder interpretarlos adecuadamente.
Objetivo: Determinar las concentraciones básales de algunos marcadores de estrés oxidante en adultos sanos (31–60 años).
Método: A 67 personas sanas, divididas en tres grupos. Grupo 1 (31–40 años); grupo 2 (41–50 años) y grupo 3 (51–60 años), se les evaluaron los siguientes marcadores de estrés oxidante: Compuestos reactivos al ácido tiobarbitúrico (CRAT), predisposición al daño oxidante, determinación de grupos carbonilo, capacidad antioxidante total de plasma (CATP), y actividad enzimática de paraoxonasa. Los resultados se sometieron a pruebas estadísticas de ANOVA de una vía y post–hoc de Bonferroni, considerando una significancia de 0.05.
Resultados: Se encontró un aumento significativo en CRAT en el grupo 2 y en el grupo 3 (8.462 ± 0.571 vs 10.34 ± 1.23µM CRAT, respectivamente). En la predisposición a la lipoperoxidación, el grupo 3 fue el más susceptible al daño, debido a que hubo un incremento en los niveles de CRAT (477.0 ± 16.71 µM) en comparación al grupo 2 (432.3 ± 25.71 µM) y al grupo 1 (320.6 ± 28.95µM). En la determinación de grupos carbonilo no existieron diferencias entre los grupos. La CATP disminuyó en el grupo 2 con respecto al grupo 1 (0.950 ± 0.071 vs 0.69 ± 0.068 unidades, respectivamente). La actividad de paraoxonasa presentó un aumento en el grupo 3 con respecto al grupo 1 (0.119 ± 0.004 vs 0.072 ± 0.007 nmol p–nitrofenol/ mg proteína, respectivamente).
Conclusión: Las concentraciones de los marcadores de daño por estrés oxidante se ven modificadas por la edad del individuo. En el proceso natural de envejecimiento, el principal daño es a Iípidos.
Palabras clave: Estrés oxidante, capacidad antioxidante, especies reactivas de oxígeno, oxidación proteica, lipoperoxidación.
ABSTRACT
Introduction: Patients with asthma, COPD, diabetes mellitus, kidney diseases and Alzheimer syndrome, conditions associated to oxidative stress, have modifications and rupture of certain plasma biomolecules. In order to explain properly this findings, basal values in normal individuals of such biomolecules should be known.
Objective: To determine the basal values of some markers of oxidative stress in healthy 31 to 60 year old individuals.
Method: Seventy seven healthy volunteers were classified into group 1, 31 to 40 years, group 2, 41 to 50 years and group 3, 51 to 60 years; the following oxidative stress markers were measured: reactive compounds to tiobarbituric acid (TBARs), predisposition to oxidative stress, determination of carbonil groups, total antioxidative capacity of plasma (TACP) and enzymatic activity of paraoxonase. ANOVA and Bonferroni tests were used; a level of 0.05 was considered significant.
Results: Croup 2 and 3 showed significant increment in TBARs (8.462 ± 0.571 vs 10.34 ± 1.23µM TBARs, respectively). In the predisposition to lipoper oxidation, group 3 was more susceptible, due to an increase in RCTA levels (477.0 ± 16.71 µM) in comparison to group 2 (432.3 ± 25.71 µM) and 1 (320.6 ± 28.95 µM). There was no difference in the determination of carbonil groups between the groups. TACP is significantly diminished in group 2 in relation to group 1 (0.950 ± 0.071 vs 0.69 ± 0.068 units, respectively). Paraoxonase's activity showed a significant increase in group 3 in relation to group 1 (0.119 ± 0.004 vs 0.072 ± 0.007 nmol p–nitrophenol/mg protein, respectively).
Conclusion: Advancing age modifies biomolecular markers of oxidative stress; during the natural aging process, the main damage is to lipids.
Key words: Oxidative stress, reactive oxygen species, antioxidant capacity, protein oxidation, lipoperoxidation.
INTRODUCCIÓN
En el organismo se mantiene un proceso homeostático relacionado con el balance ácido–base1 y de óxido–reducción; en este último, se preserva el equilibrio entre agentes oxidantes y antioxidantes. Los oxidantes representados principalmente por las especies reactivas del oxígeno (ERO), se incluye a los radicales libres del oxígeno y a las especies moleculares precursoras de los mismos (H2O2)1. Las ERO se generan por diversas fuentes, pueden ser endógenas, como la respiración mitocondrial, o exógenas como la contaminación atmosférica. Los sistemas antioxidantes se encuentran constituidos por enzimas y diversas moléculas que inactivan a los agentes antioxidantes2.
Aun en condiciones de equilibrio entre ambos sistemas, la generación de ERO, en cantidades limitadas como resultado del metabolismo celular, ocasiona modificaciones y rompimiento de biomoléculas que son detectadas y cuantificadas por una serie de marcadores de estrés oxidante en plasma3.
Diversos grupos de trabajo en el mundo han referido valores básales (población sana), para cada uno de los marcadores de estrés oxidante. Sin embargo, estos valores no pueden ser tomados como referencia para la población mexicana ya que el grado de estrés oxidante está influenciado por la alimentación, las condiciones atmosféricas y el estilo de vida, por lo que es necesario determinar los valores básales de los diferentes marcadores de estrés oxidante en la población mexicana y poder evaluar la participación de las ERO en enfermedades crónico–degenerativas asociadas con estrés oxidante, entre ellas las pulmonares como el asma4 y la enfermedad pulmonar obstructiva crónica (EPOC)5. Por ello, decidimos determinar los valores básales de algunos marcadores plasmáticos de estrés oxidante en población mexicana sana, tales como compuestos reactivos al ácido tiobarbitúrico (CRAT), predisposición al daño por lipoperoxidación, determinación de grupos carbonilo, capacidad antioxidante total de plasma (CATP) y la actividad de la enzima paraoxonasa.
MATERIAL Y MÉTODOS
Se realizó un estudio transversal en 67 voluntarios sanos en la ciudad de México sin ninguna enfermedad crónico–degenerativa, de género indistinto, de 31 a 60 años, los cuales fueron evaluados clínicamente por medio de análisis generales de laboratorio, aprovechando la muestra de sangre para el presente estudio. Los voluntarios fueron agrupados por décadas (31–40, 41–50, 51–60 años), se asignaron como grupo 1, grupo 2 y grupo 3, respectivamente; a cada voluntario se le determinaron los siguientes biomarcadores de estrés oxidante en plasma:
Determinación de compuestos reactivos del ácido tiobarbitúrico
Es un marcador de daño a lípidos en donde se lleva a cabo el rompimiento de ácidos grasos insaturados de los fosfolípidos que conforman micelas o membranas, proceso llamado lipoperoxidación, que genera como productos finales diversos aldehidos entre los que destaca el malondialdehído (MDA). Se cuantificó por el método de Yagi6. Se reporta por µM de CRAT.
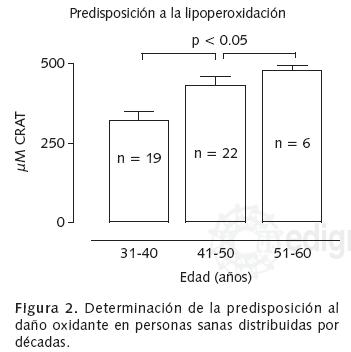
Determinación de la predisposición a la lipoperoxidación
La predisposición es un nuevo marcador de daño a lípidos que evalúa la facilidad o susceptibilidad de los lípidos (lipoproteínas y fosfolípidos totales) del plasma de un individuo a ser oxidados debido a las biomoléculas circulantes. Este nuevo marcador es propuesto por nosotros y se realiza mediante la determinación de 5 µL de plasma que se adicionan en 950 µL de amortiguador Trizma–Preset 7.2 mM pH 8.0, conteniendo H2O2 5 mM y FeCI25 mM, se incuban 15 minutos a 37°C, posteriormente se les adiciona 1 mL de ácido tiobarbitúrico al 0.375% en HCI 0.2 N, se calienta a 90°C durante 15 minutos, y finalmente se agregan 0.5 mL de HCI 0.2 N. La absorbencia fue obtenida a una longitud de onda de 532 nm a 25°C, en un espectrofotómetro Perkin Elmer UV/ VIS modelo B050–9914. Se reporta por µM de CRAT.
Determinación de la capacidad antioxidante total del plasma
La CATP es un marcador de defensa antioxidante. Se basa en la capacidad de los sistemas antioxidantes del plasma para inhibir el 50% de la formación de CRAT, se cuantificó por el método de Olivares Corichi7. Se reporta por unidades, éstas se definen como la cantidad de antioxidante total en el plasma necesario para inhibir el 50% de formación de MDA de una solución 90 mM de ácidos grasos (linolénico–linoleico), expuestos a una reacción de Fenton.
Determinación de la actividad de paraoxonasa
La paraoxonasa es una enzima que impide el proceso de lipoperoxidación, se encuentra asociada con las Apo A de las HDL8, la actividad de esterasa de tipo A le confieren la capacidad de interrumpir el proceso de lipoperoxidación ya iniciado por ERO impidiendo el daño oxidante sobre las LDL9 y la misma HDL. Para determinar la actividad de paraoxonasa en plasma se utilizó el método descrito por Bin10. La actividad es reportada por nmol de p–nitrofenol/min/mg de proteína, las cuales fueron determinadas por el método de Lowry11.
Determinación de grupos carbonilo
El biomarcador de daño a proteína más utilizado es el ensayo de grupos carbonilo12. La exposición de los grupos carbonilos puede surgir como resultado de: a) el ataque directo de los radicales, b) la interacción con metales de transición, c) la glicación o d) por la formación de aducios entre proteínas y algunos productos de la lipoperoxicidación12. Los grupos carbonilo fueron cuantificados por el método de Dalle–Done13 y se reportan por nmol/mg de proteína.
Análisis estadístico
Mediante el programa prisma 2.01 (Graph Pad, San Diego, Estados Unidos), se empleó un ANOVA de una vía, y para valorar las diferencias entre grupos se aplicó una prueba post–hoc Bonferroni, considerando un nivel de significancia estadística del 0.05.
RESULTADOS
Se encontró un aumento en CRAT (Figura 1) en el grupo 2 y el grupo 3 (8.462 ± 0.571 vs 10.34 ± 1.23 µM CRAT, respectivamente). En la predisposición a la lipoperoxidación (Figura 2) se observó que el grupo 3 (477.0 ± 16.71) es más susceptible al daño debido a que hay un incremento en los niveles de CRAT, en comparación con grupo 2 y el grupo 1 (432.3 ± 25.71 vs 320.6 ± 28.95 µM CRAT, respectivamente). La determinación de grupos carbonilo no presentó diferencias estadísticas entre grupos (Figura 3). En los marcadores de defensa, se encontró una disminución en las unidades de CATP (Figura 4) entre el grupo 2 respecto al grupo 1 (0.950 ± 0.071 vsO.69 ± 0.068 unidades, respectivamente). La actividad de paraoxonasa (Figura 5) presentó un aumento en su actividad en al grupo 3 con respecto al grupo 1 (0.119 ± 0.004 vs 0.072 ± 0.007 nmol p–nitrofenol/mg proteína, respectivamente). En la Tabla I se muestran los promedios y el error estándar de cada grupo.




DISCUSIÓN
El oxígeno es un elemento imprescindible para la vida. Se calcula que del total de oxígeno respirado por la mitocondria, en condiciones fisiológicas, del 1 al 3% es utilizado para formar radicales libres (RL), como el anión superóxido (O2.––)14. Estas reacciones son inevitables en un organismo dependiente de oxígeno como el ser humano. Una parte de estos radicales formados son necesarios para la realización de varios procesos fisiológicos, incluyendo la fertilización del óvulo por el espermatozoide y la activación de genes; tambien participan en los mecanismos de defensa del organismo durante una infección, realizando lisis bacteriana15. Los RL formados en la respiración mitocondrial que no son utilizados para ningún proceso metabólico, pueden causar modificaciones en las biomoléculas y alterar su función. Estos cambios moleculares se pueden evidenciar por metodologías bien establecidas, con las que se demuestra el daño por ERO a lípidos, proteínas, ácidos nucleicos, entre otros16. Este daño molecular en condiciones fisiológicas (personas sanas) es mínimo, ya que la actividad de los RL está regulada por los sistemas antioxidantes. La concentración y la actividad de estos sistemas antioxidantes son dependientes de múltiples factores, entre ellos: la alimentación, el sedentarismo, el sobre peso, el tabaquismo y el proceso de envejecimiento17, entre otros; por tanto, en procesos fisiológicos, el daño a las biomoléculas por las ERO son diferentes entre poblaciones.
Diferentes grupos de investigación en el mundo han reportado cifras básales de daño a biomoléculas, por el hecho de ser poblaciones con estilos de vida diferentes a la mexicana, es inadecuado utilizar esos valores como referencia. Por ejemplo, la alimentación mediterránea18 es rica en antioxidantes, mientras que la mexicana lo es en grasas y carbohidratos19,20, productos implicados en la formación de RL. Por esto, es necesario conocer los valores básales de los marcadores de daño por RL en población mexicana sana para valorar al efecto de patologías asociadas con el estrés oxidante, que corresponde a un desequilibrio entre los RL y los sistemas antioxidantes21 y determinar si la anormalidad es debida o está asociada al proceso patológico y no es consecuencia del envejecimiento por se, como sería el caso de la EPOC, que es un padecimiento crónico–degenerativo dependiente del tabaquismo y/o exposición al humo de leña22.
En esta enfermedad está implicado el proceso inflamatorio, mecanismo por el cual se producen altas concentraciones de RL; los pacientes con EPOC leve pueden presentar síntomas de la enfermedad que a veces se confunden con los del proceso natural de envejecimiento, por lo que no acuden al especialista hasta que la enfermedad se encuentra en estadios avanzados.
Tomando en cuenta que el factor común entre el envejecimiento y la EPOC es el aumento en la población de RL, que se ve reflejado por el aumento en el daño a las diferentes biomoléculas, una manera de avaluar si el paciente está cursando un estadio temprano de la EPOC o simplemente se manifiesta el proceso natural de envejecimiento, sería evaluar el daño a las biomoléculas en estos dos procesos, por lo que evaluamos las concentraciones básales de algunos marcadores de estrés oxidante, principalmente el daño a lípidos y proteínas en población mexicana sana en diferentes décadas de la vida.
Encontramos que los marcadores moleculares de estrés oxidante tienen un comportamiento particular con respecto a la edad (envejecimiento). El daño a lípidos, reportado por µM de CRAT, en el grupo 2 presenta un aumento en sus concentraciones de 0.81 veces en comparación con el grupo 3 (Figura 1); este comportamiento se asemeja con la predisposición al daño a lípidos (Figura 2), en donde el grupo 1 presenta 0.74 veces la elevación en las concentraciones de CRAT con respecto al grupo 2; de igual forma, este grupo presenta un aumento de 0.90 veces en comparación con el grupo 3.
En el marcador de daño a proteínas (Figura 3), no se presentaron cambios en los diferentes grupos, a diferencia de la EPOC donde se han reportado elevaciones en las concentraciones de grupo carbonilo23, lo cual nos indica que el daño principal es a lípidos y no a proteínas. El daño a los lípidos es debido a la disminución de la CATP con respecto a la edad. Se observó que el grupo 1 presenta un decremento de 1.36 veces en comparación con el grupo 2. En la actividad de la enzima paraoxonasa se presenta un aumento en el grupo 2 de 0.60 veces con respecto al grupo 3; esta enzima posiblemente se activa para contrarrestar la poca actividad de los sistemas de defensa antioxidante, que por algún motivo no están funcionando eficazmente ¿hábitos alimenticios, condiciones ambientales y/o genéticas?
Otro aspecto importante es que los valores que reportamos no son comparables a los de otros investigadores (Tabla II) que utilizan diferentes metodologías para evaluar los parámetros y las reportan en unidades diferentes24,25, lo que dificulta la comparación de los parámetros de estrés oxidante.
Proponemos que a la gente expuesta al humo de cigarrillo o leña cercana a los 40 años o que comience con tos, fatiga, expectoración y disnea, se les mida un marcador de daño a proteínas, que pueden ser una herramienta auxiliar para el diagnóstico en estadios tempranos de la EPOC, en donde se cuantifican grupos carbonilo de proteínas dañadas por las ERO presentes en plasma.
Una pequeña muestra de sangre bastaría para determinar este parámetro de estrés oxidante y permitiría saber si la persona está cursando con estadios iniciales de la EPOC o simplemente presenta síntomas relacionados con el envejecimiento pues, como vimos anteriormente, en sanos de edad avanzada no se encontraron concentraciones altas de grupo carbonilo, a diferencia de la EPOC, donde sí existen incrementos de este marcador en plasma; aunado a las pruebas de función respiratoria se lograría diagnosticar mejor a la EPOC en etapas tempranas.
La prueba bioquímica que proponemos es rápida, económica y no se necesita de personal ni de instrumental especializado. Sus resultados podrían ayudar a mejorar la situación laboral, sanitaria y socioeconómica del paciente, por lo que la incapacidad, morbimortalidad y alto consumo de recursos sanitarios que conlleva la EPOC26se verían disminuidos.
Nuestra intención es que la comunidad científica, las autoridades sanitarias y el público en general tomen conciencia de que esta enfermedad es un problema de salud pública; también que se promocionen líneas de investigación y recomendar estrategias que permitan aumentar el conocimiento y prevención de la EPOC, para poder disminuir la morbimortalidad asociada a esta enfermedad.
CONCLUSIONES
En el proceso de envejecimiento el daño por estrés oxidante es a lípidos, dato que puede ser auxiliar en el diagnóstico temprano de la EPOC, pudiendo determinar si los síntomas son debido al proceso natural del envejecimiento.
REFERENCIAS
1. Olivares Corichi IM, Guzmán Grenfell AM, Medina Navarro R, Hicks JJ. Especies reactivas del oxígeno (ERO): Bioquímica inorgánica y biomedicina. En: Hicks JJ, editor. Bioquímica. 2da ed. México: McGraw–Hill; 2006.p. 690–708. [ Links ]
2. Rahman I, Swarska E, Henry M, Stolk J, MacNee W. Is there any relationship between plasma antioxidant capacity and lung function in smokers and in patients with chronic obstructive pulmonary disease? Thorax 2000;55:189–193. [ Links ]
3. Droge W. Free radicals in the physiological control of cell function. Physiol Rev 2002;82:47–95. [ Links ]
4. Hicks–Gómez JJ, Sierra–Vargas MP, Olivares–Cori–chi IM, Torres–Ramos YD, Guzmán–Grenfell AM. Estrés oxidante en asma. Rev Inst Nal Enf Resp Mex 2005;18:70–78. [ Links ]
5. MacNee W. Oxidants/antioxidants and COPD. Chest 2000;117(5 Suppl 1):303S–317S. [ Links ]
6. Yagi K. Simple procedure for specific assay of lipid hydroperoxides in serum or plasma. Methods Mol Biol 1998;108:107–110. [ Links ]
7. Olivares–Corichi IM, Santillan–Medina R, Valle–Laisequilla, Pindaro A, Hicks JJ. Increase of human plasma antioxidant capacity with a novel formulation of antioxidants. Proc West Pharmacol Soc 2003; 46:45–57. [ Links ]
8. Aviram M, Rosenblat M, Bisgaier CL, Newton RS, Primo–Parmo SL, La Du BN. Paraoxonase inhibits high–density lipoprotein oxidation and preserves its functions. A possible peroxidative role for paraoxonase. J Clin Invest 1998:101:1581–1590. [ Links ]
9. Hicks JJ. Las lipoproteinas. En: Hicks JJ, editor. Bioquímica. 2da ed. México: McGraw–Hill;2006.p.415–435. [ Links ]
10. Bin AA, Zhang Q, Lim YK, Fang D, Retnam L, Lim SK. Expression of major HDL–associated antioxidant PON–1 is gender dependent and regulated during inflammation. Free Radie Biol Med 2003;34:824–829. [ Links ]
11. H.Lowry OH, Roserbrough NJ, Farr AL, Randall RJ. Protein measurement with the folin phenol reagent. J Biol Chem 1951 ;193:265–275. [ Links ]
12. Amici A, Levine RL, Stadtman ER. Conversion of amino acids residues in proteins and amino acid homopolymers to carbonyl derivatives by metal–catalyzed oxidation reactions. J Biol Chem 1989;264:3341–3346. [ Links ]
13. Dalle–Donne I, Rossi R, Giustarini D, Milzani A, Colombo R. Protein carbonyl groups as biomarkers of oxidative stress. Clin Chim Acta 2003; 329:23–38. [ Links ]
14. Sastre J, Pallardo FV, Vina J. Mitochondrial oxidative stress plays a key role in aging and apoptosis. IUBMB Life 2000; 49:427–435. [ Links ]
15. Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? BrJ Pharmacol 2004;142:231–255. [ Links ]
16. Halliwell B. Free radicals, antioxidants, and human disease: curiosity, cause, or consequence? Lancet 1994;344:721–724. [ Links ]
17. McCord JM. The evolution of free radicals and oxidative stress. Am J Med 2000;108:652–659. [ Links ]
18. Hillestrom PR, Covas Ml, Poulsen HE. Effect of dietary virgen olive oil on urinary excretion of etheno–DNA adducts. Free Radie Biol Med 2006;41: 1133–1138. [ Links ]
19. Roberts CK, Vaziri ND, Wang XQ, Barnard RJ. Enhanced NO inactivation and hypertension induced by a high–fat, refined–carbohydrate diet. Hypertension 2000;36:423–429. [ Links ]
20. Noakes M, Keogh JB, Foster PR, Clifton PM. Effect of an energy–restricted, high–protein, low–fat diet relative to a conventional high–carbohydrate, low–fat diet on weight loss, body composition, nutritional status, and markers of cardiovascular health in obese women. Am J Clin Nutr 2005;81:1298–1306. [ Links ]
21. Beal FM. Aging, energy and oxidative stress in neurodegenerative disease. Ann Neurol 1995;38:357–366. [ Links ]
22. Pauwels RA, Buist AS, Calverley PM, Jenkins CR, Hurd SS, and: GOLD Scientific Committee. Clobal strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI /WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary. Am J Respir Crit Care Med 2001 ;163:1256–1276. [ Links ]
23. Rahman I, Morrison D, Donaldson K, MacNee W. Systemic oxidative stress in asthma, COPD, and smokers. Am J Respir Care Med 1996;154(4 Pt 1):1055–1060. [ Links ]
24. Witko–Sarsat V, Friedlander M, Capeillere–Blandin C, et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia. Kidney Int 1996; 49:1304–1313. [ Links ]
25. Rajesh M, Sulochana KN, Coral K, et al. Determination of carbonyl group content in plasma proteins as a useful marker to assess impairment in antioxidant defense in patients whith Bales' disease. Indian J Ophthalmol 2004;52:139–144. [ Links ]
26. Miravitlles M, Murio C, Guerrero T, Gisbert R. Costs of chronic bronchitis and COPD: a 1–year follow–up study. Chest 2003;123:789–791. [ Links ]














