Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.18 no.4 México oct./dic. 2005
Caso Clínico
No siempre una baciloscopía positiva indica tuberculosis.
Otra razón para solicitar cultivos rutinariamente
A positive sputum smear test is not always indicative of pulmonary TB.
Another reason to order routine cultures
Rafael Laniado–Laborín* Noemí Cabrales–Vargas*
* Facultad de Mediana Tijuana. Universidad Autónoma de Baja California. México.
Correspondencia:
MSP, Rafael Laniado–Laborín FCCP.
Emiliano Zapata Num. 1423, zona Centro. Tijuana, Baja California, 22000
Teléfono/fax 01–664–686–5626
e–mail: raf aellaniado@gmail.com
Trabajo recibido: 11–X–2005
Aceptado: 05–XII–2005
RESUMEN
La detección de bacilos alcohol–ácido resistentes en un frotis teñido constituye la primera evidencia bacteriológica de la presencia de micobacterias en caso de sospecha de tuberculosis. Sin embargo, este hecho no debe ser considerado como sinónimo de tuberculosis ya que puede indicar, además de la presencia de Mycobacterium tuberculosis, la de micobacterias no tuberculosas e incluso la de otros gérmenes con propiedades tintoriales de ácido–resistencia, como la Nocardia spp. Se presentan dos pacientes que fueron referidos a la Clínica de Tuberculosis del Hospital General de Tijuana por fracaso terapéutico, con persistencia de baciloscopías positivas en expectoración, y cuya evaluación final demostró que no padecían tuberculosis.
Palabras clave: Baciloscopía, falsas positivas, tuberculosis, nocardiosis.
ABSTRACT
The Ziehl–Neelsen (IN) stain is rapid and economic technique for the identification of acid–fast organisms, primarily Mycobacterium tuberculosis. However, the presence of acid–fast bacilli can not be considered as proof of tuberculosis; there is a wide variety of acid–fast microorganisms including non–tuberculous mycobacteria and even Nocardia spp and this could be a cause of misidentification. To illustrate this point, we present a patient with pulmonary nocardiosis and another with non–tuberculous mycobacteriosis that were initially misdiagnosed and treated for tuberculosis.
Key words: Ziehl–Neelsen stain, false positive, tuberculosis, nocardiosis.
INTRODUCCIÓN
La detección de bacilos alcohol–ácido resistentes en un frotis teñido constituye la primera evidencia bacteriológica de la presencia de micobacterias en un espécimen clínico. Es un procedimiento rápido, sencillo y provee al clínico con la confirmación preliminar del diagnóstico de una micobacteriosis. La técnica de tinción para alcohol–ácido resistencia de Ziehl–Neelsen depende de la capacidad del microorganismo para retener el colorante (carbolfucsina) al ser tratado con una solución de alcohol–ácido1.
El diagnóstico de la tuberculosis pulmonar en México, como en muchos otros países, se basa en los hallazgos de la baciloscopía de expectoración. La Norma Oficial Mexicana para la prevención y control de la tuberculosis en la atención primaria a la salud, en su apartado 6.2, indica textualmente que la confirmación de la presencia de Mycobacterium tuberculosis se llevará a cabo mediante baciloscopía2.
Sin embargo, es necesario recordar que el observar bacilos alcohol–ácido resistentes en un frotis no es sinónimo de tuberculosis, ya que puede indicar, tanto la presencia de Mycobacterium tuberculosis como la de micobacterias no tuberculosas1, o incluso de otros gérmenes con propiedades tintoriales de ácido–resistencia como la Nocardia spp3.
Para ilustrar este punto, presentamos a continuación dos pacientes que fueron recientemente referidos a la Clínica de Tuberculosis del Hospital General de Tijuana por fracaso terapéutico y persistencia de baciloscopías positivas en expectoración, cuya evaluación final demostró que no padecían tuberculosis.
Caso 1
Masculino de 30 años, originario de Tijuana, toxicómano (marihuana y metanfetaminas), alcohólico, seronegativo para el virus de la inmunodeficiencia humana (VIH). Actualmente, reside en un centro comunitario de rehabilitación. En febrero de 2004 se diagnosticó tuberculosis por baciloscopia y se inició con esquema primario (rifampicina–isoniacida, pirazinamida y etambutol y, posteriormente, rifampicina–isoniacida). Sus baciloscopías se reportaron persistentemente positivas y el paciente continuó con tos pertinaz y disnea de mínimo esfuerzo. Se refirió a la Clínica de Tuberculosis en enero de 2005. Sus radiografías torácicas mostraron deterioro progresivo con extensa destrucción del lóbulo superior derecho y paquipleuritis ipsilateral (Figura 1).
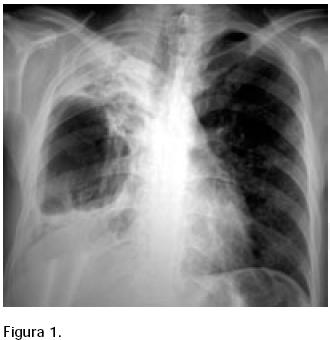
Se suspendió el tratamiento y se realizó cultivo de expectoración (BACTEC) reportándose aislamiento de Mycobacterium avium complex en marzo de 2005; se inició tratamiento con claritromicina (1 g/día) y amikacina (15 mg/kg tres veces a la semana). Su evolución clínica ha sido favorable; sus baciloscopías y cultivo se han negativizado.
Caso 2
Masculino, 50 años de edad, originario de Sinaloa. Mecánico automotor; no fuma, ni es adicto a drogas ilícitas, se embriaga una vez por semana. Se le diagnosticó tuberculosis mediante baciloscopía de expectoración en 2001 y fue tratado con esquema primario por seis meses, egresando por curación. En 2003 presentó recaída (baciloscopia positiva) y recibió nuevamente el esquema primario egresando por curación. En 2004, hubo nueva recaída con baciloscopía positiva, ingresándosele ahora a retratamiento primario estandarizado. Su radiografía con caverna de pared gruesa en el lóbulo superior derecho, como única lesión desde el inicio de su evolución. Prueba de VIH no reactiva. Al ser referido a la Clínica de Tuberculosis se solicitó un cultivo de expectoración (BACTEC), y se aisló Nocardia asteroides, sin desarrollo de micobacterias en el cultivo. Se inició tratamiento con trimetoprim (15 mg/kg/día) y sulfametoxazol (75 mg/kg/día).
DISCUSIÓN
El género Mycobacterium incluye 95 especies diferentes de microorganismos4, todos ellos de aspecto muy similar en la tinción de ácido–alcohol resistencia5. Este género incluye a los gérmenes del complejo Mycobacterium tuberculosis y a las micobacterias no tuberculosas (MNT)4,5.
Las cepas del Mycobacterium avium complex (MAC) son patógenas de baja virulencia que se han reportado especialmente en pacientes con síndrome de inmunodeficiencia adquirida con cifras muy bajas de linfocitos CD4+ (< 50/mL). En inmunocompetentes, la presentación clínica de esta micobacteriosis es idéntica a la de tuberculosis pulmonar, por lo que se recomienda incluirla en el diagnóstico diferencial en enfermos con baciloscopía persistentemente positiva y falta de respuesta al tratamiento4; el aislamiento de una MNT con potencial patógeno no debe descartarse de rutina como hallazgo incidental. Cada aislado, como cada paciente, deberá de ser evaluado individualmente5.
La Nocardia spp es un germen que, al igual que las micobacterias, pertenece al orden de los Actinomicetales; se encuentra ampliamente distribuida en el medio ambiente y la infección por este microorganismo con frecuencia se asocia a cierto grado de inmunocompromiso3. La nocardiosis puede presentarse como una neumopatía supurativa subaguda o crónica que simula a un carcinoma o un absceso pulmonar. Se reporta la presencia de consolidación lobar hasta en el 70% de los casos, y de cavitación en el 30%6. Nocardia asteroides es una bacteria Gram positiva débilmente ácido–alcohol resistente que resiste la decoloración con ácido clorhídrico (HCI) al 1%. Es conveniente mencionar que la técnica estándar de Ziehl–Neelsen indica que se debe utilizar HCI al 3% en etanol al 95%3.
Como ya se ha mencionado, el diagnóstico de tuberculosis en nuestro país se basa en los hallazgos de la baciloscopía y sólo en una mínima proporción de los casos se confirma el diagnóstico por medio del cultivo.
Todos los especímenes clínicos en los que se sospecha la presencia de micobacterias deberían ser inoculados en un medio de cultivo apropiado para tuberculosis por tres razones básicas: a) el cultivo es mucho más sensible que la baciloscopía. Estudios semicuantitativos han mostrado que se requieren de 5,000 a 10,000 bacilos por mililitro de espécimen para que se pueda detectar la presencia de bacterias en los frotis teñidos; en contraste, sólo se requieren de 10 a 100 bacilos para obtener un cultivo positivo, b) se requiere el desarrollo del microorganismo para la identificación precisa de especie; la especificidad del cultivo ha sido reportada en 98%; actualmente es posible la identificación de Mycobacterium tuberculosis directamente a partir de los especímenes clínicos mediante pruebas de amplificación de ácidos nucleicos, pero esta prueba es generalmente inaccesible en nuestro medio, y c) las pruebas de susceptibilidad a los fármacos antituberculosos requieren necesariamente del desarrollo en medios de cultivo1. También, recientemente, se han desarrollado pruebas de amplificación de ácidos nucleicos para determinar la presencia de resistencia a rifampicina, pero estas técnicas tampoco están disponibles en la mayor parte del país.
Las guías internacionales para el diagnóstico de tuberculosis de la Organización Mundial de la Salud7 y la Unión Internacional contra la Tuberculosis y Enfermedades Pulmonares8 recomiendan que en los países con economías en vías de desarrollo, el diagnóstico de la tuberculosis se base en la microscopía de expectoración, debido a que el acceso a laboratorios confiables capaces de realizar cultivos es limitado. Afortunadamente, de acuerdo con las estadísticas del Banco Mundial, México se encuentra hoy en día firmemente establecido como un país de ingreso medio, con una economía moderna y diversificada y el ingreso per capita más alto de todo Latinoamérica9, por lo que es recomendable que, en estas condiciones, ya no se aplique en México un programa de tuberculosis que fue desarrollado para países con una economía extremadamente débil.
La tuberculosis farmacorresistente es un fenómeno que se reporta cada vez con mayor frecuencia en nuestro país10–13, y para cuyo diagnóstico se requiere necesariamente de cultivo. Cada estado de la República Mexicana cuenta con un laboratorio estatal de tuberculosis con capacidad para realizar cultivos para micobacterias, y algunos de ellos tienen la infraestructura y personal capacitado para practicar pruebas de identificación de especie y sensibilidad a los antituberculosos. Urge capacitar y dotar a todos ellos con lo necesario para que funcionen como un verdadero laboratorio estatal de tuberculosis que haga accesible este método diagnóstico a todos los pacientes con tuberculosis.
Casos como los aquí descritos constituyen una razón más para justificar la realización rutinaria de cultivos; estos dos pacientes se deterioraron clínicamente durante el período que estuvieron bajo tratamiento antituberculoso, obviamente ineficaz, y se desperdiciaron recursos al tratar como tuberculosos a quienes no padecían esta enfermedad. El costo económico y humano que representa tratar en forma empírica e inadecuada a estos pacientes es inaceptablemente elevado.
REFERENCIAS
1. American Thoracic Society. Diagnostic Standards and Classification of Tuberculosis in Adults and Children. Am J Respir Crit Care Med 2000;161(4 Pt 1): 1376–1395. [ Links ]
2. Modificación a la Norma Oficial Mexicana NOM–006–SSA2–1993, para la prevención y control de la tuberculosis en la atención primaria a la salud. Diario Oficial. México. 31 de octubre, 2000. [ Links ]
3. Olson ES, Simpson AJ, Norton AJ, Das SS. Not everything acid fast is Mycobacterium tuberculosis. A case report. J Clin Pathol 1998:51:535–536. [ Links ]
4. Katoch VM. Infections due to non–tuberculous mycobacteria (NTM). Indian J Med Res 2004:120:290–304. [ Links ]
5. American Thoracic Society. Diagnosis and treatment of disease caused by nontuberculous mycobacteria. Am J Respir Crit Care Med 1997:156(2 Pt 2): 1–25. [ Links ]
6. Menendez R, Cordero PJ, Santos M, Gobernado M, Marco V. Pulmonary infection with Nocardia species: a report of 10 cases and review. Eur Respir J 1997:10:1542–1546. [ Links ]
7. World Health Organization. Treatment of tuberculosis guidelines for national programmes. 2nd ed. WHO/TB/ 97.220. Geneva, Switzerland: World Health Organization: 1997. [ Links ]
8. International Union against Tuberculosis and Lung Disease. Management of tuberculosis: a guide for low income countries. 5th ed. 2000. www.iuatld.org. [ Links ]
9. www.worldbank.org/mx. Página consultada el 1 de septiembre, 2005. [ Links ]
10. Peter CR, Schultz E, Moser K, et al. Drug–resistant tuberculosis in the Baja California–San Diego County border population. West J Med 1998:169:208–213. [ Links ]
11. Centers for Disease Control and Prevention. Population–based survey for drug resistance of tuberculosis–Mexico 1997. MMWR 1998:47:371–375. [ Links ]
12. Laniado–Laborín R, Cabrales–Vargas N. Tratamiento acortado estrictamente supervisado: estrategia necesaria pero no suficiente para controlar la tuberculosis en Baja California, México. Elevadas tasas de resistencia en el estado. Rev Inst Nal Enf Resp Mex 2000:13:23–27. [ Links ]
13. Garcia–Garcia ML, Ponce de Leon A, Jiménez–Corona ME, et al. Clinical consequences and transmissibility of drug–resistant tuberculosis in southern Mexico. Arch Intern Med 2000:160:630–636. [ Links ]














