Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.17 no.2 México jun. 2004
Rev Inst Nal Enf Resp Méx 2004; Vol. 17(2):135-145
TRABAJOS DE REVISIÓN
PARTICIPACIÓN DE LAS ESPECIES REACTIVAS DEL OXÍGENO EN LAS ENFERMEDADES PULMONARES
MARTHA PATRICIA SIERRA VARGAS
ALBERTO MARTÍN GUZMÁN GRENFELL
IVONNE MARÍA OLIVARES CORICHI
YESSICA DORIN TORRES RAMOS
JUAN JOSÉ HICKS GÓMEZ
Laboratorio de Bioquímica Inorgánica. Unidad de Investigación. INER.
Correspondencia
Dra. Martha Patricia Sierra Vargas,
Laboratorio de Bioquímica Inorgánica, Unidad de Investigación.
Instituto Nacional de Enfermedades Respiratorias.
Calzada de Tlalpan 4502, Colonia Sección XVI.
México, DF., 14080
Teléfono: 56 66 45 39, ext. 256
E-mail: jhicks@iner.gob.mx
Trabajo recibido: 11-V-2004;
Aceptado: 25-VI-2004
RESUMEN
Las especies reactivas de oxígeno son moléculas (O2—, HO , NO ), muy reactivas debido a que en el último orbital tienen un electrón no pareado (radical libre), lo cual confiere inestabilidad física. Se incluyen en las especies reactivas de oxígeno a moléculas precursoras de los radicales libres (H2O2, HONO2—). Estas especies participan en procesos fisiológicos en el organismo. Cuando la generación de especies reactivas de oxígeno supera a los mecanismos de inactivación, se presenta el estado metabólico de estrés oxidante que se caracteriza por daños moleculares y celulares que conducen a predisposición o modificación de diversos padecimientos crónico-degenerativos. Entre las enfermedades pulmonares en que se ha demostrado la participación de las especies reactivas de oxígeno, destacan el síndrome de insuficiencia respiratoria progresiva, la enfermedad pulmonar obstructiva crónica y el asma. Se analizan las características del estrés oxidante en estos padecimientos.
PALABRAS CLAVE:Radicales libres, especies reactivas de oxígeno, estrés oxidante, daño oxidativo pulmonar.
ABSTRACT
Reactive Oxygen Species (ROS) are very reactive molecules (O2—, HO, NO ) since they have a single and unpaired electron in the last orbital (free radical) which confers them physical instability. Free radical precursors such as H2O2 , HONO2— are considered ROS. These species are important in the physiological processes. When ROS production exceeds the inactivation mechanisms, oxidative stress takes place. This stress is characterized by molecular and cellular damage which predisposes to or modifies chronic-degenerative diseases. Among pulmonary diseases in which ROS participation has been proved are ARDS, COPD and asthma. The aim of this paper was to analyze the mechanisms of oxidative stress that lead to those illnesses.
KEY WORDS: Free radicals, reactive oxygen species, oxidative stress, lung, diseases, oxidative injuries.
INTRODUCCIÓN
La participación en la fisiopatología pulmonar de especies moleculares caracterizadas por su gran capacidad de interacción química (reactividad) debido a que presentan en su orbital más externo un electrón no pareado , ha sido ampliamente demostrada. A estas especies reactivas se les denomina en general como radicales libres ; sin embargo, cuando involucran a moléculas en las que el oxígeno es el elemento reactivo de su estructura, se les conoce como especies reactivas del oxígeno (ERO), incluyendo en esta connotación a moléculas precursoras de radicales libres como el peróxido de hidrógeno (H2O2 ). A continuación, presentaremos una revisión sobre la participación de las ERO en varios padecimientos pulmonares, haciendo énfasis de manera particular en aquéllos causados por la exposición con agentes oxidantes exógenos, para posteriormente enfocar nuestra atención sobre la consecuencia fundamental del exceso de radicales libres, que conducen a la condición metabólica denominada estrés oxidante. Los efectos primarios inducidos por las ERO durante el desarrollo del daño pulmonar serán considerados. En la Tabla I, se presentan algunos agentes que inducen el daño pulmonar de manera directa y/o a través de la inducción de la generación de las ERO por los leucocitos.

Durante la ventilación pulmonar se inhalan diversos agentes xenobióticos provenientes de muy diversas fuentes, que se encuentran como gases y partículas suspendidas de diversos diámetros aerodinámicos y composición química. Además del ozono (O3 ) y de los radicales libres dióxido de nitrógeno (NO2 ), hidroxilo (HO) y óxido nítrico (NO) presentes en la fase gaseosa, se han descrito otros radicales relativamente estables en las partículas suspendidas, como son los casos de semiquinonas derivadas de varias quinonas e hidroquinonas.
Otro de los contaminantes importantes del aire lo constituye el humo del cigarrillo, que contiene 1x10 16 oxidantes por bocanada, entre los que se encuentran: aldehídos, epóxidos, peróxidos, óxidos de nitrógeno, radicales peróxilo (R-COO), radicales de carbono (R3C ) y de nitrógeno que incluyen principalmente 1 al óxido nítrico (NO ) con la suficiente vida media para alcanzar el espacio alveolar.
Adicionalmente al contenido del humo del cigarrillo que es rico en radicales libres, en el individuo fumador se presenta un incremento en la presencia de neutrófilos en el tracto respiratorio inferior, lo cual conduce a la liberación de una cantidad adicional de ERO de origen leucocitario que contribuye al daño celular 2 . La pigmentación oscura de los tejidos en los pulmones de los fumadores está asociada con depósitos de hierro, en una forma similar en la que este metal es transportado o acumulado en la ferritina y en la hemosiderina 3 , y posiblemente representa microhemorragias. En los casos en que este hierro es liberado en el tejido, puede contribuir al incremento en la presentación de los procesos oxidantes del pulmón porque puede involucrarse en las reacciones de óxido reducción y contribuir a la formación del radical hidroxilo (HO ), a partir del peróxido de hidrógeno (H2O2) formado durante la generación del radical anión superóxido (O2—) que, a su vez es producido en respuesta a cerca de los 4,700 compuestos químicos presentes en el humo del cigarrillo 4
El ozono aunque no es un radical libre, reacciona como un agente oxidante poderoso, es generado por reacciones fotoquímicas entre óxidos de nitrógeno e hidrocarburos producidos por la combustión vehicular. La exposición a NO2 y O3 a concentraciones altas, produce daño epitelial e induce la liberación de diversas moléculas proinflamatorias que incrementan la permeabilidad endotelial, influjo de neutrófilos en el espacio alveolar y daño de tipo I del epitelio de las células alveolares afectando su función, e incluso constituyendo en los sacos alveolares barreras en la interacción sangre-aire. El ozono se considera como un contaminante urbano del aire, ejerciendo su efecto en el tracto respiratorio generalmente de manera conjunta con partículas contaminantes ultrafinas (PM < 1) de carbón negro (hollín). Se ha demostrado una mayor sensibilidad asociada a la edad en la respuesta a la inducción de un proceso inflamatorio y la generación de ERO por O3 y hollín 1
El daño pulmonar inducido por la inhalación de polvo mineral (asbesto, cuarzos y silicatos diversos), parece ser mediado por radicales libres (Tabla I). Estos agentes pueden afectar, tanto a las células epiteliales, mesoteliales como fibroblastos. La exposición ocupacional a los asbestos ha sido asociada con un incremento en el riesgo de fibrosis pulmonar (asbestosis). Las partículas de silicatos (calcio y magnesio) y las fibras de asbesto pueden ser fagocitadas por los macrófagos pulmonares. En esas condiciones estos leucocitos, pueden liberar por exocitosis el contenido lisosomal (enzimas proteolíticas, fosfatasas y glicohidrolasas), y mediadores quimiotácticos, causando la infiltración de otras células como son los neutrófilos e iniciando un proceso inflamatorio 5 que se acompaña de un incremento en la generación de ERO como parte del conjunto de eventos que conforman al estallido respiratorio de los leucocitos. Las fibras de asbesto contienen hierro, el cual estimula la generación del radical hidroxilo. El cúmulo de asbesto en el pulmón observado con microscopia de luz, presenta una evidente reacción histoquímica debido a la presencia de hierro. Este metal puede derivar también de la hemoglobina hidrolizada durante las microhemorragias; por otro lado, se ha demostrado en cultivos celulares que las fibras de asbesto inducen citotoxicidad y que ésta puede prevenirse en presencia de antioxidantes 6
Entre los ejemplos de enfermedades pulmonares que pueden ser consideradas como la consecuencia de la exposición a tóxicos ambientales (oxidantes) se pueden mencionar: el síndrome de insuficiencia respiratoria progresiva del adulto (SIRPA), las crisis de asma y la fibrosis pulmonar.
Entre los factores etiológicos del SIRPA se incluyen los siguientes: antecedente de un shock severo, infección masiva, aspiración de contenido gástrico, quemaduras debidas a la inhalación de agentes químicos nocivos que inducen daño tisular por inhalación (alta concentración de dióxido de nitrógeno). Durante el SIRPA, se ha demostrado la infiltración y participación de neutrófilos en el proceso 7 , probablemente reclutados por la liberación de quimiocinas, componentes del complemento o endotoxinas provenientes de las células pulmonares en respuesta al insulto molecular en vías aéreas. Los neutrófilos estimulados, pueden generar ERO y liberar diversas enzimas entre las que destacan algunas proteasas como la elastasa y la colagenasa.
En los procesos asmáticos, el grado de reactividad de las vías aéreas a estímulos no específicos, como los alergenos, agentes químicos, aire frío o ejercicio determinan las perspectivas del proceso que es considerado como un proceso inflamatorio crónico 8 , en el que la infiltración por neutrófilos pudiera ser de importancia en las crisis asmáticas 9 . La presencia de neutrófilos y de eosinófilos incrementa en número después de la inhalación del reto antigénico que activa el proceso en el paciente asmático. Los neutrófilos producen mediadores que pueden inducir la broncoconstricción, por ejemplo, los casos de prostanoides y leucotrienos, así como las ERO y otros agentes oxidantes como el ácido hipocloroso (HOCl) generado por la mieloperoxidasa. Estos oxidantes pueden tener efectos en varias células blanco del tracto respiratorio y potenciar la inflamación.
La participación de las ERO en el desarrollo de la fibrosis pulmonar 10 , se relaciona con la acumulación de macrófagos alveolares y neutrófilos, que contribuyen al daño celular del parénquima y a la fibrosis de las paredes alveolares. Eventualmente, la arquitectura alveolar es destruida y la cicatrización resulta en múltiples espacios quísticos llenos de aire en los bronquiolos terminales dilatados. Las ERO participan también en el daño al endotelio vascular conduciendo a su disfunción en estos pacientes.
El pulmón puede ser también el órgano blanco para algunos compuestos administrados por vía oral, y cuya toxicidad pulmonar es originada por mecanismos mediados por radicales libres. Las bleomicinas constituyen un grupo importante de agentes antitumorales, utilizados en el tratamiento de carcinomas escamosos de piel, cabeza, cuello y pulmón, además de linfomas y tumores testiculares. La toxicidad de la bleomicina se expresa como una fibrosis pulmonar y puede estar relacionada con formación de las ERO, dado que su toxicidad se incrementa a concentraciones altas de oxígeno. La bleomicina forma complejos con los metales de transición como el hierro, favoreciendo una condición predisponente para la generación de ERO. La toxicidad de la bleomicina está confinada a los pulmones, debido tal vez a que sus células epiteliales de tipo I y II carecen o presentan una muy baja actividad de la bleomicina hidrolasa.
El paraquat es un herbicida que presenta una conocida toxicidad pulmonar. En primera instancia daña a las células alveolares de tipo II debido a que presentan una captación selectiva para el paraquat. La reducción del paraquat por NADPH: citocromo P 450 reductasa, resulta en la formación de un radical paraquat+ (catión) que reacciona rápidamente con el oxígeno molecular formando anión superóxido que puede dar lugar al peróxido de hidrógeno por medio de la reacción de la superóxido dismutasa pulmonar (SOD, por sus siglas en inglés) 11 . El peróxido de hidrógeno da lugar a la generación del radical hidroxilo, en una reacción de tipo Fenton 12 , que se realiza en presencia de metales de transición.
Fe2 + + H2O2 --> Fe3+ + HO + HO—
Hidroxilo hidróxido
Reacción de Fenton
Daño pulmonar inducido experimentalmente
Utilizando modelos de daño experimental, se ha demostrado la participación directa de las ERO en la patología pulmonar, e incluso el diseño de isquemia-reperfusión realizado en sistemas in vitro o en órganos aislados, que ha permitido aportar en la actualidad nuevas posibilidades en el manejo posoperatorio de pacientes sometidos a periodos variables de anoxia regional (trasplantes y valvuloplastias), o en casos de reperfusión a una zona tisular anóxica como es el caso de la trombólisis posinfarto del miocardio.
Isquemia-reperfusión . Durante la fase de reperfusión de un tejido se presentan: edema, vasoconstricción, infiltración leucocitaria y sobre todo una respuesta anormal a la restauración del aporte de oxígeno por el tejido que estuvo en anoxia por periodos de tiempo variable. Los estudios iniciales sobre los mecanismos de daño tisular por isquemia-reperfusión, permitió a Granger 13 proponer un esquema del proceso, fundamentado en sus resultados experimentales obtenidos utilizando intestino delgado de gato.
Durante la isquemia, el tejido en anoxia mantiene la generación de energía prácticamente de manera exclusiva por la glucólisis anaeróbica, cuya eficiencia en la generación de adenin-trifosfato (ATP) en las reacciones de fosforilación a nivel del sustrato es limitada; condición que conduce a una acumulación de nucleótidos precursores, adenin-difosfato (ADP) y adenin-monofosfato (AMP), situación que se incrementa como consecuencia del aumento en la actividad de la enzima adenilato cinasa tendiente a generar ATP (2 ADP --> ATP + AMP), que resulta en una mayor concentración de AMP, propiciando su degradación al nucleósido (inosina) y a la base púrica libre hipoxantina que es oxidada primero a xantina y posteriormente a ácido úrico en una reacción catalizada por la xantina oxidasa (XO) y que consiste en dos hidroxilaciones sucesivas (C2 y C8). Esta enzima es un dímero que funciona en cada unidad como un complejo mini-transportador de electrones constituido por flavin-adenin-dinucleótido (FAD), dos centros Fe-S y molibdeno en sus estados redox IV y VI, cuyo aceptor final es O2 formando H2O2 , teniendo como intermediario O2— que suele ser eficientemente transmutado a peróxido de hidrógeno. Dado que la XO presenta una pobre distribución en el organismo, y su presencia se limita casi exclusivamente al intestino delgado y al hígado, el modelo de Granger se consideró insuficiente, pues algunos órganos en que se ha demostrado daño por reperfusión incluyendo al pulmón 14 y al corazón 15 , presentan una actividad muy baja de XO. En contraste, debe considerarse la presencia de esta enzima en las células del endotelio arterial de ratas y su activación por periodos cortos de anoxia e inhibición por alopurinol 16 , surgiendo evidencias por las que se propuso que en casos de anoxia se considere responsables a las células del endotelio vascular de diversos órganos 17, 18 , para iniciar la reacción por medio de la generación de anión superóxido debido a la reoxigenación brusca durante la reperfusión, y a modificaciones conformacionales en la enzima XO, inducidas por las ERO y por enzimas proteolíticas provenientes de los neutrófilos presentes en la zona reperfundida. La XO modificada estructuralmente libera el anión superóxido, al modificar sus características catalíticas por la afluencia de exceso de sustrato (O2 ). En algunos órganos este foco primario de respuesta endotelial puede ser suficiente para provocar una trombosis microvascular que conduce a la pérdida de la función del órgano 19 . En otros casos la generación de las ERO representa el factor desencadenante para la atracción, acumulación y activación de neutrófilos, quienes son los mediadores de la mayor parte del daño tisular a través de una serie de eventos en cascada 10, 11 . El O2— generado por la XO, funciona como un importante agente quimiotáctico para neutrófilos, que incrementan su presencia en la cercanía de la zona reperfundida, presentando adicionalmente una mayor adhesividad a la superficie endotelial, debida a una sobreexpresión de la glicoproteína de adhesión CD11/CD18 (integrina) del neutrófilo, así como de las moléculas de adhesión del endotelio para leucocitos (ELAM, por sus siglas en inglés). Durante este proceso se activa la generación de las ERO por los neutrófilos que, adicionalmente, secretan algunas proteasas como la elastasa. Bajo estas condiciones se presenta el daño tisular e incluso la inactivación de inhibidores de proteasas 20 , enzimas antioxidantes como la SOD y catalasa, y del óxido nítrico (NO ), o factor de relajación derivado del endotelio, debido a su combinación con el O2— formando peroxinitrito (HONO2—), con la consecuente disminución en el control vasodilatador, pudiendo exacerbar el daño microvascular. Adicionalmente, la formación de peroxinitrito representa la formación de una molécula precursora de la formación del radical hidroxilo (HO ). Este proceso sirve como amplificador del daño de las ERO, principalmente en el microambiente localizado entre el endotelio y el neutrófilo adherido 21
Mecanismos antioxidantes de la sangre
Además de las diversas moléculas con capacidad antioxidante como son las vitaminas C y E, el ácido úrico, bilirrubina y glutatión reducido, entre otras diversas proteínas circulantes como son la albúmina y las enzimas antioxidantes, en la sangre se presenta un importante mecanismo antioxidante alterno ejercido por eritrocitos y plaquetas, que tienen una participación importante en la prevención del daño pulmonar inducido por oxidantes, ya que por medio de sus sistemas antioxidantes intracelulares, proporcionan un mecanismo adicional de defensa en la microcirculación pulmonar que incrementa la capacidad antioxidante del pulmón. En circunstancias en que los radicales libres superan la capacidad antioxidante pulmonar ejercida por las células residentes, el pulmón puede recurrir adicionalmente a las fuentes antioxidantes que le proporciona la circulación sanguínea.
En apoyo a esta observación, se ha demostrado que los eritrocitos presentan un sistema antioxidante muy eficiente constituido por las enzimas superóxido dismutasa (SOD), catalasa (CAT) y los componentes del ciclo del glutatión 22 . Adicionalmente, la membrana del eritrocito contiene un canal aniónico por el que puede pasar el O2—; este radical en la membrana celular es poco permeable, el anión superóxido en el interior del eritrocito es transmutado por la SOD 23 intracelular para formar H2O2 . La capacidad del eritrocito para metabolizar ERO fue demostrada utilizando como reto H2O2 , perfundido en pulmón de rata aislado, que es protegido por eritrocitos y que, al ser metabolizado, inhibe la generación de HO y HOCl y en consecuencia el daño pulmonar. Los eritrocitos expuestos a oxidantes se adhieren preferentemente a las células endoteliales, debido a posibles modificaciones en su membrana 24 . La gran adherencia de los eritrocitos a la superficie endotelial, y su localización en el ambiente oxidante podría significar que el eritrocito funciona como un filtro en la microcirculación pulmonar para el exceso de O2— y H2O2 y en consecuencia prevenir la formación de especies reactivas más tóxicas como son el HO y el HOCl 25 . Los eritrocitos de pacientes fumadores contienen más glutatión reducido (GSH) y CAT que los de individuos no fumadores, presumiblemente debido a que los eritrocitos de fumadores están constantemente expuestos a un estrés oxidante, que conduce por medio de sus mecanismos de adaptación a esta nueva condición metabólica que involucra la síntesis de enzimas involucradas con los mecanismos antioxidantes 26 . Esta capacidad antioxidante aumentada de los eritrocitos, protegen a células endoteliales en cultivo ante un reto con peróxido de hidrógeno 27
Las plaquetas presentan suficientes características que permiten se les incluya como otra instancia esencial en la defensa antioxidante de la sangre participando en la microcirculación pulmonar. Las plaquetas contienen catalasa 27 y componentes del ciclo del glutatión, así como concentraciones similares de GSH que el eritrocito y una actividad varias veces mayor de glutatión peroxidasa (GSH-Px) 28 . Las plaquetas son agregadas en el espacio vascular por H2O2 , que funciona como un signo de reclutamiento de plaquetas en las zonas de estrés oxidante severo 29 en donde el menor tamaño de éstas les permite establecer una estrecha asociación con los neutrófilos activados adheridos en la superficie endotelial. Esta asociación les permite a las plaquetas mediar la reaccionante de los oxidantes generados por los neutrófilos 29 . Finalmente, las plaquetas son reactantes de fase aguda en el SIRPA, ya que se concentran en la microcirculación pulmonar en los primeros nueve minutos posteriores a la infusión de endotoxinas en el shock experimental 30 . Las plaquetas deben estar disponibles en el pulmón para reducir a los antioxidantes antes de que se establezca un daño endotelial irreversible.
Adaptación al estrés oxidante
Una vez que los mecanismos antioxidantes del organismo son superados por la generación de las ERO, en concentraciones y actividades mínimas, pero en las que ya se detectan efectos nocivos como microarreglos en el DNA, que se observan a dosis 1,000 veces menores a las mutagénicas 31 , se desarrollan mecanismos de adaptación fisiológica que permiten una relativa resistencia ante el siguiente reto oxidante. Algunas proteínas inducidas por las condiciones del mismo estrés, son capaces de mediar la respuesta de adaptación; proceso demostrado en cultivo de células leucémicas humanas retadas a concentraciones subumbrales de H 2 O 2 (picoMolar); que son capaces de inducir la elevación de 34 proteínas que incluyen enzimas involucradas en el metabolismo energético, traducción y procesamiento de los RNA, chaperonas, moléculas de señalización celular, de regulación redox, así como proteínas involucradas en los procesos de transporte de membrana 32 . Otro mecanismo de adaptación se presenta ante alteraciones en la función endotelial asociada a cambios bioquímicos sutiles como la inducción por citocinas o la disminución sérica de arginina durante la inflamación, dando lugar a una respuesta que involucra la expresión de varios genes incluyendo el de la enzima óxido nítrico sintasa inducible (iNOS), que presenta una mínima capacidad enzimática en la generación de su producto que es el NO. La síntesis de la enzima constituye un requisito para la expresión concomitante de genes protectores al estrés oxidante (bcl-2, factor vascular de crecimiento endotelial y hemooxígenasa-1 (HO-1) 33 . Otra familia de proteínas relacionadas con la protección o adaptación inicial, tanto al estrés oxidante como al nitrosante, la constituyen las enzimas que controlan el metabolismo del glutatión 34 ; esta adaptación se presenta en diversas estirpes celulares incluyendo al endotelio vascular ante la exposición de óxido nítrico o productos de la lipoperoxidación y a las células del epitelio pulmonar ante contaminantes y tóxicos del aire.
Se considera un estado de estrés oxidante cuando se superan los límites entre la reactividad, cantidad o frecuencia de producción de las ERO involucradas en la realización de su función fisiológica, y el umbral que representan los mecanismos antioxidantes de regulación, que se presentan en el organismo incluyendo a la adaptación antioxidante que tiende a restaurar el equilibrio redox, para impedir el establecimiento del estrés oxidante.
ESTRÉS OXIDANTE
Una vez superados los mecanismos antioxidantes del organismo, no es posible inactivar la reactividad química de las ERO, se presenta entonces el estado metabólico de estrés oxidante 35 , que se manifiesta por el evidente daño a las estructuras moleculares y biológicas del organismo que pueden redundar en alteraciones que conducen a procesos de daño estructural (aterosclerosis, fibrosis, y amiloidosis) y funcional (inhibición de actividades enzimáticas, inmunológicas y hormonales, entre otras) del organismo. Con el fin de considerar la intensidad y grado de afectación en la salud, este proceso puede dividirse al menos en dos tipos en los que se toma en consideración a) las características del daño estructural y funcional ejercido como consecuencia de la reactividad de las diferentes ERO (reto oxidante), b) el tiempo de exposición a las mismas y la evidencia concomitante de modificaciones en los procesos biológicos afectados.
Estrés oxidante severo. Generalmente se trata de un proceso agudo que al ser mediado fundamentalmente por el radical hidroxilo (HO), se manifiesta por rompimiento o modificación de biomoléculas (hidroxilación) con la consecuente liberación de una segunda generación de productos de oxidación que a su vez son moléculas muy reactivas, amplificando y propagando el daño que se manifiesta como daño celular y tisular. El daño molecular puede ser cuantificado en plasma, sobre todo cuando se trata de rompimiento o modificación de moléculas y organelos celulares. Algunas modificaciones inducidas por el estrés oxidante agudo, y que son los cambios bioquímicos intracelulares (estrés intracelular) sólo pueden ser evaluadas con el auxilio de metodología especial; sin embargo, estos procesos se manifiestan fundamentalmente por alteraciones funcionales locales y sistémicas (hipertensión arterial, arritmias, fibrilación, broncoconstricción, shock). En la Tabla II se presentan algunos de los eventos relacionados con el daño oxidante severo.

Tabla II. Estrés oxidante severo
Estrés oxidante moderado. Dado que el reto oxidante suele ser menos intenso, su expresión en cambios estructurales y funcionales, puede ser más sutil que el proceso agudo, ya que suele ser mediado por las ERO menos reactivas como el anión superóxido (O2—) y el peróxido de hidrógeno (H2O2); moléculas que a concentraciones y actividades controladas tienen una importante participación fisiológica, pero que al generarse en una proporción mayor a la funcional afectan las características de procesos intracelulares vitales de regulación y suele acompañar también a procesos crónicos (Tabla III).

Tabla III. Características del estrés oxidante moderado
Generalmente, durante el estrés oxidante se presentan simultáneamente manifestaciones de daño severo y moderado; no obstante, se considera importante distinguir entre ambos tipos de daño con fines de estrategias terapéuticas que implican la administración de agentes antioxidantes.
SUPLEMENTACIÓN CON ANTIOXIDANTES
Evidencias epidemiológicas han demostrado que dietas ricas en frutas y vegetales están asociadas con una disminución en el riesgo para diversos padecimientos incluyendo el cáncer y padecimientos cardiovasculares, cuyos procesos cursan con un evidente estrés oxidante causado parcialmente por una disminución en las concentraciones plasmáticas de algunas vitaminas antioxidantes y cofactores como el selenio (Se). El desarrollo y progresión de la enfermedad pulmonar obstructiva crónica (EPOC) ha sido asociado al incremento de estrés oxidante y reducción de la eficiencia antioxidantes, con disminución en las concentraciones plasmáticas de las vitaminas C y E en fumadores en los que se demostró hiperinsulinemia, sugiriendo que este indicador se considere en la falla endotelial asociada al estrés oxidante, que adquiere características comunes a las del síndrome metabólico de resistencia a la insulina 36 . Durante la evolución de la EPOC se presenta exhalación de peróxido de hidrógeno, productos de lipoperoxidación y modificaciones oxidativas en proteínas como consecuencia de una disminución en su capacidad antioxidante, presentando repercusiones sistémicas como son disminución de peso y en particular pérdida de la masa corporal debido a la disminución de músculo esquelético 37 . Estos procesos pueden estar asociados al estrés oxidante y con procesos relacionados con esta condición disfuncional como son la apoptosis y la inflamación.
Se ha propuesto la utilización de una dieta diseñada como estrategia para reducir el estrés oxidante crónico; sin embargo, los resultados experimentales han sido poco confiables, obteniendo sólo efectos antioxidantes para algún tipo de daño oxidante, como es la evaluación de la eficiencia de los linfocitos humanos provenientes de individuos sometidos a diferentes antioxidantes con el fin de reparar el daño en el DNA por un reto in vitro con H2O2: se demostró que para este tipo de oxidación la combinación dietética de carotenos y carotenoides (zanahoria) fue muy eficiente, mientras que la de vitaminas hidrosolubles como la C (mandarina) fue ineficaz 38
Después de analizar algunas características muy generales de los principales agentes antioxidantes utilizados como coadyuvantes en la terapéutica de diversas enfermedades crónico-degenerativas que se acompañan de estrés oxidante 39 , presentaremos algunas reflexiones sobre las condiciones ideales y la selección factible de agentes antioxidantes.
De los compuestos liposolubles que incluyen carotenos (β-caroteno, licopeno) y carotenoides sólo la vitamina E o a-tocoferol representa en el humano un mecanismo antioxidante eficiente en contra del daño a membranas inducido por las ERO, debido a su incorporación como constituyente y estabilizador de la estructura de la membrana celular 40 . La vitamina E es efectiva como agente antioxidante convirtiendo O2, HO y los radicales lipo-peroxilo en moléculas menos reactivas de acuerdo con la reacción que se presenta en la Figura 1.
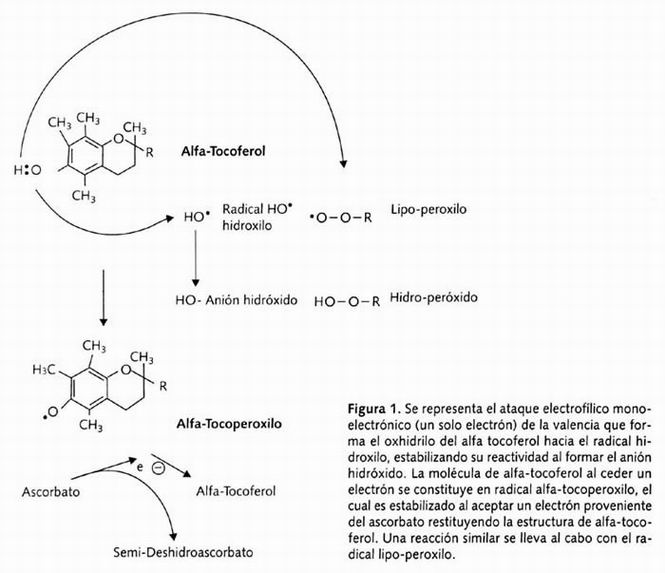
Figura 1. Se presenta el ataque electrofílico monoelectrónico ...
La vitamina E es muy eficiente como agente interruptor de la cadena de peroxidación, debido a la formación del radical tocoperoxilo (α-T ) que es relativamente estable y no reacciona con sustratos lípidos. Esta reactividad limitada es debida a la estabilidad por resonancia que le confiere su anillo aromático, disminuyendo la reactividad del electrón no pareado (radical libre); sin embargo, es suficientemente estable como para detener la cadena de reacción de radicales libres, donando su electrón, pudiendo recuperar su forma reducida, por otra reacción de reducción con ascorbato y posiblemente con la actividad externa redox de las moléculas que constituyen el par ascorbato-glutatión-SH de la membrana. Aunque la vitamina E se encuentra presente en los fluidos extracelulares y en el plasma sanguíneo, su actividad antioxidante está localizada predominantemente en las membranas celulares, por lo que debe considerarse que aunque sea la única molécula liposoluble capaz de interrumpir la cadena de lipoperoxidación en circulación, y su eficiencia se incrementa en presencia de ascorbato y ácido úrico, su contribución a la capacidad antioxidante del plasma es sólo marginal.
Adicionalmente, la vitamina E modula otras funciones en las diversas membranas celulares incluyendo a las del endotelio pulmonar 41 . Entre las funciones asociadas a la vitamina E se pueden mencionar: el transporte de 5-hidroxitriptamina (serotonina), la regulación de la producción normal de eicosanoides, y las inhibiciones de la 5-lipo-oxigenasa, migración y quimiotaxis de neutrófilos 42
Entre los agentes antioxidantes hidrosolubles destaca en primer lugar la vitamina C, que es una molécula libremente disponible en todos los compartimientos del organismo. Puede participar como agente estabilizador del radical libre al funcionar como reductor monoelectrónico ( scavenger ) de los radicales O2— y HO , modificando su estado redox al formar el radical libre semi-deshidroascorbato, que es subsecuentemente reducido a deshidroascorbato por O2— el proceso inverso involucra al glutatión reducido, que a su vez da lugar a la formación del radical tiilo (S ) (Figura 2). Este radical (S ) también puede inactivar a varios agentes oxidantes como los que se presentan en el plasma de fumadores, existiendo aún controversia en la participación de grupos SH no proteicos (glutatión), ya que al menos los SH proteicos no se ven afectados 43 . El deshidroascorbato es reducido a ascorbato nuevamente en una reacción que involucra a una reductasa dependiente de glutatión reducido (GSH), que queda en su forma oxidada (GSSG). El ciclo del glutatión es considerado como uno de los procesos esenciales en la defensa antioxidante del organismo, y es uno de los procesos afectados en el estrés oxidante. La vitamina C suprime la inactivación de antiproteasas por oxidantes generados por el sistema haluromieloperoxidasa del neutrófilo y ejerce una inactivación dosis-dependiente de los oxidantes extracelulares liberados por el neutrófilo. La vitamina C contribuye a la regeneración de la vitamina E unida a membrana oxidada, permitiendo que permanezca su función como interruptora de la lipoperoxidación. A pesar de las características antes mencionadas, la vitamina C no es considerada como el antioxidante ideal debido a que puede presentar propiedades prooxidantes; es probablemente el único agente reductor de la célula que en presencia de O2— a quien reduce y lo inactiva formando O2 , (y como consecuencia de su oxidación, forma el radical semideshidroascorbato), es capaz de reducir Fe 3 + + a Fe 2 + + que a su vez puede reaccionar con H2O2 dando lugar por medio de la reacción de Fenton al radical más reactivo que es el HO . Para que esta reacción se lleve a cabo hay dos condiciones: una es la disposición de Fe en los tejidos y en circulación debido a hemólisis o a la ingestión de hierro como suplemento en polivitamínicos. El otro factor es la automedicación de vitamina C en individuos cuya dieta ya cumpla con los requerimientos diarios establecidos.
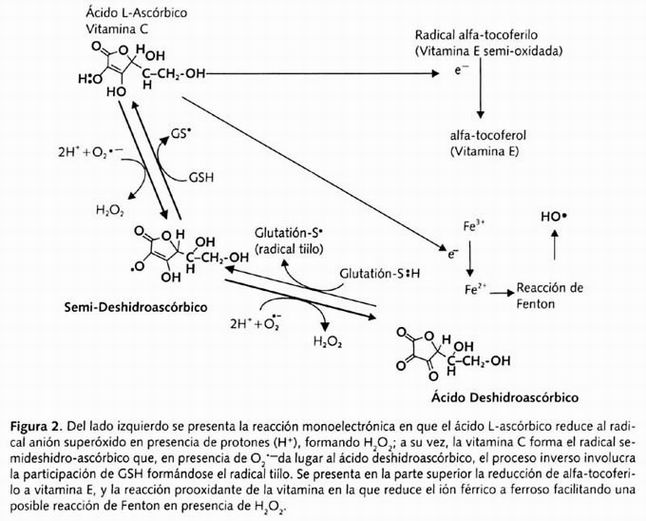
Figura 2. Del lado izquierdo se presenta la reacción monoelectrónica ...
Además de la vitamina C como antioxidante hidrosoluble, es el glutatión-SH (γ-glutamil-cisteinil-glicina) el agente redox más importante, pudiendo funcionar como cofactor de sistemas antioxidantes enzimáticos (glutatión peroxidasa) e interaccionar directamente con los radicales O2— y HO , alcoxilo, y peroxilo, dando lugar en la reacción a la formación del radical glutatiilo (GS ) y eventualmente el dímero de glutatión oxidado (GSSG) a través de una transferencia de radicales. En cuanto a la posibilidad de considerar por su importancia al glutatión como un suplemento atractivo, es importante resaltar que se trata de un tripéptido y su administración oral es inútil, por lo que sólo se puede sugerir como suplemento oral un hidrolizado proteico rico en cisteína. Sin embargo, su destino metabólico no es predecible y seguramente será incorporado a la síntesis de proteínas. Como alternativa, se ha considerado que la administración de N-acetil-cisteína representa ventajas ya que es una molécula que proporciona grupos SH libres sin ser incorporada a síntesis de proteínas. La utilidad de N-acetil-cisteína como agente antioxidante ha sido demostrada, pero debe recordarse, que la sobredosificación de estas moléculas puede conducir a una respuesta prooxidante 44 similar a la de la vitamina C, y por el mismo mecanismo 45 . El cambio en las propiedades de un compuesto antioxidante para constituirse en un agente pro-oxidante, se ha demostrado para cisteína in vitro, provocando el aminoácido un aumento a la susceptibilidad al daño e incluso muerte celular en presencia de H2O2 46 , posiblemente por medio de una reacción tipo Fenton dando lugar a la formación del radical OH.
El ácido úrico formado durante el catabolismo de purinas tiene propiedades antioxidantes importantes, incluso a las concentraciones consideradas como fisiológicas en el plasma humano; el urato inactiva directamente HO , singulete de oxígeno, grupos oxidantes oxo-hem formados por la reacción entre peróxidos y hemoglobina, y radicales peroxilo de la lipoperoxidación. Adicionalmente el ácido úrico previene la oxidación de la vitamina C y se une a los metales de transición (Fe) impidiendo su actividad inductora de las reacciones de óxido-reducción. El ácido úrico participa en estas reacciones redox funcionando como un antioxidante de sacrificio , ya que es degradado de manera irreversible.
Entre las moléculas hidrosolubles que tienen una demostrada capacidad antioxidante, se incluye a la glucosa que inactiva HO 46 , con una eficiencia similar al manitol, sin embargo, debe considerarse que la glucosa, durante su metabolismo aeróbico y por reacciones adicionales como es su autooxidación 47 , contribuye a la generación de diversas ERO 48 , proceso que se incrementa durante la hiperglucemia en el paciente diabético. Las moléculas que presentan grupos tiol (SH) como es la cisteína, la homocisteína, la cisteamina y la N-acetil-cisteína, entre otras, son consideradas como donadores de electrones capaces de participar en reacciones monoelectrónicas funcionando por medio de este proceso como inactivadores de radicales libres ( scavengers ), permitiendo que éstas obtengan estabilidad electrónica y dejen de ser un radical libre, mientras que el grupo SH es oxidado dando lugar al radical tiilo (S ), que puede ser eficientemente reactivado a SH por medio de los procesos enzimáticos que involucran al ciclo del glutatión.
Evidencias recientes indican que el estrés oxidante a través de las ERO 49 concomitantemente con los mediadores proinflamatorios, pueden alterar los mecanismos de transcripción del DNA al modificar en el núcleo el equilibrio de la relación entre las formas activa y la inactiva de las histonas (acetilación/desacetilación), que son algunas de las proteínas que contribuyen al control de la expresión génica. Las ERO en general y, particularmente, el anión superóxido permiten por este mecanismo el libre acceso para la interacción de factores de transcripción con el DNA facilitando la expresión de genes proinflamatorios en diversas células pulmonares. Los procesos de señalización que involucran el balance redox NF-κB/AP-1 regula a su vez el balance entre acetilación de histonas por la acetil-histona transferasa que es activada por H2O2' , y la desacetilación de estas proteínas que redunda en la expresión y liberación de mediadores pro y antiinflamatorios 50 , pudieran ser considerados como un objetivo novedoso en el desarrollo de estrategias terapéuticas para la manipulación farmacológica con agentes antioxidantes en procesos de daño e inflamatorios del pulmón. Sería deseable contar con agentes antioxidantes que tengan un amplio espectro de eficiencia y buena disponibilidad como es el caso de aquellos que tienen grupos tioles o moléculas que presenten un efecto dual y que no sólo protejan del daño directo por radicales libres, sino que simultáneamente sean antiinflamatorios.
En busca del antioxidante ideal. Considerando la importancia para controlar, atenuar y tal vez eliminar el estado metabólico de estrés oxidante en el paciente pulmonar, podríamos hacer algunas consideraciones que no han sido tomadas en cuenta y, como mencionan los profesores Gutteridge y Halliwell en su revisión sobre el tema intitulada Free radicals and antioxidants in the year 2000 51 , debemos esperar el futuro con confianza y las sorpresas que nos depara. Nos encontramos aún en la búsqueda de una solución a los procesos oxidantes que conducen, afectan y agravan los padecimientos pulmonares que dificultan su manejo terapéutico. Finalmente, consideramos que en el diseño de preparados o mezclas de moléculas antioxidantes se deben analizar algunas características esenciales como son: el estar formuladas con base en que sus componentes presenten diferentes potenciales redox, permitiendo establecer una cadena de mecanismos de óxido-reducción que facilite la disminución de las moléculas oxidadas durante el proceso. Otra característica fundamental es que una mezcla de sustancias antioxidantes debe estar constituida por moléculas hidrosolubles (ascorbato, N-acetilcisteína, entre otros) y liposolubles (vitamina E, β-caroteno), y no contener metales de transición aunque sean cofactores de enzimas antioxidantes como son los casos del cobre, el hierro y cromo. Lo aquí propuesto no ha sido considerado adecuadamente y aún no se tiene el antioxidante ideal.
CONCLUSIONES
Consideramos que el conocimiento de las características del estrés oxidante que acompaña a diversos padecimientos pulmonares pudiese permitir el manejo racional de agentes antioxidantes que, seguramente, modificarán la evolución del padecimiento y permitirán la utilización de un apoyo farmacológico más eficiente y posiblemente a dosis menores debido a que durante el estrés oxidante la eficiencia y metabolismo de moléculas xenobióticas también se ve modificada.
REFERENCIAS
1. Pryor WA, Dooley MM, Churh DF. The mechanism of the inactivation of human alpha-proteinase inhibitor by gas-phase cigarrete smoke. Adv Free Radical Biol Med 1986;2:161-188. [ Links ]
2. Hoidal JR, Fox RB, Le Marbe PH, Perri R, Repine JE. Altered oxidative metabolic responses in vitro of alveolar macrophages from asymptomatic cigarette smokers. Am Rev Respir Dis 1981;123:85-89. [ Links ]
3. Church DF, Burkey TJ, Prior WA. Preparation of human lung tissue from cigarette smokers for analysis by electron spin resonance spectroscopy. Methods Enzymol 1990;186:665-669. [ Links ]
4 . MacNee W. Oxidants/antioxidants and COPD. Chest 2000;117:303S-317S. [ Links ]
5. Kehrer JPMA, Mossman BT, Sevanian A, Trush, Smith MT. Contemporary issues in toxicology. Free radical mechanism in chemical pathogenesis . Toxicol Appl Pharmacol 1988;95:349-362. [ Links ]
6. Goodglick LA, Kane AB. Role of reactive oxygen metabolites in crocidolite asbest toxicity to mouse macrophages. Cancer Res 1986;46:5558-5566. [ Links ]
7. Repine JE. Scientific perspectives on adult respiratory distress syndrome. Lancet 1992;339:466-472. [ Links ]
8. Barnes PJ. Reactive oxygen species and airway inflammation . Free Radic Biol Med 1990;9:235-243. [ Links ]
9. Kay AB. Asthma and inflammation . J Allergy Clin Immunol 1991;87:893-911. [ Links ]
10. Cristal RG. Oxidants and respiratory tract epithelial injury: Pathogenesis and strategies for therapeutic intervention. Am J Med 1991;91(3C):39S-44S. [ Links ]
11. Hicks JJ, Silva-Gómez MR, Vilar-Rojas C. Induction of antioxidant enzymes by dexametasone in the adult rat lung. Life Sci 1997;60:2059-2067. [ Links ]
12. Halliwell B, Gutteridge MC. Oxygen toxicity, oxygen radicals, transition metals and disease. Biochem J 1984;219:1-14. [ Links ]
13. Granger DN, Rutili G, McCord JM. Superoxide radicals in feline intestinal ischemia. Gastroenterology 1981;81:22-29. [ Links ]
14. Heffner JE, Repine JE. Pulmonary strategies of antioxidant defense. Am Rev Respir Dis 1989;140:531-554. [ Links ]
15. Shlafer M, Kane PF, Kirsh MM. Superoxide dismutase plus catalase enhances the efficacy of hypothermic cardioplegia to protect the globally ischemic, reperfused heart. J Thorac Cardiovasc Surg 1982;83:830-839. [ Links ]
16. Miyachi M, Vickers S, Schiller HJ, Patel P, Mather I, Hildreth J, et al. Immunoaffinity localization of the free radical-generating enzyme, xanthine oxidase in the microvascular endothelium of the porcine and human brain. Circulatory Shock 1991;34:A436. [ Links ]
17. Vickers S, Hildreth J, Kuhajda F, Madara P, Mather I, Baig M, et al. Immunohistoaffinity localization of xantine oxidase in the microvascular endothelial cells of porcine and human organs. Circ Shock 1990;31:87. [ Links ]
18. Vickers S, Miyachi M, Hildreth J, Baij M, Kuhajda F, Madara P, et al. Immunohistoaffinity localization of xanthine oxidoreductase (XOR) and histochemical discrimination of dehydrogenase (XD) and oxidase (XO) in situ. FASEB J 1990;4:A895. [ Links ]
19. Marzella L, Jesudass RR, Manson PN, Myers RAM, Bulkley GB. Functional and structural evaluation of the vasculature of skin flaps after ischemia and reperfusion . Plast Reconstr Surg 1988;81:742-750. [ Links ]
20. Mayumi T, Schiller HJ, Bulkley GB. Pharmaceutical intervention for the prevention of post-ischemic reperfusion injury. Switzerland: Birkhauser Verlag Basel; 1993. [ Links ]
21. Reilly PM, Schiller HJ, Bulkley GB. Reactive oxygen metabolites in shock. In: Wilmore DW, Brennan MF, Harken, et al, editors. Care of the surgical patient. Trauma. New York: Scientific Am; 1991. p-30. [ Links ]
22. Van Asbeck BS, Hoidal J, Vercellotti GM, Schwartz BA, Moldow CF, Jacob HS. Protection against lethal hyperoxia by tracheal insufflation of erythrocytes: Role of red cell glutathione . Science 1985;227:756-759. [ Links ]
23. Toth KM, Clifford DP, Berger EM, White CW, Repine JE. Intact human erythrocytes prevent hydrogen peroxide-mediated damage to isolated perfused rat lungs and culture bovine pulmonary artery endothelial cells. J Clin Invest 1984;74:292-295. [ Links ]
24. Wali RK, Jaffes S, Kumar D, Sorgente N, Kalra VK. Increased adherence of oxidant-treated human and bovine erythrocytes to cultured endothelial cells. J Cell Physiol 1987;133:25-36. [ Links ]
25. Winterbourn CC, Stern A. Human rest cells scavenge extracellular hydrogen peroxide and inhibit formation of hipochlorous acid and hydroxyl radicals. J Clin Invest 1987;80:1486-1491. [ Links ]
26. Toth KM, Berger EM, Beehler CJ, Repine JE. Erythrocytes from cigarette smokers contain more glutathione and catalase and protect endothelial cells from hydrogen peroxide better than do erythrocytes from nonsmokers. Am Rev Respir Dis 1986;134:281-284. [ Links ]
27. Del Principe D, Menichelli A, de Matteis W, di Corpo ML, di Giulio S, Finazzi-Agro A. Hydrogen peroxide has a role in the aggregation on human platelets. FEBS Lett 1985;185:142-146. [ Links ]
28. Ramos MJI, Launay JM, Dreux C. A sensitive fluorometric microassay for the determination of glutathione peroxidase activity. Application to human blood platelets. Anal Biochem 1979;98:154-159. [ Links ]
29. Pietra GG, Ruttner JR, Wust W, Gling W. The lung after trauma and shock. Fine structure of alveolar-capilary barrier in 23 autopsies. J Trauma 1981;21:454-462. [ Links ]
30. Gutman FD, Murthy VS, Wojciechowski MT, Wurn RM, Edwards RA. Transient pulmonary platelet sequestration during endotoxemia in dogs. Circ Shock 1987;21:185-195. [ Links ]
31. Mercier G, Berthault N, Mary J, Peyre J, Antoniades A, Comet JP, et al. Biological detection of low doses by combining results of two microarray analysis method. Nucleic Acids Res 2004;32:e12. [ Links ]
32. Seong JM, Kim do K, Oh SH, Kim KS, Lee SS, Um HD. Proteomic analysis of the cellular proteins induced by adaptative concentratios of hydrogen peroxide in human U937 cells. Exp Mol Med 2002;34:374-378. [ Links ]
33. Hemmrich K, Suschek CV, Lerzynski G, Kolb-Bachofen V. iNOS activity is essential for endothelial stress gene expression against oxidative damage. J Appl Physiol 2003;95:1937-1946. [ Links ]
34. Dickinson DA, Moellering DR, Iles KE, Pate RP, Levonen AL, Wigley A, et al. Cytoprotection against oxidative stress and the regulation of glutathione synthesis. Biol Chem 2003;384:527-537. [ Links ]
35. Medina-Navarro R, Hicks JJ. Radicales libres de oxígeno: Bioquímica inorgánica y biomedicina. En: Hicks JJ, editor. Bioquímica. México: McGraw-Hill; 2002. p. 779-792. [ Links ]
36. Winkelmann BR, Boehm BO, Nauck M, Kleist P, Marz W, Verho NK, et al. Cigarette smoking is independently associated with markers of endothelial dysfunction and hyperinsulinaemia in non-diabetic individuals with coronary artery disease. Curr Med Res Opin 2001;17:132-141. [ Links ]
37. Boots AW, Haenen GR, Bast A. Oxidant metabolism in chronic obstructive pulmonary disease. Eur Respir J Suppl 2003;46:14S-27S. [ Links ]
38. Astley SB, Elliot RM, Archer DB, Southon S. Evidence that dietary supplementation with carotenoid and carotenoid-rich foods modulates the DNA damage: repair balance in human lymphocytes. Br J Nutr 2004;91:63-72. [ Links ]
39. Halliwell B. Free radicals, antioxidants and human disease: curiosity, cause, or consequence? Lancet 1994;344:721-724. [ Links ]
40. Patel JM, Block ER. Vitamin E modulates the physical state and function of pulmonary endothelial cell membranes (abstract). Am Rev Respir Dis 1988;137:78. [ Links ]
41. Steiner M. Vitamin E changes the fluidity of human platelets. Biochem Biophys Acta 1981;640:100-105. [ Links ]
42. Huang N, Lineberger B, Steiner M. Alpha-tocoferol, a potent modulator of endothelial cell function. Thromb Res 1988;50:547-557. [ Links ]
43. Rahman I, Swarska E, Henry M, Stolk J, MacNee W. Is there any relationship between plasma antioxidant capacity and lung function in smokers and in patients with chronic obstructive pulmonary disease? Thorax 2000;55:189-193. [ Links ]
44. Sprong RC, Winkelhuzen-Janssen AM, Aarsman CJ, van Oirschot JF, van der Bruggen T, van Asbeck BS. Low-dose N-acetylcysteine protects rats against endotoxin-mediated oxidative stress, but high doses increases mortality. Am J Respir Crit Care Med 1998;157:1283-1293. [ Links ]
45. Park S, Imlay JA. High levels of intracellular cysteine promote oxidative damage by driving the Fenton reaction. J Bacteriol 2003;185:1942-1950. [ Links ]
46. Sagone AL, Greenwald J, Kraut EH, Blanchine J, Singh D. Glucose: a role as free radical scavenger in biological systems. J Lab Clin Med 1983;101:97-104. [ Links ]
47. Medina NR, Durán RG, Díaz FM, Hicks JJ, Kumate J. Glucose autooxidation produce acrolein from lipid peroxidation in vitro. Clin Chim Acta 2003;337:183-185. [ Links ]
48. Medina NR, Durán RG, Díaz FM, Hicks JJ, Kumate J. Glucose-stimulated acrolein production from unsaturated fatty acids. Human Experimental Toxicology 2004;23:101-105. [ Links ]
49. Tomita K, Barnes PJ, Adcock IM. The effect of oxidative stress on histone acetylation and IL-8 release . Biochem Biophys Res Commun 2003;301:572-577. [ Links ]
50. Rahman I. Oxidative stress, chomatin remodeling and gene transcription in inflammation and chronic lung diseases. J Biochem Mol Biol 2003;36:95-109. [ Links ]
51. Gutteridge JC, Halliwell B. Free radicals and antioxidants in the year 2000. A Historical Look to the Future. Ann N Y Acad Sci 2000;899:136-147. [ Links ]














