Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.17 no.2 México jun. 2004
Rev Inst Nal Enf Resp Méx 2004; Vol. 17(2):126-134
TRABAJOS DE REVISIÓN
MHC: POLIMORFISMOS GENÉTICOS EN AUTOINMUNIDAD
RAMCÉS FALFÁN VALENCIA
Laboratorio de HLA. Dpto. Inmunogenética, INER.
Correspondencia
QC. Ramcés Falfán Valencia,
Laboratorio de HLA. Departamento de Inmunogenética,
Instituto Nacional de Enfermedades Respiratorias.
Calzada de Tlalpan 4502, Colonia Sección XVI.
México, DF., 14080
Teléfono: 56 66 45 39, ext. 152
E-mail: dcb_rfalfanv@hotmail.com
Trabajo recibido: 02-VI-2004;
Aceptado: 29-VI-2004
RESUMEN
Las enfermedades autoinmunes se caracterizan por inflamación, así como por el desarrollo y mantenimiento de anticuerpos y linfocitos T dirigidos contra antígenos propios (autoantígenos). Aunque la etiología de estas enfermedades es desconocida, poseen mecanismos en común. Existe una fuerte asociación genética entre ciertas enfermedades autoinmunes como la artritis reumatoide, esclerosis múltiple y diabetes mellitus insulino-dependiente y algunos alelos y/o haplotipos del complejo principal de histocompatibilidad. La explicación actual para este tipo de asociaciones propone que las moléculas del complejo principal de histocompatibilidad que se han encontrado asociadas, unen de manera eficiente autoantígenos envueltos en la patofisiología de la enfermedad, lo cual resulta en una respuesta inmune periférica mediada por células T contra autoantígenos y las secuelas autoinmunes. La susceptibilidad individual en autoinmunidad puede estar determinada por una combinación de polimorfismos específicos de genes que codifican para múltiples citocinas, antígenos del complejo principal de histocompatibilidad, moléculas de adhesión y proteínas celulares. Esta condición puede conducir a la expresión anormal de moléculas inmunorreguladoras y finalmente resultar en el desarrollo o exacerbación de la enfermedad. Recientemente también se ha estudiado el papel de las secuencias virales en la patogénesis de autoinmunidad, principalmente involucradas en mimetismo molecular.
PALABRAS CLAVE: AUTOINMUNIDAD, MHC, LA, HLA-DR, HLA-DQ, DIABETES MELLITUS INSULINO-DEPENDIENTE, ENFERMEDAD AUTOINMUNE
ABSTRACT
Autoimmune diseases are characterized by inflammation and by the development and maintenance of antibodies and T lymphocytes against "self" antigens. Although the etiology of these diseases is unknown, they have a number of cellular and molecular mechanisms in common. A strong genetic association exists between a number of autoimmune diseases such as rheumatoid arthritis, multiple sclerosis, and insulin-dependent diabetes mellitus (IDDM) and the expression of certain alleles or haplotypes of the major histocompatibility complex (MHC). The current explanation for this association proposes that disease-associated MHC molecules efficiently bind autoantigens involved in the pathophysiology of the disease. This results in a peripheral T cell-mediated immune response to the autoantigens and autoimmune sequelae. Individual susceptibility to autoimmune diseases may be determined by a combination of specific polymorphisms of genes encoding multiple cytokines, MHC antigens, adhesion molecules, and cellular proteins. This condition may lead to abnormal expression of immunoregulatory molecules and finally result in the development or exacerbation of the disease. Recently, the role of viral sequences in the pathogenesis of autoimmunity has been discussed, mainly involved in molecular mimicry.
KEY WORDS: Autoimmunity, MHC, HLA, HLA-DR, HLA-DQ, insulin-dependent diabetes mellitus, autoimmune disease.
INTRODUCCIÓN
La investigación en autoinmunidad se ha enfocado principalmente a las funciones de los linfocitos. El conocimiento en inmunidad celular y molecular ha crecido de manera exponencial; sin embargo, ha resultado insuficiente para explicar la patogénesis en autoinmunidad. Son muchos los mecanismos específicos, así como los antígenos que han sido estudiados en detalle en diversos procesos autoinmunes, entre ellos, componentes del sistema inmune adaptativo [por ejemplo los antígenos del complejo principal de histocompatibilidad (MHC, por sus siglas en inglés), receptores de célula T (TCR, por sus siglas en inglés), anticuerpos, entre otros] y del sistema inmune innato (proteínas del sistema del complemento, diferentes citocinas, etcétera) 1 . Las enfermedades autoinmunes se caracterizan por inflamación, así como por el desarrollo y mantenimiento de anticuerpos y linfocitos T contra antígenos propios. Aunque la etiología de la mayoría de estos padecimientos es desconocida o ha resultado controversial, existen algunos mecanismos moleculares y celulares comunes. Tal es el caso de citocinas proinflamatorias, como la interleucina-1 (IL-1) y el factor de necrosis tumoral (TNF, por sus siglas en inglés), que activan y regulan el proceso inflamatorio 2
En lo que respecta al sistema inmune adaptativo, específicamente las moléculas del MHC y gracias a que, en 1974, Zinkernagel y Doherty descubrieron el fenómeno al que denominaron restricción antigénica, y que es mediada por los antígenos del Human Leukocyte Antigens (HLA) (MHC humano), los inmunólogos hemos trabajado sobre esa base 3 . A lo largo de las últimas tres décadas se han documentado fuertes asociaciones genéticas entre algunas enfermedades autoinmunes [artritis reumatoide, esclerosis múltiple, diabetes mellitus insulino-dependiente y lupus eritematoso sistémico (LES), son sólo algunos ejemplos] y ciertos "tipos" (alelos y haplotipos) de HLA, especialmente aquellos que se localizan en la región de clase II. Los planteamientos actuales para las asociaciones entre HLA y autoinmunidad, proponen que los antígenos de HLA, que son los encargados de procesar y presentar péptidos extraños para su reconocimiento por parte del TCR de los linfocitos T (CD4 + o CD8 + , según sea el caso), procesen y presenten de una manera eficiente autoantígenos, que de manera normal no deberían ser presentados, lo cual conduce a una respuesta inmune periférica dirigida contra estos autoantígenos y las secuelas autoinmunes 4
MECANISMOS DE AUTOTOLERANCIA
Previniendo las reacciones autoinmunes
Los mecanismos que previenen las reacciones inmunes contra autoantígenos se clasifican en tres grupos: 1) la tolerancia central es debida a la muerte de linfocitos en desarrollo, cuando éstos encuentran autoantígenos en los órganos linfoides primarios; es importante para la tolerancia a autoantígenos que están presentes a elevadas concentraciones en la médula ósea y el timo. Fischer y Malissen ya han descrito los genes involucrados en la regulación del desarrollo de linfocitos 5 ; 2) la tolerancia periférica es mantenida por mecanismos que actúan en linfocitos maduros que han abandonado los órganos primarios y encuentran autoantígenos en tejidos periféricos. Algunos autoantígenos son capaces de no inducir tolerancia central ni periférica debido a que son simplemente ignorados por el sistema inmune. Tal "ignorancia clonal" puede ser debida a que el autoantígeno es anatómicamente secuestrado de los linfocitos inmunocompetentes, o bien, dicho antígeno es presentado a linfocitos en ausencia de segundas señales (coestimuladoras) que son necesarios para disparar una respuesta inmunoefectiva 6 . Los autoantígenos normalmente no inducen reacciones inmunes innatas; entonces no resulta sorprendente que éstos puedan ser ignorados por el sistema inmune. Un problema común en el entendimiento de la autotolerancia es que no hemos podido definir cómo o cuáles autoantígenos pueden inducir tolerancia central o periférica o ser ignorados, y qué características determinan cuáles de estos mecanismos de autotolerancia son operativos y 3) también son capaces de inducir tolerancia en compartimentos de linfocitos T o B maduros, si estas células encuentran los autoantígenos en ausencia de una segunda señal o si generan mecanismos de bloqueo en la activación del linfocito o si inducen su apoptosis. Aunque es sabido que el reconocimiento de autoantígenos sin señales coestimuladoras induce anergia funcional; aún no se sabe qué factores determinan si un autoantígeno es funcionalmente ignorado o induce anergia. Finalmente, el mantenimiento de la autotolerancia refleja interacciones moleculares específicas estrictamente reguladas, y no simplemente la carencia de respuesta por parte de los linfocitos a los autoantígenos 7
HLA Y SU ASOCIACIÓN CON LA ENFERMEDAD AUTOINMUNE
Las enfermedades autoinmunes son generalmente clasificadas como órganos específicos o sistémicas y pueden incluir, tanto componentes de la respuesta inmune humoral como de la respuesta inmune celular. Por otro lado, son extensas las asociaciones que se han descrito en la patología autoinmune y diversos sistemas genéticos, sobre todo aquellas que incluyen diversos componentes del MHC, para lo cual a continuación conoceremos algunos aspectos fundamentales de la inmunogenética de dicho sistema.
El complejo principal de histocompatibilidad
El MHC es un complejo de genes polimórficos, identificados durante la década de los treinta por el inmunólogo británico Gorer por medio de la caracterización serológica de aloantígenos codificados por el MHC del ratón. A este sistema genético lo llamó H-2 y ha sido investigado a profundidad a lo largo de las últimas décadas. El MHC fue identificado en todos los vertebrados estudiados y consiste en un gran número de genes fuertemente ligados. A las versiones humanas del MHC se les denominó HLA. Cada uno de los loci genéticos del HLA es altamente polimórfico y puede ser expresado en diferentes formas alternativas que se denominan alelos . Generalmente son heredados de manera conjunta formando una unidad denominada haplotipo, cada individuo poseemos dos haplotipos HLA, uno de origen paterno y otro materno; los dos haplotipos HLA presentes en un individuo constituyen el genotipo HLA 8 . Este sistema genético se encuentra localizado en el brazo corto del cromosoma 6, en la banda 21.3, contiene 224 loci identificados 9 y recientemente se adicionaron 40 loci; se trata de la región más densa del genoma humano, codifica para las proteínas humanas más polimórficas conocidas, los antígenos de HLA clase I y II 10 . En la Tabla I podemos observar los alelos identificados en secuencia y descritos para estos genes.
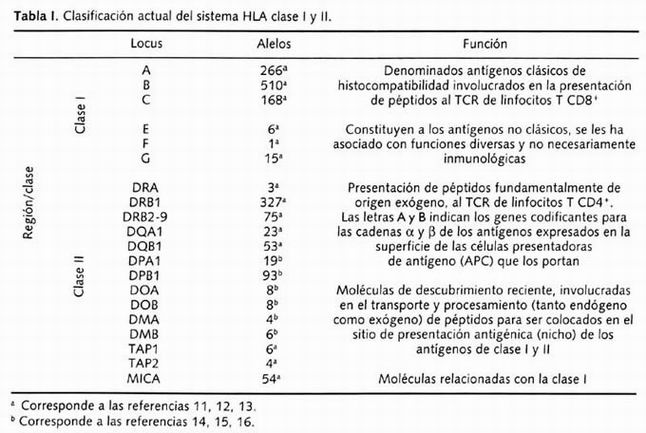
Tabla 1. Clasificación actual del sistema HLA clase I y II
Las regiones de HLA clase III y IV son distintivas entre los genes de este sistema debido a que a diferencia de las clases I y II, no codifican para proteínas de transmembrana, lo hacen para proteínas solubles del plasma. En el caso de la clase III, se agrupan a los genes del sistema del complemento C2, C4a, C4b (de la vía clásica) y el factor B (vía alterna); la 21-OH (de la vía de biosíntesis de esteroides), HSP-70, así como de reciente descubrimiento los miembros de la superfamilia de inmunoglobulinas (o Ly6) C5b, C5c, G6f, G6b, G6e, G6d, G6e y 1C7. La clase IV, de reciente creación, agrupa genes involucrados en estrés e inflamación, teniendo como principales a los genes del factor de necrosis tumoral, y los genes codificantes para las formas α y βde la linfotoxina (LT) 8, 10
Asociación con enfermedades
El fuerte desequilibrio de enlace entre los alelos HLA, especialmente entre los locus DR y DQ ha sido ampliamente documentado. La identificación precisa de alelos HLA en susceptibilidad a enfermedades puede variar dependiendo del grupo poblacional en estudio, y en muchos casos una enfermedad puede estar asociada con múltiples alelos y ser distintos alelos para una misma patología en distintas poblaciones, como se aprecia en la Tabla II. Por ejemplo, más de 20 loci han sido identificados como asociados a diabetes mellitus insulino-dependiente o también llamada diabetes tipo 1 o diabetes autoinmune; se considera que la principal contribución genética está asociada al locus HLA-DQ y constituye entre el 40-50% del riesgo genético. La compleja naturaleza de casi todas las enfermedades autoinmunes asociadas a la clase II incluyen contribuciones poligénicas, tanto de genes en la región de HLA como fuera de ésta. De manera adicional, los factores ambientales contribuyen al desarrollo de las distintas enfermedades y sus asociaciones 17, 18 . La contribución de alelos HLA como marcadores genéticos de riesgo en la susceptibilidad a otras enfermedades autoinmunes varían en la fuerza de su asociación 17
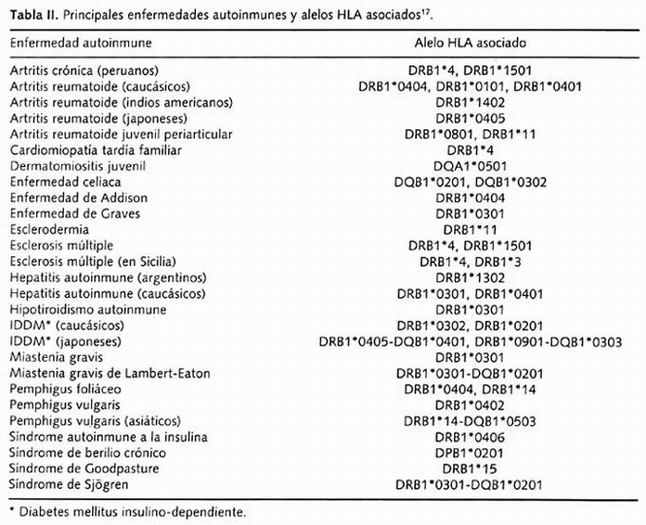
Tabla II. Principales enfermedades autoinmunes y alelos HLA asociados
Como hemos podido observar, la predisposición al desarrollo de muchas enfermedades autoinmunes está asociada a genes dentro del HLA. Sin embargo, con frecuencia es difícil determinar cuál de los muchos genes HLA son directamente involucrados en el proceso de la enfermedad. Las principales razones de esta dificultad radican en la complejidad de las asociaciones donde varios alelos/haplotipos están envueltos y el fuerte desequilibrio de enlace que existe entre los genes de este complejo. El fenómeno posterior conduce a asociaciones con enfermedades secundarias y que se pueden interpretar como polimorfismos en desequilibrio, es decir, cuando éstos sólo reflejan la presencia en cercanía de los posibles verdaderos genes responsables de la patología 19, 20
La mayoría de las enfermedades en las cuales se han descrito asociaciones que demuestran conferir susceptibilidad con alelos de HLA son con el locus HLA-DR. Sin embargo, también se han descrito alelos del locus HLA-DQ relacionados con la protección a la enfermedad, principalmente en diabetes. Las bases de este efecto protector son indudablemente complejas y han provocado dificultades de los estudios en humanos 21 . Por otro lado, se conoce que los subtipos HLA-DR, HLA-DQ y HLA-DP regulan la respuesta inmune dependiente de células T, y que una expresión aberrante en este tipo celular podría tener importantes consecuencias en autoinmunidad. El incremento en la expresión endotelial de moléculas de clase II ha sido documentado en varias enfermedades autoinmunes, incluyendo miocarditis con cardiomiopatía tardía, artritis reumatoide y LES. Datos recientes sugieren que existe una asociación entre la expresión endotelial de moléculas de HLA clase II y disfunción endotelial difusa, la cual puede ser parte de la explicación del incremento de riesgo de enfermedad cardiovascular en pacientes con enfermedades autoinmunes como las arriba mencionadas, así como en otros desórdenes inflamatorios de tipo crónico 22 . El mapeo sistemático de las variantes que confieren susceptibilidad a distintas enfermedades es requerido, apoyado de la construcción de un mapa completo de polimorfismos en humanos 23
Autoinmunidad, MHC y modelos experimentales en animales
En la actualidad, son muchos los laboratorios que han desarrollado modelos murinos experimentales, especialmente aquellos que carecen de la expresión de H-2 IE (equivalente murino de HLA-DR). En humanos resulta difícil estudiar la función de un alelo HLA de manera individual, debido a que, poseemos un par de alelos para cada locus, uno de cada progenitor, a lo cual debemos agregar el fuerte desequilibrio de enlace en la región de clase II, que hace aún más difícil distinguir el efecto individual de los alelos HLA-DR, de los efectos ligados a los alelos HLA-DQ, además de que las combinaciones -DR/-DQ tienden a persistir con muy poco grado de recombinación. Estas son las razones por las cuales surgió la necesidad de crear cepas de ratones transgénicos que sirvan como un sustituto experimental para el comportamiento de las células T CD4 + en sujetos humanos normales 21
Diabetes mellitus autoinmune
La diabetes mellitus insulino-dependiente es causada por un proceso autoinmune que culmina con la destrucción de las células b del páncreas y que resulta en la pérdida de la producción de insulina. Los estadios preclínicos se caracterizan por autoanticuerpos contra insulina, ácido glutámico descarboxilasa (GAD) e IA2 (molécula similar a tirosin-fosfatasa). Tait y colaboradores demostraron que la progresión a autoinmunidad, verificable en términos de autoanticuerpos, está fuertemente relacionada con alelos de HLA-DRB1*03 y -DRB1*04, así como por el heterocigoto DRB1*03/*04; en contraste, la progresión a la enfermedad clínica parece estar asociada con alelos de clase I A24, A30 y B18, mientras que A1, A28, B14 y B56 se encuentran asociados de manera negativa. Estos resultados son consistentes con el hecho de que las células T CD4 + responden a péptidos en el contexto de moléculas de clase II que a su vez son responsables de la iniciación de la producción de anticuerpos, mientras que la destrucción de las células β de los islotes pancreáticos que conducen a la expresión clínica de la enfermedad, se encuentra mediada por linfocitos T CD8 + que reconocen péptidos relevantes en el contexto de moléculas de clase I 24
Otros estudios en asociación con alelos del MHC han realizado modelos experimentales: uno de los hallazgos más sorprendentes lo realizó David y colaboradores al encontrar que la coexpresión de HLA-DR3 puede modificar las manifestaciones de una artritis experimental asociada a la expresión de HLA-DQ8. HLA-DQ8 también aumenta la severidad de otras enfermedades autoinmunes experimentalmente inducidas en este modelo; mientras que HLA-DQ6, puede prevenir la espontánea pérdida de la tolerancia al autoantígeno pancreático GAD65 y la insulinitis que son observadas en ratones transgénicos para el equivalente murino de -DR3-DQ8 25 - 28 . De manera independiente Todd y Mc Devitt ya han documentado que los alelos HLA-DQB1*0602 y HLA-DRB1*0403 confieren protección (o resistencia) contra IDDM 21
Los estudios de desequilibrio de transmisión (TDT) nos ayudan a conocer si un determinado marcador muestra distorsión en su transmisión en las generaciones sucesivas; en el caso de los estudios de enfermedades asociadas a HLA son pocos los estudios realizados a la fecha. En este contexto Lie y colaboradores estudiaron la transmisión del haplotipo HLA-DQA1*-DQB1* en niños con IDDM y hermanos sanos en familias noruegas, pero no encontraron resultados positivos, sugiriendo que este hecho es provocado por la baja penetrancia de los alelos de susceptibilidad 29
Por otro lado, Redondo y colaboradores encontraron que los alelos HLA-DRB1* 1501 y -DQA1* 0102-DQB1* 0602 están asociados con protección a IDDM, y que aproximadamente el 20% de los americanos y europeos portan el haplotipo DQA1* 0102-DQB1* 0602, mientras que sólo menos del 1% de niños con diabetes tipo 1 portan estos alelos. La protección provista por HLA-DQA1* 0102-DQB1* 0602, se ha encontrado dominante sobre el riesgo conferido por otros haplotipos, tales como DQA1* 0301-DQB1* 0302 o DQA1* 0501-DQB1* 0201. De manera adicional, descubrieron el haplotipo DRB1* 1401-DQA* 10101-DQB1* 0503, un haplotipo poco común, que confiere protección y que está mediada específicamente por el alelo HLA-DRB1* 1401 en desequilibrio de enlace con DQA1* 0101-DQB1* 0503, en pacientes de dos bases de datos independientes que incluyeron a individuos caucásicos 30
La mayor parte de los estudios entre HLA y diabetes tipo 1 se han enfocado al exón 2 de los polimórficos genes de clase II -DRB1*, -DQA1* y -DQB1*. Sin embargo, existen estudios que sugieren la presencia de polimorfismos adicionales que pueden estar influenciando, aunque en menor grado, el desarrollo de IDDM. Tal es el caso del alelo 3 del microsatélite D6S2223, localizado 4.9 Mb telomérico a HLA-DQ, en la región de clase I extendida, y que se encontró asociado con una reducción del riesgo conferido por el haplotipo HLA-DQ2-DR3 en poblaciones de Suecia y Francia 31, 32
Mimetismo molecular
Los posibles mecanismos que pudiesen explicar las asociaciones entre HLA y enfermedad son muchos y muy variados, pero sin duda el que ha generado más estudios en su favor es el mimetismo molecular, en donde se piensa que los agentes infecciosos desempeñan un papel central en el desarrollo de enfermedades autoinmunes. La similitud de secuencias entre los agentes infecciosos y proteínas o péptidos propios son propuestos como el principal mecanismo para la inducción de autoinmunidad. Sin embargo, ha resultado particularmente difícil la identificación de péptidos microbianos que activan las células T autorreactivas utilizando alineaciones convencionales de secuencias, para lo cual es necesario apoyarse en técnicas que incluyen el análisis de características estructurales que son importantes para el reconocimiento del TCR y de los péptidos unidos a la molécula de HLA 33, 34 . Múltiples autoantígenos se han observado en muchas enfermedades autoinmunes; más de diez antígenos han sido propuestos como candidatos en IDDM y más de cinco para esclerosis múltiple, aun en el caso de miastenia gravis, donde el blanco exclusivo de los autoanticuerpos es el receptor para acetilcolina. No existe un consenso claro acerca de la naturaleza de los epítopes generados asociados con la respuesta inmune a este autoantígeno 35
Mimetismo molecular y virus
Los virus son comúnmente citados como elementos disparadores de enfermedades autoinmunes, pero actualmente se desconoce la mayoría de los mecanismos mediante los cuales se inicia dicho proceso. El mimetismo molecular es la hipótesis más popular y propone que los antígenos virales comparten homología con antígenos propios, provocando una respuesta inmune que daña los tejidos del hospedero. Epítopes lineales y conformacionales pueden estar involucrados en esta reacción y no necesariamente compartir una secuencia exacta de aminoácidos con péptidos propios para activar las células T autorreactivas. El proceso autoinmune se puede potenciar con la exposición al sistema inmune de antígenos crípticos previamente secuestrados. Por otra parte, ciertos superantígenos que no se encuentran restringidos por el MHC al ser presentados y reconocidos pueden resultar en una marcada activación policlonal de células T 36
Virus de Epstein-Barr
Pender propuso que las enfermedades autoinmunes humanas se basan en la infección de linfocitos T autorreactivos por parte del virus de Epstein-Barr (EBV), bajo el siguiente escenario: durante la infección primaria, las células B autorreactivas son infectadas por EBV, proliferan y llegan de manera latente a células B de memoria, las cuales resisten a la apoptosis que ocurre durante la homeostasis de una célula B normal, ya que éstas expresan moléculas antiapoptóticas codificadas por EBV. La susceptibilidad genética a los efectos de la célula B infectada por EBV conduce a un incremento en el número de células B de memoria infectadas y latentes que se alojan en órganos donde sus antígenos blancos son expresados, actuando como células presentadoras de antígeno. Cuando las células T CD4 + que reconocen antígenos dentro de los órganos blanco son activadas dentro de los órganos linfoides por reactividad cruzada con agentes infecciosos, éstos migran hasta los órganos blancos, fallan en la apoptosis, pues reciben una señal coestimuladora por parte de la célula B infectada con EBV. Las células T autorreactivas entonces, proliferan y producen citocinas, las cuales reclutan otras células proinflamatorias dañando el órgano blanco como resultado y estableciéndose así una enfermedad autoinmune crónica 37
Retrovirus endógenos humanos
Recientemente el papel de las secuencias retrovirales en la patogénesis de autoinmunidad ha entrado en polémica. Los retrovirus endógenos humanos (HERV, por sus siglas en inglés) pueden haberse originado de virus exógenos que se integraron al genoma. Constituyen aproximadamente el 8% del total del DNA genómico. Mientras que los retrovirus exógenos son infecciosos con un ciclo de replicación que requiere la integración de un DNA proviral en el DNA de una célula hospedera, los HERV son transmitidos genéticamente de forma mendeliana clásica, como DNA proviral. Debido a mutaciones y deleciones acumuladas, estos elementos son considerados como inactivos para la replicación, pero en algunas condiciones, tales como luz UV, la presencia de citocinas proinflamatorias y/o agentes demetilantes pueden ser expresados espontáneamente. Los HERV pueden conducir a autoinmunidad directamente codificando autoantígenos o indirectamente afectando la expresión de genes reguladores de la respuesta inmune y la tolerancia inmunológica 38, 39 . La expresión de HRES-1 (human-T-cell-lymphotropic-virus-related endogenous sequence 1) y HERV-3 ha sido documentada en LES y anticuerpos contra HRES-1/p28 y la proteína env de HERV fue detectada en pacientes con lupus y en madres de bebés con lupus neonatal, respectivamente. Dicha reactividad cruzada entre antígenos propios y proteínas virales ha sido propuesta como un claro elemento disparador de autoinmunidad en lupus. HRES-1 fue el primer HERV que se demostró estar expresado a nivel de proteína 39
CONCLUSIONES
Son extensos los estudios que han correlacionado el papel que desempeñan las moléculas de HLA en varias enfermedades autoinmunes. Estructuras cristalográficas en rayos X y análisis de unión entre péptido y MHC han provisto un detallado entendimiento de la interacción entre HLA y péptidos antigénicos. Tanto los alelos HLA descritos como susceptibles y no susceptibles pueden presentar péptidos derivados de autoantígenos, pero sólo las interacciones con alelos de susceptibilidad conducen a autoinmunidad. Aún no queda del todo claro cómo las células T autorreactivas escapan en la periferia de aquellos individuos con alelos susceptibles. Es posible que las células T autorreactivas se encuentren en una frecuencia mucho mayor en individuos con alelos susceptibles en comparación con individuos con alelos no susceptibles. La eliminación de células T potencialmente patogénicas puede contar para el efecto protector de ciertos alelos HLA de clase II que previenen de la enfermedad autoinmune en humanos. Adicionalmente, se ha especulado sobre la participación de los factores ambientales como elementos disparadores de diversos procesos patológicos; el mecanismo por el cual lo hacen, queda aún por resolver. Futuras investigaciones en las áreas de unión péptido-MHC, así como la definición de secuencias consenso entre los diferentes alelos de HLA y cada patología, conducirán al esclarecimiento de los mecanismos operantes en la enfermedad autoinmune.
Agradecimientos:
A la Dra. Ana Ma. Salazar M. del Instituto de Inv. Biomédicas y al Dr. Angel E. Camarena O. del INER, por su apoyo en la revisión del presente artículo.
REFERENCIAS
1. Rudd PM, Elliott T, Cresswell P, Wilson IA, Dwek RA. Glycosylation and the immune system. Science 2001;291:2370-2376. [ Links ]
2. Descamps FJ, van den Steen PE, Nelissen I, van Damme J, Opdenakker G. Remnant epitopes generate autoimmunity: from rheumatoid arthritis and multiple clerosis to diabetes . Adv Exp Med Biol 2003;535:69-77. [ Links ]
3. Parham P. Pictures of MHC restriction . Nature 1996;348:109-110. [ Links ]
4. Ridgway WM, Fassó M, Fathman CG A new look at MHC and autoimmune disease. Science 1999;238:749-751. [ Links ]
5. Fischer A, Malissen B. Natural and engineered disorders of lymphocyte development. Science 1998;280: 237-243. [ Links ]
6. Ohashi PS, Oehen S, Buerki K, Pircher H, Ohashi CT, Odermatt B, et al. Ablation of "tolerance" and induction of diabetes by virus infection in viral antigen ransgenic mice. Cell 1991;65:305-317. [ Links ]
7. Parijs LV, Abbas AK. Homeostasis and self-tolerance in the immune system: Turning lymphocytes off . Science 1998;280:243-249. [ Links ]
8. Dupont B The HLA system: An introduction. In: Lee J, editor. The HLA system: A new approach . USA: Springer-Verlag; 1995. p. 3-5. [ Links ]
9. MHC sequencing consortium. Complete sequence and gene map of a human major histocompatibility complex (MHC). Nature 1999;401:921-923. [ Links ]
10. Beck S, Trowsdale J. The human major histocompatibility complex: Lessons from the DNA sequence. Annu Rev Genomics Hum Genet 2000;01:117-137. [ Links ]
11. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al Nomenclature for factors of the HLA system, 2002. Tissue Antigens 2002 ;60: 407-464. [ Links ]
12. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2002. Eur J Immunogenetics 2002; 29:463-515. [ Links ]
13. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2002. Hum Immunol 2002; 63: 1213-1268. [ Links ]
14. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2000. Tissue Antigens 2001 ;57: 236-283. [ Links ]
15. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2000. Eur J Immunogenetics 2001 ;28:377-424.
16. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2000. Hum Immunol 2001 ;62:419-468.
17. Gebe JA, Swanson E, Kwok WW. HLA class II peptide-binding and autoimmunity . Tissue Antigens 2002;59:78-87. [ Links ]
18. Todd JA, Farral M. Panning for the gold: genome wide scanning linkage in type 1 diabetes. Hum Mol Genet 1996;5:1443-1448. [ Links ]
19. Undlien DE, Lie BA, Thorsby E. HLA complex genes in type 1 diabetes and other autoimmune diseases. Which genes are involved? Trends Genet 2001;17:93-100. [ Links ]
20. Lie BA, Todd JA, Pociot F, Nerup J, Akselsen HE, Joner G, et al The predisposition to type 1 diabetes linked to the human leukocyte antigen complex includes at east one non-class II gene. Am J Hum Genet 1999;64:793-800. [ Links ]
21. Sonderstrup G, McDevitt HO DR, DQ, and you: MHC alleles and autoimmunity . J Clin Invest 2001;107:795-796. [ Links ]
22. Turesson C. Endothelial expression of MHC class II molecules in autoimmune disease . Curr Pharm Des 2004;10:129-143. [ Links ]
23. Stewart CA, Horton R, Allcock RJ, Ashurst JL, Atrazhev AM, Coggill P, et al. Complete MHC haplotype sequencing for common disease gene mapping. Genome Res 2004;14:1176-1187. [ Links ]
24. Tait BD, Colman PG, Morahan G, Marchinovska L, Dore E, Gellert S, et al. HLA genes associated with autoimmunity and progression to disease in type 1 diabetes . Tissue Antigens 2003;61:146-153. [ Links ]
25. Taneja V, Griffiths MM, Luthra H, David CS. Modulation of HLA-DO-restricted-colagen induced arthritis by HLA-DRB1 polymorphism. Int Immunol 1998;10: 1449-1457. [ Links ]
26. Das P. Complementation between specific HLA-DR and HLA-DQ genes in transgenic mice determines susceptibility to experimental autoimmune encephalomyelitis . Hum Immunol 2000;61:279-289. [ Links ]
27. Abraham RS, Kudva YC, Wilson SB, Strominger JL, David CS. Coexpression of spontaneous insulitis and loss of tolerance to GAD65 in transgenic mice . Diabetes 2000;49:548-554. [ Links ]
28. Wong FS, Wen L The study of HLA class II and autoimmune diabetes. Curr Mol Med 2003;3:1-15. [ Links ]
29. Lie BA, Ronningen KS, Akselsen HE, Thorsby E, Undlien DE. Application and interpretation of transmission/disequilibrium tests: transmission of HLA-DQ haplotypes to unaffected siblings in 526 families with type 1 diabetes . Am Hum Genet 2000;66:740-743. [ Links ]
30. Redondo MJ, Kawasaki E, Mulgrew CL, Noble JA, Erlich HA, Freed BM, et al DR-and DQ-associated protection from type 1A diabetes: Comparison of DRB1*1401 and DQA1*0102-DQB1*0602*. JCE & M 2000;85:3793-3797. [ Links ]
31. Johansson S, Lie BA, Todd JA, Pociot F, Nerup J, Cambon-Thomsen A, et al. Evidence of at least two type 1 diabetes susceptibility genes in the HLA complex distinct from HLA-DQB1, -DQA1 and -ARB1. Genes Immun 2003;4:46-53. [ Links ]
32. Johansson S, Lie Ba, Pociot F, Nerup J, Cambon-Thomsen A, Kockum I, et al. HLA associations in type 1 diabetes: DPB1 alleles may act as markers of other HLA-complex susceptibility genes. Tissue Antigens 2003;61:344-351. [ Links ]
33. Wucherpfennig KW. Structural basis of molecular mimicry. J Autoimmun 2001;16:293-302. [ Links ]
34. Massa M, Mazzoli F, Pignatti P, de Benedetti F, Passalia M, Viola S, et al. Proinflammatory responses to self HLA epitopes are triggered by molecular mimicry to Epstein-Barr virus proteins in oligoarticular juvenile idiopathic arthritis. Arthritis Rheum 2002;46:2721-2729. [ Links ]
35. Fourneau JM, Bach JM, van Endert PM, Bach JF. The elusive case for a role of mimicry in autoimmune diseases. Mol Immunol 2004;40:1095-1102. [ Links ]
36. Vogel A, Manns MP, Strassburg CP. Autoimmunity and viruses. Clin Liver Dis 2002;6:451-465. [ Links ]
37. Pender MP. Infection of autoreactive B lymphocytes with EBV, causing chronic autoimmune diseases. Trends Immunol 2003;24:584-588. [ Links ]
38. Urnovitz HB, Murphy WH. Human endogenous retroviruses: natural, occurrence and clinical implications in human diseases. Clin Microbiol Rev 1996;1:72-99. [ Links ]
39. Osmola A, Namysl J, Jagodzinski PP, Prokop J. Genetic background of cutaneous forms of lupus erythematosus: update on current evidence. J Appl Genet 2004;45:77-86. [ Links ]














