Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto Nacional de Enfermedades Respiratorias
versión impresa ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.17 no.1 México mar. 2004
Rev Inst Nal Enf Resp Méx 2004; Vol. 17(1):15-21
ARTÍCULO ORIGINAL
RESULTADOS DE TRATAMIENTO DE TUBERCULOSIS RESISTENTE EN 91 PACIENTES DEL INSTITUTO NACIONAL DE ENFERMEDADES RESPIRATORIAS: 2001-2003
MIGUEL ÁNGEL SALAZAR LEZAMA
ALFREDO TORRES CRUZ
RAFAEL RICARDO VALDEZ VÁZQUEZ
ENRIQUE LÓPEZ SEGUNDO
Servicio Clínico de Tuberculosis Pulmonar, INER
HÉCTOR VILLARREAL VELARDE
Servicio Clínico de Tuberculosis Pulmonar, INER. Subdirector Médico, INER.
FRANCISCO QUIÑÓNEZ FALCONI
Laboratorio de Microbiología Médica, INER.
RENATA BÁEZ SALDAÑA
Servicio Clínico de Tuberculosis Pulmonar, INER. Departamento de Postgrado, INER.
Correspondencia:
Dr. Miguel Ángel Salazar Lezama,
Jefe del Servicio de Tuberculosis Pulmonar. Instituto Nacional de Enfermedades Respiratorias.
Calzada de Tlalpan 4502, colonia Sección XVI. México, D.F.
14080. Tel/Fax (55) 5666-4539, extensión 130.
Email: miguels1@prodigy.net.mx
Trabajo recibido: 01-III-2004;
Aceptado: 24-III-2004
RESUMEN
Introducción: La tuberculosis persiste como un problema mundial de salud pública. Aliviar la enfermedad, el sufrimiento y la muerte de los individuos causados por la tuberculosis es la principal inquietud humanitaria y requiere un enfoque de responsabilidad política social y económica centrado en el paciente para el control de esta enfermedad.
Material y métodos: Se revisaron los expedientes de 91 pacientes con diagnóstico de tuberculosis farmacorresistente que fueron referidos al Instituto Nacional de Enfermedades Respiratorias por los servicios de salud de los distintos estados del país y del Distrito Federal. Los casos fueron clasificados al final, acorde con los criterios establecidos por la Organización Mundial de la Salud.
Resultados: En el Grupo 1 el éxito fue del 63%, en el Grupo 2 del 100% y en el Grupo 3 del 41.8%. En el total de los tres grupos la tasa de éxito fue del 49%. Al hacer el análisis de estado por estado, los resultados menos favorables fueron Morelos con 0%, Puebla 25%, México 38%, y Distrito Federal 58% (7 de 12). Los mejores resultados obtenidos fueron en Veracruz con 77%, Guerrero con 75%, y Chiapas con 71%. Lo que hace evidente que la distancia no fue un factor de riesgo para el fracaso del tratamiento.
Conclusiones: Los bajos resultados del estudio obligan a pensar que la prioridad es prevenir la aparición de casos multifarmacorresistentes al asegurar mejores tasas de curación, y reducir la diseminación de la enfermedad al tratar en forma eficiente a todos los casos nuevos.
PALABRAS CLAVE: Tuberculosis resistente a múltiples fármacos, quimioterapia, fracaso, farmacorresistencia.
ABSTRACT
Background: Tuberculosis (TB) persists as a public health world-wide problem. The principal human concern is to cure, relieve the suffering and reduce the mortality caused by this disease. A serious problem is the increasing prevalence of multidrug-resistant tuberculosis which contributes to the failure to erradicate TB. This requires an approach based on political, social and economic responsibility focused on the patient for TB control.
Methods: We analyzed ninety-one files of patients with multidrug-resistant tuberculosis that were referred to the Institute by health services of different states and Mexico City. The cases were classified according to the criteria established by the World Health Organization (WHO).
Results: In Group 1, the success rate was 63%, in Group 2 was 100% and in Group 3 was 41.8%. In the three groups the rate of success was 49%. After analyzing data by state, the worst results were from Morelos with 0%, Puebla 25%, Mexico state 38% and Mexico City with 58% (7 of 12). The best results were from Veracruz with 77%, Guerrero 75% and Chiapas 71%. This makes evident that the distance from the reference center is not a risk factor for treatment failure.
Conclusions: It is imperative to prevent new cases of multidrug-resistant tuberculosis by increasing the rate of cure and to reduce the dissemination of the disease by efficiently treating all new cases.
KEY WORDS: MDR-TB, chemotherapy, failure, drug-resistance.
INTRODUCCIÓN
La tuberculosis (TB) persiste como un problema mundial de salud pública de grave magnitud que requiere de atención urgente. Aliviar la enfermedad, el sufrimiento y la muerte de los individuos causados por la TB es la principal inquietud humanitaria y requiere un enfoque centrado en el paciente para el control de la TB.
La persistencia de la enfermedad se ha debido principalmente a los programas de control descuidados y mal administrados, la pobreza, el crecimiento de la población y la migración, así como un aumento significativo de los casos de TB en zonas endémicas del virus de la inmunodeficiencia humana.
Lo anterior ha dado como resultado que un tercio de la población mundial esté ya infectada por el Mycobacterium tuberculosis . Cada año 8.4 millones de nuevos casos se producen de este reservorio de infectados, 1.9 millones de personas mueren de la enfermedad. Los pobres y marginados en el mundo en desarrollo son los más afectados: 95% de todos los casos y un 98% de defunciones por TB ocurren en los países de escasos recursos.
En 1994, la Organización Mundial de la Salud (OMS), y la Unión Internacional de Lucha contra la Tuberculosis y Enfermedades Respiratorias (UICTER) se combinaron para llevar a cabo una vigilancia global de resistencias a fármacos de primera línea 1 . La resistencia a múltiples fármacos (definida como resistencia simultánea a isoniacida y rifampicina (TBRMF)), fue encontrada en los 35 países. Áreas con muy alta prevalencia de TBRMF _también llamados "focos calientes"_ fueron identificadas en Europa del este (Estonia, Lituania y Rusia), así como en Argentina, China, República Dominicana y Costa de Marfil. Posteriormente, en el año 2000 2 , la vigilancia se extendió a 72 países, y era más extenso de lo que se había pensado anteriormente, con prevalencias alarmantes de TBRMF en la provincia de Henan (35%), en China, Ivanovo Oblast (32.4%), en Rusia y Lituania (29%), aunque Estonia, por el tamaño de su población, tiene el mayor problema con una prevalencia del 8.5%.
Por estas razones, existe preocupación mundial por tratar a los pacientes con TBRMF, ya que a pesar de establecer un estricto control en el tratamiento, pueden presentarse fracasos a éste. Y aunque el problema es lo suficientemente obvio, la solución está bastante lejos de ser óptima. En Inglaterra, por ejemplo, curar a un paciente con TBRMF puede costar hasta US $100,000.00 3 . Mucho interés ha despertado la llamada estrategia Tratamiento Acortado Estrictamente Supervisado-plus (TAES-plus o DOTS-plus, por sus siglas en inglés) la cual, aunque efectiva, es muy costosa y en muchos países del mundo su implementación requiere de grandes recursos 4.
En México se registran anualmente entre 15 y 16,000 casos nuevos al año, con casi 2,400 muertes en el mismo período, con una prevalencia de multifarmacorresistencia del 2.9% (390 casos, datos de la Dirección General de Epidemiología). En nuestro país se lleva a cabo la estrategia del Tratamiento Acortado Estrictamente Supervisado (TAES o DOTS, por sus siglas en inglés) que comprende, entre otras acciones, la de otorgar tratamiento diariamente a todos los casos nuevos en el centro de salud más cercano a su domicilio lo que asegurará que se curen, al menos en el 85% de los casos; sin embargo, los casos resistentes pueden disminuir esta tasa debido a que frecuentemente fracasan al tratamiento con fármacos de primera línea.
El Instituto Nacional de Enfermedades Respiratorias (INER), ha apoyado a los distintos estados del país con fármacos de segunda línea para el tratamiento de los pacientes con TBRMF que son referidos desde esas entidades. En este trabajo se analiza el éxito del tratamiento desde 2001 a la fecha, en 91 pacientes ambulatorios de toda la República.
MATERIAL Y MÉTODOS
Se revisaron expedientes de 91 pacientes con diagnóstico de TB farmacorresistente que fueron referidos al INER por los servicios de salud de los estados del país y del Distrito Federal, según registros del Departamento de Epidemiología Clínica del Instituto del 2000 al 2003. Doce fueron excluidos por no iniciar tratamiento o por un registro equivocado. Se tomaron los datos demográficos, resultados de cultivo, pruebas de susceptibilidad, fármacos tomados, tiempo de tratamiento y resultado final del mismo. Los casos fueron clasificados al final acorde con los criterios establecidos por la OMS, como sigue: curación; cuando el paciente presentaba cultivo en expectoración negativo, tratamiento terminado; por presentar baciloscopia negativa y mejoría clínica, fracaso; con baciloscopia y/o cultivo persistentemente positivos durante el tratamiento (al menos 12 meses) y abandono o pérdida de seguimiento cuando el paciente no se presentó después de la segunda o subsecuentes citas.
El tratamiento administrado fue categorizado acorde con las guías de la OMS 5 como: 1) retratamiento de primera línea estandarizado (dos meses de isoniacida (I), rifampicina (R), pirazinamida (Z), etambutol (E) y estreptomicina (S), seguido de un mes con I, R, Z y E y cinco meses con I, R, E, tres veces por semana); 2) retratamiento estandarizado de segunda línea (tres meses con ciprofloxacino (Cx), pirazinamida (Z), protionamida (Pt) y kanamicina (K), seguido de 18 meses de Cx, Z y Pt), y 3) tratamiento individualizado con otros fármacos de segunda línea.
RESULTADOS
Al final se incluyeron 79 expedientes; 25 de mujeres, con media de edad 50.64 (intervalo mínimo, máximo 23 a 96) y 54 de hombres, con una media de edad de 45.85 (intervalo mínimo, máximo 17 a 82). La media de edad de la población en total fue 47.35 (intervalo mínimo, máximo 17 a 96). Los pacientes fueron referidos de 18 diferentes estados de la República; los de México, Distrito Federal y Veracruz con 18, 12 y 9 casos, respectivamente, significaron el 48% del total. En 49 de los 80 (61%) se realizó cultivo y pruebas de susceptibilidad; todos fueron positivos a Mycobacterium tuberculosis. Las resistencias más frecuentes encontradas fueron a isoniacida más rifampicina, en 32% de los casos (16/49), y a isoniacida, rifampicina, etambutol y estreptomicina, en 20% de los casos (10/49), (Tabla I).

Tabla I. Patrones de resistencia en 49 aislados.
Resultados de tratamiento
Los pacientes fueron divididos acorde con el esquema de tratamiento al cual fueron asignados por el médico tratante: en el grupo del retratamiento estandarizado con fármacos de primera línea (Grupo 1), hubo 22 pacientes que significaron el 27.8% del total; en el Grupo 2 retratamiento estandarizado de segunda línea 2 (2.5%), y en el individualizado (Grupo 3), 55 (69.9%). Los fármacos utilizados fueron: isoniacida, rifampicina, etambutol, pirazinamida, estreptomicina, ciprofloxacino, protionamida, tiacetazona, amikacina, kanamicina, diaminodifenilsulfona (DDS) y roxitromicina. En todos los pacientes el tratamiento fue autoadministrado, con una carta de referencia del lugar de origen y el régimen de retratamiento sugerido. Los resultados del tratamiento fueron como sigue acorde con cada grupo: en el retratamiento de primera línea hubo 1 fracaso, 14 curados (tomados como curación más tratamiento terminado) y 7 abandonos; en el retratamiento estandarizado de segunda línea los 2 pacientes fueron curados. En el grupo de retratamiento individualizado el éxito fue como sigue: 19 fueron fracaso al tratamiento, 23 se curaron y 13 lo abandonaron.
En el Grupo 1 el éxito fue del 63%, en el Grupo 2 del 100% y en el Grupo 3 del 41.8%. En el total de los tres grupos la tasa de éxito fue del 49% (Tabla II).
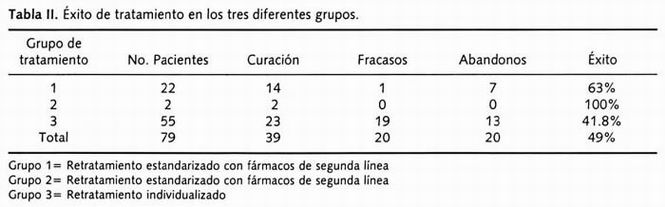
Tabla II. Éxito de tratamiento en los tres diferentes grupos.
Al hacer el análisis estado por estado, se encontró que los peores resultados presentados fueron: Morelos con 0% (ninguno de 3), Puebla 25% (2 de 8), México, con éxito del 38% (7 de 18 pacientes) y Distrito Federal 58% (7 de 12). Los mejores resultados obtenidos fueron en Veracruz con 77% (7 de 9), Guerrero con 75% (3 de 4) y Chiapas con 71% (5 de 7). Lo que hace evidente que la distancia no fue un factor de riesgo para el fracaso del tratamiento (Tabla III).

Tabla III. Éxito de tratamiento en pacientes referidos
de los diferentes estados de la república
DISCUSIÓN
Los bajos resultados del presente trabajo retrospectivo de pacientes que acuden al INER, referidos por los estados a retratamiento nos dan información que llama a sugerir el reforzamiento de las acciones de las autoridades del Sector Salud en el control de la enfermedad.
México está considerado como un país de prevalencia media de TB, con un poco más de 15,000 casos nuevos de TB pulmonar, con una tasa descendente de morbimortalidad a partir de 1997 (datos de la Dirección General de Epidemiología); sin embargo, los datos no concuerdan con aquéllos reportados por la OMS, en donde el subregistro puede llegar hasta el 40%, cuestión que ya ha sido analizada por Báez y colaboradores 6 , elevando esta cantidad en forma considerable. Granich y colaboradores 7 , en 1997 reportaron una multifarmacorresistencia primaria en tres estados de la República del 2.4%, lo que supondría un problema no grave en nuestro país, pero también existe un subregistro de éstos, lo que obliga a poner atención, ya que la TB resistente a múltiples fármacos puede disminuir el éxito de tratamiento en los casos nunca tratados, tal como ha sido reportado por García y colaboradores 8 y otros 9,10 . Es de llamar la atención que 14 de los 79 casos diagnosticados como "multifármacos resistentes" (17%), se curaron con el esquema de cinco fármacos de primera línea, lo que traduce una falla de los programas de control regionales al diagnosticar a pacientes como resistentes, cuando el problema es de notificación de casos entre jurisdicciones, es decir, el paciente se mueve entre una y otra; de hecho, 6 de los 49 cultivos realizados con pruebas de susceptibilidad, tenían monorresistencia.
El tratamiento estandarizado con fármacos de segunda línea fue efectivo en los dos casos que se utilizó; éste, aunque controversial, ha mostrado ser efectivo, sobre todo cuando ha sido utilizado en condiciones de programa 11.
Otra circunstancia observada fue la administración de fármacos de segunda línea en pacientes dentro del Grupo 3 (individualizado) que recibieron medicamentos con poca o nula actividad demostrada en ensayos clínicos para la enfermedad, tal como son la diaminodifenilsulfona y la roxitromicina, además de la clofacimina que, aunque recomendada en algunos esquemas de retratamiento por la OMS 12 , es sabido que su actividad es más bien contra M. leprae, un problema frecuentemente encontrado, ya que los estados no cuentan con fármacos de segunda línea, por lo que tiene que solicitarlos al INER quien sólo cuenta con la protionamida como único antituberculoso de segunda línea efectivo.
Analizando estado por estado, tal como ya fue referido, los resultados del tratamiento no fueron influenciados por las distancias. Los estados con mejores resultados de tratamiento parecen ser que tienen mejor programa de control que el Estado de México, Morelos, Puebla y el Distrito Federal.
En México, el diagnóstico y tratamiento de los casos nunca tratados de TB son siempre gratuitos y descentralizados e integrados a los servicios de salud, pero no hay muchos especialistas en tratar casos resistentes, además de agregar que cada estado decide el presupuesto asignado para el Programa de Control, y no cuentan con fármacos de segunda línea. Como consecuencia, al apoyar el INER con medicamentos a los servicios de salud, queda en la imposibilidad de ejercer la estrategia TAES-plus, estrategia lanzada por la OMS desde 1998 13,14.
El 49% de respuesta favorable en esta cohorte es menor que en Corea 15 , Turquía 16 y Perú 17 . Es aún menor que el reportado en Denver 18 (56%). Dos de las principales causas de los bajos resultados fue la falta de prescripción de fármacos activos contra la TB, ya que en muchos de los casos se agregaban fármacos de escasa o nula actividad tal como DDS y roxitromicina; la otra fue la pérdida de seguimiento en 20 de los casos (28%).
Los países desarrollados o aquéllos en vías en desarrollo, como es el caso de Perú, con mucho apoyo de Organizaciones no Gubernamentales, muestran tratamientos efectivos, aunque caros y largos, lo que podría distraer presupuestos para tratar los casos nuevos.
¿Qué hacer entonces? Farmer y colaboradores 19 establecen "la misión es curar la TB sin importar el patrón de resistencia" y argumentan que todos los pacientes deben de ser tratados con cultivo y pruebas de susceptibilidad previos, sin importar el costo para mejorar la salud pública. Lo anterior es plausible, pero todos sabemos que los recursos son finitos, sobre todo en países en vías de desarrollo, con una alta carga de casos nuevos y presupuestos recortados. De tal manera que, desde el punto de vista epidemiológico y económico, ha sido demostrado que la estrategia con mejor costo-beneficio es la estrategia definida por la OMS 20 como TAES, que consiste en dar tratamientos estándar para aquellos pacientes nunca tratados, y que se basa en cinco componentes: 1) compromiso del gobierno, 2) suministro regular de medicamentos de alta calidad, 3) captación pasiva de casos nuevos basado en microscopia de esputo, 4) notificación y registro de casos, y 5) supervisión directa del tratamiento. Así, un modelo matemático elaborado por Dye y Williams 21 sugiere que una buena práctica del tratamiento acortado puede prevenir la aparición de multifarmacorresistencia, aunque existan cepas resistentes a isoniacida y rifampicina. El mismo modelo, sin embargo, muestra que el tratamiento estándar no contendrá a la mutifarmacorresistencia, una vez que ésta se ha elevado, a menos que sean detectados el 70% de los casos nuevos, y curado al 80% de los mismos.
CONCLUSIONES
Establecer tratamientos estandarizados puede ser una estrategia efectiva en el control de la enfermedad.
La estrategia TAES-plus debe de ser únicamente establecida en regiones donde haya un TAES verdaderamente efectivo. Por otra parte ¿se deben de efectuar pruebas de susceptibilidad a todos los aislados iniciales de M. tuberculosis? La respuesta pudiera ser que sí, si dos limitaciones son superadas: 1) la escasez de especialistas y si se conforma un equipo de expertos que analicen esos casos, y 2) disminuir los altos costos que significan las pruebas de susceptibilidad a fármacos de primera y segunda línea en laboratorios confiables con alto control de calidad. Además, es necesario establecer protocolos de retratamiento, tal como lo ha propuesto la OMS 12.
No debemos olvidar que la prioridad es prevenir la aparición de casos multifarmacorresistentes al asegurar mejores tasas de curación y reducir la diseminación de la enfermedad al tratar en forma eficiente a todos los casos nuevos.
La estrategia TAES-plus es necesaria, pero quizá tengamos que esperar hasta contar con fármacos de segunda línea efectivos; de no ser así, el "fenómeno de amplificación" se aplicará hasta éstos. Hay que asegurarse que se tengan la totalidad de los medicamentos para iniciar el tratamiento, ya que darlo en forma parcial aumenta el riesgo de resistencias amplificadas. Y tal como escribe Enarson 22 : "Tú no puedes curar la tuberculosis resistente a múltiples fármacos tan rápido como la causas".
REFERENCIAS
1. Anti-tuberculosis Drug Resistance in the World. The WHO/IUATLD Global Project on Anti-tuberculosis Drug Resistance Surveillance 1994-1997. WHO/TB/97.229. [ Links ]
2. Espinal MA, Laszlo A, Simonsen L, Boulahbal F, Jae KS, Reniero A, et al. Goblal Trenes in Resistance to Antituberculosis Drugs. N Engl J Med 2001;344:1294-1303. [ Links ]
3. White VL, Moore-Gillon. Resource Implications of Patients with Multidrug-resistant Tuberculosis. Thorax 2000;55:962-963. [ Links ]
4. Zumia A, Grange JM. Multidrug-resistant Tuberculosis can the Tide be Turned? Lancet Infect Dis 2001;1:199-202. [ Links ]
5. World Health Organization. Treatment of Tuberculosis: Guidelines for National Programmes. World Health Organization-Geneva, 2003. [ Links ]
6. Báez SR, Pérez PR, Salazar LM. Discrepancias entre los datos ofrecidos por la Secretaría de Salud y la Organización Mundial de la Salud sobre tuberculosis en México, 1981-1998. Salud Publica Mex 2003;45:78-83. [ Links ]
7. Grancih RM, Balandrano S, Santaella AJ, Binkin NJ, Castro KG, Márquez-Fiol A, et al. Survey of Drug Resistance of Mycobacterium tuberculosis in 3 Mexican States, 1997. Arch Intern Med 2000;160:639-644. [ Links ]
8. García-García ML, Ponce de León A, Jiménez-Corona E, Jiménez-Corona A, Palacios-Martínez M, Balandrano-Campos S, et al. Clinical Consequences and Transmissibility of Drug-resistant Tuberculosis in Southern Mexico. Arch Intern Med 2000;160:630-636. [ Links ]
9. Espinal MA, Kim SJ, Suárez PG, Kam KM, Khomenko AG, Migliori GB, et al. Standard Short Course Chemotherapy for Drug Resistant Tuberculosis. Treatment Outcomes in 6 Countries. JAMA 2000;283:2968-2974. [ Links ]
10. Bastian I, Rigouts L, van Deun A, Portaels F. Directly Observed Treatment, Short-course Strategy and Multidrug-resistant Tuberculosis: are any Modifications Required? Bull World Health Organ 2000;78:238-251. [ Links ]
11. Suárez PG, Floyd K, Portocarrero J, Alarcón E, Rapiti E, Ramos G, et al. Feasibility and Cost-effectiveness of Standardized Second line Drug Treatment for Chronic Tuberculosis Patients: a National Cohort Study in Peru. Lancet 2002;359:1980-1989. [ Links ]
12. Guidelines for Establishing DOTS-Plus Pilot Projects for the Management of Multidrug-resistant Tuberculosis (MDR-TB). World Health Organization. WHO/CDS/TB/2000. [ Links ]
13. Farmer PE, Kim JY. Community-based Approaches to the Control of Multi-drug-resistant Tuberculosis: Introducing "DOTS-plus". Brit Med J 1998;317:671-674. [ Links ]
14. Iseman MD. MDR-TB and the Developing World- a Problem no Longer to be Ignored: the WHO Announces "DOTS Plus" Strategy. Int J Tuberc Lung Dis 1998;2:867. [ Links ]
15. Park SK, Kim CT, Song SD. Outcome of Chemotherapy in 107 Patients with Pulmonary Tuberculosis Resistant to Isoniazid and Rifampin. Int J Tuberc Lung Dis 1988;2:877-884. [ Links ]
16. Tahaoglu K, Torun T, Sevim T, Güliz KA, Karasulu L, Ozmen KN. The Treatment of Multidrug-resistant Tuberculosis in Turkey. N Engl J Med 2001;345:170-174. [ Links ]
17. Mitnick C, Bayona J, Palacios E, Shin S, Furin J, Alcántara F, et al. Community-based Therapy for Multidrug-resistant Tuberculosis in Lima, Peru. N Engl J Med 2003;348:119-128. [ Links ]
18. Goble M, Iseman MD, Madsen LA, Waite D, Ackerson L, Horsburgh R. Treatment of 171 Patients with Pulmonary Tuberculosis Resistant to Isoniazid and Rifampin. N Engl J Med 1993;328:527-532. [ Links ]
19. Farmer P, Bayona M, Becerra M, Furin J, Henry C, Hiatt J, et al. The Dilemma of MDR-TB in the Global Era. Int J Tuberc Lung Dis 1998;2:869-876. [ Links ]
20. What is DOTS? A Guide to Understanding the WHO-recommended TB Control Strategy Known as DOTS. 1999. WHO/CDS/CPC/TB99.270. [ Links ]
21. Dye C, Williams BG. Criteria for the Control of Drug-resistant Tuberculosis. Proc Natl Acad Sci USA 2000;97:8180-8185. [ Links ]
22. Enarson DA. Resistance to Antituberculosis Medications. Hard Lessons to Learn. Arch Intern Med 2000;160: 581-582. [ Links ]














