INTRODUCCIÓN
Las abejas melíferas (Apis sp.) son un género de insectos de la familia Apidae: Hymenoptera, integrada por aproximadamente 6000 especies. En este género se encuentran algunas de las especies más valiosas del planeta, pues intervienen en la polinización de al menos un cuarto de millón de especies vegetales de importancia ambiental, social y agrícola. El 75 % de los cultivos alimenticios del mundo depende, al menos parcialmente, de la zoopolinización (ONU, 2021).
Los himenópteros forman parte de un extenso grupo de especies con amenaza de extinción. Existen evidencias de que la actividad humana es responsable de ésto y, en parte, la propia agricultura co-dependiente de las mismas. Una de las causas de pérdida de abejas es la aplicación de agroquímicos para el control de plagas agrícolas, entre los cuales, el grupo de los neonicotinoides representa una amenaza para las abejas (Gill et al., 2012).
La humanidad debe convivir con diversos factores del ambiente, conservar y ampliar áreas naturales y valorar de manera conveniente a las demás especies que conforman los ecosistemas, abejas incluidas, con el fin de evitar la extinción de éstas. Por lo anterior, surge la necesidad de impulsar investigaciones que se enfoquen en evitar o reducir la muerte de las abejas, una de los cuales es Apis mellifera L. Algunas de las amenazas más importantes que encara esta especie son la presencia de enfermedades causadas por hongos, ácaros y otros parásitos (Moritz et al., 2010), pérdida de hábitat y recursos florales (Foley et al., 2005), y la exposición a plaguicidas que merman sus poblaciones, interfieren con la obtención de su alimento y contaminan sus panales (Blacquière et al., 2012;Fischer et al., 2014;Henry et al., 2012).
Uno de los insecticidas que con frecuencia se utilizan en los sistemas convencionales de producción agrícola es el imidacloprid, que pertenece al grupo de los neonicotinoides (Cresswell, 2011); éstos actúan sobre el sistema nervioso de los insectos al unirse al sitio receptor de la acetilcolina, principal neurotransmisor en el sistema nervioso central del insecto, lo que provoca hiperexcitación, letargia y parálisis (IRAC, 2021). Este insecticida se usa en diversas áreas del ámbito agrícola.
El imidacloprid, pese a sus virtudes como plaguicida, es tóxico para las abejas y otros insectos benéficos (Arena y Sgolastra, 2014; Whitehorn et al., 2012), pues disminuye las poblaciones de crianza y silvestres, sea por contacto directo o por ingesta del mismo. El polen de plantas tratadas con este insecticida, que las abejas transportan y procesan para elaborar su alimento, resulta contaminado con el ingrediente activo y sus propiedades sistémicas y residuales deterioran la función cerebral del insecto, efecto que es acumulativo (Gill et al., 2012).
Por el riesgo que representa este tipo de insecticidas para las abejas y la producción de miel para consumo humano, la Autoridad Europea de Seguridad Alimentaria (EFSA) declaró en el año 2013 a tres insecticidas neonicotinoides (imidacloprid, tiametoxam y clotianidina) como “un riesgo agudo elevado para [la sobrevivencia de] las abejas…” (DOUE, 2013); además, hay evidencia de que el uso de insecticidas, entre ellos los neonicotinoides y organofosforados, en los cultivos forma parte de los factores que han causado la pérdida de colonias de abejas en varias regiones agrícolas de importancia apícola, en especial en aquellas del norte de México (SENASICA-UNAM, 2018).
Los coadyuvantes agrícolas, como el DAP Plus® (acidificante, regulador de pH orgánico al 32%, polialcoholes, y glicoles al 38%; en lo sucesivo DAP), se adicionan a la aplicación de agroquímicos, tanto para mejorar su actividad como para facilitar su aplicación. Existen escasos registros de investigaciones relacionadas con la aplicación de agroquímicos en polinizadores que incluyan coadyuvantes. Mayer et al. (1998) y Mayer y Lunden (1999) mencionaron que la adición de un coadyuvante en aerosoles insecticidas generó resultados variables, según el coadyuvante y las especies de abejas. No se conocen investigaciones que incluyan un coadyuvante con imidacloprid en estudios de toxicidad ni de dosis letal media.
La dosis letal media (DL50) es la cantidad de una sustancia que mata al 50 % de individuos después de un tiempo determinado (IUPAC, 1997). Este valor permite identificar los grados de tolerancia/susceptibilidad de una población a esa substancia. La DL50 suele calcularse, según el objetivo del estudio, plaguicida, método de aplicación, vía de administración y dosis, después de algunos minutos o 12, 24, 48 o 72 h después de la aplicación; el lapso queda a criterio de cada investigador (Mayer y Lunden, 1999; Medrzycki et al., 2013).
Tomando como base la variación entre colonias en el apiario experimental del PREGEP-Genética del Colegio de Posgraduados, los objetivos de la presente investigación fueron: 1) detectar la DL50 de diversas colonias (genotipos) y medir la influencia de un coadyuvante en la mortalidad, 2) corroborar que la dosis mínima en campo de Confidor® 350SC (1.0 mL L-1), recomendada por el fabricante, es letal para la abeja melífera, y 3) identificar los lapsos apropiados de evaluación de la DL50 para detectar diferencias entre colonias.
Se espera encontrar al menos una colonia que muestre un grado considerable de tolerancia al insecticida, corroborar la mortalidad de aquellas abejas expuestas a la dosis de insecticida recomendada por el fabricante, determinar una dosis del insecticida y un lapso de tiempo de exposición óptimos, que permitan observar diferencias en la sobrevivencia de las abejas, y evaluar el grado en que un coadyuvante influye sobre la mortalidad de éstas.
MATERIALES Y MÉTODOS
Sitio de estudio
El estudio se realizó entre julio y septiembre del año 2020 en la unidad de manejo apícola experimental del Colegio de Postgraduados, ubicado en Montecillo, Estado de México (19° 27´ 18” N y 98° 54´ 26” O), cuya temperatura media anual es 15.4 ºC y precipitación media anual de 811 mm; altitud de 2250 msnm; prevalece un clima templado subhúmedo con lluvias en verano (Climatedata.org, 2022; García, 2004).
Selección de colonias e incubación de abejas
Se seleccionaron al azar siete colonias de abejas euroafricanas (Pérez-Sato y Cervantes-Santana, 2001; Urbina-Romero et al., 2019) dentro del apiario experimental del PREGEP-Genética del Colegio de Postgraduados en Montecillo, Texcoco, Estado de México, identificadas con los números 016, 023, 036, 054, 083, 103 y 119. Las características de cada colonia fueron las siguientes: reina joven y sana, con rasgos genotípicos y fenotípicos deseables, colonia fuerte, con buenos hábitos de higiene, sin signos de loque americana (Paenibacillus sp.) o europea (Melissococcus sp.), bastidores con suficiente cría operculada, próxima a emerger, cámaras de cría con provisión de polen y miel.
A fin de homogeneizar la edad de las abejas en el estudio, se colocó un panal por cada colonia con suficiente cría de abejas operculadas (pupas) próximas a nacer, en un portanúcleo de madera de pino con malla de metal (0.2 × 0.2 mm) dentro de una incubadora refrigerada para pruebas de BOD (Thermo Scientific, Modelo Presicion, Wilmington, North Carolina, EUA) y se utilizó un termómetro de sonda (Ysi Tele-Thermometer, YSI Incorporated, Yellow Springs, Ohio, EUA) para medir la temperatura interna, la cual se mantuvo a 30 ± 3 ºC. Se usó un higrómetro digital (Extech Instruments, Nashua, New Hampshire, EUA) para mantener la humedad relativa dentro de la incubadora, y para mantenerla sobre el 50 % se colocó una bandeja con agua. De esta manera se proporcionaron la temperatura y humedad relativa que prevalecen al interior de una cámara de cría en campo, a fin de propiciar la emergencia uniforme de abejas adultas. Cada bastidor permaneció en la incubadora por tres días previos a cada experimento, las abejas emergieron dentro de este periodo de tiempo; es decir, tenían de cero a tres días de emergidas al momento de iniciar cada experimento.
Unidades experimentales y estudios preliminares
Cada unidad experimental (UE) consistió de 15 abejas de cada colonia en una cámara ventilada (jaula) hecha de un vaso de plástico de 30 mL, con perforaciones (60 agujeros de 4 mm de diámetro) con unión a una caja Petri de 100 × 15 mm por una liga de hule, semejante al diseño propuesto por Medrzycki et al. (2013), y un tubo Eppendorff de 2 mL perforado, lleno con jarabe de azúcar estándar (Figura 1).
Se condujeron cuatro ensayos preliminares para calibrar el proceso experimental; el primero, para determinar que las cámaras no fueran letales por sí mismas, se colocaron 15 abejas dentro de una cámara ventilada, cuyo diseño se describió en el párrafo anterior y se mantuvieron en observación durante 72 h con tres repeticiones; del segundo al cuarto ensayo, en cada uno se evaluaron tres dosis menores a 1.0 mL L-1 (dosis mínima recomendada por el fabricante con fines agrícolas en campo) con el objetivo de determinar las dosis apropiadas para calcular la DL50 y registrar la mortalidad durante 72 h después de la exposición de las abejas al insecticida. Las dosis del segundo ensayo fueron 1.00, 0.66 y 0.33 mL L-1, las del tercero 0.33, 0.22 y 0.11 mL L-1, y las del cuarto, 0.11, 0.066 y 0.033 mL L-1; cada ensayo incluyó un testigo sin insecticida.
Aplicación del insecticida
Se colocó el producto Confidor® en atomizadores calibrados con cinco dosis: 1.00, 0.066, 0.033, 0.011 y 0 mL L-1, con y sin el acidificante/coadyuvante DAP Plus®, por lo que se prepararon 10 soluciones. Se aplicó una solución por cámara, lo que generó 70 UE, testigos incluidos, en 10 tratamientos con aplicación de agroquímicos en siete colonias por repetición. Se contabilizó el número de abejas muertas post-aspersión al cabo de 21 lapsos: 5, 15 y 30 min, 1, 1.5, 2, 2.5, 3, 6, 9, 12, 18, 24, 30, 36, 42, 48, 54, 60, 66 y 72 h. En cada lapso se registró el comportamiento cualitativo de las abejas con base en las sugerencias de Medrzycki et al. (2013): sin efecto visible, con desorientación, espasmos, parálisis, otro, y combinaciones de estos efectos.
Diseño experimental y análisis estadístico
Se generaron 4410 unidades experimentales producto de la combinación factorial de siete genotipos (colonias), cinco dosis de insecticida, dos condiciones de acidificante/ coadyuvante, 21 lapsos de tiempos de lectura y tres repeticiones. Como algunas UE variaron ligeramente de 15 como número de individuos, se calculó la proporción del número de abejas muertas entre el número de abejas por cámara (M/C) a través del tiempo. Se realizó análisis de varianza mediante el procedimiento GLM, aplicando la transformación al arcoseno de la raíz de la relación M/C (arcsen
RESULTADOS Y DISCUSIÓN
De los ensayos preliminares, se concluye que las cámaras ventiladas no son letales para las abejas, pues no hubo efecto significativo en la mortalidad. El segundo ensayo preliminar permitió calibrar las dosis del insecticida que se utilizaron en la investigación. Todas las dosis que se probaron en estos ensayos previos fueron 100 % letales, pues ninguna abeja sobrevivió a las 72 h posteriores a la exposición, excepto en la dosis 0.033 mL L-1, donde se registró una sobrevivencia.
En el experimento formal que se estableció con siete colonias, cinco dosis del insecticida Confidor®, con y sin coadyuvante (DAP Plus®) en el que se tomaron lecturas sobre la mortalidad en varias ocasiones hasta las 72 h después de la aplicación, se detectaron diferencias significativas (P ≤ 0.01) entre colonias, entre dosis de insecticida y entre tiempos de lectura, así como significancia (P ≤ 0.01) para las interacciones para dos factores, excepto DAP × Tiempo; de las interacciones para tres factores, sólo hubo significancia para Colonias × DAP × Dosis (Cuadro 1).
Cuadro 1 Cuadrados medios del análisis de varianza para la mortalidad de abejas melíferas euroafricanas en la prueba de siete colonias, cinco dosis de insecticida Confidor® con y sin coadyuvante (DAP) con registros a diferentes tiempos.
| Fuentes de variación | GL | Cuadrados medios |
|---|---|---|
| Bloques | 2 | 8.798 *** |
| Colonias | 6 | 1.444 *** |
| DAP | 1 | 0.093 |
| Dosis | 4 | 45.554 *** |
| Tiempos | 20 | 47.493 *** |
| Colonias × DAP | 6 | 0.084 |
| Colonias × Dosis | 24 | 0.471 *** |
| Colonias × Tiempos | 120 | 0.070 *** |
| DAP × Dosis | 4 | 0.239 *** |
| DAP × Tiempos | 20 | 0.024 |
| Dosis × Tiempos | 80 | 1.372 *** |
| Colonias × DAP × Tiempos | 120 | 0.018 |
| Colonias × DAP × Dosis | 24 | 0.136 *** |
| Colonias × Dosis × Tiempos | 480 | 0.036 |
| DAP × Dosis × Tiempos | 80 | 0.021 |
| Error | 2954 | 0.045 |
***: significativos al 0.001, R2 = 0.91, C.V. = 33.58 %. Análisis aplicado sobre la transformación.
A continuación se presentan los resultados en promedios para cada fuente de variación de acuerdo con las significancias estadísticas observadas en el análisis de varianza.
Factores Simples
Colonias
En el Cuadro 2 se observa que la Colonia 1 (ID 54) presentó menor porcentaje promedio de mortalidad, lo cual se puede interpretar como mayor tolerancia al insecticida en comparación con las demás colonias evaluadas. Cada colonia está constituida por la descendencia de una reina fecundada por varios zánganos; la diferencia en comportamiento entre colonias corresponde a variación entre familias de medios hermanos maternos, lo cual se atribuye a efectos genéticos heredables (Márquez, 1992).
Cuadro 2 Porcentaje mortalidad de abejas en cada colonia, promedio de cuatro dosis, con y sin testigos, 21 lapsos de lectura, con y sin coadyuvante. Montecillo, Texcoco, Edo. Méx. 2020.
| Colonia | Media con testigos (%) | Media sin testigos (%) |
|---|---|---|
| 1 (ID 054) | 26.3 a | 32.6 a |
| 2 (ID 016) | 32.9 b | 37.4 b |
| 3 (ID 083) | 32.2 b | 40.6 b |
| 4 (ID 103) | 33.7 b | 41.0 b |
| 5 (ID 023) | 38.4 c | 44.3 c |
| 6 (ID 119) | 39.5 c | 45.3 c |
| 7 (ID 036) | 41.6 c | 47.8 c |
DSH con testigos = 3.7%, DSH sin testigos = 4.3%.
Se recomienda criar y seleccionar reinas de esta colonia u otras que se puedan detectar en estudios posteriores para transferir la característica deseada y seleccionar nuevamente con base en la tolerancia, a fin de obtener, al cabo de varias generaciones, colonias tolerantes al ingrediente activo probado en este estudio. Se plantea la hipótesis, además, que una colonia tolerante a imidacloprid podría ser tolerante a otros insecticidas del mismo grupo por efecto de resistencia cruzada (FAO, 2012); sin embargo, hacen falta más estudios para reforzar esta hipótesis. Las colonias 6 (ID 119) y 7 (ID 036) fueron las que presentaron menor tolerancia (Cuadro 2).
DAP
El uso de coadyuvante no presentó diferencias estadísticas en el porcentaje de abejas muertas (sin DAP 34.1 % vs. con DAP 35.4 %) ni hubo significancia considerando el factor simple (P > 0.05); por tanto, este estudio demuestra la escasa influencia del coadyuvante en la mortalidad de A. mellifera cuando se usa la substancia en cuestión, un aspecto poco explorado en este tipo de investigaciones.
Dosis
En el Cuadro 3 se observa que las abejas que recibieron la dosis mínima de Confidor® recomendada por el fabricante para controlar plagas en campo (1.0 mL L-1) murieron antes de las primeras 3 h después de la exposición; se demuestra la extrema mortalidad que provoca esta dosis en las abejas, lo que concuerda con lo encontrado por Eden (2020; Com. Pers.)1, quien al asperjar 0.3 g del i.a. mL-1 de Confidor® 350 SC observó 93.25 % de mortalidad después de 3 h de la exposición en prueba de contacto.
Cuadro 3 Porcentaje de mortalidad de abejas en promedio por dosis. Promedio de siete colonias, con y sin coadyuvante y a través de 21 tiempos de lectura. Montecillo, Texcoco, Estado de México, 2020.
| Dosis (mL L-1) | Mortalidad (%) |
|---|---|
| 1.000 | 75.10 a |
| 0.066 | 36.37 b |
| 0.033 | 35.91 b |
| 0.011 | 20.68 c |
| 0.000 | 12.80 d |
| DSH | 2.9 |
DSH diferencia significativa honesta.
La relación entre dosis y mortalidad fue evidente, pues en promedio de colonias, tiempos de lectura y presencia de coadyuvante, a menor dosis se presentó una mayor sobrevivencia (Cuadro 3); también se observaron efectos subletales de las abejas sobrevivientes, tales como daño en las funciones motoras, incapacidad de vuelo, desorientación, parálisis parcial y completa
Tiempos de lectura
Se encontraron mediante prueba de medias al menos cinco tiempos que pudieran ser apropiados para toma de datos, en los cuales se observaron diferencias significativas entre colonias: 9, 12, 18, 24 y 30 h. Las primeras cinco lecturas fueron estadísticamente diferentes debido a que en el periodo de 5 min a 1.5 h no hubo, en promedio, mortalidad de abejas, por lo que se consideran no apropiadas para este fin. Las observaciones posteriores a las 60 h de iniciado el experimento fueron igualmente diferentes, ésto se debe a que hay algunas colonias que, a ciertas dosis, no sobreviven después de este lapso, mientras que otras mantienen una dinámica de mortandad observada en el resto del experimento.
Las diferencias en el porcentaje y tiempo de mortalidad podrían deberse a variación genética entre colonias, ya que se han homogeneizado hasta un punto aceptable los factores ambientales tales como temporada, clima, tiempo, edad de las abejas (cero a tres días), temperatura y humedad de incubación, nutrición, tamaño de colonia, salud, ubicación y tamaño de la colonia, manejo cultural, entre otros; sin embargo, no se descarta que haya efectos ambientales en la respuesta al insecticida. Hacen falta más estudios para descartar tales efectos.
Interacciones
Colonia × tiempo
Al graficar la mortalidad de las colonias sobre el tiempo, se observa una mayor separación de las líneas de tendencia entre las 25 y las 45 h, por lo que debe considerarse especialmente este tiempo como recomendable para valorar la obtención de respuestas cuando la expresión de la mortalidad es más variable entre colonias (Figura 2), además del lapso alrededor de las 20 h descrito en el párrafo anterior.
Interacciones triples
La significancia de la interacción de los factores colonias, DAP y dosis indica que las combinaciones de colonias con dosis pueden presentar diferente tendencia cuando son sometidas a la aplicación del coadyuvante DAP, entre otras posibilidades de la combinación de dos factores con respecto a los niveles del tercero. Gráficamente, se observó la interacción entre las dosis y las colonias, por separado con y sin DAP, como se muestra en la Figura 3.
Se encontró que la mortalidad de las colonias se comporta diferente si son tratadas con DAP Plus®, pues las pendientes de las líneas son mayores en aquellas colonias sometidas a los tratamientos con el coadyuvante; además, hay puntos de cruce entre las líneas que varían según el tratamiento, la variación más evidente se observó en las colonias 1 (ID 54), 3 (ID 83) y 7 (ID 36). Se observó mayor magnitud de respuesta en términos de mortalidad en los tratamientos con DAP.
En la comparación de medias para los factores con interacción triple, excluyendo los testigos, las combinaciones que exhibieron menor porcentaje de mortalidad fueron: en la dosis con 0.011 mL L-1, las colonias 1 (ID 54) sin DAP y 2 (ID 16) con DAP; con 0.033 mL L-1, la 2 (ID 16) sin DAP; con 0.066 mL L-1, la 1 (ID 54) y 2 (ID 16), ambas sin DAP; y con 1.0 mL L-1, la 1 (ID 54) con y sin DAP.
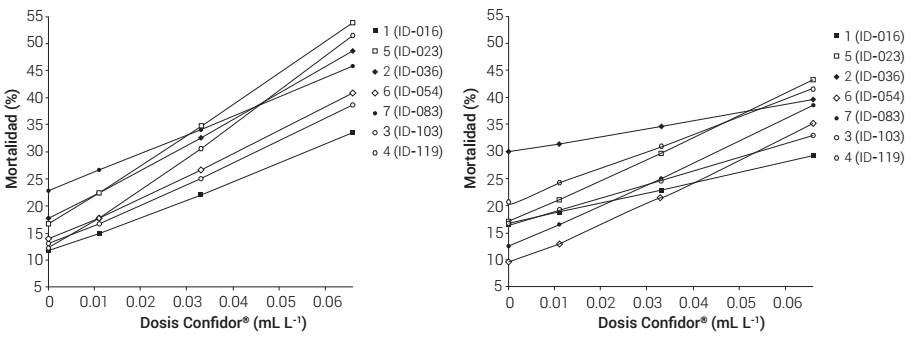
Figura 3 Mortalidad en función de la dosis de insecticida por colonia, con uso de DAP Plus (izquierda) y en ausencia de DAP Plus (derecha). Promedios de todos los lapsos de tiempo.
Se encontró que las colonias se comportan de manera diferente ante algunas dosis; es decir, unas mueren en mayor proporción que otras a la misma dosis, en el mismo lapso de tiempo; lo mismo ocurre con relación al tiempo, abejas de algunas colonias mueren antes que otras a las mismas dosis de insecticida. Las dosis del insecticida propician desigual mortalidad a través del tiempo, como es de esperarse.
Dosis letal media
Se estimó la dosis letal media con base en los valores ajustados al aplicar un modelo cuadrático en cada colonia. Se despejó el valor de la dosis de acuerdo con los coeficientes de la regresión, para el caso de mortalidad = 0.5 (Cuadro 4).
Cuadro 4 Dosis letales medias (DL50) de la proporción M/C de siete colonias de Apis mellifera.
| Colonia | Dosis letal al 0.5 de M/C (mL L-1) |
Tiempo de alcance de DL50 en horas |
|---|---|---|
| 1 (ID 054) | 1.001 | 26.150 |
| 2 (ID 016) | 0.112 | 21.851 |
| 3 (ID 083) | 0.071 | 21.173 |
| 4 (ID 103) | 0.094 | 19.907 |
| 5 (ID 023) | 0.066 | 18.368 |
| 6 (ID 119) | 0.075 | 18.135 |
| 7 (ID 036) | 0.078 | 16.651 |
La Colonia 1 (ID 54) exhibió la mayor DL50 (1.0 mL L-1) y tardó el mayor tiempo (26 h y 9 min) en alcanzar dicha mortalidad en comparación con las otras colonias. Bovi et al. (2018) obtuvieron una dosis letal media de 0.03 ± 0.02 μg de i.a./abeja, al igual que daño en las funciones motoras de abejas africanizadas expuestas a dosis subletales de imidacloprid; por su parte, Costa et al. (2015) reportaron una DL50 de 2.41 ng/abeja en 24 h y 1.29 ng/abeja en 48 h cuando se aplicó imidacloprid en abejas meliponas, mientras que Suchail et al. (2000) observaron una DL50 de 24 ng/abeja entre 24 y 48 h después de la exposición por contacto a imidacloprid en A. mellifera mellifera. Considerando las equivalencias para esta letalidad, la colonia 1 (ID 054) tuvo una DL50 de 47.1 μg de i.a./abeja 26 h después de la exposición y la colonia 5 (ID 23) una DL50 de 3.08 μg de i.a./abeja 18 h después de la exposición. Blacquière et al. (2012) reportaron diversas DL50, que van desde los 4 hasta los 104 ng i.a./abeja (Costa et al., 2015).
La gran variedad de resultados derivados de otros estudios, la forma en que se reportan, las unidades utilizadas, los métodos y enfoques (contacto e ingestión) para calcular la DL50 dificulta la comparación de los resultados obtenidos en este experimento; sin embargo, los resultados reportados por Costa et al. (2015) son los más cercanos a los encontrados en este estudio.
Los resultados aportan un avance hacia metas mayores no abordadas en este estudio, como el desarrollar mediante selección, colonias de abejas tolerantes a imidacloprid y, por efecto de resistencia cruzada, al resto de los neonicotinoides; proporcionar una alternativa para el control de Varroa destructor al incluir aspersiones esporádicas del plaguicida en el manejo de un apiario tolerante, pues ya se observó mortalidad de éste ácaro en las unidades experimentales, y abordar una posible solución a la colonización de abejas africanizadas a los apiarios. Se reportan dosis y tiempos de lectura en intervalos dirigidos, útiles en la calibración de nuevos tratamientos y adecuados para valorar un mayor número de colonias, que permitan incorporar la tolerancia al insecticida como criterio para la selección de reinas.
Se recomienda realizar más estudios en los que, en función de los resultados de esta investigación, se diseñe la valoración de la respuesta al insecticida en un mayor número de colonias (familias de medios hermanos maternos) con una calibración más acotada de la dosis del insecticida, así como de los tiempos de registro de esas respuestas. Los resultados de esta investigación ofrecen una metodología aplicable para la selección de colonias más tolerantes al insecticida en los apiarios, y en perspectiva, iniciar el establecimiento de una estrategia defensiva desde la apicultura ante el riesgo que representan los insecticidas para la sobrevivencia de las abejas.
CONCLUSIONES
La dosis mínima del insecticida (1.0 mL L-1) recomendada por el fabricante de Confidor® para control de plagas es altamente letal para las colonias evaluadas. Los mejores lapsos de tiempo para observar diferencias entre la mortalidad de las colonias son alrededor de las 20 y las 45 h. La interacción entre las colonias a través del tiempo y a través de las dosis con y sin el uso de coadyuvante demuestra que ciertas colonias muestran mayor sensibilidad al imidacloprid que otras en diferentes lapsos y diferentes dosis. Existe variación genética entre colonias para mortalidad, lo cual permite esperar respuesta a la selección, y al cabo de varios ciclos, generar colonias tolerantes a imidacloprid.











 nova página do texto(beta)
nova página do texto(beta)




