INTRODUCCIÓN
Algunos fitoquímicos son compuestos bioactivos presentes en alimentos de origen vegetal, aportan características al color y aroma, y confieren beneficios a la salud. En frutos y hortalizas la mayoría de ellos están en forma libre o como glucósidos solubles conjugados (Shahidi, 2009). La familia Solanaceae se considera fuente de fitoquímicos (Eick, 2008).
Las plantas pueden ser alimento y fuente de metabolitos con actividad curativa. Schippmann et al. (2005) estimaron que el número de especies usadas con propósitos medicinales es mayor de 52,000, de las cuales 2,500 son comercializadas mundialmente, pero sólo algunos cientos de ellas son cultivadas de manera formal.
Physalis peruviana pertenece a la familia Solanaceae, sus frutos contienen vitaminas, además de bioactivos con acción anticancerígena, como witanólidos y fisalinas (Chiang et al., 1992; Ramadan, 2011). Las propiedades etnofarmacológicas de Physalis son atribuidas a compuestos como carotenoides, esteroles, ácidos fenólicos, flavonoides, glicósidos, taninos y alcaloides (Jovanović et al., 2021).
Las saponinas son tensoactivas naturales de las plantas, propiedad atribuida a su estructura química con componentes hidrosolubles y liposolubles (Cheeke, 2000; San Martín y Briones, 2000). Estos compuestos se encuentran como glucósidos, se caracterizan por su sabor amargo y son factores antinutricionales endógenos (López y Rosas, 2016; Tacon, 1995) por su efecto negativo sobre la fermentación ruminal y el proceso digestivo en bovinos (Carmona, 2007) y, por disminuir la población de protozoarios ruminales, también se les conoce como agentes defaunadores. Esta acción está relacionada con la estructura de su aglicona, que puede ser triterpénica o esteroidal, y con los azúcares unidos a ella, que le permiten interaccionar con los esteroles de la membrana celular y formar poros que ocasionan lisis celular (Arabski et al., 2012; Cheeke, 2000).
Las saponinas pueden estimular el crecimiento de bacterias celulolíticas y hongos ruminales, incrementar el aporte de proteínas microbiales al duodeno y generar mayor tasa de degradación de la materia orgánica, incluidos los almidones (Diaz et al., 1993; Galindo et al., 2000; Goetsch y Owens, 1985; Valdez et al., 1986; Wang et al., 2000). La información actual relacionada con su efecto en poblaciones de bacterias y la degradación de las fibras es contradictoria (Santos et al., 2005; Wallace et al., 1994; Wang et al., 2000; Williams y Coleman, 1991). Las diferencias pueden deberse a la cantidad de alimento consumido (Carmona, 2007).
Los antioxidantes son compuestos que tienen la capacidad de prevenir reacciones químicas nocivas en las que se combina el oxígeno con sustancias como lípidos, proteínas y polisacáridos. La oxidación lipídica en los alimentos genera rancidez y los productos de esa reacción pueden ser mutagénicos y carcinogénicos (Embuscado, 2015).
Los carotenoides son sintetizados en las plantas y confieren coloración a los tejidos vegetales y de animales que los consumen. Compuestos como el α y β-caroteno y la β-criptoxantina son precursores de la vitamina A; sin embargo, la propiedad antioxidante de estos pigmentos es la que ha incrementado el interés por los alimentos que los contienen (Meléndez-Martínez et al., 2004).
La presencia y concentración de algunos productos del metabolismo especializado en las plantas están asociadas con el estrés. Algunos de ellos, como glucósidos de fenoles y lactonas, son sustancias antipatogénicas constitutivas, tóxicas para los microorganismos que invaden a la plantahospedera, por liberación desde los compartimentos de la célula o después de una transformación enzimática (Jankiewicz y Sobiczewki, 2003). Entre los compuestos fenólicos están los flavonoides, como las antocianinas, y los tejidos que los contienen son fuente de antioxidantes (Ghiselli et al., 1998; Jankiewics, 2003). Las antocianinas son glucósidos de antocianidinas, pertenecen al grupo de los flavonoides y representan los principales pigmentos solubles en agua visibles al ojo humano. La concentración mayor de antocianinas se encuentra en flores y frutos, pero las semillas, tallos y hojas también pueden contenerlas (Aguilera et al., 2011). El color de los tejidos varía con el tipo y la concentración de antocianinas (Salinas et al., 2013).
Medina-Medrano et al. (2015) evaluaron poblaciones de Physalis recolectadas en Durango, México y determinaron que P. angulata, P. heredifolia, P. solanacea, P. patula y P. subulata contienen compuestos fenólicos con actividad antioxidante.
En México existen 70 especies silvestres y cultivadas del género Physalis, al menos 19 de ellas se recolectan para consumo como hortaliza; dentro de este grupo, P. ixocarpa es la más importante como cultivo para el consumo nacional y para la exportación (Santiaguillo y Blas, 2009; Santiaguillo et al., 2010; 2012). El Servicio Nacional de Inspección y Certificación de Semillas (SNICS) tiene registradas únicamente 23 variedades de la especie P. ixocarpa, 16 de ellas pertenecen a la Universidad Autónoma Chapingo, además existen nueve registros de otras especies del mismo género (Bautista et al., 2016; SNICS, 2022).
El estudio de la composición química de germoplasma poco explorado incrementa la posibilidad de comercialización y conservación de germoplasma en riesgo de extinción, pues el uso puede motivar su recolecta y resguardo en bancos (Schippmann et al., 2005). El objetivo de la presente investigación fue cuantificar compuestos bioactivos y la actividad antioxidante en extractos de frutos de P. ixocarpa, P. peruviana, P. angulata, P. lagascae y P. nicandroides, a fin de determinar su potencial de uso, bajo la hipótesis de que existen diferencias entre las especies estudiadas.
MATERIALES Y MÉTODOS
Sitio experimental y material genético
El ensayo se condujo entre julio de 2019 y enero de 2020. Once poblaciones de Physalis sp. (Cuadro 1) se cultivaron en un invernadero del campo experimental de la Universidad Autónoma Chapingo (UACh), Texcoco, Estado de México (19° 29’ 05” N, 98° 53’ 11” O; 2250 msnm), con sistema hidropónico y tezontle como soporte.
Cuadro 1 Poblaciones de Physalis evaluadas†.
| Número | Población | Origen | Descripción |
|---|---|---|---|
| 1 | Jade TFG/Con registro SNICS | UACh | Cultivado. Fruto verde muy grande. Uso en salsas. |
| 2 | Zafiro MSM/Con registro SNICS | UACh | Cultivado. Fruto verde-morado mediano. Uso en salsas. |
| 3 | Arandas /158JAL42 | UACh | Cultivado. Fruto morado. Uso en salsas. |
| 4 | Arandas /173JAL57 | UACh | Cultivado. Fruto morado. Uso en salsas. |
| 5 | Arandas /182JAL65 | UACh | Cultivado. Fruto morado. Uso en salsas. |
| 6 | Arandas /183JAL66 | UACh | Cultivado. Fruto morado. Uso en salsas. |
| 7 | Juanacatlán | UACh | Silvestre. Resistente a virus. Uso en salsas. |
| 8 | Physalis peruviana L. | COLPOS | Cultivado. Fruto amarillo, pequeño y dulce. Consumo como fruta. |
| 9 | Physalis angulata L. | Guanajuato | Silvestre. Fruto pequeño. Uso en salsas. |
| 10 | Physalis lagascae Roem. et Schult. | Guanajuato | Silvestre. Fruto morado y pequeño. Consumo no especificado. |
| 11 | Physalis nicandroides Schltdl. /09MICH01 | UACh | Silvestre. Uso en salsas, medicinal, ceremonial y como trampa vegetal. |
†Fuentes: Pérez et al. (1992), Santiaguillo y Blas (2009), SNICS (2022), Tuxtla-Andrade et al. (2022). Las poblaciones 1 a 7 son Physalis ixocarpa Brot. ex Horm., las poblaciones 9 y 10 se recolectaron en Guanajuato para este estudio, UACh: programa de mejoramiento genético de tomate de cáscara de la Universidad Autónoma Chapingo, COLPOS: programa de investigación del Colegio de Postgraduados.
Tratamientos, diseño y unidad experimental
Cada población correspondió a un tratamiento; el diseño experimental fue bloques completos al azar con cuatro repeticiones y la unidad experimental consistió de un grupo de 19 plantas. De cada unidad experimental se obtuvieron tres muestras de frutos en madurez de consumo, una por subgrupo de seis plantas. Los frutos se cosecharon entre diciembre de 2019 y enero de 2020. En P. peruviana la cosecha se realizó en el grado 6 de color, según la Norma Técnica Colombiana 4580 (ICONTEC, 1999). Las muestras se analizaron en los Laboratorios de Postcosecha de Frutos y Fitoquímica del Departamento de Fitotecnia de la UACh.
Variables evaluadas
Luminosidad (L), croma y tono (ºhue)
Fueron determinados con el método descrito por McGuire (1992) a partir de los valores L, a y b del epicarpio de los frutos, con un colorímetro portátil (ColorTec-PCM, Cole Palmer, Vernon Hills, Illinois, EUA)
Carotenoides (CAR)
La cuantificación fue por espectrofotometría en extractos acuosos de acetona 80 % (v:v) (AOAC, 1990). La absorbancia se obtuvo en un espectrofotómetro de UV-Vis (Genesis Modelo 10S, Thermo Fisher Scientifics, Waltham, Massachusetts, EUA). Las concentraciones se expresaron en microgramos por 100 gramos de peso fresco (µg 100 g-1 PF).
Sapogeninas (SAP)
Se cuantificaron con el método descrito por Hiai et al. (1976), modificado por Le et al. (2018), en extractos de 0.5 g de fruto fresco homogenizado (piel, semilla y pulpa) con etanol diluido con agua al 80 % (v:v). Las concentraciones se expresaron en mg equivalentes de diosgenina por 100 g de tejido fresco (mg DE 100 g-1 PF), con base en la curva estándar:
Compuestos fenólicos totales (CFT)
Se cuantificaron con el método descrito por Waterman y Mole (1994) en extractos con metanol de 1 g de fruto molido y homogenizado. Las concentraciones se expresaron en miligramos equivalentes de ácido gálico por 100 g de biomasa seca (mg GAE 100 g-1 BS) derivados de la curva estándar:
Antocianinas (ANT)
Se cuantificaron mediante la diferencia de pH, según lo descrito por Giusti y Wrolstad (2001), en extracto de metanol de 1 g de fruto deshidratado, triturado y homogenizado. La cuantificación se realizó a 520 nm con las siguientes fórmulas:
Donde: A = (Aλ vis-max - A700) pH 1.0 - (Aλ vis-max - A700) pH 4.5, PM: peso molecular de cianidina 3-glucósido (449.2 g), FD: factor de dilución, ε: coeficiente de extinción molar para cianidina-3-glucósido (26,900) y l: longitud de paso de celda.
Las concentraciones se expresaron en miligramos de antocianinas totales por 100 g de peso seco (mg 100 g-1 BS).
Actividad antioxidante (AA)
Se determinó con el método de decoloración del radical 2,29-azinobis-(ácido 3-etilbenzotiazolina-6-sulfónico) o ABTS (Re et al., 1999) en extracto metanólico de fruto. Se expresó en porcentaje de inhibición del radical ABTS (%) para 30 min de reacción, calculado a partir de una curva estándar con base en milimoles equivalentes de trolox por gramo de peso seco (mM TE g-1 BS):
Las concentraciones de SAP, CFT, ANT y AA se obtuvieron en triplicado por muestra, en un espectrofotómetro UVvisible (Modelo Genesis 10UV, Thermo Fisher Scientific, Waltham, Massachusetts, EUA). En el resto de las variables se cuantificaron cinco determinaciones por muestra, excepto en CAR, donde se hizo sólo una.
Análisis estadístico
A los resultados se les aplicó análisis de varianza, comparación de medias de Tukey (P ≤ 0.05) y correlaciones de Pearson con el programa estadístico SAS/STAC 9.0 (SAS Institute, 2002). Los valores de °hue y CAR fueron transformados con logaritmo, L, croma, SAP y CFT con arcoseno y ANT y AA con raíz cuadrada.
RESULTADOS Y DISCUSIÓN
El efecto de las poblaciones fue altamente significativo (P ≤ 0.01) en L, croma, °hue, CAR y SAP, significativo (P ≤ 0.05) en CF y TRO y no fue significativo para ANT (Cuadro 2).
Cuadro 2 Análisis de varianza de las variables determinadas en frutos de 11 poblaciones de Physalis spp.
| FV | GL | L | GL | °hue | GL | CRO | GL | CAR | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P | 10 | 5.31 | ** | 10 | 1.29 | ** | 10 | 22.82 | ** | 10 | 10.77 | ** |
| B | 3 | 0.12 | NS | 3 | 0.02 | NS | 3 | 0.87 | * | 3 | 2.07 | * |
| P × B | 30 | 1.16 | ** | 30 | 0.03 | ** | 30 | 1.06 | ** | 28 | 0.72 | NS |
| Error | 518 | 0.23 | 500 | 0.02 | 518 | 0.32 | 52 | 0.68 | ||||
| Total | 561 | 543 | 561 | 91 | ||||||||
| CV (%) | 9.41 | 2.70 | 15.86 | 19.75 | ||||||||
| Media | 43.64 | 106.19 | 23.51 | 163.51 | ||||||||
| SAP | CFT | GL | ANT | GL | TRO | |||||||
| P | 10 | 43.19 | ** | 10 | 2.16 | * | 10 | 3.12 | NS | 10 | 0.23 | * |
| B | 3 | 3.23 | ** | 3 | 0.53 | * | 3 | 1.85 | * | 3 | 0.30 | ** |
| P × B | 28 | 3.26 | ** | 127 | .86 | ** | 6 | 1.49 | ** | 127 | 0.10 | ** |
| Error | 260 | 0.42 | 259 | 0.16 | 215 | 0.58 | 256 | 0.02 | ||||
| Total | 301 | 299 | 254 | 296 | ||||||||
| CV (%) | 20.41 | 11.46 | 39.10 | 11.16 | ||||||||
| Media | 20.69 | 21.81 | 4.54 | 1.58 |
FV: fuente de variación, P: poblaciones, B: bloques, GL: grados de libertad, L: luminosidad, CRO: croma, CAR: carotenoides, SAP: sapogeninas, CFT: compuestos fenólicos totales, ANT: antocianinas, TRO: trolox, **: significativo con P ≤ 0.01, *; significativo con P ≤ 0.05, NS: no significativo.
Las diferencias entre tratamientos fueron significativas (Cuadro 3). Physalis peruviana mostró el valor mayor de L; aunque, sólo fue diferente (P ≤ 0.05) con respecto a las poblaciones 183JAL66, 173JAL57 y a P. nicandroides con los valores menores. Los valores de °hue diferenciaron la tonalidad amarillo-naranja de P. peruviana del resto de las poblaciones, en las que osciló entre verde y verde-morado. El intervalo de croma estuvo entre 41.86 en P. peruviana y 13.66 en P. lagascae. Los valores de L, tono y croma de la población Jade TFG fueron similares a los obtenidos por Cruz-Álvarez et al. (2012) en la variedad mejorada CHF1-Chapingo.
Cuadro 3 Comparación de medias de los parámetros de color y composición química parcial de frutos de 11 poblaciones de Physalis spp.
| Poblaciones | L | °hue | Croma | CAR | SAP | CFT | ANT | TRO |
|---|---|---|---|---|---|---|---|---|
| Jade TFG | 44.22 abc | 109.43 ab | 27.83 b | 44.05 c | 15.15 bc | 28.33 a | 5.80 a | 1.81 a |
| Zafiro MSM | 42.00 abc | 108.16 ab | 17.76 cde | 100.96 c | 8.79 c | 22.78 abc | 3.89 a | 1.77 a |
| 158JAL42 | 43.96 abc | 113.37 ab | 25.63 b | 101.26 bc | 12.74 bc | 20.87 abc | 5.44 a | 1.47 a |
| 173JAL57 | 34.08 c | 119.87 a | 13.78 e | 31.99 c | 13.88 bc | 16.65 bc | 2.53 a | 1.34 a |
| 182JAL65 | 45.73 ab | 107.40 ab | 22.80 bcd | 26.63 c | 9.95 c | 24.41 abc | 5.55 a | 1.87 a |
| 183JAL66 | 33.85 c | 114.63 ab | 15.10 de | 36.43 c | 15.21 bc | 21.17 abc | 4.88 a | 1.55 a |
| Juanacatlán | 45.63 ab | 110.39 ab | 23.49 bc | 71.38 bc | 11.78 c | 26.21 ab | 2.43 a | 1.86 a |
| P. peruviana | 53.92 a | 68.08 c | 41.86 a | 294.70 ab | 59.56 a | 17.30 abc | 3.80 a | 1.31 a |
| P. angulata | 44.93 abc | 111.31 ab | 27.79 b | 106.16 bc | 16.83 bc | 24.60 abc | 7.12 a | 1.81 a |
| P. lagascae | 44.73 abc | 103.97 b | 13.66 e | 30.84 c | 14.40 bc | 14.32 c | 3.03 a | 1.50 a |
| P. nicandroides | 41.22 bc | 113.20 ab | 26.47 b | 762.15 a | 32.97 ab | 22.28 abc | 1.33 a | 1.33 a |
L: luminosidad, CAR: carotenoides (µg 100 g-1 PF), SAP: sapogeninas (mg DE 100 g-1 PF), CFT: compuestos fenólicos totales (mg GAE 100 g-1 PS), ANT: antocianinas (mg 100 g-1 PS), Tro: trolox (mM TE g-1 PS). Valores seguidos con letras distintas en una columna son significativamente distintos (Tukey, P ≤ 0.05).
Physalis peruviana presentó la mayor L y saturación de color, con prevalencia de color amarillo (Meléndez-Martínez et al., 2004). El tono menor en esta especie evidenció su tonalidad diferente del resto de las poblaciones.
CAR de P. nicandroides y P. peruviana difirió significativamente del resto de las poblaciones, con concentraciones menores; en esta última, CAR fue similar al valor documentado por Mier y Cáez (2011) en el ecotipo Colombia, en grado de color 6, y coloración amarilloanaranjado; no obstante, posiblemente este pigmento en P. nicandroides no se expresó debido al alto contenido de clorofilas que mantiene aún en la maduración. Los carotenoides se encuentran en relación de uno por tres o cuatro partes de clorofila en las plantas, y el color amarillo de aquellos es enmascarado por el de la clorofila, hasta que esta última se degrada durante la maduración (Meléndez-Martínez et al., 2004).
La concentración de SAP de P. peruviana fue significativamente mayor a la del resto de las poblaciones, excepto la de P. nicandroides. La presencia de saponinas, taninos, esteroides y flavonoides se documentó en hojas de P. peruviana, usada en la herbolaria del suroeste keniano (Maobe et al., 2013), resultado que concuerda con los obtenidos en la presente investigación.
Concentraciones de 3 a 5 mg mL-1 de saponinas tienen actividad inhibitoria en bacterias, especialmente Gramnegativas (Santos et al., 2005), lo cual se atribuye a la alteración de esos compuestos en la pared celular (Sen et al., 1998), dependiente de la concentración y el tipo de saponinas (Santos et al., 2005). Donkor et al. (2012) determinaron que extractos crudos de frutos de P. angulata son potentes inhibidores de Staphylococcus aureus, pero no de Pseudomonas aeruginosa.
La concentración mayor y menor de CFT correspondió a la variedad Jade TFG y P. lagascae, respectivamente. El contenido de CFT determinado en este estudio, bajo condiciones de invernadero, fue inferior al de frutos recolectados en campo (Medina-Medrano et al., 2015), aunque en ambas investigaciones P. angulata presentó los valores mayores. Los compuestos fenólicos actúan como antioxidantes, que se asocian con mecanismos relacionados con la diferenciación celular, la desactivación de procarcinógenos, el mantenimiento de la reparación del ADN, la inhibición de la formación de N-nitrosamina y el cambio del metabolismo de los estrógenos, entre otros (Shahidi, 2004); además, otros fitoquímicos en alimentos nutracéuticos y funcionales, como fitatos, carotenoides, terpenoides, saponinas e inhibidores enzimáticos, también contribuyen sinérgicamente a mantener la salud (Shahidi, 2009).
Los frutos de las 11 poblaciones presentaron antocianinas, lo cual explica sus tonalidades moradas, excepto Jade TFG que tiende al verde y P. peruviana, cuya coloración es amarillo-naranja. La cianidina es una antocianidina con prevalencia en frutos, así como la pelargonidina y la delfinidina (Aguilera et al., 2011), lo que explica el color amarillo-anaranjado de P. peruviana. La concentración de antocianinas en todas las poblaciones de P. ixocarpa fue superior al intervalo entre 0.15 y 0.22 mg 100 g-1 PS reportados por Rosas-Medina et al. (2020) en frutos de la variedad Rendidora. Estos autores afirmaron que la acumulación del pigmento puede ser un mecanismo para tolerar salinidad. Los cultivares de arroz tolerantes a salinidad contienen concentraciones mayores de compuestos fenólicos y flavonoides en comparación con los susceptibles. Esta respuesta corresponde a especies que enfrentan el estrés mediante la modificación de la biosíntesis y acumulación de compuestos bioactivos (Asensi-Fabado et al., 2017; Minh et al., 2016).
La actividad antioxidante se ubicó en el intervalo de 1.31 a 1.87 mM TE g-1 PS en P. peruviana y 182JAL65, respectivamente, sin diferencia significativa, lo que representa aproximadamente entre 51 y 71 % de inhibición del radical ABTS (Figura 1).
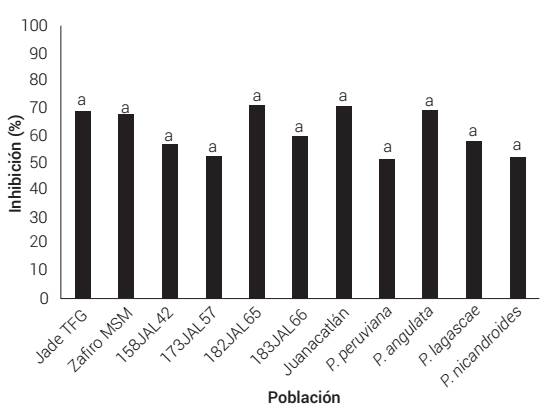
Figura 1 Actividad antioxidante (porcentaje de inhibición del radical ABTS) en frutos de 11 poblaciones de Physalis spp.
La actividad antioxidante de P. peruviana fue mayor a la de frutos con color 6 de la misma especie, obtenida con el método de ABTS en la fase hidrofílica (Repo y Encina, 2008). La actividad antioxidante de un tejido está relacionada con la acción sinérgica de sus compuestos bioactivos, como fenoles, carotenos y ácido ascórbico (Dragovic-Uzelac et al., 2007; Navarro et al., 2006) y la actividad antioxidante total es la suma de esa actividad en las fases hidrofílica y lipofílica (Repo y Encina, 2008). Aunque el ABTS cuantifica antioxidantes hidrofílicos y lipofílicos, es posible que el extractor utilizado y la presencia de otros metabolitos expliquen la inexistencia de correlación entre CAR y AA (Cuadro 4).
Cuadro 4 Correlaciones entre variables de color y variables fitoquímicas de frutos de 11 poblaciones de Physalis spp.
| Variables | °hue | Croma | CAR | SAP | ANT | CFT | TRO |
|---|---|---|---|---|---|---|---|
| L | -0.789** | 0.786** | 0.134 | 0.539 | 0.072 | 0.080 | 0.129 |
| °hue | -0.726* | -0.167 | -0.826** | 0.042 | 0.291 | 0.263 | |
| Croma | 0.408 | 0.769** | 0.146 | 0.222 | -0.102 | ||
| CAR | 0.588 | -0.513 | -0.030 | -0.499 | |||
| SAP | -0.245 | -0.322 | -0.601 | ||||
| ANT | 0.386 | 0.489 | |||||
| CFT | 0.767** |
L: luminosidad, CAR: carotenoides, SAP: sapogeninas, ANT: antocianinas, CFT: compuestos fenólicos totales, TRO: trolox, *: significativo con P ≤ 0.05, **: significativo con P ≤ 0.01.
Correlación entre las variables
La correlación entre luminosidad y croma (P = 0.0042) y entre croma y concentración de saponinas (P = 0.0057) fue positiva, y aquella entre °hue y luminosidad (P = 0.0039), °hue y croma (P = 0.0114), y °hue y concentración de saponinas y (P = 0.0017) fue negativa. Ya que el color no sólo depende de la concentración de antocianinas, sobresalió la ausencia de significancia en la correlación de estos pigmentos con los componentes del color (Cuadro 4). La correlación entre CFT y actividad antioxidante fue positiva y altamente significativa (P = 0.0059), y no fue significativa la de CFT con antocianinas, ni antocianinas con actividad antioxidante; sin embargo, los compuestos independientes del grupo de los fenoles podrían relacionarse de manera diferente con las antocianinas. En frutos de P. angulata solo 16.21 % de CFT correspondió a flavonoides y 21.25 % a ácidos fenólicos, y ambos grupos son reconocidos por su actividad antioxidante (Medina-Medrano et al., 2015).
CONCLUSIONES
Los valores de °hue diferencian la tonalidad amarillonaranja de P. peruviana de las poblaciones verde y verdemorado. La luminosidad y el croma están directamente relacionados con la concentración de carotenoides en P. peruviana. La concentración de compuestos bioactivos difiere entre especies, P. nicandroides y P. peruviana muestran concentración mayor de carotenoides y sapogeninas. El valor mayor de compuestos fenólicos totales (CFT) correspondió a la variedad Jade TFG y el menor a la especie P. lagascae. Las poblaciones con valores mayores de CFT muestran la mayor actividad antioxidante. Los frutos de todas las poblaciones presentaron antocianinas, lo cual explica la tendencia general hacia tonalidades moradas. Las poblaciones de Physalis evaluadas poseen carotenoides, saponinas, compuestos fenólicos totales y actividad antioxidante, lo que las hace promisorias como fuentes nutracéuticas.











 nova página do texto(beta)
nova página do texto(beta)


