Introduccion
El almidón es una molécula que las plantas usan para almacenar reservas de carbono. Se acumula de manera transitoria en las hojas y su degradación permite que la actividad metabólica continúe durante la noche. En Arabidopsis (Arabidopsis thaliana), la degradación del almidón es estimulada por el ritmo circadiano (Graf et al., 2010) e inhibida por el nivel de trehalosa 6-fosfato (Tre 6-P), que refleja la velocidad con que se exporta la sacarosa (Figueroa y Lunn, 2016). El resultado es un mecanismo que ajusta la velocidad de degradación del almidón a la duración de la noche, evitando su agotamiento prematuro, al mismo tiempo que permite reducirla si la sacarosa no se exporta eficientemente.
Degradación del almidón
El crecimiento de las plantas demanda constantemente moléculas que se sintetizan a partir de la actividad fotosintética; el almidón que las hojas almacenan durante el día es muy importante para amortiguar los efectos negativos de los periodos de oscuridad (Thalmann y Santelia, 2017). El almidón es un polímero formado por moléculas de glucosa unidas por enlaces glucosídicos α-1,4 y α-1,6 que permite almacenar carbono reducido sin alterar la osmolaridad de las células o inhibir la actividad fotosintética (Pfister y Zeeman, 2016). El almidón está constituido por dos tipos de moléculas denominadas amilosa y amilopectina; la primera se distingue por ser poco ramificada y la segunda por la ramificación profusa; la proporción de ambas depende del origen botánico del almidón y determina sus propiedades.
El análisis de los gránulos de almidón revela que la amilosa y la amilopectina se acomodan de manera muy compacta para formar una estructura cristalina; esta propiedad constituye un obstáculo para la acción de las enzimas responsables de su degradación (Ritte et al., 2006); sin embargo, la fosforilación en las posiciones C6 y C3 de los residuos de las moléculas de glucosa ubicadas en la superficie de los gránulos modifica el empaquetamiento e incrementa la hidrofilicidad; las enzimas glucán agua dicinasa (GWD) y fosfoglucán agua dicinasa (PWD) catalizan la fosforilación en la posición C6 y C3, respectivamente (Ritte et al., 2006). La actividad de GWD introduce una distorsión que facilita la participación de la PWD (Hejazi et al., 2009). Esta circunstancia explica porqué ciertas mutaciones en GWD reducen significativamente la degradación del almidón y provocan su acumulación (Mahlow et al., 2014); sin embargo, los grupos fosfato son un obstáculo para la actividad de las enzimas que llevan a cabo la degradación y deben ser removidos por las fosfatasas SEX4 (Starch excess 4) y LSF2 (like SEX4) (Ritte et al., 2006). La SEX4 puede desfosforilar las posiciones C3 y C6, mientras que la LSF2 sólo remueve los grupos fosfato de la posición C3 (Hejazi et al., 2010; Santelia et al., 2011); después de eso, las enzimas amilolíticas pueden degradarlo.
La degradación del almidón y su transformación a sacarosa, la cual es exportada al resto de la planta, es un proceso que involucra la participación de enzimas tanto del cloroplasto como del citosol (Figura 1). La parte del proceso que ocurre en el cloroplasto se caracteriza por la producción de maltosa. Tanto las α- como las β-amilasas pueden actuar sobre los glucanos que forman el almidón. En general, las especies vegetales de caracterizan por tener múltiples genes que codifican para ambas enzimas. En el caso particular de Arabidopsis, su genoma contiene tres genes que codifican para la α-amilasa; sin embargo, la mutación de todos ellos no afecta la velocidad de degradación del almidón, lo que significa que en condiciones normales no participan en el proceso (Yu et al., 2005).

Figura 1 Degradación nocturna de almidón en hojas de Arabidopsis. El proceso involucra la participación de enzimas localizadas en el cloroplasto y en el citosol. La maltosa es el producto principal de la primera etapa , que en la segunda se convierte en azúcares fosforilados que pueden ser usados en la síntesis de sacarosa que se exporta al resto de la planta. GWD, glucán agua dicinasa; PWD, fosfoglucán agua dicinasa; SEX4, starch excess 4; LSF2, like SEX4,2; ISA3, isoamilasa 3; LDA, dextrinasa límite; BAM1, β amilasa 1; BAM3, β amilasa 3; DPE1, enzima desproporcionadora 1; pGlcT, transportador de glucosa; MEX1, transportador de maltosa; DPE2, enzima desproporcionadora 2; PHS2, glucán fosforilasa 2; HK, hexocinasa. El grosor de las flechas indica la importancia de la reacción.
Las β-amilasas son exohidrolasas que actúan rompiendo los enlaces glucosídicos α-1,4 a partir del extremo no reductor; su actividad genera maltosa y glucanos pequeños. En Arabidopsis existen nueve genes que codifican para β-amilasas, cuatro de ellas (BAM1, BAM2, BAM3 y BAM4) se localizan en el cloroplasto (Monroe y Storm, 2018). La mutación de los genes que las codifican reduce la degradación nocturna del almidón; de ellas, BAM3 es la más importante (Fulton et al., 2008). Las enzimas isoamilasa 3 (ISA3) y dextrinasa límite (LDA) son necesarias para hidrolizar los enlaces glucosídicos α-1,6 que generan las ramificaciones de los glucanos. La enzima desproporcionadora 1 (DPE1) in vitro transfiere unidades de glucosa de la maltoheptaosa al glucógeno, lo que indica que dentro del cloroplasto participa en la síntesis de glucanos, sobre los que pueden seguir actuando las β-amilasas (Schopper et al., 2015); por su parte, la enzima glucán fosforilasa cloroplástica (PHS1 o Pho1) cataliza la fosforólisis de las maltodextrinas y produce glucosa 1-P (Cuesta-Seijo et al., 2017).
De acuerdo con este planteamiento, los productos de la degradación del almidón (maltosa y en menor proporción glucosa) se exportan al citoplasma por los transportadores MALTOSE EXCESS PROTEIN 1 (MEX1) y PLASTID GLUCOSE TRANSPORTER (pGlcT), respectivamente (Niittylä et al., 2004); ahí, la glucosa, producto de la degradación del almidón, es fosforilada y se incorpora a los procesos metabólicos que ocurren en ese compartimento; mientras tanto, las enzimas desproporcionadora 2 (DPE2) y glucán fosforilasa 2 (PHS2 o Pho2) actúan coordinadamente para metabolizar la maltosa. La enzima DPE2 tiene actividad de glucán transferasa y al transferir una molécula de glucosa de la maltosa a un glucano citosólico, libera otra molécula de glucosa. Este glucano citosólico puede ser un amortiguador importante en el metabolismo de la maltosa (Malinova y Fettke, 2017). Por su parte, la enzima PHS2 actúa sobre el glucano soluble y, mediante una reacción de fosforólisis, libera glucosa 1-P (Schopper et al., 2015).
Regulación de la degradación del almidón
La degradación nocturna del almidón que se acumula en las hojas garantiza que durante la noche haya intermediarios para procesos metabólicos y de crecimiento. El ritmo circadiano y el nivel de Tre 6-P contribuyen a que la velocidad de degradación del almidón coincida con la duración de la noche (Graf et al., 2010).
Control circadiano
La degradación del almidón en tejidos fotosintéticos está sujeta a un control que garantiza que la mayor parte se use durante la noche. Ese mecanismo también afecta su síntesis y puede ajustar las velocidades de ambos procesos en función de las variaciones estacionales de la duración del día y la noche; gracias a ello, plantas de Arabidopsis cultivadas en fotoperiodo corto acumulan almidón más rápidamente y por la noche lo degradan a menor velocidad (Fernandez et al., 2017). El reloj circadiano está formado por un conjunto de represores [LATE ELONGATED HYPOCOTYL (LHY), CIRCADIAN CLOCK ASSOCIATED 1 (CCA1), PSEUDORESPONSE REGULATOR (PRR), CCA1 HIKING EXPEDITION (CHE) y LUX ARRHYTMO (LUX)] y activadores transcripcionales [BROTHER OF LUX ARRHYTMO (BOA) y REVEILLE (REV)] (Webb y Satake, 2015), cuya participación conjunta modifica la expresión genética y la estabilidad de proteínas −entre otros efectos−, para tener respuestas cíclicas en función de la duración de los periodos de luz y oscuridad.
En lo que se refiere a la degradación del almidón, LHY y CCA1 tienen un efecto muy importante, y mutaciones en los genes que los codifican hacen que el proceso se acelere y que el almidón se agote antes de que termine el periodo de oscuridad (Philippou et al., 2019); sin embargo, el funcionamiento del sistema aún no está completamente claro. Se ha propuesto que la degradación nocturna del almidón también depende de la disponibilidad de las enzimas participantes en el proceso. El hecho de que las cantidades de los mensajes que codifican a muchas de ellas se incrementen y alcancen los valores máximos antes de que inicie el periodo de oscuridad apoya esa sugerencia; no obstante, esos cambios tienen poco impacto en la cantidad de las proteínas (Skeffington et al., 2014). También se ha sugerido que la degradación nocturna del almidón es promovida por la activación de las enzimas participantes, en respuesta a cambios que en el estroma de los cloroplastos promueven la alternancia de los periodos de luz y oscuridad.
Las actividades de las enzimas GWD, SEX4, BAM1, BAM3, AMY3 y LDA se incrementan cuando se ensayan en condiciones donde puentes disulfuro, que son críticos, se encuentran reducidos (Silver et al., 2014); sin embargo, durante la noche el estroma se vuelve oxidante, lo que afectaría negativamante la actividad de todas ellas. Otros autores han reportado que las actividades de BAM1 y BAM3 se mantienen relativamente constantes durante el día y la noche (Monroe et al., 2014). Recientemente se ha considerado que el mecanismo que regula la degradación del almidón durante la noche involucra la participación de elementos que forman parte del reloj circadiano, en coordinación con otros que evalúan la cantidad de almidón disponible (Seki et al., 2017). El grado de fosforilación de la superficie de los gránulos, que define su susceptibilidad a la degradación, también podría ser clave para evaluar la cantidad de almidón presente (Fernandez et al., 2017). El hecho de que la cantidad de glucosa 6-P en los gránulos se incremente durante el día, que alcance su punto más alto al atardecer, y se reduzca durante la noche a medida que el almidón se degrada (Scialdone et al., 2013), son aspectos que apoyan este planteamiento.
Regulación por Tre 6-P
Otra teoría sugiere que, para establecer la velocidad nocturna de la degradación del almidón, se requieren la participación conjunta del ciclo circadiano y de un mecanismo que evalúa los niveles de sacarosa (Seki et al., 2017). La Tre 6-P es una molécula descubierta hace relativamente poco tiempo; se encuentra en concentraciones muy pequeñas (en el rango de nmolar), que varían en proporción casi directa con los cambios en sacarosa (Morabito et al., 2021). La Tre 6-P se sintetiza a partir de la UDP-glucosa y la glucosa 6-P en una reacción catalizada por la enzima Tre 6-P sintasa (TPS); el producto puede ser desfosforilado por la enzima Tre 6-P fosfatasa (TPP) (Gao et al., 2021); es un regulador metabólico muy efectivo (Figura 2) que inhibe la degradación del almidón (Martins et al., 2013).
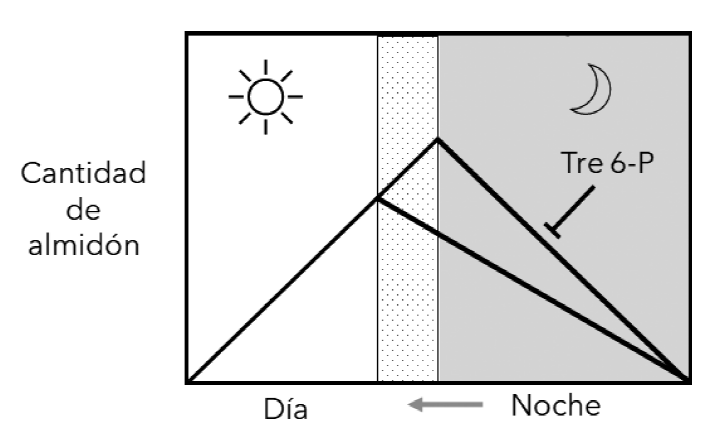
Figura 2 Control de la velocidad de degradación de almidón. La velocidad del proceso está determinada por la duración del periodo de oscuridad. Si oscurece más temprano (zona punteada y flecha gris), se reduce la velocidad del proceso. Adicionalmente, si la sacarosa no se exporta eficientemente, se favorece la síntesis de Tre 6-P, que reduce la velocidad del proceso.
El efecto inhibitorio de la Tre 6-P sobre la degradación del almidón es consecuencia de su acción sobre el metabolismo de la maltosa en el citosol (Martins et al., 2013). De acuerdo con esta propuesta, el proceso de degradación del almidón está sometido a un doble control; por un lado, el ritmo circadiano, que establece la velocidad máxima de degradación que garantiza que las reservas de almidón no se agoten antes de que termine la noche, y por el otro, los niveles de Tre 6-P, que reducen la velocidad del proceso y la ajustan con la de exportación de sacarosa (Figura 3).
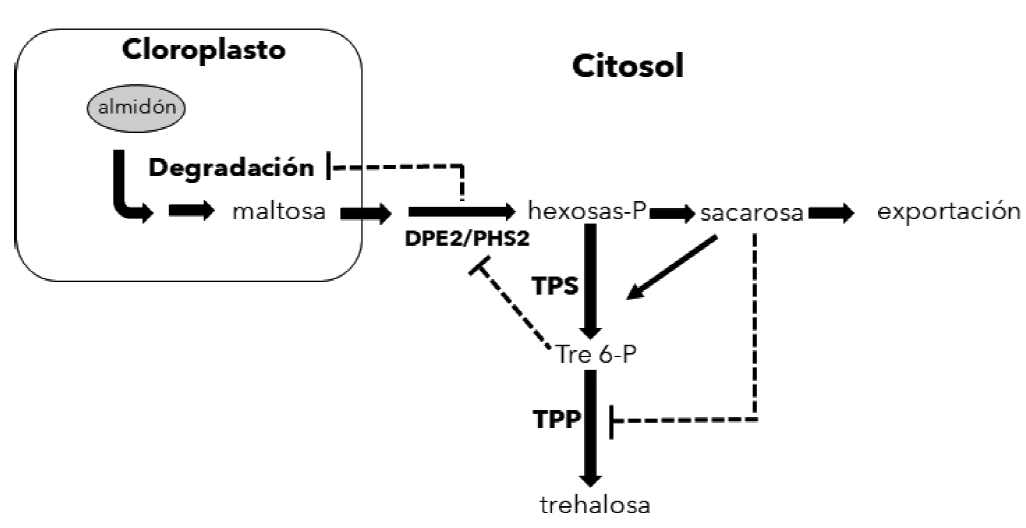
Figura 3 Regulación de la velocidad de degradación del almidón por trehalosa 6-P (Tre 6-P). En el citosol, los productos de la degradación del almidón se convierten en azúcares fosforilados que se usan en procesos metabólicos de la misma célula o se convierten en sacarosa que se exporta al resto de la planta. Si la sacarosa no se exporta eficientemente, su acumulación promueve la síntesis de Tre 6-P que inhibe el metabolismo de maltosa en el citosol y reduce la velocidad de degradación del almidón. Las líneas punteadas indican efectos inhibitorios. DPE2, enzima desproporcionadora 2; PHS2, glucán fosforilasa 2; TPS, Tre 6-P sintasa; TPP, Tre 6-P fosfatasa.
Conclusiones
El almidón, que durante el día se acumula en las hojas, es fundamental para que las plantas enfrenten exitosamente los efectos negativos de la oscuridad en el proceso de la fotosíntesis. Su degradación está sometida a un control muy estricto, donde el ritmo circadiano, el grado de fosforilación de los gránulos y los niveles de Tre 6-P se combinan para crear un mecanismo efectivo y flexible. La mayoría de la información disponible proviene de estudios realizados en hojas de Arabidopsis; es necesario investigar si la degradación del almidón almacenado temporalmente en otros órganos (tallos y pericarpios de frutos) se regula de manera similar y si las características de este proceso se conservan en las especies cultivadas.











 nueva página del texto (beta)
nueva página del texto (beta)


