Introducción
Las heliconias son plantas ornamentales tropicales originarias de América del Sur, Centroamérica, las islas del Pacífico e Indonesia (Kress et al., 2004). El género Heliconia incluye entre 225 y 250 especies (Jerez, 2007). Las heliconias destacan por el color y la belleza de sus inflorescencias, así como por las formas exóticas de sus brácteas. La vida de anaquel de sus inflorescencias permite comercializarlas como flores de corte y como plantas de maceta para decoración de paisajes. En México sobresalen especies de heliconias nativas con atributos ornamentales tales como H. collinsiana, H. aurantiaca, H. bourgaeana, H. champneiana, H. librata, H. uxpanapensis, H. vaginalis, H. wagneriana, entre otras. H. collinsiana Griggs produce inflorescencias colgantes con brácteas de color rojo intenso, crece de forma natural en las selvas y orillas de ríos. Los productores han domesticado y adaptado esta especie para su cultivo comercial como flor de corte y para jardinería. En la actualidad las heliconias se han consolidado en México dentro del mercado de flores tropicales de corte, junto con los anturios (Anthurium andreanum), ave de paraíso (Strelitzia reginae), bastón de rey (Etlingera elatior), ginger (Alpinia purpurata) y las maracas (Zingiber sp.).
La principal forma de propagación de las heliconias es vía asexual por división de rizomas; este método asegura plantaciones clonales. Las semillas pueden servir para propagar especies silvestres o semidomesticadas, pero en cultivares comerciales se emplean rizomas para mantener las características; además, la mayoría no produce semillas. Para reducir el riesgo de diseminar enfermedades fungosas (Fusarium sp.) y bacterianas (Erwinia sp., Ralstonia solanacearum), al establecer nuevas plantaciones se requieren sistemas de propagación que garanticen material vegetativo libre de patógenos, como el obtenido por cultivo in vitro de tejidos vegetales.
La propagación in vitro de heliconias por organogénesis se ha reportado para genotipos élite, especies silvestres y cultivares comerciales (Hernández-Meneses et al., 2018; Meneses-Guzmán et al., 2009). Nathan et al. (1992) fueron los primeros en aplicar las técnicas de cultivo in vitro para regenerar plantas de H. psittacorum a partir de yemas laterales. Otros estudios reportaron la micropropagación de H. standleyi (Sosa et al., 2008) y H. bihai cv. Lobster Salmón (Marulanda-Ángel et al., 2011).
En la embriogénesis somática ciertas células pueden inducirse en condiciones in vitro para formar estructuras embrionarias y regenerar plantas completas en ausencia de la fusión de gametos. El proceso inicia con la desdiferenciación celulas que da origen a callos y continúa con la diferenciación de los embriones (Méndez-Hernández et al., 2019). La embriogénesis somática se considera más eficiente que la organogénesis por las características de las estructuras obtenidas y la gran cantidad de plantas que se pueden regenerar (Ochoa-Alejo, 2016).
Las investigaciones respecto a la propagación in vitro mediante embriogénesis somática en heliconias no han logrado establecer las condiciones óptimas para inducir esta ruta morfogénica (Ulisses et al., 2007; 2010). La presente investigación tuvo como objetivos desarrollar un sistema de regeneración de plantas de Heliconia collinsiana vía embriogénesis somática y caracterizar histológicamente la inducción y diferenciación de los embriones somáticos.
Materiales y métodos
Material vegetal
Plantas regeneradas in vitro obtenidas por organogénesis de acuerdo con el protocolo descrito por Hernández-Meneses et al. (2018) fueron las donadoras de explantes; dichas plantas se mantuvieron por seis meses en medio MS (Murashige y Skoog, 1962) con sacarosa (30 g L-1), BA (2.5 mg L-1), ácido indolacético (AIA, 0.18 mg L-1) y agar-agar Sigma® (9.0 g L-1).
Medio de cultivo y condiciones de incubación
El medio empleado en todas las etapas de la embriogénesis somática fue el MS basal, el cual se gelificó con agar-agar (Sigma®, 9.0 g L-1), el pH del medio se ajustó a 5.7 con un potenciómetro (Orion 3 Star Plus, Thermo Scientific®, Waltham, Massachusetts, EUA) y se esterilizó a 121 ºC y 1.5 kg cm-2 de presión por 20 min.
Inducción de callo embriogénico
Para la inducción de callo embriogénico se implementó el procedimiento descrito por Hernández-Meneses et al. (2013). Mediante la técnica de capa fina de células (thin cell layer) (da Silva, 2010) se obtuvieron secciones transversales de 1 mm de grosor de la base de pseudotallos de vitroplantas de seis meses de edad, las cuales se establecieron en medio MS con 18 mg L-1 de 2,4-D y 0.5 g L-1 de carbón activado. Los cultivos se incubaron a 26 ± 2 °C en oscuridad por 12 semanas con un subcultivo a medio fresco a las seis semanas y después se expusieron a 16 h de luz (intensidad luminosa de 45 µmol m-2 s-1) por dos semanas más.
Multiplicación de los callos y diferenciación de embriones somáticos
Masas de callo de aproximadamente 400 mg de peso se establecieron en medio MS adicionado con 2,4-D (0, 1 y 2 mg L-1) y carbón activado (0.5 g L-1). Los cultivos se incubaron en condiciones de luz (16 h) por 16 semanas con subcultivos cada cuatro semanas. A las 4, 8, 12 y 16 semanas se evaluó el peso fresco de los callos, el porcentaje de los callos que dieron origen a callo embriogénico y el número de embriones en etapa globular y escutelar. El experimento tuvo un diseño completamente al azar con tres tratamientos y10 repeticiones. La unidad experimental fue un frasco con callo.
Maduración de embriones somáticos y germinación
Masas de callos embriogénicos de aproximadamente 300 mg de peso, que contenían en promedio 15 embriones en las etapas globular y escutelar, se establecieron en medio MS con 0.5 g L-1 de carbón activado y tres concentraciones de ácido abscísico (ABA, 1, 2 y 4 mg L-1), tres de BA (0.5, 1 y 2 mg L-1) y un testigo sin reguladores de crecimiento. Los cultivos se incubaron en luz (16 h) con un subcultivo a las cuatro semanas. A las ocho semanas se contabilizó el peso de los callos en fresco, el número de embriones en las etapas globular, escutelar y coleoptilar y el porcentaje de germinación. El experimento tuvo un diseño completamente al azar con siete tratamientos y 10 repeticiones, la unidad experimental fue un frasco con callo embriogénico.
Conversión y crecimiento de las plantas
Plántulas de 0.5 a 1 cm de longitud se establecieron en un medio con 50, 75 y 100 % de la concentración del medio MS adicionado con carbón activado (0.5 g L-1) y sin reguladores de crecimiento vegetal (RCV). Los cultivos se incubaron en luz (16 h) con un subcultivo a las cuatro semanas. A las ocho semanas se contabilizó el porcentaje de conversión y la altura promedio de las plantas (cm). El experimento tuvo un diseño completamente al azar con tres tratamientos y 10 repeticiones. La unidad experimental fue un frasco con 10 plántulas.
Análisis histológico del callo embriogénico
Callos embriogénicos de 16 semanas de cultivo procedentes de la etapa de proliferación se procesaron con la técnica de inclusión en parafina. Las muestras se fijaron en formalina-ácido acético-alcohol (FAA, 50:5:10 v/v) por 24 h; se deshidrataron con una serie de alcohol isopropílico (30, 40, 50, 70, 90 y 100 %) y luego en alcohol isopropílico-xileno (3:1, 1:1, 1:3) y dos cambios en xileno (6 h en cada solución); después, se embebieron en parafina líquida a 60 °C, con dos cambios (12 h). Las muestras se cortaron en secciones de 10 µm de grosor con un micrótomo rotatorio manual (Histostat, Reichert®, Depew, New York, EUA), éstas se montaron en portaobjetos con adhesivo de cromo; finalmente, se tiñeron con safranina (0.05 % por 12 h) y verde rápido (0.12 % por 1 min) (López et al., 2005). Las preparaciones se observaron en fotomicroscopio III (Carl Zeiss®, Oberkochen, Alemania) y las fotomicrografías se capturaron con cámara digital Paxcam®.
Microscopía estereoscópica y de barrido
Los callos embriogénicos y embriones somáticos se observaron con un microscopio estereoscópico (Modelo Tessovar, Carl Zeiss®, Oberkochen, Alemania) y las imágenes se captaron con una cámara digital Paxcam®. Las muestras para la microscopía electrónica de barrido se fijaron en glutaraldehído 2.5 % en solución amortiguadora de fosfatos de Sorensen 0.1 M con pH de 7.2 por 24 h (Bozzola y Rusell, 1999) y se lavaron tres veces (5 min cada una) con la misma solución. Las muestras se deshidrataron en serie gradual de etanol (30, 40, 50, 60, 70, 80 y 90 %) por 45 min en cada concentración y tres cambios de 20 min en etanol 100 %. Las muestras se secaron en aparato (Sandri-780A®, Tousimis Research Corporation, Rockville, Maryland, EUA) a punto crítico, se montaron y orientaron sobre el porta muestras y luego se recubrieron con oro durante 4 min en una ionizadora (Ion Sputter JFC-1100, Jeol®, Fine Coat, Tokyo, Japón) para luego ser observadas en un microscopio electrónico de barrido (JEOL JSM 6390®, Tokyo, Japón) operado a 10 kV.
Resultados y discusión
Multiplicación de los callos embriogénicos y diferenciación de los embriones
Los callos inducidos inicialmente en oscuridad con 18 mg L-1 de 2,4-D fueron de color blanco y consistencia compacta, pero cuando se incubaron en condiciones de luz se tornaron de color verde. Estos callos se usaron en las etapas de multiplicación del callo y de diferenciación de embriones. El 2,4-D afectó significativamente el incremento de biomasa de los callos a las 8, 12 y 16 semanas de cultivo. La inclusión de 1 y 2 mg L-1 de 2,4-D en el medio promovió la diferenciación de los embriones a las 16 semanas de cultivo; el peso del callo embriogénico obtenido después de este tiempo fue 18 veces mayor que el establecido inicialmente (Cuadro 1). La proliferación de estos callos es importante para incrementar la cantidad de embriones somáticos que potencialmente puedan generarse.
Cuadro 1 Efecto del 2,4-D sobre la multiplicación de los callos y la diferenciación de embriones de H. collinsiana.
| 2,4-D (mg L-1) | 4 semanas | 8 semanas | 12 semanas | 16 semanas | Número de embriones por g de callo |
| Peso fresco del callo (g) | |||||
| 0 | 0.6 a | 0.0 b | 0.0 b | 0.0 b | - |
| 1 | 0.7 a | 2.2 a | 3.6 a | 5.4 a | - |
| 2 | 0.8 a | 2.6 a | 3.8 a | 5.5 a | - |
| Callo embriogénico (%) | |||||
| 0 | - | - | - | 0.0 b | - |
| 1 | - | - | - | 60.0 a | - |
| 2 | - | - | - | 70.0 a | - |
| Número de embriones en etapa globular | |||||
| 0 | - | - | - | 0.0 b | 0.0 b |
| 1 | - | - | - | 88.5 a | 16.3 a |
| 2 | - | - | - | 97.7 a | 17.7 a |
| Número de embriones en etapa escutelar | |||||
| 0 | - | - | - | 0.0 b | 0.0 b |
| 1 | - | - | - | 27.9 a | 5.1 a |
| 2 | - | - | - | 23.8 a | 4.3 a |
Medias con letras iguales en cada columna dentro de cada variable no son estadísticamente diferentes (Tukey, P ≤ 0.05).
En el medio de cultivo sin RCV sólo se observó la proliferación de los callos en las primeras cuatro semanas; después, éstos se oxidaron y murieron. El incremento en peso fresco de los callos por efecto del 2,4-D fue evidente a la cuarta semana y fue paulatino con cada subcultivo. La formación de callos embriogénicos se observó hasta las 16 semanas de cultivo y se presentó en 60 y 70 % de los explantes cultivados con 1 y 2 mg L-1 de 2,4-D, respectivamente. Con 2 mg L-1 de 2,4-D el número de embriones globulares fue 3.6 veces mayor que los escutelares. No se observaron diferencias estadísticas significativas para el número de embriones globulares y escutelares formados en los callos expuestos a 1 o 2 mg L-1 de 2,4-D (Cuadro 1); no obstante, con estas dosis de 2,4-D se pudieron generar hasta 17.7 embriones globulares y 5.1 escutelares por g de callo. Esta respuesta se debe a que en el mismo callo se pueden observar embriones en diferentes etapas de desarrollo. La cantidad de embriones escutelares registrados en esta etapa correspondió a los primeros globulares que se diferenciaron en el callo.
Los callos cultivados con 2,4-D se tornaron de color verde amarillento a las ocho semanas y dieron origen a masas proembriogénicas (Figura 1A). Los embriones en etapas globular y escutelar se observaron a las 16 semanas de cultivo (Figura 1B). Los primeros embriones coleoptilares también se observaron en este tiempo y cambiaron de color blanco a verde, indicativo de la germinación de los embriones somáticos. Los embriones globulares adquirieron forma elíptica hasta alcanzar la fase escutelar (Figura 1C), etapa distintiva de la embriogénesis en monocotiledóneas (Mujib et al., 2016).
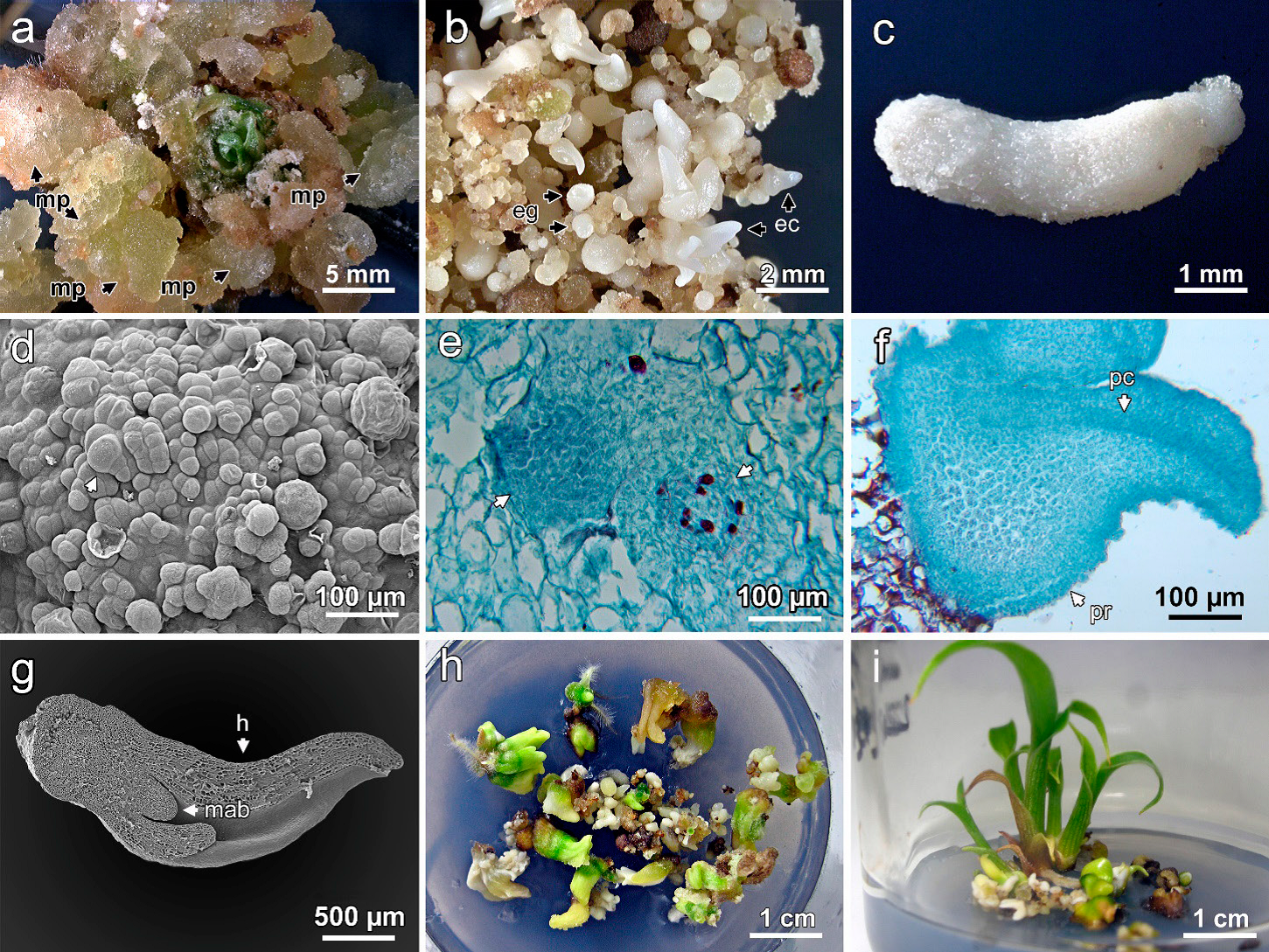
Figura 1 Embriogénesis somática en Heliconia collinsiana. A) formación de masas proembriogénicas con 2 mg L-1 de 2,4-D, B) embriones globulares y coleoptilares en medio MS con 2 mg L-1 de 2,4-D, C) embrión en etapa escutelar, D) masas embriogénicas con embriones en etapa globular temprana en desarrollo, E) anatomía de embriones en etapa globular temprana, F) embrión germinado donde se aprecia el procambium, G) plántula con las primeras hojas y meristemo apical de brote, H) plántulas en un medio con 1 mg L-1 de BA, I) crecimiento de plantas regeneradas en medio MS a la mitad de su concentración. mp: masa proembriogénica, eg: embrión globular, ec: embrión coleoptilar, pc: procambium, h: hoja, mab: meristemo apical de brote.
En distintas especies la embriogénesis somática comprende fases independientes de inducción y diferenciación. En la inducción las células somáticas diferenciadas adquieren competencia embriogénica y proliferan como células embriogénicas; en la diferenciación, las células embriogénicas dan lugar a embriones somáticos (Fehér, 2015). En el presente estudio se observaron ambas fases en la etapa de proliferación de los callos, donde el principal activador fue el 2,4-D. Se ha reportado que el suministro exógeno de este RCV promueve la síntesis de novo o relocalización de otras auxinas endógenas que contribuyen a la diferenciación de los embriones a partir de las células somáticas (Altamura et al., 2016).
Los callos no embriogénicos mostraron apariencia similar a los embriogénicos; sin embargo, sólo incrementaron su tamaño y después se oxidaron; en contraste, los callos embriogénicos formaron masas proembriogénicas después de las 12 semanas de cultivo. Estas masas indicaron que en los callos las células totipotentes expresaron su capacidad genética para formar células embriogénicas que completaron su transición de un estado somático a uno embriogénico.
El 2,4-D tiene la característica única de funcionar simultáneamente como RCV sintético y como herbicida inductor de estrés, ambas propiedades pueden contribuir a su eficiencia como promotor de la embriogénesis somática (Fehér, 2015). Las diferentes etapas de desarrollo de los embriones somáticos de heliconia observadas en los tratamientos con 2,4-D fueron similares a las que ocurren en la embriogénesis cigótica. En la mayoría de los protocolos de regeneración in vitro las auxinas actúan como inductores de la embriogénesis somática y la diferenciación sucede al reducir o eliminar la auxina del medio de cultivo (Nic-Can y Loyola-Vargas, 2016). En los callos de heliconia el 2,4-D fue necesario para la diferenciación de los embriones; su ausencia produjo la oxidación y muerte de los callos. Este efecto del 2,4-D también se ha reportado en la embriogénesis somática de algunas variedades de Musa acuminata, donde la inducción de los callos embriogénicos requirió de 4 mg L-1 de 2,4-D (Youssef et al., 2010).
En la literatura existen reportes relacionados con la embriogénesis somática en Heliconia stricta (Atehortúa y Valencia, 2002) y H. psittacorum (Urrea y Ceballos, 2005); no obstante, la información derivada de estos trabajos no permite replicar dichos protocolos en otras especies o variedades de este género. Por otra parte, Ulisses et al. (2007) establecieron secciones de ovarios de los cultivares Sexy Pink y Sexy Scarlet de H. chartacea en medio MS con 5 mg L-1 de 2,4-D; después de 13 semanas en oscuridad, los explantes se oxidaron y no generaron callos. En otro estudio, Ulisses et al. (2010) lograron inducir callos embriogénicos a partir de secciones de ovarios del cultivar Sexy Pink con 5 mg L-1 de 2,4-D y 2.5 mg L-1 de AIA; sin embargo, los callos no proliferaron y no se logró la diferenciación de embriones somáticos, es por ello que el protocolo para obtener embriones somáticos en H. collinsiana aquí desarrollado se considera exitoso, debido a que permite la diferenciación de embriones somáticos a partir de capas finas de células de pseudotallos y su conversión en plantas; además, los resultados obtenidos en estudios previos con otras especies, y los observados en la presente investigación, indican que dentro de la familia Helioniaceae el genotipo tiene una fuerte influencia sobre la respuesta morfogenética.
Análisis histológico de callos embriogénicos y microscopía de barrido
Los callos cultivados con 1 y 2 mg L-1 de 2,4-D durante la etapa de multiplicación mostraban apariencia translúcida a las ocho semanas de iniciar el cultivo. Los cortes histológicos de los callos mostraron que se componían de células de parénquima de paredes delgadas irrigados con tejido vascular. En la periferia del callo se observaron células en constante división anticlinal, perpendicular a su superficie, con núcleos grandes (masas proembriogénicas) (Figura 1D). Las masas proembriogénicas se observaban de color beige a las 12 semanas de cultivo y los primeros embriones en etapa globular se diferenciaron a partir de estas masas a las 16 semanas.
Los embriones globulares estaban constituidos por células pequeñas en división continua, con citoplasma denso y procambium (Figura 1E). Estos embriones crecieron hasta alcanzar el estado de desarrollo escutelar y, posteriormente, se formó el primordio foliar; en la región central del embrión se observó el meristemo apical del brote; en el ápice de los embriones en estado coleoptilar se observó el procambium (Figura 1F) que dio origen al tejido vascular embrionario, mientras que en la conversión del embrión se observaron las primeras hojas envainantes (Figura 1G).
Maduración de embriones somáticos y germinación
La ausencia de RCV favoreció la diferenciación de embriones en estado globular y su desarrollo hasta la etapa escutelar, pero limitó su maduración. Esta respuesta sugiere que la presencia de ABA y BA fue indispensable para completar la maduración de los embriones. El crecimiento de los callos embriogénicos, así como la maduración de los embriones y germinación del 100 % de éstos, fue promovida con 0.5 mg L-1 de BA; en contraste, la inclusión de 4 mg L-1 de ABA en el medio de cultivo inhibió el proceso (Cuadro 2).
Cuadro 2 Maduración de embriones somáticos de Heliconia collinsiana y su germinación en presencia de ácido abscísico (ABA) y benciladenina (BA) después de ocho semanas de cultivo.
| Regulador de crecimiento vegetal | Concentración (mg L-1) | Callo fresco (g) | Número de embriones | Germinación (%) | |||||||
| Globular | Escutelar | Coleoptilar | |||||||||
| Sin regulador | 0 | 4.9 | a | 4.5 | b | 7.0 | d | 0.0 | d | 0.0 | c |
| ABA | 1 | 2.1 | cd | 7.1 | b | 5.0 | e | 2.1 | cd | 20.0 | bc |
| 2 | 1.6 | de | 5.7 | b | 4.0 | e | 1.0 | cd | 0.0 | c | |
| 4 | 0.9 | e | 3.9 | b | 4.0 | e | 0.0 | d | 0.0 | c | |
| BA | 0.5 | 3.6 | b | 11.8 | a | 15.0 | a | 12.5 | a | 100.0 | a |
| 1 | 2.8 | bc | 7.0 | b | 11.0 | b | 6.9 | b | 50.0 | b | |
| 2 | 2.1 | cd | 5.9 | b | 9.0 | c | 4.1 | bc | 30.0 | bc | |
Medias con letras iguales en cada columna no son estadísticamente diferentes (Tukey, P ≤ 0.05).
Los embriones cultivados con 0.5 mg L-1 de BA cambiaron de color, primero de blanco a amarillo y posteriormente a verde. La cantidad de embriones escutelares se incrementó, mientras se redujo la de globulares; esta respuesta indicó que los embriones globulares continuaron desarrollándose hasta alcanzar las etapas siguientes. La BA (0.5 mg L-1) también promovió que los embriones en estado coleoptilar germinaran; en contraste, el uso de 1 y 2 mg L-1 de BA ocasionó anormalidades en las plantas (forma de roseta), característica no deseada (Figura 1H).
La etapa de maduración de los embriones somáticos es esencial para la germinación y su conversión en plantas, ya que durante esta etapa se lleva a cabo la síntesis y acumulación de carbohidratos, lípidos y proteínas de reserva (Bhojwani y Dantu, 2013). Un protocolo de regeneración exitoso se obtiene cuando los embriones alcanzan su madurez y adquieren la capacidad para convertirse en plantas normales, tal como se observó en este estudio.
El efecto negativo del ABA en la maduración de los embriones somáticos de H. collisiana difiere de lo documentado en otras especies. Algunos beneficios del ABA son impedir la germinación precoz, contribuir a la formación de las semillas y evitar la embriogénesis secundaria y pluricotiledonar (Gray, 2011); sin embargo, en este estudio el ABA causó la oxidación y muerte de los embriones de heliconia. Esta respuesta probablemente está asociada con la susceptibilidad de los embriones a este regulador de crecimiento y con su fitotoxicidad en las concentraciones probadas.
Los RCV de tipo citocininas, como BA, 6-furfurilaminopurina (cinetina) y 1-fenil-3-(thiadiazol-5-yl) urea (thidiazuron), normalmente se utilizan en la etapa de inducción de los callos embriogénicos en combinación con auxinas como 2,4-D, picloram (ácido 4-amino-3,5,6 tricloropiridin-carboxílico) o ácido naftalenacético (ANA) (Gray, 2011); en cambio, el uso de citocininas en la maduración de los embriones somáticos es menos frecuente y su efectividad se ha reportado en concentraciones bajas, tal como se observó en este estudio, ya que con 0.5 mg L-1 de BA los embriones de Heliconia lograron madurar. Asimismo, en híbridos de Musa sp. la maduración de los embriones se consiguió con 0.5 mg L-1 de BA (Daniels et al., 2003); en otros cultivares de este género, los mejores resultados se obtuvieron con 0.05 mg L-1 de BA (Jalil et al., 2003), al igual que en Cajanus cajan (Aboshama, 2011).
Conversión y crecimiento de las plantas
Noventa por ciento de las plántulas lograron crecer y formar hojas verdaderas cuando se cultivaron en medio MS al 50 % de su concentración. En este medio las plantas alcanzaron la altura máxima (5.85 cm) (Figura 1I); asimismo, éstas emitieron raíces adventicias e incrementaron el número de hojas a las ocho semanas de cultivo (Cuadro 3).
Cuadro 3 Conversión de embriones somáticos de Heliconia collinsiana en medios de cultivo con distinta concentración de sales.
| MS (%) | Conversión (%) | Altura de planta (cm) | ||
| 100 | 25.0 | b | 2.90 | b |
| 75 | 51.0 | b | 3.80 | b |
| 50 | 90.0 | a | 5.85 | a |
MS: sales de Murashige y Skoog. Medias con letras iguales en cada columna no son estadísticamente diferentes (Tukey, P ≤ 0.05).
En el presente estudio el medio MS con la mitad de concentración de sales fue suficiente para estimular la conversión de 90 % de los embriones somáticos en plantas normales; de estas plantas, 95 % se aclimataron favorablemente y continuaron su crecimiento después del trasplante a condiciones de invernadero en una mezcla de turba y perlita (1:1).
Este documento constituye el primer reporte sobre la regeneración de plantas de heliconia mediante embriogénesis somática. El método descrito de propagación clonal in vitro favorece la obtención de un mayor número de plantas comparado con la organogénesis, y es más eficiente que la propagación convencional por división de rizomas. El protocolo aquí desarrollado podría ser utilizado para propagar especies silvestres de este género que sobresalen por su potencial ornamental en México, así como cultivares y especies comerciales que emiten pocos hijuelos al año (variedades comerciales derivadas de H. caribaea y H. vellerigera); también puede ser una herramienta útil para incrementar las poblaciones de nuevos híbridos obtenidos por mejoramiento genético y reducir el tiempo de selección.
Conclusiones
En este estudio se estableció el primer protocolo de micropropagación de H. collinsiana mediante embriogénesis somática a partir de secciones transversales de pseudotallos expuestos a concentraciones altas de 2,4-D. El análisis histológico confirmó la naturaleza embriogénica de las plantas regeneradas. Este protocolo representa una opción para la multiplicación clonal de esta especie, nativa de México, así como de otras especies silvestres, variedades comerciales o genotipos élite.











 nova página do texto(beta)
nova página do texto(beta)


