INTRODUCCIÓN
Las bacterias promotoras de crecimiento vegetal (BPCV) son habitantes naturales del suelo que pueden encontrarse en la rizósfera o en el interior de los tejidos de las plantas y son capaces de promover el crecimiento y la productividad de los cultivos (González y Fuentes, 2017). Cuando estas bacterias son susceptibles de ser aisladas y multiplicadas en laboratorio, poseen un alto potencial para ser comercializadas y usadas para mejorar el rendimiento y sanidad de los cultivos. La producción de los cultivos agrícolas utilizando BPCV es una tecnología que cada día gana mayor importancia en la agricultura de México y el mundo. Los beneficios de las relaciones asociativas que se establecen entre las plantas y las BPCV incluyen el aumento de la productividad, la calidad de las cosechas y la reducción de la incidencia de enfermedades (Aguado-Santacruz, 2012).
Los mecanismos de acción de las BPCV se dividen en directos e indirectos. Los efectos directos incluyen la producción de fitohormonas (ácido indolacético, ácido giberélico, citocininas y ácido abscísico), la capacidad de producir la enzima 1-aminociclopropano 1-carboxilato (ACC) desaminasa, que mejora el crecimiento de las plantas al reducir los niveles internos de etileno, el aumento en la asimilación de nutrientes del suelo mediante su solubilización a partir de formas complejas de elementos como fósforo, hierro y potasio, entre otros, y la fijación biológica de nitrógeno, mientras que los mecanismos indirectos se relacionan con la modificación del ambiente rizosférico y con sus actividades de biocontrol contra agentes fitopatógenos, mediante la liberación de sideróforos, β-1,3-glucanasas, quitinasas o antibióticos (González y Fuentes, 2017).
La incorporación de nitrógeno al suelo y a las plantas a partir del aporte atmosférico constituye uno de los mecanismos más importantes para el crecimiento y rendimiento de cultivos (Ariza et al., 2020), aunque la existencia de capacidades adicionales en los microorganismos para mejorar el crecimiento de las plantas, tales como la solubilización de fosfato y hierro, les confiere un valor agregado (Aguado-Santacruz, 2012). La deficiencia de hierro y fósforo representa un problema en México, en particular en el norte del país, donde la elevada concentración de sales limita fuertemente la disponibilidad de estos elementos (Romero et al., 2019). El fósforo es un nutriente limitante para las plantas ubicadas en zonas áridas, ya que aunque los suelos pueden presentar una alta concentración de este nutriente; es decir, 557-729 kg ha-1, sólo del 2.4 al 3.9 % se encuentra en formas asimilables para las plantas, el resto se encuentra en formas insolubles, tales como fosfatos de aluminio en suelos ácidos y fosfatos de calcio en suelos derivados de material parental sedimentario alcalino.
Las estrategias para corregir la baja disponibilidad de fósforo incluyen el uso de fuentes orgánicas de este elemento y la utilización de bacterias solubilizadoras de fosfatos, las cuales utilizan diferentes mecanismos, como la producción de ácidos orgánicos y enzimas fosfatasas, para convertirlo en formas iónicas solubles como la monobásica (H2PO4-) y la dibásica (HPO4-2) (Aguado-Santacruz, 2012).
Por otra parte, el hierro es el cuarto metal más abundante en los suelos;. A pesar de ésto, en presencia de oxígeno y pH neutro, este elemento es escaso y no disponible debido a la rápida oxidación de Fe2+ a Fe3+ y la subsecuente formación de silicatos de ferromagnesio, hidróxidos u óxidos de hierro, formas que no son fácilmente asimilables por las plantas; además, el pH, los contenidos de materia orgánica, la textura y aireación del suelo afectan su disponibilidad; por ejemplo, en suelos calcáreos la concentración de hierro disponible decrece rápidamente a medida que el pH incrementa; a partir de un pH de 7.4, como límite inferior, la solubilidad empieza a decrecer hasta un valor de 8.5.
De acuerdo con el grupo funcional quelador del hierro, los sideróforos pueden clasificarse en catecolatos (fenolatos), hidroximatos e hidroxicarboxilatos, formas moleculares que conforman complejos octaédricos hexadentados con el metal (Miethke y Marahiel, 2007). Considerando las premisas anteriores, la búsqueda de microorganismos que sean capaces de aportar nitrógeno a las plantas en suelos con baja disponibilidad de hierro y fósforo posee una gran importancia para la agricultura nacional y mundial, pues es necesario consolidar una producción de alimentos agrícolas menos dependiente de agroquímicos, generar alimentos inocuos y desarrollar una agricultura con un impacto mínimo al ambiente. En esta investigación se planteó el objetivo de identificar a nivel molecular una colección de cepas diazotróficas, aisladas a partir de maguey y analizar su potencial para solubilizar P y Fe.
MATERIALES Y MÉTODOS
Recolección de muestras
La presente investigación inició con un muestreo en el Rancho Magueyero San Isidro, ubicado a 5 kilómetros al suroeste de la localidad de Nanacamilpa de Mariano Arista, Tlaxcala en el año 2018. Los materiales de maguey utilizados para el aislamiento de bacterias incluyeron a Manso, Chalqueño, Ayoteco, Púa Larga y Carricillo. Se recolectó una penca de la sección media del maguey. Una vez realizado el trabajo de campo, se procedió al traslado de las muestras a los laboratorios de la empresa BIOqualitum S.A. de C.V. ubicados en la ciudad de Celaya, Guanajuato, para su procesamiento.
Aislamiento de bacterias
Las muestras vegetales fueron procesadas dentro de los 5 d posteriores a su colecta, considerando tres secciones de las pencas (basal, media y distal); la sección basal fue aquella más próxima a la roseta de las plantas, mientras que la sección distal incluía la púa de la penca. Se retiraron las espinas laterales y distales del maguey para facilitar su procesamiento; posteriormente, los trozos de pencas de maguey se lavaron con agua y se cortaron en cubos de 5 × 5 cm. Estos trozos se desinfectaron con etanol 70 % por 30 s y posteriormente con hipoclorito de sodio 1 % por 10 min; a continuación, los trozos de maguey se lavaron tres veces con agua destilada estéril para eliminar los restos de los desinfectantes. A los fragmentos de maguey se les retiró la epidermis, se fraccionaron en trozos más pequeños de 1 × 1 cm, se colocaron sobre sanitas estériles para eliminar el exceso de humedad y, al final, se sembraron en el medio selectivo ELMARC a 30 °C hasta observar el desarrollo de crecimiento bacteriano.
Identificación molecular
La identificación de los géneros bacterianos seleccionados requirió del cultivo de los aislados en medio Luria Bertani (LB) (extracto de levadura 10 g L-1, NaCl 10 g L-1, peptona de caseína 5 g L-1, agar 15 g L-1) (Sambrook et al., 1989) por 24 h. Después del periodo de cultivo, se tomó una alícuota de 2 mL que fue centrifugada a 12,000 rpm por 5 min; después, se extrajo el ADN genómico siguiendo el método de Sarcosina (Lopes et al., 1995). Para verificar la calidad del ADN se llevó a cabo una electroforesis en gel de agarosa 1 %; a continuación, con el uso del ADN extraído, se amplificó un fragmento de la subunidad ribosomal 16S con la técnica de PCR utilizando los iniciadores 46F (5’-GCCTAACACATGCAAGTC-3’) y 1540R (5’-AAGGAGGTGATCCAGCCGCA-3’) (Santiago-Urbina y Ruíz-Terán, 2014). La reacción de PCR se llevó a cabo en un volumen de 25 μL considerando la siguiente mezcla: dNTPs 1 μL, 0.5 μL de cada primer (46F y 1540R), 1 μL ADN Taq polimerasa Platinum, 1 μL MgCl2, 2.5 µL Buffer, 3 µL de ADN purificado y 15.5 µL de agua Mili-Q. La amplificación se llevó a cabo en un termociclador Eppendorf (Mastercycler Gradient, Eppendorf International, Hamburgo, Alemania). Las condiciones para la PCR fueron las siguientes: 94 ºC (5 min), 35 ciclos a 94 ºC (50 s), 58 ºC (50 s), 72 ºC (60 s) y finalmente 72 ºC durante 5 min. Los productos amplificados se corrieron en un gel de agarosa 1 % con una carga de 3 μL del producto de la PCR y 0.5 μL del amortiguador de carga 6x (Invitrogen) con un marcador de peso molecular de 1 kb (DNA Ladder) para determinar el tamaño de los amplicones. El gel se corrió a 85 V durante 45 min y luego se visualizó en un transiluminador de luz ultravioleta (UV). Los productos amplificados de los diferentes aislados se extrajeron del gel y se purificaron con el uso del kit QIAEX II (Quiagen), de acuerdo con las instrucciones del fabricante. El producto purificado se envió al laboratorio de secuenciación del LANGEBIO (CINVESTAV-Irapuato) para luego analizar las secuencias obtenidas en la base de datos del National Center for Biotechnology Information (NCBI) GenBank a través del programa BLAST.
Estimación de la actividad de la enzima nitrogenasa
La actividad de la enzima nitrogenasa de las bacterias diazotróficas fue estimada a través de la prueba de reducción de acetileno ARA (Chauhan et al., 2017). Las bacterias se cultivaron en matraces Erlenmeyer de 250 mL que contenían 100 mL de medio de malato semisólido libre de nitrógeno (Nfb) a 30 °C por 48 h en un agitador rotatorio a 100 rpm hasta que llegaron a la mitad de su fase exponencial. Viales de ensayo conteniendo medio Nfb libre de nitrógeno se inocularon con alícuotas de las bacterias (0.1 DO a 600 nm) y se incubaron hasta alcanzar la fase exponencial. En los tubos inoculados, la fase superior gaseosa de los viales fue reemplazada con acetileno (10 % v/v) y nuevamente se incubaron por 18 h. La producción de etileno se analizó usando un cromatógrafo de gases (Hewlett Packard, modelo HP 5890, Palo Alto, California, EUA) equipado con un detector de ionización de llama (FID) y una columna capilar.
La tasa de fijación de nitrógeno se expresó como la cantidad de etileno acumulado (mmol C2H4 ufc-1 h-1) con base en la curva estándar y el porcentaje del área pico; posteriormente, se tomó una alícuota de los cultivos para determinar las ufc de los crecimientos bacterianos por el método de dilución seriada.
Evaluación cuantitativa de solubilización de fosfatos
Las cepas de bacterias se cultivaron en caldo de sacarosa-sales basales (SB) complementado con Ca-P, con un tiempo de incubación de 40 h a 28 °C y 120 rpm (Chuang et al., 2007); después, el crecimiento de las bacterias se uniformizó a una concentración de 109 ufc mL-1 mediante el método de diluciones seriadas. Para la determinación de la actividad de solubilización de fosfato de cada cepa bacteriana se utilizó el método colorimétrico descrito por Alamgir y Marschner (2013). La técnica se estandarizó de acuerdo con las condiciones propias del equipo del laboratorio con un espectrofotómetro (JenwayTMEspectrofotómetro UV/visible 6305, Staffordshire, UK) a una absorbancia de 420 nm y el uso de una curva patrón donde se utilizó fosfato de potasio y se consideró un intervalo de concentraciones de 10 hasta 465 mg L-1 y un índice de correlación ≥ 0.95. Se mezclaron 2 mL de caldo SB con 40 µL de los cultivos bacterianos, se reservó un tubo control (sin inocular) y se mantuvieron en agitación durante 24 y 96 h a 120 rpm; luego, se centrifugaron en una microcentrífuga (Fisher ScientificTM accuSpin Micro 17, Tampa, Florida, EUA) a 5000 rpm y el sobrenadante se mezcló con el reactivo de vanadato-molibdato (Sigma-Aldrich) en una relación 1:1 con un tiempo de reposo de 10 min. Por último, se registraron las absorbancias y se establecieron las concentraciones de fosfato con la curva patrón.
Evaluación cualitativa de la producción de sideróforos
Para la prueba, se inoculó cada bacteria en caldo LB, se mantuvieron en agitación por 48 h a 120 rpm y 30 ºC. La evaluación cualitativa de la producción de sideróforos se llevó a cabo en medio cromo azurol sulfonato (CAS) (Schwyn y Neilands, 1987), el cual se dividió en cuadrantes para obtener 4 repeticiones; por último, se tomó un círculo de un diámetro de 6 mm para cada cuadrante, el cual se sumergió por medio de pinzas estériles en el caldo inoculado respectivo de cada bacteria y se colocaron en cajas Petri con medio CAS. Las placas se incubaron a 28 °C y después de 5-7 días se observó la formación de un halo naranja alrededor de la colonia analizada (producción de sideróforos).
Identificación de la naturaleza química de los sideróforos
La identificación de la naturaleza química de los sideróforos de cada cepa bacteriana seleccionada requirió de la inoculación en tubos de ensayo con 15 mL de medio succinato (g L-1): 6.0 K2HPO4, 3.0 KH2PO4, 1.0 (NH4)2SO4, 0.2 MgSO4·7H2O, 4.0 C4H4Na2O4·6H2O, a pH 7.0 y se incubaron en agitación (120 rpm) a 28 ºC por 3 d (Nair et al., 2007); posteriormente, los tubos se centrifugaron a 7000 rpm por 5 min y se recuperó el sobrenadante para su lectura en el espectrofotómetro (Jenway UV/visible), que indicó los picos de mayor absorbancia: 420 a 450 nm para sideróforos tipo hidroxamato y 495 nm para los de tipo catecolato (Baakza et al., 2004).
Evaluación cuantitativa de sideróforos
Se prepararon diluciones con las cepas de bacterias que presentaron naturaleza de tipo catecolato a una concentración de 109 ufc mL-1; después, se colocó 1 mL de caldo LB en tubos Eppendorf, se inoculó con 40 µL de los cultivos bacterianos. Se reservó un tubo con medio LB sin inocular como testigo negativo. Estos tubos se mantuvieron en una incubadora (LumistellMR IEC-36, Celaya, México) 28 °C por 24 y 96 h; posteriormente, se centrifugaron (Fisher ScientificTM accuSpin Micro 17, Tampa, Florida, EUA) a 10,000 rpm por 10 min. El sobrenadante se mezcló con el medio CAS en una relación 1:1, se mantuvo en reposo por 20 min y entonces se tomaron lecturas de absorbancia de las muestras a 630 nm empleando el medio CAS como blanco. Para construir la curva patrón se utilizó el reactivo catecol (Sigma-Aldrich), se consideró una amplitud de concentraciones de 0.15 a 0.65 mg mL-1; después, se tomó 1 mL de cada una de las mezclas anteriores, se combinó con 1 mL del medio CAS, se agitó cada tubo para homogenizar la solución y se dejó en reposo por 20 min. El blanco utilizado en este caso fue la mezcla de 1 mL de agua destilada con 1 mL de CAS. Al final, los valores de absorbancia obtenidas se graficaron en Excel para obtener la tendencia central de la recta y, de esta forma, generar una curva patrón con un índice de correlación ≥ 0.95.
RESULTADOS Y DISCUSIÓN
Identificación molecular de las bacterias y estimación de su capacidad de fijación de N2
Después de colocar los fragmentos de cada uno de los tipos de maguey muestreados en el medio de selección, fue posible observar colonias bacterianas entre 5 y 8 d después de la incubación a 30 °C. A partir de las pencas de los cinco tipos de maguey muestreados, se logró aislar un total de 18 microorganismos en el medio selectivo ELMARC. Previamente, Martínez-Rodríguez et al. (2014) aislaron 300 cepas endófitas de hojas de Agave tequilana del estado de Nayarit, México, y confirmaron que los aislados correspondían a bacterias promotoras del crecimiento de las plantas (BPCV) por su capacidad de fijación de nitrógeno; asimismo, Bautista-Cruz y Martínez-Gallegos (2020) lograron el aislamiento de tres cepas de bacterias fijadoras de nitrógeno a partir de la rizósfera de Agave angustifolia cultivado en el distrito de Tlacolula, Oaxaca, México. En el presente estudio, el análisis de las secuencias de estas bacterias en la base del NCBI indicó que 12 de estas 18 especies se ubicaron en el orden Enterobacterales (Enterobacter sp., Erwinia tasmaniensis, Leclercia sp. y un miembro no identificado de la familia Enterobacteriaceae), uno en el orden Bacillales (Bacillus mojavensis), tres en el orden Actinomycetales (Brevibacterium halotolerans, Brevibacterium brevis y Curtobacterium flaccumfaciens), uno en el orden Pseudomonadales (Acinetobacter sp.) y uno más en el orden Aeromonadales (Aeromonas caviae). Las coincidencias en cuanto a los resultados de los géneros bacterianos con los encontrados por Martínez-Rodríguez et al. (2014) incluyeron a Enterobacter sp. y Bacillus sp.
Debido a que la enzima responsable de la fijación biológica de nitrógeno ‒nitrogenasa‒ es capaz de reducir el acetileno a etileno, la prueba ARA (Acetylene Reduction Assay) se ha usado como un índice de la tasa de fijación de nitrógeno (Das y Kumar, 2018). Aunque las determinaciones cuantitativas de la fijación biológica de N2 requieren del empleo de las técnicas de 15N2, la técnica de ARA es ampliamente usada debido a que provee una manera altamente sensitiva y económica para cuantificar la actividad enzimática relativa de la nitrogenasa (Yin et al., 2015). En el presente estudio la naturaleza diazotrófica de las bacterias endófitas aisladas, establecida inicialmente por su crecimiento en el medio ELMARC, pudo ser comprobada a través de las pruebas ARA realizadas (Cuadro 1). Del grupo de bacterias que alcanzaron un crecimiento de 10-9 ufc destacaron por su capacidad de reducción de acetileno Brevibacterium halotolerans y Enterobacter cloacae (Encl1), en el de 10-8 Bacillus mojavensis y Erwinia tasmaniensis, y finalmente, en el de 10-7 Acinetobacter sp. y la cepa Ensp2 de Enterobacter sp.
Cuadro 1 Identidad de bacterias endófitas diazotróficas aisladas a partir de maguey y estimación de su capacidad de fijación biológica de nitrógeno.
| Bacteria | Código | Identidad NCBI (%) | ARA (mmol C2H4 ufc-1 h-1) |
|---|---|---|---|
| Acinetobacter sp. | Aesp | 96.85 | 4.1 × 10-7 |
| Aeromonas caviae | Aeca | 95.94 | 1.3 × 10-9 |
| Bacillus mojavensis | Bamo | 94.22 | 5.4 × 10-8 |
| Brevibacterium brevis | Brbr | 93.06 | 4.1 × 10−8 |
| Brevibacterium halotolerans | Brha | 96.67 | 3.8 × 10--9 |
| Curtobacterium flaccumfaciens | Cufl | 92.69 | 2.9 × 10-8 |
| Enterobacter cloacae | Encl1 | 96.84 | 4.1 × 10-9 |
| Enterobacter cloacae | Encl2 | 96.89 | 3.3 × 10-8 |
| Enterobacter kobei | Enko | 96.67 | 3.9 × 10-8 |
| Enterobacter ludwigii | Enlu | 95.21 | 3.2 × 10-9 |
| Enterobacter sp. | Ensp1 | 96.17 | 2.7 × 10-8 |
| Enterobacter sp. | Ensp2 | 96.44 | 2.9 × 10-7 |
| Enterobacteriaceae | Enba | 77.21 | 2.8 × 10-7 |
| Erwinia tasmaniensis | Erta | 90.88 | 4.7 × 10-8 |
| Leclercia sp. | Lesp1 | 95.20 | 2.8 × 10-7 |
| Leclercia sp. | Lesp2 | 96.20 | 1.9 × 10-9 |
| Leclercia sp. | Lesp3 | 95.91 | 3.3 × 10-8 |
| Leclercia sp. | Lesp4 | 94.30 | 2.7 × 10-7 |
Capacidad de solubilización de fosfatos
De las 18 cepas evaluadas, dos de ellas, Erwinia tasmaniensis y la cepa Ensp1 de Enterobacter sp. destacaron por ser las mejores solubilizadoras de fosfatos, al mostrar valores de solubilización a las 96 h de 56.48 y 49.51 mg L-1, respectivamente (Figura 1). Estos datos concuerdan con los referidos por Clavijo et al. (2012), quienes encontraron que de entre 104 cepas de bacterias diazotróficas nativas de la rizosfera de olivo en Perú, Erwinia tasmaniensis fue la especie con mejor capacidad solubilizadora de fosfato tricálcico; además, se ha demostrado que esta especie de Erwinia es la única considerada como no fitopatógena, ya que no produce uno de los dos exopolisacáridos importantes para la formación de biopelículas, capacidad que es necesaria para patogenicidad (Polsinelli et al., 2019). Es importante mencionar que los valores de solubilización de fosfatos encontrados en maguey para estas dos cepas bacterianas son casi la mitad de aquellos detectados para la cepa de Pseudomonas fluorescens (Psfl), 109.468 mg L-1, que fue usada como referencia en la presente investigación. Pseudomonas fluorescens es muy conocida, además de su capacidad para producir sideróforos, por su potencial para solubilizar fosfatos (Ingle y Padole, 2017). El valor de solubilización de fosfatos obtenido en el presente estudio supera en más de cuatro veces el valor de 26.57 mg L-1, consignado por Sánchez et al. (2014) para esta misma especie bacteriana.
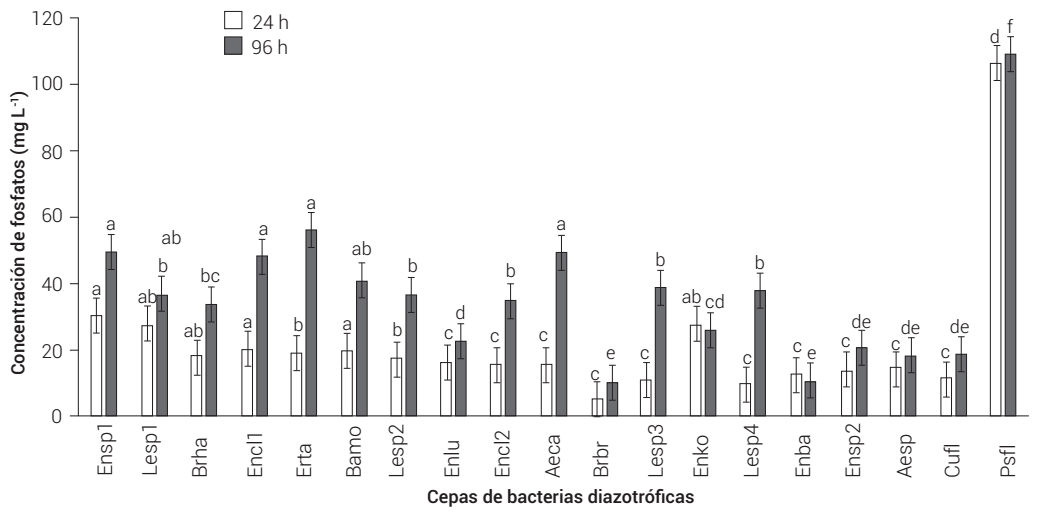
Figura 1 Capacidad de solubilización de fosfatos de las cepas de bacterias endófitas aisladas de maguey. Aeromonas caviae (Aeca), Acinetobacter sp. (Acsp), Bacillus mojavensis (Bamo), Brevibacterium brevis (Brbr), Brevibacterium halotolerans (Brha), Curtobacterium flaccumfaciens (Cufl), Enterobacter cloacae (Encl1), Enterobacter cloacae (Encl2), Enterobacteriaceae (Enba), Enterobacter kobei (Enko), Enterobacter ludwigii (Enlu), Enterobacter sp. (Ensp1), Enterobacter sp. (Ensp2), Erwinia tasmaniensis (Erta), Leclercia sp. (Lesp1), Leclercia sp. (Lesp2), Leclercia sp. (Lesp3) y Leclercia sp. (Lesp4). Las barras muestran los errores estándar de las bacterias para cada tiempo de evaluación. Distintas literales indican diferencias significativas (Tukey, P ≤ 0.05) entre las bacterias para cada tiempo de evaluación.
Capacidad de producción de sideróforos
Los resultados de la prueba cualitativa de CAS mostraron diferencias en las capacidades de las cepas endófitas diazotróficas aisladas para solubilizar hierro, lo cual se evidenció por la formación de los halos de color naranja alrededor de las colonias sembradas en el medio CAS; un halo de color naranja indica una fuerte actividad para solubilizar hierro, mientras que uno de color amarillo se relaciona con una menor capacidad de producción de sideróforos (Arora y Verma, 2017). Para llevar a cabo la determinación de la naturaleza química de los sideróforos producidos por las bacterias se descartaron seis de las 18 cepas analizadas en virtud de que, de acuerdo con la prueba cualitativa de CAS, éstas mostraron poca capacidad para solubilizar hierro [las cepas Encl1 y Encl2 de Enterobacter cloacae, Erwinia tasmaniensis (Erta), Enterobacter ludwigii (Enlu), la cepa Ensp2 de Enterobacter sp. y un miembro de la familia Enterobacteriaceae (Enba)].
De las 12 cepas evaluadas, se identificaron seis que produjeron sideróforos de tipo catecolato: Bacillus mojavensis (Bamo), Leclercia sp. (Lesp2), Aeromonas caviae (Aeca), Leclercia sp. (Lesp3), Enterobacter kobei (Enko) y Leclercia sp. (Lesp4); por otro lado, se identificaron seis cepas productoras de sideróforos de tipo hidroxamato: Enterobacter sp. (Ensp1), Leclercia sp. (Lesp1), Brevibacterium halotolerans (Brha), Brevibacterium brevis (Brbr), Acinetobacter sp. (Acsp) y Curtobacterium flaccumfaciens (Cufl); la cepa de referencia, Pseudomonas fluorescens Ag_001 (Psfl) también resultó ser un microorganismo productor de sideróforos tipo hidroxamato. Al final, sólo tres cepas bacterianas (Lesp2, Lesp3 y Lesp4) resultaron ser productoras de ambos tipos de sideróforos (catecolato/hidroxamato). Los resultados del presente estudio concuerdan con los de Nair et al. (2007), quienes mostraron que el género Pseudomonas produce sideróforos de tipo hidroxamato; así mismo, diversas investigaciones muestran que los géneros Aeromonas, Bacillus y Acinetobacter son bacterias productoras de sideróforos de tipo catecolato (Bharucha et al., 2013; Reitz y Butler, 2020).
Una vez identificada la naturaleza química de los sideróforos producidos por las microorganismos, se llevó a cabo un estudio cuantitativo de la capacidad productora de sideróforos tipo catecolato de las bacterias, debido a que los estudios sobre antagonismo de rizobacterias contra hongos fitopatógenos se han realizado principalmente en bacterias productoras de este tipo de sideróforos (Fernández-Herrera et al., 2018), además de que estos sideróforos presentan una de las constantes de formación de complejos férricos más elevada (Kf 1052), lo que le permite disociar con mayor facilidad este metal de la proteína acarreadora de hierro transferrina (Aguado-Santacruz et al., 2012).
Las mayores concentraciones de sideróforos tipo catecolato se observaron a las 24 h de crecimiento bacteriano en medio LB. La bacteria que destacó como mejor productora de sideróforos tipo catecolato fue Bacillus mojavensis (Bamo, P ≤ 0.05), la cual mostró una producción de estos compuestos de 0.669 mg mL-1, mientras que la segunda mejor productora fue la cepa Lesp2 de Leclercia sp. (0.443 mg mL-1), aunque no mostró diferencias significativas (P > 0.05) con la cepa Lesp4 de este mismo género ni con Aeromonas caviae (Figura 2). Estos valores superan por mucho los referidos por Grobelak y Hiller (2017) para diversas cepas endófitas aisladas a partir de Festuca rubra; el valor máximo de producción de sideróforos tipo catecolato entre diversas bacterias analizadas en ese estudio fue de 0.0029 mg mL-1. Por su parte, Gupta y Gopal (2008) analizaron 10 cepas de rizobacterias productoras de sideróforos, destacando las bacterias Pseudomonas fluorescens y Enterobacter sp., pero contrariamente a los resultados del presente estudio, tres cepas de Bacillus spp. no fueron capaces de producir sideróforos.

Figura 2 Capacidad de producción de sideróforos tipo catecolato a las 24 y 96 h en seis bacterias endófitas diazotróficas aisladas de maguey: Aeromonas caviae (Aeca), Bacillus mojavensis (Bamo), Enterobacter kobei (Enko), Leclercia sp. (Lesp2), Leclercia sp. (Lesp3) y Leclercia sp. (Lesp4). Las barras muestran los errores estándar de las bacterias para cada tiempo de evaluación.
Aunque las cepas Lesp2 y Lesp4 de Leclercia sp. no destacaron por ser las mejores solubilizadoras de fósforo y hierro, éstas presentaron valores por arriba del promedio, lo cual las convierte en candidatas idóneas para ser evaluadas en invernadero y campo, ya que al poder evitar algunas de las limitaciones nutricionales relacionadas con la disponibilidad de fósforo y hierro en el suelo, se esperaría que pudieran realizar una fijación biológica de nitrógeno más eficiente. Los resultados de este estudio, y los microorganismos aislados, son considerados como alternativas viables para mejorar la productividad de diversos cultivos de México.
El presente estudio está en línea con las tendencias actuales en la agricultura de Méxio, que busca implementar un nuevo modelo para la producción agrícola que reduzca el uso de agroquímicos y el impacto negativo al ambiente, y al mismo tiempo sea capaz de producir alimentos inocuos. El presente, constituye el primer estudio en el que se consignan bacterias endófitas diazotróficas aisladas de tejidos vegetales sanos de maguey y que, además, poseen capacidad para la solubilización de fosfatos y hierro. Aunque Li et al. (2020) ya han explorado con buenos resultados la posibilidad de mejorar la eficiencia de la fijación biológica de nitrógeno mediante la co-inoculación de una bacteria diazotrófica (Paenibacillus beijingensis BJ-18) y una solubilizadora de fosfatos (Paenibacillus sp. B1), en esta investigación se buscó identificar bacterias endófitas de maguey con capacidad de fijación biológica de nitrógeno, que además pudieran solventar deficiencias nutricionales relacionadas con la presencia de formas insolubles de fósforo y hierro en el suelo; aunque destacaron Erwinia tasmaniensis por su capacidad para solubilizar fosfatos y Bacillus mojavensis por su producción de sideróforos, se identificaron algunas otras cepas con capacidades intermedias en estas variables (e.g., las cepas Lsp2 y Lsp4 de Leclercia sp.), lo cual las convierte en modelos de estudio interesantes para evaluar su impacto sobre el crecimiento de cultivos desarrollados en suelos con limitaciones de hierro y fósforo. Actualmente se están realizando ya pruebas de campo que permitan analizar la factibilidad de su empleo para aumentar la rentabilidad de los cultivos hortícolas en virtud del actual encarecimiento sin precedente de los agroquímicos en México.
CONCLUSIONES
Los resultados indican que el acervo bacteriano del maguey no permite seleccionar cepas que puedan fijar nitrógeno y que además puedan solventar deficiencias nutricionales relacionadas con la disponibilidad de hierro y fósforo. Dado que esta situación es muy común en muchos de los suelos de México, es muy importante validar este enfoque dual bajo condiciones de campo. Evaluaciones preliminares en campo e invernadero permiten visualizar la posibilidad de utilizar estas cepas para mejorar la productividad de los cultivos de México en condiciones limitativas de Fe y P.











 nova página do texto(beta)
nova página do texto(beta)


