INTRODUCCIÓN
La roya amarilla, causada por el hongo Puccinia striiformis f. sp. tritici W. (Pst), es actualmente una de las enfermedades más importantes del trigo en México y en el mundo (Beddow et al., 2015). La resistencia genética a la enfermedad sigue siendo el enfoque más sostenible y ecológico; sin embargo, debido a la constante evolución del hongo hacia nuevas combinaciones de virulencia, el reto de encontrar las mejores combinaciones de genes que confieran resistencia a la roya amarilla existentes o la búsqueda de nuevas fuentes de resistencia sigue siendo una de las actividades más importantes tanto para los fitopatólogos como para los mejoradores (Juliana et al., 2020).
A la fecha, se han catalogado más de 78 genes que confieren resistencia a la roya amarilla (Wang et al., 2017). La mayoría de estos genes son de raza específica que pueden conferir casi inmunidad, una respuesta de hipersensibilidad alta, o bien, niveles intermedios en su tipo de infección (Wang et al., 2017), tanto en el estado de plántula o en la hoja bandera en la etapa de planta adulta. Los genes del grupo que confiere resistencia de raza especifica, por su modo de actuar, se clasifican en dos tipos principalmente: 1) aquellos que, en ausencia de virulencia del patógeno, actúan en todas las etapas de crecimiento de las plantas, y 2) los que no son funcionales en estado de plántula, pero efectivos en el estado adulto de la planta, también conocidos como genes que confieren resistencia de planta adulta (RPA) (Singh et al., 2003). Existen también otros genes de raza no especifica y más efectivos en la hoja bandera; es decir, en planta adulta como Yr18, Yr29, Yr30 y Yr46, que confieren resistencia de desarrollo lento de la enfermedad (Huerta-Espino et al., 2020).
Yr78 es un gen de resistencia típico de planta adulta (RPA) que confiere resistencia específica a distintas razas del hongo causante de la roya amarilla y recientemente identificado por Dong et al. (2017) en la línea de trigo harinero del Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT) PI52108 (HORK/KALYANSONA), entre otras. Las plantas que sólo poseen el gen Yr78 son susceptibles en etapa de plántula, pero en el estado de desarrollo de planta adulta la hoja bandera muestra una clorosis y necrosis muy pronunciada, típica respuesta de alta hipersensibilidad (Sanzón y Zavaleta, 2011). El gen asociado a esta respuesta se encuentra localizado en el cromosoma 6BL ligado al marcador molecular IWA7257-Yr78 (Dong et al., 2017).
HORK, unos los progenitores de PI520108, es una línea derivada de la cruza HOPPS/ROBIN-México//KALYANSONA, identificada con el número de cruza CM8874, realizada en México y enviada a otras partes del mundo para su evaluación desde 1973 (Skovmand et al., 1997). La línea HORK se liberó como variedad con el nombre de Huasteco M81 en 1981 para su cultivo en el Noreste de México (Cervantes, 1981). Dado que no se ha notificado ningún gen específico de resistencia en las plantas adultas de Kalyansona (Siete Cerros T66), aparte de Yr29 que es de raza no especifica, y dada la importancia de la roya amarilla y la necesidad de identificar nuevas fuentes de resistencia, se plantea el siguiente estudio cuyo objetivo fue probar la respuesta a la roya amarilla de HORK (Huasteco M81) y determinar la presencia de Yr78 en líneas que presenten HORK en su pedigrí, así como en líneas derivadas; además, determinar la frecuencia de Yr78 en líneas avanzadas de reciente creación por el programa de trigos harineros del CIMMYT.
MATERIALES Y MÉTODOS
Material vegetal
Se identificaron 1023 accesiones en el banco de germoplasma del CIMMYT que llevan a HORK como progenitor en su pedigrí; de éstas, 106 son de triticale (× Triticosecale spp.) y 917 líneas de trigo harinero (Triricum aestivum L.) desarrolladas durante las décadas de los 1970s y 1980s, mismas que fueron incluidas en los diferentes viveros internacionales distribuidos por el CIMMYT, como el IBWSN, SAWSN y HRWSN. De las accesiones identificadas, se tomó un subconjunto representativo de las diferentes cruzas, tomando el menor número de líneas hermanas. Los genotipos seleccionados para su evaluación representan el 12 % de la muestra (117 líneas) aproximadamente. Se utilizaron como testigos de referencia de los genotipos el diferencial que posee Yr78, GID 8249784 y Huasteco M81 (GID 422381).
Análisis molecular
El análisis molecular se llevó a cabo en el laboratorio de Biotecnología del Programa de Mejoramiento Molecular de Trigo en el CIMMYT. Las 117 líneas y los testigos Yr78 [GID 8249784 y Huasteco M81 (GID 422381)] fueron sembradas en charolas de plástico que contenían suelo estéril. Se marcaron pequeños orificios y se colocaron de ocho a 10 semillas por línea, para acomodar 24 líneas por charola.
Para la extracción de ADN se colectaron porciones del tejido foliar en plántulas de 16 días de edad y se colocaron en tubos de 1.1 mL en placas de 96 tubos; posteriormente, se almacenaron en un ultracongelador a -80° C por 3 h y se transfirieron a un liofilizador manteniendo la temperatura a -50° C y un nivel de vacío de 0.0 a 0.120 mbar por 48 h; posteriormente, usando un molino (GenoGrinder 2010, Metuchen, New Jersey, EUA) se molió el tejido colocando balines de acero de 4 mm por 2 o 3 min hasta obtener el tejido. La extracción, cuantificación y valoración de la calidad del ADN se realizó de acuerdo con los protocolos de laboratorio y aplicaciones para trigo descritos por Dreisigacker et al. (2016).
Se utilizó el marcador co-dominante IWA7257-Yr78 con la tecnología de genotipificación Kompetitive Allele Specific PCR Genotyping System. La mezcla de reacción fue de 12 µL de 100 µM iniciador FAM, 12 µL de 100 µM iniciador VIC, 30 µL de 100 µM iniciador común (reversa), éstos a una concentración de 100 µM cada uno agregando 46 µL de H2O dd, 30 µL de 100 µM iniciador común (reversa). El volumen total de la reacción de PCR fue de 4 µL: 2 µL de mix de reacción PACETM genotyping master mix 1X (3CR Bioscience, Harlow, UK), 0.07 µL de la mezcla de los iniciadores de ensayo y 2 µL de H2O dd; previamente, se adicionaron en la placa de PCR 3 µL de ADN (~50 ng µL-1), que fueron secados a 65 °C durante 50 min. Las condiciones de amplificación consistieron de una desnaturalización inicial a 94 °C por 15 min, seguido por 11 ciclos de ‘touch down’ [94 °C por 30 s, 65 °C por 1 min (disminuyendo 0.8 °C por ciclo), 72 °C por 30 s], 26 ciclos de 94 °C por 30 s, 57 °C por 1 min, 30 °C por 30 s), 1 ciclo de 72 °C por 2 min, y finalmente, incubación a 20 °C por 5 min.
Se incluyeron muestras control VIC y FAM, correspondientes a los alelos positivo y negativo, HET (heterocigotos) y muestra en blanco (agua), además de los testigos positivos para Yr78 Blanca Grande Summit 515 y Tepoca M86; los negativos Jagger y Chinese Spring. La lectura de las placas del producto de PCR se realizó en un lector de placas fluorescentes (BMG Pherastar Plus, BMG Labtech, Ortenberg, Alemania) y para la visualización gráfica de datos genotípicos se utilizó el software KlusterCaller TM (Biosearch Technologies, Hoddesdon, UK). Se consideraron como positivos los datos genotípicos que presentaron el alelo favorable para resistencia a roya y como negativos a los datos genotípicos que no portaban el alelo.
Evaluación en invernadero, etapa de plántula
Las líneas se sembraron en charolas de plástico de 20 × 30 × 6 cm, mismas que se llenaron con suelo estéril, se marcaron pequeños orificios y se colocaron ocho semillas por línea, cada charola con 24 líneas; posteriormente, 14 días después de la siembra, las plántulas se inocularon con una suspensión de urediniosporas de las razas de roya amarilla MEX14.191, cuya fórmula de avirulencia/virulencia es Yr1, 5a, 5b (Sp) 10, 15, 24, 26, Poll/Yr2, 3, 6, 7, 8, 9, 17, 27, 31, 32, y MEX17.83, con fórmula de avirulencia/virulencia Yr1, 5a, 5b (Sp) 10, 15, 24, 26, 27, 31, Poll/Yr2, 3, 6, 7, 8, 9, 17, 32 (Huerta-Espino et al., 2015). Las urediniosporas fueron suspendidas en aceite mineral (Soltrol ® , Chevron Phillips Chemical Company, The Woodlands, Texas, EUA) a una concentración de 5 mg de urediniosporas por mL de aceite (Huerta-Espino et al., 2020; Randhawa et al., 2018) y asperjadas con un atomizador conectado a un compresor eléctrico (Valdez-Rodríguez et al., 2020). Las plántulas inoculadas se colocaron en una cámara de incubación a temperatura de 7 ºC por 24 h y rocío (humedad relativa) al 100 %; posteriormente, se trasladaron al invernadero con una temperatura máxima de 18 o C y después de 15 d de inoculación se registró su reacción a la roya amarilla mediante la escala de 1-9 propuesta por McNeal et al. (1971), donde las lecturas del 1 al 6 se consideran resistentes y del 7 al 9 susceptibles.
Evaluación en el invernadero, etapa de planta adulta
Cada uno de los 117 genotipos derivados de HORK y los testigos correspondientes fueron sembrados en macetas de plástico que contenían suelo esterilizado para realizar la evaluación en planta adulta. A los 65 días después de la siembra los genotipos fueron inoculados con la raza de roya MEX 14.191, asperjando las urediniosporas suspendidas en aceite mineral con un atomizador conectado a un compresor de aire eléctrico, únicamente en la hoja bandera; posteriormente, las plantas se mantuvieron en una cámara de incubación en las mismas condiciones descritas para las plántulas. La evaluación de la severidad de la enfermedad se realizó 15 días después de la inoculación, adaptando las escalas propuestas por McNeal et al. (1971) y Kishii et al. (2019).
Evaluación de campo
Los 117 genotipos y los respectivos testigos se sembraron en un ensayo de campo siguiendo un diseño completamente al azar con dos repeticiones en surcos dobles de 1.0 m de longitud y espaciados a 0.3 m. Se sembraron aproximadamente 100 semillas por parcela. Los surcos del esparcidor de inóculo constituido en partes iguales por las variedades susceptibles Morocco, Nana F2007 y PBW343, genotipos con genes de resistencia específicos como Borlaug 100 (Yr17), Murga (YrMga) y las diferenciales de Avocet YR17/6*AOC (Yr17), AOC-YrA*3/PASTOR (Yr31) y seis líneas de la cruza AOC-YrA/ATTILA (Yr9 + Yr27) se inocularon con urediniosporas frescas de la raza MEX14.191. Las esporas del hongo activadas se utilizaron para hacer una suspensión de 5mg mL -1 de aceite mineral Soltrol 170 y se inocularon alrededor de la etapa de encañe. La enfermedad se evaluó 2-3 veces; la severidad se midió por el porcentaje de área de la hoja cubierta por las colonias o pústulas del patógeno (Kishii et al., 2019); al mismo tiempo, la reacción de la planta se evaluó por el método de Roelfs et al. (1992). Cuando las hojas no presentaron lesiones o sólo mostraron clorosis, se registraron como resistentes (R); cuando las hojas mostraron uredíneas rodeadas de necrosis o clorosis se registraron como moderadamente resistentes (MR); una reacción de susceptibilidad moderada (MS) se registró cuando las hojas presentaron uredíneas con ausencia de necrosis y clorosis; cuando las hojas mostraron respuestas de MRMS o la combinación de MR y MS y presentaron uredíneas rodeadas de necrosis y un nivel de infección moderada o clorosis, se registraron como M; y S se registró cuando las hojas mostraron grandes áreas cubiertas de uredíneas o lesiones sin tejido necrótico o clorosis (Kishii et al., 2019).
RESULTADOS Y DISCUSIÓN
Relación entre el marcador y la resistencia a roya
Del grupo de las 117 líneas derivadas de HORK, el 76 % fueron positivas para el marcador molecular IWA7257-Yr78 (Figura 1). De los genotipos positivos, el 73 % fueron susceptibles en etapa de plántula a la raza de roya amarilla MEX14.191, con un comportamiento similar al de los testigos Yr78 y Huasteco M81, mientras que el 27 % restante fueron resistentes a la misma raza en estado de plántula (Figura 2A). De las líneas que resultaron negativas para el marcador Yr78, 68 % fueron susceptibles y 32 % resistentes en estado de plántula (Figura 2B). Los genotipos susceptibles en estado de plántula indicaron la ausencia de otros genes no identificados de raza específica efectivos contra la raza MEX14.191, mientras que en los genotipos resistentes existe por lo menos un gen de resistencia efectivo contra la misma raza, independientemente de si fueron positivos o negativos para el marcador Yr78.
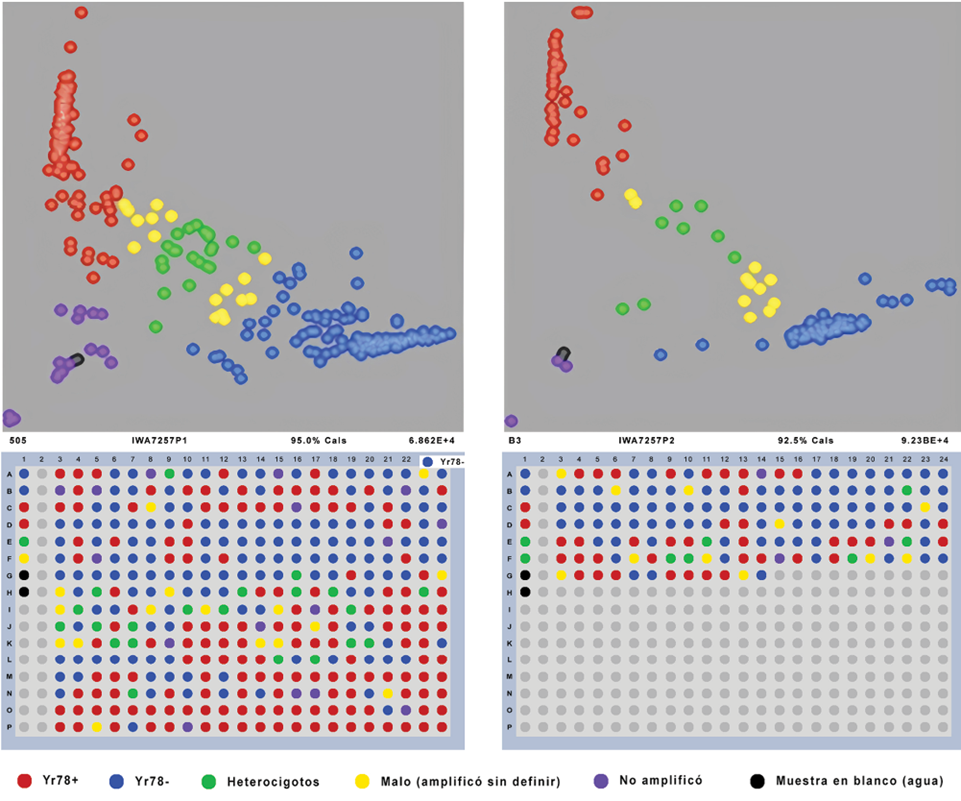
Figura 1 Visualización gráfica de datos genotípicos de líneas de trigo derivadas de HORK con el marcador IWA7257-Yr78.

Figura 2 Porcentajes de infección de roya amarilla en planta adulta en el campo y número de líneas derivadas de HORK. A) positivas para el marcador IWA7257-Yr78, B) negativas para el marcador IWA7257-Yr78. SP M+: susceptible en plántula y positivas para el marcador, RP M+: resistente en plántula y positivas para el marcador, SP M-: susceptible en plántula y negativas para el marcador, RP M-: resistente en plántula y negativas para el marcador.
Cuando estos mismos genotipos fueron evaluados con la raza MEX17.83 en estado de plántula también se observó la presencia de genotipos susceptibles y resistentes; en este caso, los testigos Yr78 y Huasteco M81 (HORK) permanecieron susceptibles en plántula; sin embargo, con esta raza, cuya fórmula de avirulencia/virulencia difiere de la de MEX14.191. Se observó que de los 64 genotipos susceptibles a la raza MEX14.191 en plántula y positivos al marcador Yr78, 50 % permanecieron susceptibles y 50 % resistentes cuando se inocularon con la raza MEX17.83 (Figura 3A); el cambio puede explicarse en este caso por la presencia de Yr27, que es común en el germoplasma mexicano, presente en las variedades Opata M85 y Bacanora T88 incluidas en el juego de diferenciales como Yr27, o bien por el gen Yr31, que es muy común en variedades relacionadas con Rebeca F2000 y Pastor incluidos en el grupo de diferenciales, u otros genes de resistencia para los cuales MEX17.83 es avirulenta.
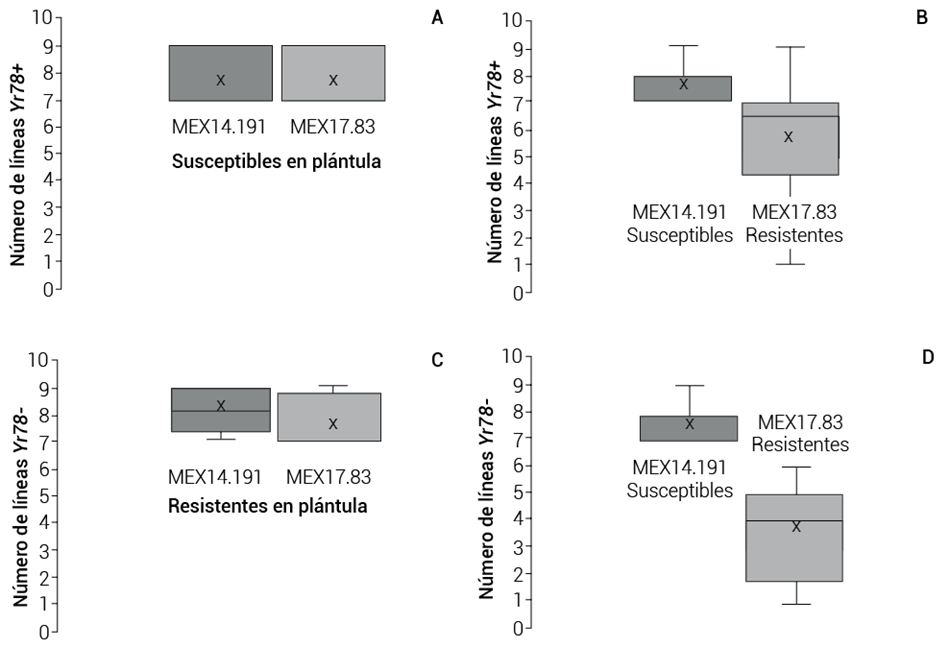
Figura 3 Respuesta de los genotipos evaluados en plántula a las razas MEX14.191 y MEX17.83 positivos y negativos al marcador IWA7257-Yr78. A) líneas susceptibles en plántula a MEX14.191 y MEX17.83 positivas a Yr78, B) líneas susceptibles en plántula a MEX14.191 pero resistentes a MEX17.83 positivas a Yr78, C) líneas resistentes a MEX14.191 y resistentes a MEX17.83 negativas a Yr78, pero con un tipo de infección más bajo, D) líneas susceptibles a MEX14.191 y resistentes a MEX17.83 negativas a Yr78.
De los 24 genotipos que fueron resistentes en plántula y positivos al marcador Yr78, 21 permanecieron resistentes y sólo tres fueron susceptibles, lo que indica que MEX17.83 posee virulencia adicional para otros genes no identificados en estado de plántula y que no se reflejan en la fórmula de avirulencia/virulencia.
De las 20 líneas negativas al marcador Yr78, también susceptibles en plántula a la raza MEX14.191, ocho permanecieron susceptibles y 12 presentaron resistencia a la raza MEX17.83 (Figura 3B), lo que se explicaría por la presencia de Yr27 y Yr31, solos o combinados.
De las nueve líneas restantes resistentes a MEX14.191 y negativas para el marcador Yr78, ocho permanecieron resistentes y sólo una cambió de resistente a la raza MEX14.191 a susceptible a la raza MEX17.83.
Los datos de planta adulta en invernadero se usaron para confirmar la efectividad del gen Yr78 y el tipo de infección para los casos de niveles altos de hipersensibilidad con clorosis y necrosis pronunciada, incluyendo el testigo Yr78, pero más atenuada en el caso de Huasteco M81 (no se muestran datos).
Evaluaciones de campo
En el campo, las líneas susceptibles en plántula y positivas para el marcador mostraron un nivel de infección que osciló entre 0 (cero) y 80M, mientras que en las líneas que fueron resistentes en etapa de plántula los porcentajes de infección en la hoja bandera fueron de 5 a 60M. Resultados similares se observaron entre las líneas negativas para el marcador, donde los genotipos susceptibles en plántula se clasificaron en campo entre 10 y 50M, en tanto que, los materiales resistentes oscilaron entre 5 y 40M, denotando la presencia de otros genes de resistencia efectivos en todas las etapas, así como también, la presencia de otros genes de resistencia de planta adulta.
De acuerdo con los resultados de Dong et al. (2017), Yr78 no fue eficaz contra Pst en plántula, definiéndolo como un gen que confiere resistencia en planta adulta (RPA), lo que fue confirmado en el presente estudio; además, Huasteco M81 y Náhuatl F2000 han sido probadas y su resistencia permanece efectiva (Yr78) contra las razas Pst presentes en experimentos de campo realizados en el oeste de USA entre 2011 y 2016 (Chen, Com. Pers.)1. Se prevé que este gen esté presente en baja frecuencia en el germoplasma de trigo sembrado en esa zona de los Estados Unidos, y que pueda proporcionar una herramienta útil para diversificar las fuentes de resistencia contra este patógeno, a diferencia de México, donde HORK ha sido expuesta a las poblaciones del patógeno desde 1974, y posteriormente con las variedades Harrier, Corrydon, Husteco M81, Náhuatl F2000 y Rebeca F2000, entre otras.
Yr78 se identificó como QYr.ucw-6B asociado con el marcador IWA7257 (alelo de resistencia relacionado al nucleótido T) con base en un estudio de asociación de genoma completo (GWAS) (Maccaferri et al., 2015). Yr78 fue validado en 10 cruzas de poblaciones biparentales y se mapeó a 0.6 cM próximo a IWA7257 y 3.9cM distal a IWA4408 y wmc737 (Dong et al., 2017). Yr78 está presente en el germoplasma PI 520108 proveniente de México y confirmado en el presente estudio, además de otros genotipos de trigo harinero, incluyendo a PI 192493 de Mozambique (Pusa Florence), PI 519805 de Uruguay, PI 494101 de USA, PI 532116 de Egipto, PI 191351 (Novinka) de Rusia, PI 286543 de Ecuador, PI 351878 de Burundi, PI 520265 de USA y PI 520378 de Siria (Dong et al., 2017; Maccaferri et al., 2015). El alelo T del marcador IWA7257 es un buen marcador de diagnóstico para detectar la presencia de Yr78 debido a su cercanía física con el gen. Es muy probable que el marcador QYr.sun-6B en la variedad Janz corresponda a Yr78 (Bariana et al., 2010), al igual que en Stephens (Santra et al., 2008), ya que ambos fueron positivos al alelo T de IWA7257.
Una vez validado el marcador en las líneas derivadas de HORK, éste se usó para determinar la frecuencia del gen en viveros del CIMMYT de reciente creación, incluyendo el vivero de selección internacional de trigo harinero (IBWSN), el vivero de selección de trigo para zonas áridas (SAWSN) y el vivero de selección de trigo para precipitación alta (HRWSN). Los resultados indicaron que 396 de 621 genotipos probados (64 %) fueron positivos para el marcador (61 % en el vivero 52IBWSN, 65 % en el vivero 37SAWYT y 70 % en el vivero 30HRWSN (Figura 4). En todas las líneas que componen estos viveros los niveles de infección en planta adulta son muy bajos en las condiciones de prueba en México y con las razas antes mencionadas, debido a la presencia de otros genes de resistencia efectivos en plántula y planta adulta.
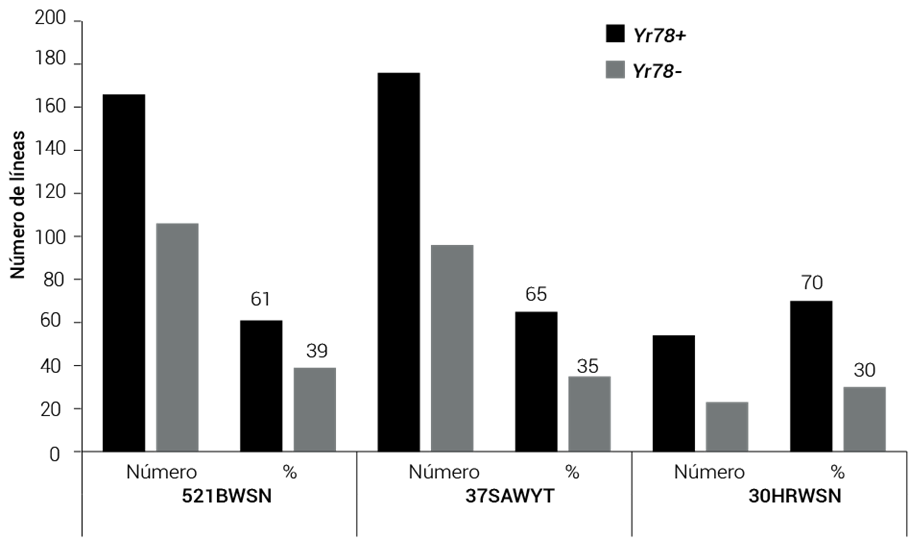
Figura 4 Número de líneas positivas y negativas al marcador Yr78 en tres diferentes viveros internacionales de trigo harinero.
A pesar de que Yr78 parece ser parcialmente eficaz en Norteamérica a la población Pst actual de roya amarilla, la eficacia global en otras áreas epidemiológicas sigue siendo desconocida. Aun cuando el gen de resistencia Yr78 ha sido descubierto y catalogado recientemente, su frecuencia en el germoplasma mexicano y en los viveros internacionales de reciente creación indica que Yr78 es más común de lo inicialmente esperado y por lo menos ha sido expuesto a las poblaciones del patógeno por más de 50 años.
Es necesario desarrollar un probador con Yr78 para medir la efectividad de dicho gen en ausencia de otros genes de resistencia; entre tanto, Yr78 debe formar parte del complejo genético en las variedades resistentes a roya amarilla; por ejemplo, el genotipo identificado como GID685306 alcanzó un nivel de 80 % de infección, lo que indica que Yr78 protege en un 20 % cuando se encuentra solo, pero contribuye significativamente en reducir la enfermedad en presencia de otros genes, como en el caso de Huasteco M81 que posee los genes Yr18, Yr29 y Yr30 (Huerta-Espino et al., 2020), el cual presentó un 50 % de infección y un comportamiento similar a Pfau, Warbler y Tomas Catedral, todas positivas para el marcador Yr78. Otros genotipos susceptibles en etapa de plántula y positivos para el marcador Yr78 fueron Anáhuac F2000, Yukón y Xequijel 88 con 20 % de infección y Dayma 96 con 15 %, denotando que, además de Yr78, existen otros genes de resistencia en estos genotipos.
CONCLUSIONES
Se confirma que el gen Yr78 que confiere resistencia roya amarilla en trigo es efectivo sólo en planta adulta. El marcador molecular IWA7257-Yr78 puede usarse para verificar su presencia en cualquier etapa de desarrollo de la planta en un programa de selección asistida por marcadores en trigo. El gen Yr78 existe en más del 60 % del germoplasma de trigo harinero disponible en México. Las evaluaciones de invernadero y de campo en etapa adulta indicaron que Yr78 induce una fuerte clorosis y necrosis, pero no reduce la severidad de la enfermedad suficientemente. Yr78 debe utilizarse en combinación con otros genes de raza específica o genes de desarrollo lento de la roya amarilla, incluyendo Yr18, Yr29, Yr30 y Yr46.











 nueva página del texto (beta)
nueva página del texto (beta)


