Introducción
La Orinoquía Colombiana contribuye con cerca del 90 % de la producción nacional de soja, siendo el departamento del Meta el mayor productor con 100,000 t por año, dirigidas a la elaboración de concentrados de la cadena avícola y porcícola (Fenalce, 2020).
Phytophthora sojae Kaufm. & Gerd., causante de la pudrición de raíces y tallo, se considera uno de los patógenos más limitantes del cultivo en el mundo (Dorrance, 2018; Dorrance y Grünwald, 2009; Zhang et al., 2010). En Colombia, P. sojae se reportó por primera vez en el Valle del Cauca en el año de 1985 (Granada y Varón de Agudelo, 1986) y seis años después en el piedemonte llanero (Montoya, 1991). En esta misma subregión, para el año 2000, la enfermedad presentó niveles de incidencia cercanos al 41 %, presentando pérdidas del 26 % de la producción en la variedad Corpoica Orinoquia 3 (Tapiero y Rey, 2006; Valencia et al., 2005). Recientemente, el patógeno se ha reportado en la región de la altillanura plana del Meta con un 8 % de incidencia en lotes comerciales (López-Casallas et al., 2020).
Phytophthora. sojae es un patógeno asociado al suelo, siendo las oosporas su principal fuente de inóculo, ya que se producen en cantidades masivas en raíces durante una epidemia y pueden sobrevivir en residuos de cosecha y en el suelo por más de 10 años. Las oosporas germinan cuando la temperatura y el nivel de humedad del suelo son adecuados para formar esporangios, liberación de zoosporas y desplazamiento hacia la planta hospedante (Dorrance, 2018). A nivel mundial, los métodos más comunes de inoculación de P. sojae son los basados en micelio y oosporas como fuente de inóculo, para evaluar su patogenicidad y determinar la respuesta de diferentes cultivares de soja a su inoculación; de ellos, el más utilizado es la inserción de un pequeño trozo de agar conteniendo micelio en una incisión longitudinal en el hipocótilo de plantas jóvenes (Dorrance, 2018; Jiménez y Lockwood, 1980); por el contrario, los métodos de inoculación basados en esporangios como fuente de inóculo no han sido los más utilizados en P. sojae, por la dificultad en la inducción de esta estructura en condiciones in vitro.
Entre las prácticas más destacadas de manejo integrado de la enfermedad se encuentra la generación y uso de variedades con fuentes de resistencia al patógeno (Dorrance et al., 2008; Schmitthenner, 1985; Schneider et al., 2016; Wu et al., 2011). Desde los años 1980s, la combinación de los genes específicos de resistencia (Rps) y la resistencia parcial es la estrategia que ha ofrecido mayor protección, especialmente en zonas donde se encuentra gran variedad de patotipos de este patógeno (Dorrance y Schmitthenner, 2000; Schmitthenner, 1985); por lo tanto, los programas de mejoramiento han requerido de una constante evaluación de la resistencia de los genotipos, que requieren de la disponibilidad de métodos de inoculación eficientes (Cardona-Piedrahita y Castaño-Zapata, 2019).
El crecimiento del cultivo de soja en la Orinoquia colombiana ha generado la necesidad de buscar nuevos recursos genéticos con adaptación específica, altos rendimientos y resistencia a enfermedades. Por la importancia que representa el cultivo de la soja en esta región, y considerando que en la agricultura moderna la práctica más eficiente para la reducción de pérdidas de cosecha ocasionadas por P. sojae ha sido la utilización de variedades con fuentes de resistencia, se propuso el desarrollo de este trabajo de investigación a fin de comparar metodologías para selección por resistencia a Phytophthora sojae en plántulas de soja bajo condiciones de casa de malla, con el objetivo principal de identificar un método de inoculación eficiente para seleccionar masivamente germoplasma de soja por su respuesta a este patógeno y de esta manera contribuir al programa de mejoramiento de soja de la Corporación Colombiana de Investigación Agropecuaria, AGROSAVIA.
Materiales y métodos
Área experimental
El ensayo se realizó en casa de malla anti áfidos, bajo las condiciones del Centro de Investigación La Libertad (04° 03’ latitud norte y 73° 29’ longitud oeste, altitud de 336 msnm, temperatura máxima promedio de 30.9 °C, temperatura mínima promedio de 22.01 °C y humedad relativa promedio de 81.45 %), en macetas plásticas de 40 cm de diámetro y 50 cm de alto conteniendo 2 kg de suelo caolinítico extraído del mismo centro de investigación, clasificado como Typic Hapludox (Amezquita, 1999) de terraza alta del piedemonte llanero.
Inóculo de P. sojae
Para las pruebas de inoculación se empleó una cepa de P. sojae previamente evaluada, seleccionada por su alta virulencia y codificada como 5057302, proveniente de la colección de trabajo de oomycetes de AGROSAVIA, colecta enmarcada en el permiso conferido a AGROSAVIA bajo la resolución del ANLA No 1466 de diciembre 03 de 2014, Colombia. El aislamiento fue recuperado de una planta de soja de la variedad Panorama 29, con síntomas de pudrición de raíces y tallo en el año 2016 en el municipio de Puerto López, vereda Carubare, en la Estación Experimental Taluma, departamento del Meta (4° 22´ 42.232” Latitud N, 72° 13’11,421” Longitud W). El aislamiento del oomycete se realizó utilizando los protocolos estandarizados en el laboratorio, los cuales fueron purificados a partir de una oospora, su identificación morfológica fue confirmada por secuenciación de la región ITS y se aplicaron postulados de Köch, como fue descrito por López-Casallas et al. (2020).
Métodos de inoculación
Inoculación directa al hipocótilo con discos de agar (Laviolette y Athow, 1981)
Se preparó agar V8 (jugo V8 180 mL L-1, CaCO3 2 g L-1, agar 15 g L-1, Rifampicina 750 ppm) y se inoculó con un disco de micelio del aislamiento P. sojae 5057302 de 10 días de edad. Se realizó incubación durante 10-14 días a 28 ° C ± 2 º C en oscuridad. El día de la inoculación se cortaron discos de micelio de 0,4 cm de diámetro y se insertaron en un corte longitudinal dentro del hipocótilo. La herida fue cubierta con vaselina para evitar la desecación del inóculo y se cubrió con cinta.
Palillos colonizados con el microorganismo (Keeling, 1982; Yorinori, 1996)
Usando discos de papel filtro perforados simétricamente con ayuda de una aguja histológica, se incrustaron puntas de palillos a una altura menor que la altura de la caja de Petri para permitir el cierre. El montaje fue esterilizado mediante una autoclave por 15 min a 121 °C y, posteriormente, fue vertido Agar V8 (jugo V8 180 mL L-1, CaCO32 g L-1, agar 15 g L-1), de modo que aproximadamente 2 mm de las puntas quedaron fuera de la superficie y se dejó solidificar. Inmediatamente se sembraron nueve discos de micelio del aislamiento P. sojae 5057302, teniendo 10 días de edad, colocando la superficie colonizada hacia abajo; se realizó incubación en oscuridad a 28 ºC durante 10 a 14 días hasta la colonización del micelio en la totalidad de la punta del palillo.
Inyección directa al tallo con macerado de micelio (Schmitthenner et al., 1994)
El inóculo se preparó siguiendo la metodología descrita previamente para el método de inoculación con los discos de agar. El día de la inoculación se cortaron tiras del medio de cultivo con micelio con ayuda de un bisturí previamente flameado y enfriado. Las tiras se colocaron en una jeringa de 20 mL y, con el émbolo, se presionó hacia el extremo sin aguja para obtener una solución de inóculo compuesta por el macerado del medio con la colonia. Este proceso se repitió dos veces para homogenizar el macerado de micelio y oosporas (200-400 UFC mL-1), con el cual se llenó la jeringa, colocando una aguja de 0.8 mm (calibre 18). Para la inoculación, se realizó un corte en el hipocótilo de 1 cm de longitud con ayuda de la aguja, comenzando aproximadamente a 0.5 cm por debajo de los cotiledones, y se inyectó aproximadamente 0.1 mL del macerado en la ranura.
Evaluación de los métodos de inoculación
Para la evaluación de los tres métodos de inoculación se usaron dos variedades de soja susceptibles a P. sojae como testigo susceptible universal y testigo susceptible local, Williams y Corpoica Orinoquia 3, para cada tratamiento se sembraron 15 semillas en macetas, conteniendo aproximadamente 2 kg de suelo con corrección del pH, suficiente para obtener entre 10 y 15 plántulas para ser inoculadas por repetición para un total de tres repeticiones. Entre 11 y 15 días después de la siembra, las plántulas de cada tratamiento se inocularon en aproximadamente 1 cm por debajo del cotiledón (Costamilan y Clebsch, 2016). El daño mecánico de la aplicación de cada método en las plántulas inoculadas fue analizado en ausencia o presencia del patógeno para corroborar que la respuesta del material de soja fuera causada por el patógeno y no por las heridas ocasionadas en el tallo, previas a la inoculación. Después de la inoculación, las plántulas se mantuvieron en cámara húmeda dentro de la casa de malla por 48 h y se evaluaron diariamente por 30 días, en los cuales se realizó el registro de las variables.
Diseño y unidad experimental
Se utilizó un diseño de bloques completos al azar con arreglo factorial (3 × 2 × 2), para un total de 12 tratamientos: tres métodos de inoculación (inyección, palillos y discos de agar), dos variantes de inoculación (con y sin inóculo), dos variedades (Williams y Corpoica Orinoquía 3) y tres repeticiones. La unidad experimental comprendió entre 10 a 15 plántulas por repetición. Los tratamientos se describen en el Cuadro 1.
Cuadro 1 Estructura de los tratamientos conformados por los métodos, fuentes de inoculación y variedades.
| Tratamientos | Métodos de Inoculación | Fuentes de Inoculación | Variedades |
| 1 | Palillos | Con aislamiento 5057302 | Williams |
| 2 | Inyección | Con aislamiento 5057302 | Williams |
| 3 | Discos de agar | Con aislamiento 5057302 | Williams |
| 4 | Palillos | Con aislamiento 5057302 | Orinoquia 3 |
| 5 | Inyección | Con aislamiento 5057302 | Orinoquia 3 |
| 6 | Discos de agar | Con aislamiento 5057302 | Orinoquia 3 |
| 7 | Palillos | Sin aislamiento | Williams |
| 8 | Inyección | Sin aislamiento | Williams |
| 9 | Discos de agar | Sin aislamiento | Williams |
| 10 | Palillos | Sin aislamiento | Orinoquia 3 |
| 11 | Inyección | Sin aislamiento | Orinoquia 3 |
| 12 | Discos de agar | Sin aislamiento | Orinoquia 3 |
Variables evaluadas
Se calculó el período de incubación, medido como el tiempo en días entre la inoculación y la aparición de síntomas iniciales de marchitez; el tiempo de inoculación, calculado como la duración en min para inocular 10 plántulas por tratamiento, y el porcentaje de mortalidad (%) de las plántulas mediante la siguiente fórmula:
Dónde: PM% es el porcentaje de plántulas muertas, PM es el número de plántulas muertas por maceta, PI es el número de plántulas infectadas (con síntomas de marchitez), cada plántula infectada se considera equivalente a media plántula muerta y TP son las plántulas totales evaluadas por repetición (entre 10 y 15 plántulas).
Análisis estadístico
Cómo no se cumplieron los supuestos del análisis de varianza, se realizó un análisis de componentes principales, con las medias de cada una de las variables para cada uno de los doce tratamientos con el fin de reducir la dimensionalidad y posteriormente, un análisis de conglomerados para clasificar los tratamientos en grupos homogéneos, mediante la utilización de los procedimientos PRINCOMP y CLÚSTER (algoritmo de Ward) respectivamente, del software SAS (9.4).
Resultados y discusión
El análisis de componentes principales permitió seleccionar dos componentes que explicaron el 98.1 % de la variabilidad de los datos. El primer componente estuvo influido preponderantemente por las variables período de incubación y mortalidad, el segundo componente por el tiempo de inoculación (Figura 1). Posteriormente, y con base en los dos componentes principales seleccionados en el análisis anterior, se realizó un análisis de conglomerados mediante el algoritmo de WARD, que permitió agrupar y clasificar los tratamientos, utilizando el procedimiento CLUSTER del mencionado software, generando cuatro grupos homogéneos, que acumularon el 97.5 % de la variabilidad contenida en los componentes principales seleccionados (Figura 1).

Figura 1 Dendrograma correspondiente a la clasificación de los 12 tratamientos en los dos componentes principales y en los cuatro grupos (el número designa el tratamiento correspondiente), mediante el análisis de conglomerados.
El primer grupo, representado por los tratamientos T1, T2, T4 y T5, correspondientes a los métodos de palillos colonizados y de inyección directa al tallo usando inóculo en las variedades Williams y Orinoquia 3. En este grupo se presentaron los valores medios más altos para el período de incubación y el segundo valor de mortalidad, con 8.08 días y 96.67 %, respectivamente, con un máximo del 100 %, para esta última variable. El segundo grupo estuvo conformado por los tratamientos T7, T10, T8 y T11; en estos tratamientos se empleó el método de palillos colonizados y de inyección directa al tallo, pero no se usó inóculo en las variedades Williams y Orinoquia 3; por lo tanto, no hubo registro de las variables período de incubación y mortalidad de plántulas (%). El tercer grupo comprendió los tratamientos T3 y T6, los cuales correspondieron al método de discos de agar, mediante el uso de inóculo en las variedades Williams y Orinoquia 3, éste presentó el valor de mortalidad más alto, con 98.33 % y un máximo del 100 %. El último grupo estuvo constituido por los tratamientos T9 y T12, los cuales incluyeron el método de discos de agar sin usar inóculo en las variedades Williams y Orinoquia 3. La variable tiempo de inoculación permitió diferenciar los grupos correspondientes a los métodos basados en palillos e inyección (grupos 1 y 2) del método de discos de agar (grupos 3 y 4) (Figura 1, Cuadro 2).
Cuadro 2 Estadísticas descriptivas para los grupos conformados mediante análisis de conglomerados para las variables período de incubación, mortalidad de plántulas (%) y tiempo de inoculación.
| Grupo | Tratamiento | Método | Inóculo | Variedad | Variable | Media† | Valor mínimo | Valor Máximo | CV (%) |
| 1 | 1 | Palillos | Con | Williams | Período de incubación | 8.08 | 6.33 | 9.33 | 16.96 |
| 2 | Inyección | Con | Williams | Mortalidad | 96.67 | 86.67 | 100.00 | 6.90 | |
| 4 | Palillos | Con | Orinoquia 3 | Tiempo de inoculación | 2.56 | 1.76 | 3.49 | 36.07 | |
| 5 | Inyección | Con | Orinoquia 3 | ||||||
| 2 | 7 | Palillos | Sin | Williams | Período de incubación | 0.00 | 0.00 | 0.00 | |
| 8 | Inyección | Sin | Williams | Mortalidad | 0.00 | 0.00 | 0.00 | ||
| 10 | Palillos | Sin | Orinoquia 3 | Tiempo de inoculación | 2.54 | 1.81 | 3.28 | 32.04 | |
| 11 | Inyección | Sin | Orinoquia 3 | ||||||
| 3 | 3 | Agar | Con | Williams | Período de incubación | 4.67 | 4.00 | 5.33 | 20.20 |
| 6 | Agar | Con | Orinoquia 3 | Mortalidad | 98.33 | 96.67 | 100.00 | 2.40 | |
| Tiempo de inoculación | 10.58 | 10.17 | 11.00 | 5.57 | |||||
| 4 | 9 | Agar | Sin | Williams | Período de incubación | 0.00 | 0.00 | 0.00 | |
| 12 | Agar | Sin | Orinoquia 3 | Mortalidad | 25.00 | 0.00 | 50.00 | 141.42 | |
| Tiempo de inoculación | 10.50 | 10.33 | 10.67 | 2.24 |
†Los valores de las variables a la derecha de la línea vertical se refieren al grupo correspondiente de la primera columna
Los resultados demostraron que tanto el método del palillo colonizado (T1 y T4) como la inyección directa al tallo con inóculo (T2 y T5) produjeron porcentajes de mortalidad de las plántulas de entre el 87 y 100 % en un período de incubación entre 6 a 9 días (Figura 3A-B y 3C-D). El tiempo de inoculación no permitió diferenciar los tratamientos basados en palillos e inyección.
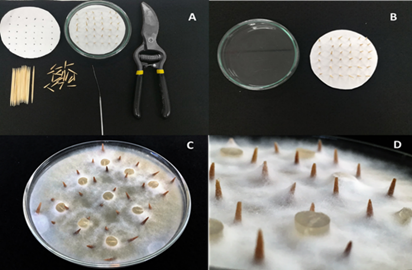
Figura 2 De izq a der: A y B) montaje de técnica de palillos, C) crecimiento de micelio con nueve trozos de agar, D) detalle de la colonización del micelio. Fotografías: Marcela López-Casallas.

Figura 3 Respuesta de la variedad Williams a los métodos de inoculación. A-B: palillo colonizado con el patógeno, C-D: método de inyección, E-F: discos de agar. Fotografías: Nathali López-Cardona.
Por otro lado, se corroboró que las inoculaciones realizadas con el método de palillos e inyección al tallo sin usar inóculo en las variedades Williams y Orinoquia 3 (Tratamientos T7, T10, T8 y T11) no ocasionaron plántulas muertas por daño mecánico. Estos resultados permitieron concluir que ambos métodos son seguros y no ocasionan plántulas muertas como consecuencia de las heridas causadas en las plántulas previas a la inoculación. Por otro lado, los discos de agar con inóculo (T3 y T6) causaron el 97 y 100 % de la mortalidad de plántulas en un período de incubación entre 4 a 5 días (Figura 3E-F). No obstante, la variable tiempo de inoculación generó la separación de los tratamientos basados en discos de agar, ya que fue el método que más tiempo requirió para la inoculación de 10 plántulas. Este método mostró que aún sin inóculo, puede causar 50 % de mortalidad en las plántulas (T12) debido al daño mecánico previo a la inoculación (Figura 4A). De acuerdo con los resultados anteriores, la elección del método de inoculación se basó en tres criterios: 1) la fiabilidad en la respuesta a la inoculación, 2) la homogeneidad de la respuesta de las plántulas a la infección y 3) la practicidad en la inoculación de volúmenes considerables de material. Para el primer criterio se tuvo en cuenta el método menos invasivo, de tal manera que permitiera observar la reacción del material de soja a la inoculación del patógeno, evitando el ruido causado por la exposición de los haces vasculares de la plántula a heridas drásticas antes de la inoculación, lo que podrían generar falsos positivos al momento de identificar germoplasma susceptible a P.sojae. El método con los mejores resultados fue el de palillos colonizados por la uniformidad en la reacción a la inoculación (Figura 4B) y eficiente infección, lográndose obtener el 100 % de plántulas muertas en las variedades susceptibles evaluadas; además, la infección se desarrolló más lentamente en este método (PI = 9 días), comparado con la inoculación de discos de agar (PI = 5 días) en Williams, que fue la variedad que presentó mayor uniformidad en la expresión de síntomas durante la estandarización del protocolo de inoculación; por lo tanto, se demostró su efectividad como testigo susceptible universal a P. sojae comparada con el testigo susceptible local Corpoica Orinoquía 3. Adicionalmente, este método fue considerado el más práctico para la inoculación masiva de germoplasma de soja.

Figura 4 A) detalle de la herida para la inoculación con discos de agar, B) expresión homogénea de síntomas en plántulas inoculadas con palillos, C) crecimiento de microorganismos contaminantes en el macerado inyectado al tallo. Fotografías: Nathali López-Cardona.
El tiempo de reacción de la plántula al método de inoculación es extremadamente valioso a la hora de evaluar germoplasma, porque se garantiza que la mortalidad de las plántulas es obtenida por el patógeno per se, más que por el efecto combinado de la predisposición de las plántulas a la profundidad de la herida en el tallo y a la exposición al patógeno. Por otro lado, con los palillos colonizados, los aislamientos fueron menos manipulados y expuestos a contaminación cruzada. Aunque el método de inyección al tallo también fue eficiente, se detectaron problemas de contaminación con microorganismos saprófitos que colonizaron el agar después de la inoculación (Figura 4C). Los métodos reportados más utilizados para la evaluación de la respuesta de las variedades a la infección por los diferentes aislados de P. sojae son los basados en la inoculación directa de discos de agar y el macerado de micelio al hipocótilo (Dorrance et al., 2004; Matthiesen et al., 2016; Zhao et al., 2016). Modificaciones a la metodología de inoculación al hipocótilo han sido propuestas con el fin de generar un método práctico de inoculación para la evaluación de material vegetal a gran escala; una de ellas basada en la mezcla directa del agar con micelio de P. sojae al suelo (MAPS), para la evaluación de minicolecciones de variedades de soja, entre las que se observó una amplia variación en la resistencia de los materiales (Jiang et al., 2017). Recientemente se reportó una modificación para evaluación de germoplasma, donde las plántulas después de inoculadas son envueltas en papel absorbente saturado con agua destilada para asegurar el contacto del micelio con el hipocótilo y luego en papel aluminio para promover las condiciones de oscuridad que requiere P. sojae (Yang et al., 2020). En contraste con lo anterior, los resultados revelaron que el método con discos de agar, aunque presenta eficiencia en el nivel de infección con una alta mortalidad en plántulas bajo las condiciones evaluadas, puede ser muy agresivo, presentando muerte de plántulas por el daño mecánico y tomando más tiempo de manipulación para evaluaciones a gran escala. La efectividad del método de inoculación con palillos colonizados en la selección de germoplasma resistente a P. sojae ha sido documentada con éxito (Costamilan et al., 2013; López-Cardona y López-Casallas). Actualmente, es el método adoptado en el programada de mejoramiento genético de soja en EMBRAPA, por ser el método más práctico y costo-eficiente en la búsqueda de resistencia completa a P. sojae (Keeling, 1982; Soares y Arias, 2016; Yorinori 1996). El método también ha sido comprobado en inoculación de Phytophthora parasitica en cítricos (Siviero et al., 2002).; así mismo, se ha documentado su uso en la inoculación de Rhizoctonia solani y Macrophomina phaseolina en melón (Cucumis melo) (Medeiros et al., 2015), con Fusarium solani y Sclerotium rolfsii en melón (Nogueira et al., 2019) y la inoculación de Diaporthe phaseolorum f. sp. meridionalis (Siviero y Menten, 1995) y Fusarium solani f. sp. glycines en soja (Klingelfuss et al., 2007). En todos los trabajos publicados se resaltan las múltiples bondades del método con respecto a la eficiencia del proceso de selección de materiales resistentes a diferentes grupos de patógenos, y en la facilidad para estandarizar y validar los resultados.
Conclusión
Considerando las variables analizadas en este estudio, el método de los palillos colonizados presentó la respuesta más eficiente, uniformidad en la expresión de síntomas, un período de incubación aceptable y practicidad en la inoculación, lo que permitió su adopción en el programa de mejoramiento genético de soja de AGROSAVIA, con proyección para ser implementado en programas de mejoramiento genético vegetal en otras especies.











 nueva página del texto (beta)
nueva página del texto (beta)


