Introducción
El nardo (Polianthes tuberosa L.) es una planta geófita ornamental nativa de México de la familia Asparagaceae (APG, 2009), es producida en regiones tropicales y subtropicales del mundo como una flor de corte o planta de jardín; también cuenta con una amplia popularidad debido a los aceites esenciales de sus flores, que son usados en perfumería (Benschop, 1993). Esta especie requiere alta luminosidad, más no es afectada por el fotoperíodo, debido que es una planta de día neutro, que generalmente induce floración con altas temperaturas (Barba-González et al., 2012).
En México, el nardo es una especie que se cultiva como flor de corte en condiciones de cielo abierto, donde el ciclo natural de floración comienza a finales de verano hasta inicios del otoño, en invierno la cantidad de escapos florales y la calidad de los mismos disminuyen, pero en verano vuelve a incrementar la producción; de este modo, se trata de un cultivo multianual (Barba-González et al., 2012); sin embargo, al tratarse de una planta que no tolera temperaturas menores de 5 °C, en algunas regiones se manejan ciclos anuales dejando descansar los bulbos en el suelo hasta por tres meses (Nagar, 1995).
El crecimiento y la floración en la mayoría de las geófitas es controlada por factores internos, como la latencia, tamaño y edad de los bulbos, las condiciones de almacenamiento y las temperaturas de forzado (De Hertogh y Le Nard, 1993; Okubo, 2013). Cada especie tiene un intervalo de temperaturas que son tolerables y propicias para su crecimiento; generalmente, las plantas tienen un intervalo de temperaturas óptimas para florecer de entre 18 y 22 °C. Si la temperatura incrementa o desciende de estas temperaturas óptimas, la floración se ve afectada (Dole y Wilkins, 2005). Dada la demanda de nardo en otros países, se realizan prácticas culturales de forzamiento para mover los periodos de cosecha en el momento que en el mercado exista una mayor demanda o un mejor precio; sin embargo, los estudios a este respecto han sido poco concordantes (Huang y Okubo, 1995; Watako y Ngamau 2013; Yang et al., 2014). De este modo, las limitaciones para la producción de nardo se deben a la falta de conocimiento en el forzamiento de los bulbos y desde hace varios años se han realizado investigaciones en el control de factores ambientales, fertilización y uso de reguladores de crecimiento, con el fin de obtener floración antes del tiempo natural o mejorar la calidad de las flores (Amin et al., 2017; Asil et al., 2011; Selim et al., 2017). El objetivo del presente estudio fue evaluar el efecto de temperaturas de almacenamiento de bulbos de nardo en la diferenciación y la floración en dichos bulbos como alternativa para modificar los tiempos de producción comercial y obtener cosechas en épocas de mayor demanda.
Materiales y métodos
Sitio experimental y material genético
Los tratamientos de almacenamiento, el experimento en invernadero y microscopia se realizaron en la Unidad de Biotecnología Vegetal de CIATEJ A. C. Ubicado en Zapopan, Jalisco, México. Bulbos de nardo P. tuberosa var. Doble, calibre 10/12, provenientes de Cuauchichinola, Morelos, México se dividieron en cuatro grupos: el primer grupo de bulbos se almacenó a 4 ± 1.83 ºC y humedad relativa de 71 ± 8.63 %, el segundo grupo de bulbos se almacenó a 27 ± 1.95 ºC con humedad relativa de 53 ± 14.84 %; estos dos grupos se almacenaron durante 4, 5, 6 y 7 semanas en dos cámaras diferentes con temperatura controlada. El tercer grupo de bulbos correspondió al testigo, con bulbos mantenidos a temperatura ambiente (20-22 ºC) y humedad relativa 60-70 %; el cuarto grupo consistió en bulbos tratados con 200 ppm de AG3 (sumergidos en esta solución por 15 min) previo a la siembra. A partir de estas temperaturas y semanas se dividieron en 10 diferentes tratamientos (Cuadro 1).
Cuadro 1 Valores promedio de las variables largo (LM) y ancho del meristemo (AM) en bulbos de P. tuberosa bajo diferentes temperaturas de almacenamiento a los 0 y 30 días después del establecimiento en invernadero.
| Tratamiento | Temperatura (º C) / Duración (semanas) | 0 AE | 30 DDE | ||
| LM (µm) | AM (µm) | LM (µm) | AM (µm) | ||
| 0 | 0/0 | 113.28 a | 69.01 a | 340.77 a | 372.52 a |
| 1 | 4/7 | 150.21 a | 237.45 bc | 714.41 ab | 891.04 ab |
| 2 | 4/6 | 141.00 a | 213.00 bc | 353.88 a | 362.48 a |
| 3 | 4/5 | 136.53 a | 236.61 bc | 211.09 a | 265.93 a |
| 4 | 4/4 | 165.86 a | 226.05 bc | 282.58 a | 340.31 a |
| 5 | 27/7 | 166.30 a | 244.23 bc | 633.84 ab | 706.23 a |
| 6 | 27/6 | 143.91 a | 244.32 bc | 575.76 ab | 583.20 a |
| 7 | 27/5 | 188.07 a | 261.95 c | 1476.99 bc | 1786.93 d |
| 8 | 27/4 | 184.69 a | 188.10 b | 1654.63 c | 1662.06 bc |
| 9 | AG3 0/0 | 307.91 a | 378.12 a | ||
| Valor de P | 0.343 | 0.0001 | 0.0005 | 0.0305 | |
Para cada columna valores con la misma letra son estadísticamente iguales (Duncan, P ≤ 0.05). AE: antes del establecimiento, DDE: días después del establecimiento
Manejo del experimento y variables respuesta
Posterior a los tratamientos, los bulbos se establecieron en invernadero en cajas plásticas con dimensiones de 37 cm de largo × 26.5 cm de ancho, en substrato (tierra de monte y turba 3:1 v/v). Se sembraron 17 bulbos por cada tratamiento en un diseño completamente al azar con 4 repeticiones a 3 cm de profundidad en 3 hileras. Para evaluar el efecto de los tratamientos de almacenamiento se registraron las variables días a floración (DF) cuando el 50 % de los escapos florecieron, largo del escapo floral (EF) en cm, tamaño de la espiga (TE) en cm, número de flores (NF), diámetro del tallo floral (DT) en mm, y días a brotación vegetativa.
Para evaluar el efecto de los tratamientos térmicos en el desarrollo y diferenciación del meristemo floral se tomaron muestras de bulbos antes del tratamiento de almacenamiento, durante el almacenamiento y a los 30, 60 y 90 días después del establecimiento (DDE). Para medir el largo y ancho de la base del meristemo foliar se realizó un corte destructivo de bulbos por cada tratamiento, con base en la técnica descrita por López et al. (2005) con algunas modificaciones; se separaron los meristemos del resto del bulbo con disecciones manuales retirando las hojas envolventes superficiales con cortes longitudinales para evitar rompimiento del plato basal, y posterior a ello se retiraron desde la base las hojas envainadoras concéntricas al meristemo apical situado en la parte superior del plato basal. La muestra se conservó en solución FAA (3.7 % formaldehido: 5 % ácido acético: 50 % etanol) en cuarto frío a 4 ºC hasta su análisis. En microscopio estereoscópico y con ayuda de bisturí se aislaron los meristemos limpiando todos sus primordios foliares y se colocaron en soluciones de alcohol:agua para la deshidratación en relaciones de 25, 50, 75, 85, 90 y 100 % durante 2-3 min cada solución; posteriormente, se retiraron los residuos de alcohol y se colocaron gotas de solución de Hoyers (7.5 g goma arábiga, 100 g hidrato de cloral, 5 mL glicerol y 30 mL agua destilada) durante 20-30 min. Esta solución permite clarificar los tejidos para ser vistos con mayor facilidad al microscopio. Cada muestra se colocó en portaobjetos cubierto y se procedió a la observación en microscopio óptico (Marca Leica®, Modelo DMRA2, Leica Biosystems, Buffalo Grove, Illinois, EUA). Las variables que se midieron fueron largo de meristemo (LM) y ancho de la base del meristemo (ABM) en µm.
Análisis estadístico
Se realizó análisis de varianza y comparación de medias de Duncan (P ≤ 0.05), empleando el programa Statistical Analysis System® (SAS) versión 9.1 (SAS Institute, 2004).
Resultados y discusión
Días a brotación
Transcurridos los tratamientos térmicos y una semana después de su establecimiento en invernadero se visualizaron las primeras hojas en los tratamientos de calor, testigo y ácido giberélico (Figura 1), y fue hasta la segunda semana después de la siembra que emitieron crecimiento los bulbos tratados con baja temperatura (4 ºC), independientemente del tiempo del tratamiento (4, 5, 6 o 7 semanas de almacenamiento). En concordancia con estos resultados, Dhua et al. (1987) encontraron diferencias en bulbos sembrados de P. tuberosa con almacenamiento previo a la siembra, donde los cormos almacenados a temperaturas menores de 4 ºC presentaron una brotación más lenta a los 30 días en relación con aquellos bulbos tratados a 10 ºC. El mismo efecto de diferencias en el almacenamiento térmico se encontró en un estudio realizado en Japón, por Huang et al. (1995), en el cual a mayor temperatura y mayor tiempo de almacenamiento la brotación en bulbos de nardo fue más acelerada, aunque afectó el peso seco de los bulbos debido a una mayor tasa de transpiración; de igual modo, Watako y Nagamau (2013) reportaron que el almacenamiento de cormos de nardo a 5 °C retrasó la brotación.

Figura 1 Brotación de las primeras hojas (1 semana después del establecimiento) de cormos de P. tuberosa sometidos a diferentes temperaturas y tiempos de almacenamiento. A, B, C y D: cormos almacenados a 4 ºC por 4, 5, 6 y 7 semanas respectivamente, E: testigo a temperatura ambiente 20-22 ºC; F, G, H, I: cormos almacenados a 27 ºC por 4, 5, 6 y 7 semanas respectivamente, J: cormos tratados con AG3 (200 ppm).
Efecto de la temperatura de almacenamiento en la diferenciación del meristemo
Se monitorearon los cambios en el tamaño del meristemo antes del tratamiento, durante las diferentes semanas de almacenamiento y una vez establecidos en invernadero (0, 30, 60 y 90 DDE). Hasta los 0 DDE, ningún tratamiento registro diferencias significativas para la variable largo del meristemo (LM) (Cuadro 1), similar a lo reportado por Huang et al. (1995), de tal manera que no se presentó un crecimiento en los meristemos hasta antes la de siembra. Por su parte, Toma et al. (2015), al evaluar cormos de nardo en dos condiciones de almacenamiento, una fría (10-12 ºC) y otra ambiental (20-22 ºC), encontraron que bajo condiciones de temperatura ambiental de almacenamiento, se presentó un ligero crecimiento de los cormillos laterales, e incluso la aparición de nuevos cormos, además de que la yema central del cormo principal estaba fuera de reposo presentando divisiones celulares, concluyendo al igual que Benschop (1993), que el reposo en nardo no es tan profundo como en otras geófitas.
A los 30 días después del establecimiento (DDE) se evidenciaron diferencias entre tratamientos para la variable largo del meristemo con relación al testigo T0 (Cuadro 1). Los tratamientos con temperaturas de 27 ºC con 4 y 5 semanas de almacenamiento (T7 y T8, respectivamente) alcanzaron valores promedio 4.8 y 4.3 veces mayores que el testigo, respectivamente. En el caso de la variable ancho del meristemo el comportamiento fue similar, nuevamente los tratamientos a 27 °C por 4 y 5 semanas mostraron los valores promedio más altos para esta variable. Todos los tratamientos que recibieron temperaturas de 27 ºC registraron aumento en el tamaño del meristemo entre los 0 y 30 DDE, sugiriendo que pasaron de la etapa vegetativa a la iniciación floral. Los bulbos tratados con frío registraron menor longitud de meristemo, con excepción del tratamiento 1 (4 ºC por siete semanas). Se omiten los valores de los bulbos con ácido giberélico (T9) a los 0 DDS, ya que no recibieron tratamiento térmico alguno previo a la siembra (Cuadro 1). Resultados similares fueron reportados por Huang et al. (1995), quienes no encontraron cambios en los meristemos almacenados a 5 y 25 ºC durante el tiempo de almacenamiento, pero aquellos almacenados a 25 ºC fueron más precoces en crecimiento vegetativo y en floración, mientras que, Fragoso-Jimenez et al. (2021) coinciden en que los tratamientos de almacenamiento a 27 ºC adelantaron la diferenciación de los meristemos, pero las temperaturas de 12 ºC fueron las que retrasaron más este fenómeno en nardo. Coincidentemente, altas temperaturas de producción han mostrado beneficios en tulipán (Tulipa sp.), jacinto (Hyacinthus sp.), narciso (Narcissus sp.) e iris (Iris sp.), ya que para etapas tempranas de iniciación floral, temperaturas alrededor de los 20 ºC (cercana al óptimo), promueven el crecimiento temprano y la rápida iniciación floral (Okubo, 2013).
En la Figura 2 se muestra la morfología de los meristemos apicales de los bulbos en los diferentes tratamientos a los 30 DDE. En el testigo (Figura 2A) y tratamiento con ácido giberélico (Figura 2J) no se observa ningún cambio morfológico más allá del aumento en tamaño reportado en el Cuadro 1. En los tratamientos de almacenamiento a 4 ºC se observaron cambios menores de formación de los primeros órganos florales, con excepción del T1 (Figura 2B), en el cual se observó una notable diferenciación floral. El mismo efecto de diferencias en el almacenamiento térmico se encontró en un estudio realizado en Japón por Huang et al. (1995), en el cual mientras mayor fue la temperatura de almacenamiento y a mayor tiempo de almacenamiento la brotación en bulbos de nardo fue más acelerada, aunque afectándo el peso seco de los bulbos debido a una mayor tasa de transpiración. Estos mismos autores mencionaron que en todos los tratamientos de calor, sin importar las semanas de almacenamiento, se observó una clara diferenciación del meristemo, lo que sugiere que el efecto del tratamiento de calor, además de ayudar a una pronta brotación, también define en menor tiempo los primordios florales con relación al resto de los tratamientos evaluados, similar a lo reportado por Fragoso-Jimenez et al. (2021). Por su parte, Yang et al. (2014) mencionaron que, además de las temperaturas, existen otros factores que afectan la diferenciación floral en los meristemos de nardo como el fotoperiodo, reportaron que en días largos (12 a 14 h) durante un mes los meristemos presentan diferenciación floral, mientras que en días cortos la diferenciación del meristemo y los días a floración aumentaron.
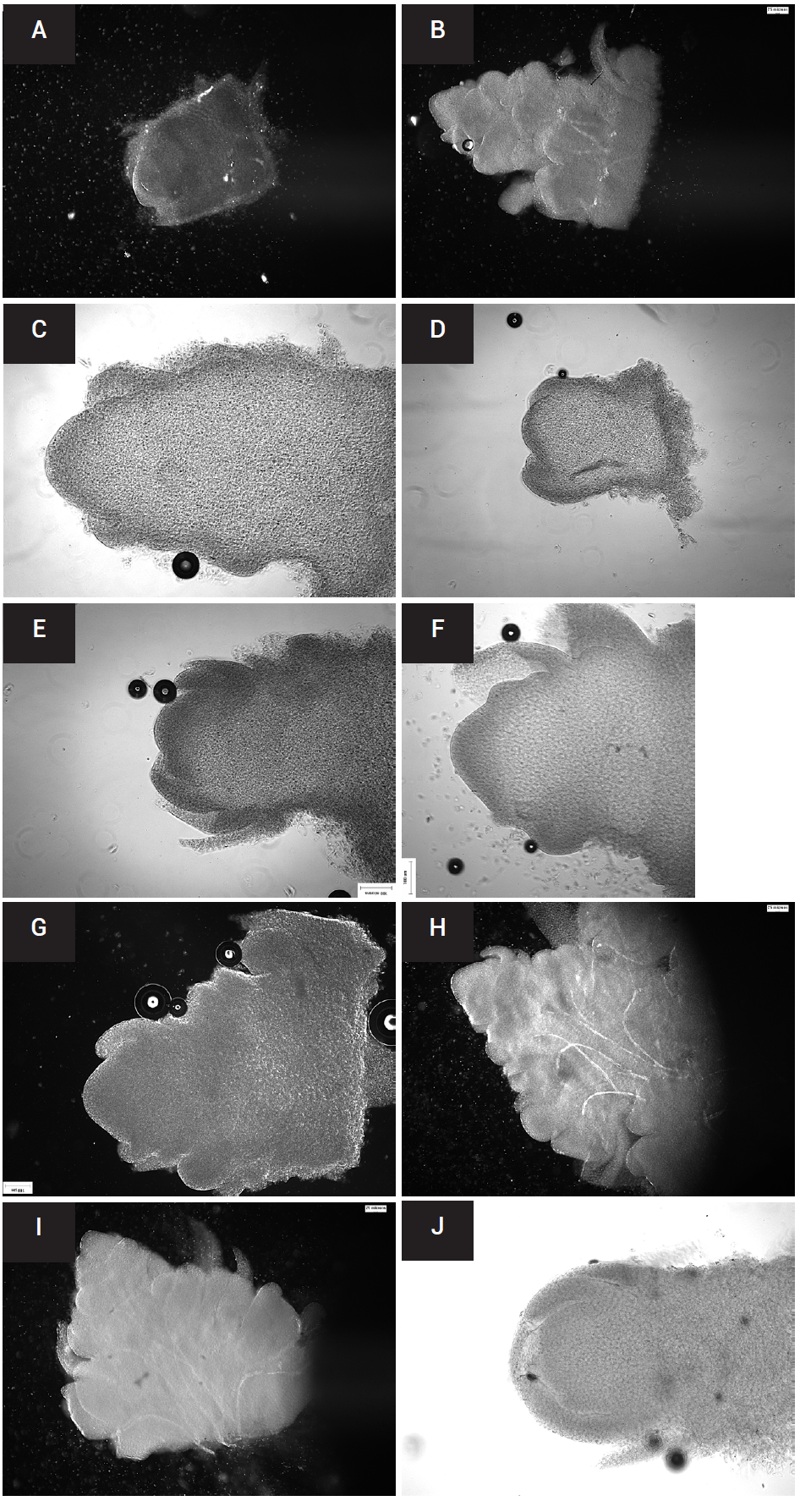
Figura 2 Desarrollo meristemático en P. tuberosa a los 30 DDS. A: testigo a temperatura ambiente 20-22 ºC; B, C, D y E: tratamientos con frío (4 ºC) por 7,6,5, y 4 semanas, respectivamente; F, G, H, I: tratamientos con calor (27 ºC) por 7,6,5, y 4 semanas, respectivamente. J: tratamiento con AG3. Escala 100 µm.
Caracteres florales
Las variables largo del tallo (LT) y número de flores (NF) no presentaron diferencias significativas entre tratamientos (Cuadro 2). En todos los tratamientos la variable LT registró un intervalo de 110.18 a 117.77 cm, superando la medida comercial (90 cm), por lo que ninguna temperatura afectó la elongación del tallo. La variable diámetro del tallo (DT) tuvo un incremento en el tratamiento con ácido giberélico (T9), con un valor de 10.59 mm, en comparación con el testigo de 8.86 mm.
Cuadro 2 Valores promedio de las variables largo del tallo (LT) largo de la espiga (LE), número de flores (NF), diámetro del tallo (DT) y días a floración (DAF) en bulbos de P. tuberosa sometidos a diferentes temperaturas y tiempos de almacenamiento.
| Tratamiento | T ºC/semanas | LT (cm) | LE (cm) | NF | DT (mm) | DAF días |
| T0 | 0/0 | 115.54 a | 28.84 cd | 32.31 a | 8.86 bcd | 124.56 bcd |
| T1 | 4/7 | 113.23 a | 27.49d | 29.94 a | 8.01 d | 100.8 d |
| T2 | 4/6 | 116.02 a | 35.29 a | 35.92 a | 9.18 bc | 119.25 bcd |
| T3 | 4/5 | 111.09 a | 29.86 bcd | 31.12 a | 9.51 b | 141.57 b |
| T4 | 4/4 | 113.44 a | 30.23 abcd | 31.03 a | 8.67 bcd | 128.39 bc |
| T5 | 27/7 | 117.77 a | 30.79 abcd | 33.41 a | 8.48 bcd | 112.33 cd |
| T6 | 27/6 | 116.59 a | 33.36 abc | 32.53 a | 8.22 cd | 104.01 cd |
| T7 | 27/5 | 111.50 a | 30.32 abcd | 31.78 a | 8.34 cd | 115.16 cd |
| T8 | 27/4 | 117.96 a | 34.40 ab | 34.62 a | 8.61 bcd | 109.21 cd |
| T9 | GA3 0/0 | 110.18 a | 30.97 abcd | 34.58 a | 10.59 a | 173.46 a |
| Valor de P | 0.351 | 0.026 | 0.301 | 0.001 | 0.001 |
Para cada columna valores con la misma letra son estadísticamente iguales (Duncan, P ≤ 0.05).
En relación con la variable largo de espiga floral (LE), se encontraron diferencias estadísticas, resultando el tratamiento de almacenamiento a 4 ºC durante 6 semanas (T2) con los valores más altos estadísticamente, con un valor de 35.29 cm, lo que representa 6.45 cm mayor que el testigo. Es importante recalcar que en los tratamientos a 27 ºC, sin importar las semanas de almacenamiento, se tuvo un valor promedio de 32.2 cm. Las diferencias en tamaño de la espiga no afectaron el número de flores (NF), ya que para esta última variable no hubo diferencias significativas.
En el caso de la variable días a floración (DAF), hubo diferencias estadísticas entre los tratamientos, siendo los más precoces el T1 (4 ºC por 7 semanas) con 100.8 días y T6 (27ºC por 6 semanas) con 104.1 días; sin embargo, se observó una mayor homogeneidad en la floración en el tratamiento de calor T6 (27 oC por 6 semanas). Los valores promedio de la variable días a floración en los tratamientos de 27 ºC (sin importar las semanas de almacenamiento) fue de 110.42 días, mientras que en los tratamientos de 4 ºC fue de 125.53 días, el testigo (T0) fue de 124.56 días y la floración más tardía se encontró en los bulbos tratados con ácido giberélico (T9) con una media de siembra a cosecha de 173.46 días. En congruencia con los resultados del presente estudio, Fragoso-Jimenez et al, (2001) reportaron que altas temperaturas de almacenamiento (27 ºC por 7 semanas) adelantaron hasta en 15 días la floración con respecto al testigo y hasta en 30 días más con respecto a aquellos cormos almacenados a 12 ºC; sin embargo, estos mismos autores reportaron que los cormos almacenados a 4 ºC fueron estadísticamente iguales al testigo para esta misma variable.
En este estudio la aplicación de 200 ppm de ácido giberélico no adelantó la floración, por lo que se puede considerar que el ácido giberélico aplicado a los cormos no sustituye al frío o al calor en nardo, como sucede en otras especies como lillium (Lilium sp.), narciso y mini callas (Zantedeschia sp.), donde bajo condiciones controladas, aplicaciones exógenas de AG3 favorecen la elongación del tallo e inducción floral sin pasar por semanas de almacenamiento en frío (Khodorova y Boitel-Conti, 2013). En dalia (Dahlia sp.), Pudelska y Podgajna (2013) reportaron un retraso en la floración con aplicaciones foliares de giberelinas, similar a los encontrado en este estudio en nardo; en contraste, otros autores han reportado que aplicaciones de ácido giberélico vía foliar adelantaron los días a floración en nardo (Amin et al., 2017; Asil et al., 2011).
Para la variable DT, el tratamiento T9 fue el que presentó los valores promedio más altos (10.59 mm), esta característica puede deberse al efecto estimulante de las giberelinas sobre la división celular y elongación. En los demás tratamientos solamente se encontraron diferencias mínimas numéricas entre ellos, sin diferencias entre grupos por calor y frío; de este modo, tratar los bulbos de nardo con AG3 (200 ppm) previo a la siembra genera una ganancia en grosor del tallo, aunque también retrasa la floración (50 dias más que el testigo), lo que resulta ventajoso si se busca un método inmediato de retrasar las fechas de floración sin forzamiento por temperaturas; sin embargo, Nagar (1995) no encontró efecto sobre la ruptura de la latencia al tratar bulbos con AG3 en presiembra; además, algunos autores reportan que aplicaciones foliares de AG3 afectaron la calidad de las flores en nardo (Amin et al., 2017; Asil et al., 2011).
En la práctica, los productores siempre buscan la manera más rápida de obtener el producto de sus siembras, ya que obtendrán más ciclos de cultivo por tiempo determinado, mejor aprovechamiento del suelo, rompimiento del ciclo de las plagas y enfermedades, mayor calidad de las flores y redistribución de las cosechas a lo largo del año (De Hertogh y Le Nard, 1993); entonces, los productores pueden superar este estado de latencia colocando las plantas en invernaderos, defoliación o tratamiento con productos químicos, en su mayoría con reguladores de crecimiento sintéticos (Dole, 2003).
En México los cormos de nardo se establecen a cielo abierto, sin ningún tratamiento para forzar la floración, la única condicionante es establecer los bulbos con calibres 10/12, que se refieren a diámetros de 2.5 a 3.5 cm (Poursafarali et al., 2011) en la primavera. A pesar de que el nardo se cultiva en diferentes partes del mundo, no existe una concordancia respecto a las temperaturas de almacenamiento y su efecto en la floración; por ejemplo, en la India (Mukhopadhyay et al., 1986) proponen almacenar a temperaturas de 30 ºC durante ocho semanas, con la restricción de calidad para el tallo floral. Almacenar a 10 ºC por 30 días aumenta la productividad; sin embargo, almacenar a esa temperatura por períodos mayores de tiempo ocasiona disminución en la producción (De Hertogh y Le Nard, 1993). Los tratamientos con almacenamiento a bajas temperaturas parecen no tener efecto sobre la iniciación floral en nardo, según lo reportado por Huang et al. (1995), quienes también consideran que las bajas temperaturas son perjudiciales para obtener tallos florales de calidad. Por otro lado, Wataco y Ngamau (2013) reportaron que el almacenamiento a bajas temperaturas (5 ºC) seguido de una activación a 20 ºC por 2, 3 y 4 semanas mejoraron la brotación y la calidad de las flores, caso similar a lo reportado por Edrisi y Mirzaei (2017), quienes mencionaron que almacenar los cormos de nardo por 4 semanas a 12 ºC y posteriormente 4 semanas a 20 ºC fue el tratamiento que menos afectó las variables de crecimiento y calidad de las flores.
En el presente estudio las bajas temperaturas retrasaron la brotación inicial de las hojas y los días a floración, sin un efecto drástico en el resto de las variables evaluadas; de este modo, se pueden usar diferentes tratamientos de almacenamiento (4 o 27 ºC), de acuerdo con las fechas de mayor demanda de flores, a fin de lograr adelantos o atrasos en la producción sin demeritar la calidad.
Conclusiones
La diferenciación floral en P. tuberosa no ocurre durante el almacenamiento térmico, sino después del establecimiento. Los tratamientos a 4 °C afectaron la brotación inicial de las hojas, además de retrasar la floración. Los tratamientos a 27 °C adelantaron la brotación inicial de las hojas, la diferenciación de los meristemos y los días a floración en relación con el testigo; sin embargo la aplicación de 200 ppm de AG3 previo a la siembra fue el tratamiento que retrasó más la floración.











 nova página do texto(beta)
nova página do texto(beta)


