Introducción
Debido a que el consumo intensivo de colorantes artificiales tiene mayor riesgo de desarrollar diversos tipos de cáncer, la industria de los alimentos incrementó la demanda de pigmentos naturales (Basu y Kuma, 2014; Hengel y Shibamoto, 2013). Las antocianinas son compuestos fenólicos con propiedades antioxidantes que pueden sustituir a los colorantes artificiales de tonos rojos. El maíz morado es una fuente importante de antocianinas, las cuales se acumulan prácticamente en cada estructura de la planta (Li et al., 2008); además, el pigmento del maíz morado está reconocido y avalado por la Unión Europea y la legislación japonesa como ingrediente seguro en la industria de alimentos (Lao et al. 2017)
En el continente americano existe amplia diversidad genética de maíces de grano antociano (azul, rojo, morado, negro), documentado en México (Aragón y Taba, 2013; Ávila et al., 2016), Perú (Oscanoa y Sevilla, 2008), Ecuador (Yánez et al., 2017; Com. Pers.)1, Bolivia (Ramírez et al., 1961) y Costa Rica (Oreamuno y Monge, 2018). En estos países el maíz morado se usa para elaborar alimentos tradicionales y hacia ello han orientado su mejoramiento, excepto en Perú, donde el maíz morado también se utiliza para extraer pigmentos a nivel industrial (Yánez et al., 2017; Com. Pers.)1.
Un programa de mejoramiento genético de maíz pigmentado para la producción de alimentos tradicionales difiere del requerido para la producción comercial de antocianinas; en el primer caso, se usan principalmente variedades de polinización libre y la producción es en su mayoría de autoconsumo o de mediana escala, orientada más a la conservación del germoplasma que al desarrollo de agronegocios (Escobedo y Benítez, 2013; Hellin et al., 2013), donde importa más la cantidad de antocianinas en el grano porque no se aprovecha el olote.
En la producción comercial de antocianinas el productor es tecnificado y con visión empresarial, aquí se requiere formar híbridos a partir de poblaciones con alta concentración de pigmentos en olote y grano, tanto en pericarpio como en capa de aleurona, con resistencia al acame para cosecha mecanizada, tolerantes a enfermedades, especialmente a pudriciones de la mazorca. Los maíces nativos con pigmentos tipo antociano tienen endospermo harinoso (Mendoza-Mendoza et al., 2017; Salinas et al., 2005a), por lo cual es necesario seleccionar hacia endospermo córneo, lo que permitirá reducir granos quebrados por la trilladora, daños de plagas de almacén, facilitar el perlado del grano y uso de subproductos del grano para la elaboración de combustibles como el etanol (Somavat et al., 2018).
La gran diversidad del maíz pigmentado en cantidad de antocianinas en grano, entre y dentro de poblaciones (Espinosa et al., 2009; Harakotr et al., 2015; Mendoza-Mendoza et al., 2017; Salinas et al., 2013) justifica seleccionar las accesiones antes de iniciar un programa de hibridación (Hallauer y Miranda, 1988). Bajo este contexto, el objetivo de esta investigación fue seleccionar accesiones de maiz morado locales e introducidas en México, para iniciar un programa de mejoramiento genético de maíz morado para la extracción comercial de antocianinas, considerando aspectos de adaptación, variables agronómicas, fisiológicas, características físicas de grano y contenido de antocianinas.
Materiales y métodos
Material genético
A partir de imágenes disponibles de la colecta de maíces nativos financiada por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) y realizada por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), se seleccionaron 13 accesiones de maíz morado de México. Con los datos de pasaporte se solicitó una muestra de semilla al banco de germoplasma de maíz, ubicado en el Campo Experimental Valle de México del INIFAP; además, se solicitó al banco de germoplasma del Centro Internacional de Maíz y Trigo (CIMMYT) semilla de 35 accesiones de maíz morado, de las cuales dos son originarias de Costa Rica, 13 de Ecuador y 20 de Perú. Como testigos se utilizaron la variedad de maíz morado (MCP) de la empresa Altecsa S.A. de C.V. ubicada en Huamantla, Tlaxcala y el maíz morado Negro Ixtenco, colectado en San Juan Ixtenco, Tlaxcala, México. Las muestras (de 200 a 400 semillas) se dividieron en tres partes para: 1) multiplicación de la semilla, 2) caracterización física del grano, cuantificación y análisis de antocianinas, y 3) conservación como semilla remanente.
Multiplicación de semilla
La semilla de las 48 poblaciones y los testigos se sembró el 5 de junio de 2015 bajo riego en el Campo Experimental Valle de México del INIFAP, ubicado en Coatlinchán, Texcoco, Estado de México, con coordenadas geográficas 19º 26′ 56″ N, 98º 52′ 20″ O a 2300 m de altitud. Las poblaciones se sembraron en surcos de 10 m de longitud separados a 0.8 m, el número de surcos sembrados por población fue de 2, 4 o 7 surcos en función de la semilla disponible.
Se sembraron dos semillas cada 25 cm, para aclarear a una planta por mata, lo que representó una densidad de población de 50 mil plantas ha-1. Para el manejo agronómico se aplicaron las recomendaciones para maíz generadas por el INIFAP para esta localidad (INIFAP, 2017). En la etapa de floración se realizaron polinizaciones planta a planta en número variable para cada población, pues hubo heterogeneidad en el porcentaje de germinación y asincronía floral por desadaptación de algunas poblaciones introducidas.
Con base en una muestra de cinco plantas, se realizó una caracterización agronómica preliminar de las poblaciones. Las características registradas fueron: a) días a floración masculina, desde la siembra hasta liberación de polen en 50 % de las plantas, b) días a floración femenina, desde la siembra hasta aparición de estigmas con una longitud mínima de 3.0 cm en el 50% de las plantas, c) altura de planta, medida en cm desde el nivel del suelo hasta la hoja bandera, d) altura de la mazorca, medida en cm desde el nivel del suelo hasta el nudo donde se inserta la mazorca principal, e) sanidad de planta, mediante calificación visual de 1 a 10, donde 1 conrresponde a plantas completamente enfermas y 10 a plantas completamente sanas, f) porcentaje de acame de tallo, relación entre el número de plantas quebradas por debajo de la mazorca principal y multiplicada por 100, g) porcentaje de acame de raíz, relación entre el número de plantas caídas o desviadas 30º de la vertical y multiplicada por 100, h) longitud total de la espiga en cm, i) número de ramas de la espiga, y j) número de hojas arriba de la mazorca principal. No se estimó el rendimiento de grano debido a que las plantas se utilizaron para multiplicar el grano y las mazorcas polinizadas generalmente no estuvieron completamente llenas. La cosecha y desgrane fueron de forma manual y se hizo una clasificación racial preliminar para ubicar de manera más precisa el acervo genético bajo evaluación.
Análisis físicos del grano
Se registró el peso de cien semillas (PCS); para ello, se pesaron 50 granos de cada población en una balanza semi-analítica Sartorius BL610 (Sartorius AG, Goettingen, Alemania) y el peso se multiplicó por 2. Para determinar la ubicación del pigmento (UP) y tipo de endospermo (TE), se remojaron 10 granos sanos en agua a temperatura ambiente por 20 min, se les retiró el agua, y el pericarpio se separó con bisturí. El pigmento se ubicó en pericarpio (P), capa de aleurona (CA) o en ambas estructuras (P/CA); para determinar el TE, los granos se cortaron en plano longitudinal para obtener dos mitades, éstas se clasificaron visualmente por la proporción de endospermo harinoso con base en la escala de Bedolla y Rooney (1982), donde: 1 corresponde a 100 % harinoso (H), 2 a 75 % H, 3 a 50 % H, 4 a 25 % H, y 5 a 100 % cristalino. Estos análisis se realizaron por duplicado en la semilla de las accesiones proporcionada por los bancos de germoplasma (semilla original).
Preparación de muestra, extracción y análisis de antocianinas en pericarpio y grano
En el grano de maíz morado las antocianinas se concentran principalmente en el pericarpio (Salinas et al., 2005b); por lo tanto, las poblaciones se seleccionaron considerando el contenido de antocianinas de esta estructura del grano. Dado que la separación del pericarpio del grano es una actividad laboriosa, al requerir un tamaño de muestra de entre 20 y 25 pericarpios para un análisis confiable, el análisis de antocianinas en pericarpio (CATp) sólo se realizó en 14 accesiones de grano morado; sin embargo, en todas se cuantificaron las antocianinas en grano entero (CTAg), tanto en la semilla original como en las multiplicadas de las que se dispuso de semilla. Para obtener el CATp se remojaron 25 granos en agua caliente (50-60 ºC) por 15 min; después, los pericarpios se separaron con bisturí, se secaron a temperatura ambiente y en oscuridad por 24 h y se molieron en un molino tipo ciclónico (UDY Corporation, Cyclone Sample Mill, Fort Collins, Colorado, EUA) con malla 0.5 mm (Monroy et al. 2016). La harina obtenida se colocó en viales ámbar en una estufa a 40 ºC por 40 h. Las muestras se dejaron enfriar en un desecador.
Para obtener el CATg, el tamaño de muestra fue de 15 granos, los cuales se remojaron por 15 min en agua caliente (50-60 ºC), luego se les removió el embrión con un bisturí. Los granos se colocaron en toallas de papel para que secaran y al día siguiente se molieron en un molino tipo ciclónico con malla de 0.5 mm. La harina se colocó en charolas pequeñas de aluminio y se deshidrató por 24 h en un horno a 40 ºC. Las muestras se dejaron enfriar en un desecador, se guardaron en viales oscuros sellados y se almacenaron en refrigeración (Salinas et al., 2005b). Como la pérdida de antocianinas se acelera al moler la muestra, los análisis se realizaron en los días inmediatos.
Para la extracción de antocianinas en pericarpio, una muestra de 20 mg de pericarpios molidos se depositó en un matraz Erlenmeyer de 50 mL y se agregaron 10 mL de metanol acidificado 1% con ácido triflouracético como disolvente. La muestra se sonicó por 15 min en un baño sonicador (Branson 2510 Ultrasonic Cleaner, Branson Ultrasonics Corp., Danbury, Connecticut, EUA) y se colocó en refrigeración durante 105 min, se centrifugó a 4000 rpm durante 10 min (Centrifuga Hettich Zentrifugen Modelo Universal 32, Hettich Corp., Tuttlingen, Alemania). El sobrenadante se recuperó y el residuo se sometió a una nueva extracción con 10 mL del solvente; en esta ocasión la muestra no se sonicó, sólo se colocó en un agitador horizontal durante 105 min en oscuridad y a temperatura ambiente, se centrifugó, y el sobrenadante se juntó con el primero. El extracto se filtró con papel Whatman No. 4 y se midió el volumen. Los extractos se almacenaron a -20 °C hasta su análisis. Para la extracción del pigmento del grano se siguió el mismo procedimiento que para el pericarpio, con un tamaño de muestra de 1.0 g de harina y 15 mL de disolvente.
La absorbancia del extracto se leyó en un espectrofotómetro (Lambda 25 UV/VIS, Perkin Elmer, Waltham, Massachusetts, EUA) a 530 nm. Se realizaron diluciones cuando fue necesario, empleando el disolvente de extracción. Se preparó una curva patrón de cianidina 3-glucósido (Extrasinthase, Francia). El contenido de antocianinas se expresó en mg equivalentes de cianidina 3-glucósido (ECG)/100 g de muestra seca (MS) (Salinas et al., 2005b). Los análisis, tanto del CATg como del CATp se hicieron por duplicado.
Análisis de las antocianinas del grano por cromatografía líquida de alta resolución (HPLC)
Este análisis se hizo sólo en ocho accesiones, dos de cada grupo con CATg contrastantes, y los dos testigos, la variedad MCP y el maíz Negro Ixtenco. Se utilizó un equipo Perkin Elmer series 200 (Waltham, Massachusetts, EUA) integrado por bomba cuaternaria, degasificador, detector de UV-Vis con arreglo de diodos (DAD) y auto-muestreador. Se empleó una columna analítica Hypersil ODS-2 250 × 46 mm, con tamaño de partícula de 5 µm. El análisis se hizo con la metodología de Fossen et al. (2001) aplicando las modificaciones indicadas por Salinas et al. (2005b). Las muestras se purificaron en una columna de Amberlita XAD-7 (Sigma, Minnesota, EUA) y se filtraron con acrodiscos de membrana 0.22 µm (Millipore Corporation, Burlington, Massachusetts, EUA). La identidad de los picos se realizó mediante comparación de los tiempos de retención de estándares comerciales de cianidina 3-glucósido (Cy 3-glu), pelargonidina 3-glucósido (Pg 3-glu) y peonidina 3-glucósido (Pn 3-glu) (Polyphenols AS, Sandnes, Noruega) y con apoyo de la información de trabajos publicados sobre análisis de antocianinas en maíz morado (Aoki et al., 2002; Salinas et al., 2005b).
Análisis estadístico
Para las variables agronómicas, en cada grupo de las poblaciones se computó el promedio, valor máximo y mínimo, mientras que para los análisis físicos y químicos del grano se calculó el promedio y desviación estándar y se realizó análisis de regresión lineal entre el CATp y el CATg de las poblaciones estudiadas.
Resultados y discusión
Características agronómicas de las poblaciones
La precocidad de las poblaciones de Ecuador, Perú y Costa Rica, en Coatlinchán, Edo. de México fue de ciclo intermedio, en promedio la floración masculina y femenina en las poblaciones de Ecuador ocurrió a los 84 y 88 días, en las de Perú 83 y 87 días, y en las de Costa Rica de 90 a 95 días, valores que son menores que los registrados en el híbrido azul HA-911 (99 días a floración femenina) clasificado como intermedio-tardío (Arellano et al., 2013). Es importante la precocidad mostrada por las poblaciones pigmentadas de Ecuador y Perú, pues el número de días a floración de la variedad INIAP-119 Racimo de Uva en Ecuador tiene 114 días (Yánez et al., 2017; Com. Pers.)1 y el de la raza Kculli en Perú entre 100 y 120 días (Manrique, 2000), y hasta 140 y 144 días (Oscanoa y Sevilla, 2008).
En las poblaciones mexicanas el promedio fue 85 y 89 días, seis de éstas fueron de ciclo intermedio y tardío y el resto precoces, con 68 y 70 días a floración masculina y femenina, incluyendo al testigo Negro Ixtenco (Cuadro 1).
Cuadro 1 Características agronómicas de poblaciones pigmentadas de maíz nacionales e introducidas, evaluadas en 2015 en el Campo Experimental de INIFAP de Coatlinchán, Edo. de México.
| Población | Origen | Altitud msnm | Clasif. racial primaria | Floración (d) | Altura (cm) | San. | Acame (%) | Espiga (cm) | No. Hojas AMZ | ||||
| Masc. | Fem. | Pta. | Maz. | Tallo | Raíz | Longitud | No. ramas | ||||||
| ECU-214 | EC | ND | 85 | 89 | 263 | 159 | 9 | 0 | 1.7 | 65 | 13 | 6 | |
| ECU-215 | EC | Racimo | 81 | 85 | 184 | 110 | 9 | 3.3 | 2.2 | 67 | 13 | 5 | |
| ECU-398 | EC | Racimo | 83 | 87 | 180 | 105 | 8 | 2.6 | 0 | 58.4 | 17 | 7 | |
| ECU-6018 | EC | 2810 | Racimo | 89 | 94 | 232 | 143 | 8 | 0 | 8.3 | 60 | 11 | 6 |
| ECU-6020 | EC | 2810 | Racimo | 86 | 90 | 219 | 117 | 9 | 0 | 0 | 60 | 11 | 6 |
| ECU-6021 | EC | 2810 | Racimo | 87 | 91 | 221 | 121 | 9 | 0 | 3.6 | 54 | 10 | 6 |
| ECU-7201 | EC | Racimo | 80 | 83 | 246 | 136 | 8 | 0 | 0 | 64.4 | 12 | 6 | |
| ECU-12702 | EC | ND | ND | 86 | 90 | 229 | 135 | 8 | 0 | 0 | 60 | 12 | 7 |
| ECU-12675 | EC | ND | ND | 86 | 90 | 202 | 106 | 9 | 4.3 | 0 | 59.6 | 15 | 7 |
| ECU-12696 | EC | 2650 | ND | 85 | 90 | 225 | 132 | 8 | 0 | 0 | 57 | 16 | 6 |
| ECU-6019 | EC | 2810 | ND | 84 | 88 | 189 | 99 | 7 | 1.9 | 1 | 62 | 10 | 5 |
| ECU-12717 | EC | 2750 | ND | 83 | 86 | 222 | 126 | 7 | 0 | 0 | 51 | 20 | 6 |
| ECU-12803 | EC | 2900 | Racimo | 81 | 85 | 177 | 95 | 7 | 0 | 0 | 70 | 17 | 6 |
| Media | 84 | 88 | 215 | 122 | 8 | 1 | 1 | 61 | 14 | 6 | |||
| Máximo | 89 | 94 | 263 | 159 | 9 | 4.3 | 8.3 | 70 | 20 | 7 | |||
| Mínimo | 80 | 83 | 177 | 95 | 7 | 0 | 0 | 51 | 10 | 5 | |||
| APUC-123 | P | ND | 79 | 83 | 168 | 110 | 7 | 0 | 1.2 | 63 | 13 | 5 | |
| APUC-136 | P | 3500 | ND | 74 | 78 | 163 | 95 | 7 | 0 | 0 | 63 | 13 | 5 |
| ANC-383 | P | 3200 | ND | 72 | 77 | 159 | 68 | 6 | 0 | 0 | 64 | 13 | 4 |
| ANC-395 | P | ND | 77 | 79 | 180 | 115 | 7 | 0 | 0 | 58.4 | 15 | 4 | |
| PERU-586 | P | ND | Alazán | 96 | 101 | 236 | 191 | 6 | 0 | 1.2 | 66 | 12 | 6 |
| AYA-77 | P | 2400 | Kculli | 79 | 82 | 207 | 130 | 6 | 0 | 1 | 60 | 14 | 6 |
| AREQ-130 | P | ND | 79 | 82 | 210 | 136 | 6 | 1.2 | 0 | 56.4 | 14 | 5 | |
| AREQ-165 | P | 2600 | ND | 74 | 77 | 203 | 110 | 7 | 1.6 | 1.6 | 60 | 10 | 6 |
| PERU-628 | P | 46 | ND | 92 | 96 | 230 | 166 | 6 | 3.6 | 1.8 | 57 | 20 | 5 |
| PERU-578 | P | 732 | Arizona | 99 | 104 | 234 | 155 | 6 | 1.4 | 2.8 | 63 | 16 | 5 |
| PERU-593 | P | 92 | Colorado | 93 | 96 | 250 | 172 | 6 | 2.5 | 1.2 | 61 | 21 | 6 |
| PERU-800 | P | 74 | Alazán | 83 | 88 | 212 | 154 | 6 | 0 | 0 | 61 | 15 | 5 |
| PERU-606 | P | Colorado | 93 | 97 | 203 | 119 | 6 | 0 | 0 | 51 | 22 | 6 | |
| PERU-614 | P | ND | Alazán | 94 | 98 | 251 | 197 | 6 | 3.4 | 1.1 | 56 | 20 | 4 |
| PERU-633 | P | 92 | Colorado | 70 | 72 | 196 | 116 | 7 | 2.9 | 1.4 | 55 | 14 | 5 |
| ANC-413 | P | 2800 | ND | 96 | 101 | 247 | 161 | 6 | 2.5 | 0 | 60 | 19 | 5 |
| AREQ-191 | P | 2620 | ND | 74 | 77 | 206 | 121 | 7 | 0 | 0 | 58 | 12 | 4 |
| AYA-47 | P | ND | ND | 75 | 79 | 185 | 112 | 7 | 0 | 0 | 56 | 20 | 4 |
| ANC-627 | P | 2850 | ND | 95 | 100 | 292 | 194 | 9 | 2.8 | 2.8 | 62 | 21 | 6 |
| APUC-99 | P | 3100 | ND | 73 | 80 | 220 | 120 | 7 | 2.1 | 1.1 | 63 | 17 | 5 |
| Media | 83 | 87 | 213 | 137 | 7 | 1.2 | 0.9 | 59.7 | 16 | 5 | |||
| Máximo | 99 | 104 | 292 | 197 | 9 | 3.6 | 2.8 | 66 | 22 | 6 | |||
| Mínimo | 70 | 72 | 159 | 68 | 6 | 0 | 0 | 51 | 10 | 4 | |||
| CRI-268 | CR | 70 | Negrito | 90 | 95 | 128 | 85 | 6 | 0 | 0 | 53 | 14 | 5 |
| CRI-397 | CR | 180 | Chococ | 90 | 95 | 172 | 102 | 6 | 0 | 0 | 56 | 13 | 6 |
| Media | 90 | 95 | 150 | 94 | 6 | 0 | 0 | 54.3 | 13.5 | 5.2 | |||
| Máximo | 90 | 95 | 172 | 102 | 6 | 0 | 0 | 56 | 14 | 6 | |||
| Mínimo | 90 | 95 | 128 | 85 | 6 | 0 | 0 | 53 | 13 | 5 | |||
| GRO-559 | MEX | 1619 | Ancho | 74 | 78 | 171 | 97 | 7 | 0 | 0 | 63 | 10 | 5 |
| TLAX-43 | MEX | 2491 | E. Cónicos | 72 | 74 | 178 | 125 | 7 | 0 | 8.1 | 60 | 8 | 4 |
| TLAX-44 | MEX | E. Cónicos | 71 | 74 | 185 | 118 | 7 | 1.7 | 13.7 | 62 | 6 | 4 | |
| TLAX-71 | MEX | 2500 | E. Cónicos | 68 | 71 | 165 | 105 | 7 | 0 | 10.2 | 59 | 9 | 4 |
| TLAX-112 | MEX | 2250 | E. Cónicos | 67 | 69 | 164 | 89 | 7 | 0 | 0 | 54 | 6 | 4 |
| TLAX-245 (783) | MEX | 2160 | E. Cónicos | 77 | 80 | 215 | 132 | 7 | 0 | 18.2 | 64 | 8 | 4 |
| VER - 402 | MEX | Arrocillo Am. | 101 | 106 | 281 | 187 | 9 | 1.8 | 6.4 | 64.8 | 9 | 5 | |
| VER-416 | MEX | 1937 | Arrocillo-Tuxpeño | 101 | 106 | 272 | 182 | 8 | 0 | 8.2 | 62 | 10 | 6 |
| VER-421 | MEX | Tuxpeño | 102 | 107 | 275 | 190 | 8 | 1.8 | 5.4 | 57 | 10 | 6 | |
| VER-407 | MEX | 1950 | Arrocillo-Tuxpeño | 95 | 100 | 222 | 148 | 8 | 0 | 7.4 | 61 | 14 | 5 |
| VER-549 | MEX | 1970 | Arrocillo-Tuxpeño | 98 | 103 | 248 | 145 | 6 | 0 | 0 | 58 | 15 | 6 |
| PUE-735 | MEX | 2131 | E. Cónicos | 113 | 118 | 176 | 115 | 7 | 0 | 0 | 49 | 14 | 6 |
| PUE-652 | MEX | 2776 | E. Cónicos | 67 | 70 | 178 | 99 | 7 | 0 | 0 | 56 | 7 | 3 |
| Media | 85 | 89 | 210 | 133 | 7 | 0 | 6 | 59 | 10 | 5 | |||
| Máximo | 113 | 118 | 281 | 190 | 9 | 2 | 18 | 65 | 15 | 6 | |||
| Mínimo | 67 | 69 | 164 | 89 | 6 | 0 | 0 | 49 | 6 | 3 | |||
| MCP (T) | 2500 | 81 | 85 | 197 | 118 | 7 | 0 | 0.9 | 64 | 17 | 5 | ||
| Negro Ixtenco (T) | MEX | 2542 | E. Cónicos | 68 | 70 | 191 | 131 | 7 | 0 | 0 | 59 | 8 | 3 |
EC: Ecuador, P: Perú, CR: Costa Rica, MÉX: México, AMZ: número de hojas arriba de la mazorca, San.: sanidad de planta (1 = completamente enferma y 10 = completamente sana), ND: no definida, MCP: maíz comercial pigmentado.
Las poblaciones de Ecuador, en promedio, fueron las más altas (215 cm), seguidas por las de Perú (213 cm), México (210 cm) y Costa Rica (150 cm). El mayor promedio de altura de mazorca se registró en las poblaciones de Perú (137 cm). Los valores máximos y mínimos de altura de planta y mazorca de las poblaciones de Ecuador están dentro de los valores registrados en la variedad INIAP-199 Racimo de Uva (Yánez et al., 2017; Com. Pers.)1. De manera similar, en las poblaciones de Perú el promedio de altura de planta estuvo dentro del intervalo de la variedad de maíz Morado Canteño (180 a 250 cm) (Manrique, 2000), y en las de México el promedio de altura de planta fue similar al informado para poblaciones de maíz azul (Arellano et al., 2003) (Cuadro 1).
El porcentaje de acame de tallo osciló de 0.0 a 1.2 %, el valor máximo se registró en la población PERÚ-628 (3.6 %). En promedio, el acame de raíz en los cuatro grupos de poblaciones osciló entre 0 y 6.0 %, el valor máximo, 18.2 %, se registró en la población de México TLAX45. La sanidad de planta se tomó como medida de adaptación de las poblaciones introducidas, donde sobresalieron las poblaciones de Ecuador con valores máximos y mínimos de entre 7 y 9, en las poblaciones de Perú sólo ANC-627 registró 9 y el resto tuvo valores entre 6 y 7, y en las de México sólo VER-402 tuvo 9, y en el resto la calificación fluctuó entre 6 y 8. Las poblaciones de Perú y Ecuador tienen longitud de espiga de 59.7 y 61 cm promedio, respectivamente, similar a las de México (59 cm promedio), pero mayor número de ramas, lo que puede ser una ventaja en la producción de polen para su multiplicación. También las poblaciones de Ecuador, en promedio, tuvieron seis hojas arriba de la mazorca, lo que podría conferirles más eficiencia en la producción de grano (Subedi y Ma, 2005) con respecto a los otros tres grupos (Cuadro 1).
Características físicas de grano
En el análisis de las características físicas del grano de las accesiones de evaluadas se encontró que en las de Ecuador, Perú y Costa Rica y en el testigo MCP el pigmento estuvo en el pericarpio, excepto en la accesión de Costa Rica CRI-397, mientras que en las de México y el testigo Negro Ixtenco el pigmento se ubicó tanto en pericarpio como en capa de aleurona (CA) (Cuadro 2). La concentración de pigmentos en el pericarpio facilita la separación mecánica de la fracción colorida, y el resto del grano, germen y endospermo, pueden destinarse a otros usos de valor comercial, lo cual reduce el costo del pigmento y hace más rentable la producción de maíz morado (Salinas et al., 2005a; Somavat et al., 2018).
Cuadro 2 Características físicas del grano y contenido de antocianinas totales en semilla original y multiplicada de poblaciones de maíz morado de Ecuador, Perú, Costa Rica y México.
| Genealogía | Clasificación racial primaria | UP | TE (%) | PCS (g) | CATg (mg 100-1 g MS) | Diferencia | |
| Original | Multiplicada | Orig.-Mult. | |||||
| ECU-214 | ND | P | 100H | 51.4 | 49.4 ± 6 | 19.0 ± 1 | 30.4 |
| ECU-215 | Racimo | P | 100H | 54.3 | 78.5 ± 0.12 | ||
| ECU-398 | Racimo | P | 100H | 55.9 | 260.1 ± 17.3 | ||
| ECU-6018 | Racimo | P | 100H | 49.3 | 32.9 ± 1.8 | ||
| ECU-6020 | Racimo | P | 75H | 58.7 | 303.7 ± 19 | 222.1 ± 13 | 81.6 |
| ECU-6021 | Racimo | P | 100H | 53.5 | 57.5 ± 3 | 399 ± 19 | -341.5 |
| ECU-7201 | Racimo | P | 100H | 42.7 | 255.8 ± 30.2 | 211.3 ± 16.2 | 44.5 |
| ECU-12702 | ND | P | 100H | 44.3 | 275.1 ± 12 | 78.0 ± 2 | 197.1 |
| ECU-12696 | ND | P | 100H | 38.3 | 338.0 ± 1 | 411.9 ± 12 | -73.9 |
| ECU-6019 | ND | P | 100H | 49.9 | 183.4 ± 4.6 | ||
| ECU-12675 | ND | P | 100H | 49.9 | 342.6 ± 2.8 | ||
| ECU-12717 | ND | P | 100H | 41.8 | 88.3 ± 6 | 149.4 ± 5 | -61.1 |
| ECU-12803 | Racimo | P | 100H | 34.1 | 51.0 ± 0 | 74.7 ± 6 | -23.7 |
| Media | 47.1 | 166.1 | 195.6 | -146.5 | |||
| Max | 100H | 58.7 | 342.60 | 411.9 | |||
| Min | 75H | 34.1 | 51.0 | 19.0 | |||
| APUC-123 | ND | P | 100H | 45.5 | 121.9 ± 23.7 | 193.6 ± 1.6 | -71.7 |
| APUC-136 | ND | P | 100H | 41.3 | 49.6 ± 8.7 | 286.3 ± 0.0 | -236.7 |
| ANC-383 | ND | P | 100H | 47.3 | 43.3 ± 0.3 | 3.9 ± 3.5 | 39.5 |
| ANC-395 | ND | P | 100H | 38.1 | 734.6 ± 107 | 667.5 ± 24 | 67.1 |
| PERU-586 | Alazán | P | 50H | 34.6 | 9.2 ± 0.4 | 5.8 ± 2.3 | 3.4 |
| AYA-77 | Kculli | P | 100H | 32.7 | 44.0 ± 10.3 | 175.2 ± 1.2 | -131.2 |
| AREQ-165 | ND | P | 100H | 49.5 | 15.2 ± 0.1 | 13.5 ± 0.4 | 1.7 |
| PERU-606 | Colorado | P | 25H | 48.3 | 23.2 ± 2.8 | 8.7 ± 0.22 | 14.5 |
| PERU-628 | ND | P | 100H | 20.2 | 11.6 ± 0.0 | 5.4 ± 1.6 | 6.3 |
| PERU-578 | Arizona | P | 75H | 34.7 | 10.2 ± 0.1 | 6.5 ± 0. | 3.7 |
| PERU-593 | Colorado | P | 100H | 40.6 | 5.7 ± 0.5 | 7.3 ± 0.2 | -1.6 |
| PERU-800 | Alazán | P | 75H | 36.4 | 4.0 ± 0.0 | 4.0 ± 0.5 | 0.0 |
| PERU-614 | Alazán | P | 100H | 32.4 | 4.1 ± 0.1 | 3.6 ± 0.1 | 0.5 |
| PERU-633 | Colorado | P | 100H | 26.2 | 16.0 ± 0.1 | 3.4 ± 1.1 | 12.6 |
| ANC-413 | ND | P | 75H | 36.7 | 7.2 ± 0.2 | 4.1 ± 0.5 | 3.0 |
| AREQ-130 | ND | P | 100H | 49.9 | 674.1 ± 23.4 | 268.1 ± 8.2 | 406 |
| AREQ-191 | ND | P | 100H | 50.3 | 267.3 ± 4.1 | 53.2 ± 1.5 | 214.2 |
| AYA-47 | ND | P | 100H | 38.3 | 252.5 ± 2.3 | 71.0 ± 17.6 | 181.5 |
| ANC-627 | ND | P | 100H | 41.3 | 6.5 ± 0.2 | 3.7 ± 0.0 | 2.8 |
| APUC-99 | ND | P | 100H | 44.3 | 69.5 ± 3.7 | 52.7 ± 0.7 | 16.8 |
| Media | 37.9 | 118.5 | 91.9 | 396.2 | |||
| Max | 100H | 50.3 | 734.6 | 667.5 | |||
| Min | 50H | 20.2 | 4.0 | 3.4 | |||
| CRI-268 | ND | P | 25H | 20.0 | 69.6 ± 2.0 | 29.9 ± 6.0 | 39.7 |
| CRI-397 | Negrito | P/CA | 100H | 19.2 | 181.2 ± 12 | 184.9 ± 17 | -3.8 |
| Media | 19.6 | 125.4 | 107.4 | 35.9 | |||
| Max | 100H | 20 | 181.2 | 184.9 | |||
| Min | 25H | 19.2 | 69.6 | 29.9 | |||
| GRO-559 | Elotes Cónicos | P/CA | 75H | 48.7 | 64.1 ± 5.0 | 101.6 ± 4.0 | -37.5 |
| TLAX-44 | Elotes Cónicos | P/CA | 100H | 35.2 | 301.0 ± 12.9 | 167.9 ± 13 | |
| TLAX-43 | Elotes Cónicos | P/CA | 100H | 36.9 | 24.5 ± 3.0 | 153.3 ± 1.0 | -128.8 |
| TLAX-71 | Elotes Cónicos | P/CA | 100H | 31.4 | 23.0 ± 5.0 | 103.9 ± 0.0 | -80.8 |
| TLAX-112 | Elotes Cónicos | P/CA | 100H | 33.4 | 63.6 ± 4.0 | 59.2 ± 3 | 4.4 |
| TLAX-245 | Elotes Cónicos | P/CA | 100H | 45.5 | 82.7 ± 7.0 | 136.4 ± 1.0 | -53.7 |
| VER - 402 | Arrocillo | P/CA | 50H | 43.1 | 361.4 ± 5.8 | ||
| VER-416 | Arrocillo-Tuxpeño | P/CA | 50H | 38.1 | 56.9 ± 5.9 | ||
| VER-407 | Arrocillo-Tuxpeño | P/CA | 50H | 31.9 | 125.1 ± 7.1 | ||
| VER-421 | Tuxpeño | P/CA | 25H | 33.1 | 572.1 ± 24.8 | 124.6 ± 1.48 | |
| VER-549 | Arrocillo-Tuxpeño | P/CA | 25H | 36.8 | 78.8 ± 2.0 | 85.9 ± 1.0 | -7.1 |
| PUE-735 | Elotes Cónicos | P/CA | 50H | 35.3 | 127.9 ± 10 | 135.3 ± 15 | -7.4 |
| PUE-652 | Elotes Cónicos | P/CA | 100H | 37.3 | 83.4 ± 1.0 | 77.9 ± 2.0 | 5.5 |
| PUE-325 | Tuxpeño | P/CA | 25H | 27.9 | |||
| Media | 36.7 | 151.1 | 114.6 | 275.2 | |||
| Max | 100H | 48.7 | 572.1 | 153.3 | |||
| Min | 25H | 27.9 | 23.0 | 59.2 | |||
| Maíz MCP (T) | ND | P | 100H | ||||
| Negro Ixtenco (T) | Elotes Cónicos | P/CA | 100H | ||||
El tipo de endospermo del grano en las accesiones de Ecuador fue 100 % harinoso (100H), excepto en ECU-6020 que fue 75H; en las de Perú, en PERÚ-800 y ANC-413 el grano fue 75H y PERÚ-586 50H y el resto tuvieron grano 100H. En las de Costa Rica el grano de CRI-268 fue 25H y el de CRI-397 100H, mientras que en las de México, las accesiones de la raza Elotes Cónicos tuvieron endospermo 100H, la de la raza ancho GRO-559 fue 75H y en la raza Arrocillo-Tuxpeño el tipo de endospermo osciló de 25H a 50H (Cuadro 2). El tipo de endospermo del grano es importante para la extracción de pigmentos, pues maíces con endospermo 100H se rompen durante la separación mecánica del pericarpio como fracción colorida (Salinas et al., 2005a), mientras que maíces pigmentados con endospermo 50H o 25H son más resistentes al “perlado”; sin embargo, los maíces morados de Ecuador (Yánez et al., 2017; Com. Pers.)1, Perú (Manrique, 2000; Oscanoa y Sevilla, 2008) y México (Espinosa et al., 2009) se caracterizan por tener endospermo 100H. Por tanto, en el mejoramiento genético de maíz para alto contenido de antocianinas debe incluirse la textura cornea del grano como criterio de selección.
El peso de cien semillas (PCS) en las accesiones de Ecuador varió entre 34.1 y 58.7 g, en las de Perú entre 20.2 y 50.3 g y en las de México entre 27.9 y 48.7 g. Los valores de PCS fueron más homogéneos en comparación con las de Ecuador y Perú, atribuido a su menor diversidad racial. El PCS más bajo se registró en las accesiones de Costa Rica (Cuadro 2). Con el PCS se estima el tamaño del grano (Roque-Maciel et al., 2016) y es otro criterio importante a considerar en la selección de germoplasma para la extracción de pigmentos, pues la cantidad de pigmento en las capas periféricas del grano tiene relación con el tamaño del grano, granos pequeños tienen mayor superficie de contacto que granos grandes, y por tanto, tendrá mayor cantidad de pigmento por unidad de peso (Aguilar-Hernández et al. 2019), pero habrá que fijar un límite en el tamaño del grano para facilitar el manejo agronómico de las variedades.
Contenido de antocianinas en semilla original y multiplicada
De las 48 accesiones sembradas de maíz pigmentado escogidas en grano, sólo se seleccionaron 40 que tuvieran semilla de al menos 20 polinizaciones, en el resto de las accesiones se observaron problemas de germinación y adaptación debido a su lugar de origen, pues Coatlinchán, Edo. de México se ubica a 2300 m de altitud, y los sitios de colecta de algunas poblaciones de Perú como APUC-136 y Perú 628 se ubican a alturas tan contrastantes como 3500 y 46 m, respectivamente. Un porcentaje elevado (38.5 %) de las accesiones de Ecuador no produjeron grano. En las de México, algunas son de la raza Tuxpeño o combinaciones Arrocillo-Tuxpeño, cuyo origen requiere de un proceso de selección previo para adaptarse a los Valles Altos de México (López-Morales et al., 2021; Pérez et al., 2002) (Cuadros 1 y 2).
En el Cuadro 2 se observan los contrastes en las diferencias entre la semilla original y la multiplicada en las accesiones ECU-12672 (197 mg/100 g MS), APUC-136 (-236.7 mg/100 g MS), TLAXC-112 (4.0 mg/100 g MS) y PERÚ 200 (0 mg/100 g MS), la correlación entre el CATg de semilla original y multiplicada fue r = 0.48, la correlación ideal en líneas completamente homocigóticas sería r = 1. Las diferencias en el CATg entre la semilla original y multiplicada podrían deberse a la influencia del sitio de multiplicación y a la segregación genética en color de grano de la población después de su multiplicación, pues se ha informado que el contenido de antocianinas en grano se altera por efecto de la localidad, fecha de siembra y manejo del cultivo (Giordano et al., 2018).
Se considera que el tamaño de muestra influyó en las diferencias por la segregación en color de grano que se presentó en las accesiones multiplicadas, pues éstas son de polinización libre y la herencia del color morado en grano y olote del maíz es cuantitativa (Harakotr et al., 2016), cuyos genes se han identificado en QTLs en los cromosomas 1, 3, 6 y 10 (Xu et al., 2016; Yonemaru et al., 2018).
Una estrategia para seleccionar poblaciones con grano y olote de maíz morado sería: 1) determinar el ambiente objetivo, 2) seleccionar poblaciones de maíz con grano y olote morado con un mínimo de 400 mg/100 g de CATg en grano, 3) multiplicar semilla de las poblaciones seleccionadas eliminando mazorcas no objetivo, y en cada población, hacer un compuesto balanceado con semilla de las mazorcas seleccionadas, 4) hacer una segunda multiplicación de semilla de las poblaciones seleccionadas polinizando un mínimo de 200 mazorcas, a la cosecha, seleccionar sólo mazorcas del color objetivo y hacer un compuesto balanceado con semilla de las mazorcas seleccionadas, y 5) determinar el CATg de las poblaciones multiplicadas, seleccionar las que tengan un mínimo de 400 mg 100 g-1 de CATg, y la diferencia entre la semilla original y multiplicada sea positiva o cercana a cero.
Antocianinas en pericarpio y grano
El menor contenido de antocianinas en pericarpio (CATp) se registró en las poblaciones de Ecuador ECU-214 y PERU-606, 132.7 ± 4.7 y 152.2 ± 11.9 mg 100 g-1 de MS, respectivamente, debido a que el grano es de color rojo, y el más alto, 4792.8 ± 286.0 mg 100 g-1 de MS en la población de Perú ANC-395, la población de México VER-402 tuvo el valor más alto de CATp (2959.0 ± 239.6 mg 100 g-1 de MS) superando al testigo Negro Ixtenco (2387.0 ± 278.6 mg 100 g-1 de MS), pero ninguna de las poblaciones evaluadas superó al testigo MCP (5844.7 ± 183.7 mg 100 g-1 de MS) (Cuadro 3).
Cuadro 3 Características físicas de grano y contenido de antocianinas (mg/100 g MS) en pericarpio y grano de accesiones de maíz morado de diferentes orígenes.
| Origen | País | Clasificación racial primaria | UP | TE | CATp | CATg | CATp/CATg |
| CRI-397 | Costa Rica | Chococ | P | 100H | 2032.6 ± 20.3 | 181.2 ± 16.8 | 11.2 |
| ECU-398 | Ecuador | Racimo | P | 100H | 2386.4 ± 161.2 | 260.1 ± 17.3 | 9.2 |
| ECU-214 | Ecuador | ND | P | 100H | 132.7 ± 4.7 | 49.4 ± 6.4 | 2.7 |
| ECU-7201 | Ecuador | Racimo | P | 100H | 3086.7 ± 68.6 | 255.8 ± 30.2 | 12.1 |
| ECU-12675 | Ecuador | ND | P | 100H | 4129.0 ± 28.5 | 342.6 ± 2.83 | 12.1 |
| Media | 2433.7 | 217.8 | 9.0 | ||||
| APUC-123 | Perú | ND | P | 100H | 1538.1 ± 100.0 | 121.9 ± 23.7 | 12.6 |
| ANC-395 | Perú | ND | P | 100H | 4792.8 ± 286.0 | 734.6 ± 107.6 | 6.5 |
| AREQ-130 | Perú | ND | P | 100H | 4222.9 ± 33.9 | 674.1 ± 23.4 | 6.3 |
| PERU-606 | Perú | Colorado | P | 25H | 152.2 ± 11.9 | 23.2 ± 2.8 | 6.6 |
| Media | 2676.5 | 388.5 | 8.0 | ||||
| TLAX-44 | México | Elotes Cónicos | P/CA | 100H | 1272.7 ± 14.0 | 301.0 ± 12.9 | 4.2 |
| VER - 402 | México | Arrocillo Am. | P/CA | 50H | 2959.0 ± 239.6 | 361.4 ± 5.8 | 8.2 |
| VER-421 | México | Tuxpeño | P/CA | 25H | 891.9 ± 56.4 | 572.1 ± 24.8 | 1.6 |
| Media | 1707.9 | 411.5 | 4.7 | ||||
| MCP (T) | P | 100H | 5844.7 ± 183.7 | 827.4 ± 95.0 | 7.1 | ||
| Negro Ixtenco (T) | México | Elotes Cónicos | P/CA | 100H | 2387.0 ± 278.6 | 562.7 ± 39.1 | 4.2 |
UP: ubicación del pigmento en el grano (P: pericarpio, CA: capa de aleurona), TE: tipo de endospermo, H: harinoso, CATp: contenido de antocianinas totales en el pericarpio, CATg: contenido de antocianinas totales en grano. Valores después del signo ± corresponden a la desviación estándar, MCP: maíz comercial pigmentado, T: testigo.
El CATp comparado con el contenido de antocianinas en grano (CTAg) varió dentro de cada grupo, en las poblaciones de Ecuador éste osciló de 2.7 a 12.1, en las de Perú de 6.5 a 12.6 y en las de México de 1.6 a 8.6. Al respecto, Mendoza-Mendoza et al. (2017) informaron que en 20 líneas elite derivadas del maíz Negro Ixtenco, el CATp fue de 2.2 a 13.9 veces mayor que el del CATg. Ninguna de las poblaciones analizadas tuvo un CATp igual o mayor que el testigo MCP, pero varias de ellas superaron al testigo Negro Ixtenco (Cuadro 3). Algunos valores de CATp en las poblaciones analizadas son similares a los reportados por Mendoza-Mendoza et al. (2017) y por otros investigadores que han analizado esta variable en maíces morados con origen genético similar (Salinas et al., 2005b). Los elevados valores de CATp en maíces morados comparados con los de CATg podrían deberse a que el pericarpio es una estructura completamente colorida, en tanto que el grano carece de pigmento en el endospermo (Mendoza-Mendoza et al. 2017), que representa 80 % de su peso, excepto el que presentan en capa de aleurona algunas poblaciones.
La relación entre el CATp y el CATg fue positiva y se ajustó al modelo lineal, CATp = 5.1211×CATg + 632.44, pero su ajuste fue bajo, R² = 0.5811 (Figura 1 A), y sería impreciso usarla como ecuación de predicción para estimar el CATp en el resto de las poblaciones. Al analizar las poblaciones en función de la ubicación del pigmento, en aquellas con el pigmento en pericarpio, la relación fue positiva y el modelo lineal, CATp = 6.1474×CATg + 698.57, fue más preciso con una R² = 0.8726 (Figura 1 B); en cambio, las poblaciones donde el pigmento estuvo en pericarpio y capa de aleurona, en los datos no hubo una tendencia definida, en el modelo CATp = -1.191×CATg + 2412.8 la relación fue negativa con R² = 0.0296 (Figura 1 C).
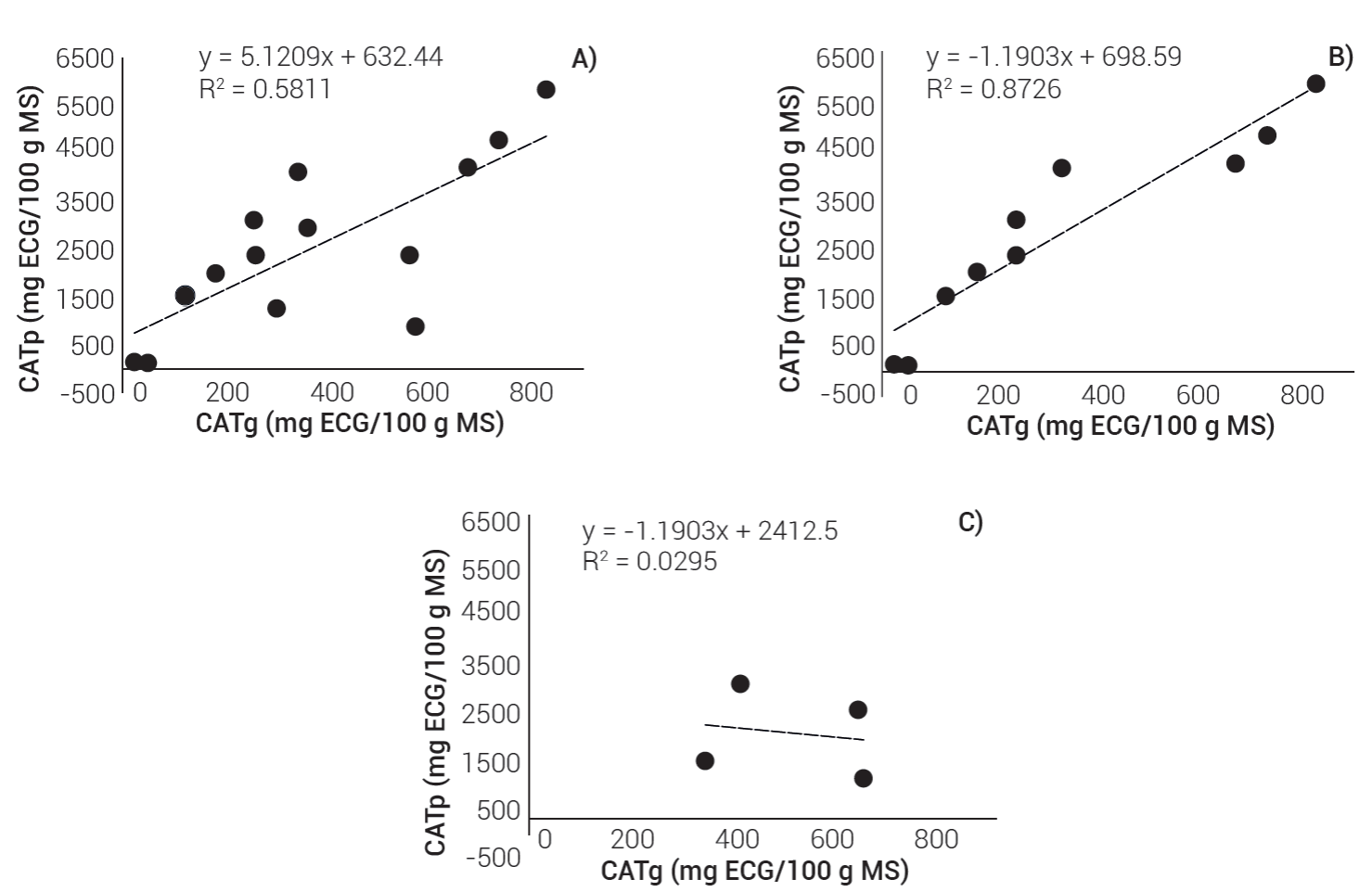
Figura 1 Regresión lineal entre el contenido de antocianinas en pericarpio (CATp) y grano (CATg)) de poblaciones de maíz morado con presencia de antocianinas en pericarpio y capa de aleurona (A), sólo en pericarpio (B), y sólo en capa de aleurona (C).
Los resultados indican que la cantidad de pigmento en la capa de aleurona difiere entre las poblaciones evaluadas y no tiene relación lineal como en el pericarpio, tal como lo reportan (Mendoza-Mendoza et al., 2017); sin embargo, es necesario señalar que el tamaño de muestra fue reducido. Se requieren modelos de estimación más precisos porque la separación y análisis del pericarpio del grano es costosa.
Análisis de las antocianinas del grano por cromatografía líquida de alta resolución (HPLC)
Con el protocolo de análisis aplicado, en los cromatogramas de las poblaciones analizadas de maíz morado se separaron de 13 a 15 picos (Figura 2) y nueve de ellos fueron identificados. Las diferencias en el perfil cromatográfico de las antocianinas de las poblaciones fueron el número de picos y la proporción relativa de algunos de ellos. Se identificaron picos de alta polaridad (picos 1 a 5) en la población exótica ANC-395 (Figura 2 A) y el testigo MCP (Figura 2 C); sin embargo, estos picos de alta polaridad no se identificaron en las poblaciones nacionales VER-402 (Figura 2 B) y el testigo Negro Ixtenco (Figura 2 D). Los picos de alta polaridad 1 a 5 se han identificado como pigmentos producto de la condensación entre una molécula de antocianina y un flavanol (González-Manzano et al., 2008), los que por hallarse en baja proporción no afectan la calidad del pigmento del maíz morado (Luna-Vital et al., 2017).
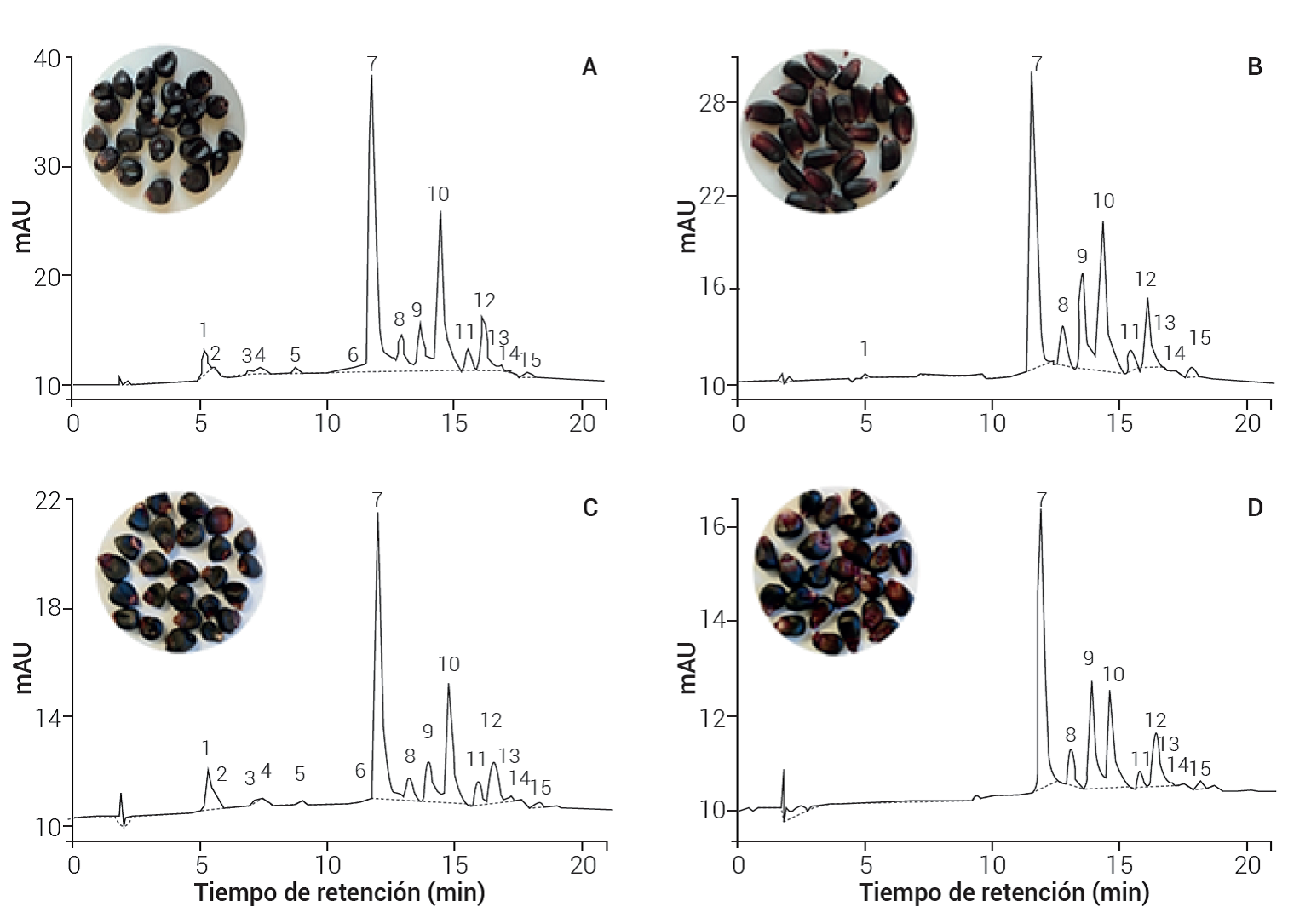
Figura 2 Perfil cromatográfico de las antocianinas del grano de maíz morado de la población de origen andino (A: ANC-395), una población nacional (B: VER-402) un testigo comercial (C: MPC) y el testigo (D: Negro Ixtenco). La identidad de los picos es: 1 y 2: pigmentos flavanol-antocianina; 3, 4 y 5 no fueron identificados; 6: cianidina 3,5 diglucósido, 7: cianidina 3-glucósido, 8: pelargonidina 3-glucósido, 9: peonidina 3-glucósido, 10: cianidina 3-malonil glucósido, 11: pelargonidina 3-malonil glucósido, 12: peonidina 3-malonil glucósido, 13: cianidina 3-dimalonil glucósido, 14 y 15 no fueron identificados.
Respecto a la proporción de las diferentes antocianinas, en las cuatro poblaciones el pico 7 (cianidina 3-glucósido) fue dominante, lo que coincide con lo informado por otros investigadores para maíces con este color de grano (Aoki et al, 2002; Salinas et al. 2005b). La población exótica ANC-395 y el testigo MCP mostraron alta proporción del pico 10 (cianidina 3-malonil glucósido), mientras que en las poblaciones de México, la proporción de los picos 9 (peonidina 3-glucosido) y 10 fue similar. Cada antocianina se asocia con un color particular, aunque todas presentan un tono rojizo a pH ácido; sin embargo, los derivados de pelargonidina, cianidina y peonidina presentan tonos más rojos que los derivados de delfinidina, petunidina y malvidina, que tienden más hacia tonos azul-morado (Trojak y Skowron, 2017). Los perfiles cromatográficos de las poblaciones analizadas coinciden con los informados por otros autores para maíces de grano morado (Aoki et al., 2002; Li et al., 2017).
En esta investigación sólo se analizó el potencial genético de la producción de antocianinas en el grano de las poblaciones de maíz morado; sin embargo, la industria extractora de pigmentos obtiene más antocianinas del olote que del grano; por tanto, las variedades mejoradas de maíz morado deberán seleccionarse con alto contenido de antocianinas en grano y olote, esto es posible, pues los QTLs que contienen los genes para ambas características residen en los cromosomas 6 y 10 (Xu et al., 2015).
Conclusiones
Las poblaciones exóticas de Ecuador y Perú tuvieron ciclo de madurez, sanidad de planta, altura de planta y mazorca, y tolerancia al acame similar a las poblaciones nativas de México, y en los tres grupos la textura del grano fue harinosa. El pigmento en el grano de las poblaciones exóticas se ubicó en el pericarpio y en las nacionales en pericarpio y capa de aleurona. La relación entre el contenido de antocianinas en el pericarpio y el grano fue positiva, y más precisa cuando las antocianinas se encontraron sólo en el pericarpio que en pericarpio y capa de aleurona. En el perfil de antocianinas en grano de las poblaciones ANC-395 y el testigo MPC se identificaron compuestos de baja polaridad que no están presentes en las poblaciones nacionales VER-402 y Negro Ixtenco. Las poblaciones con mayor contenido de antocianinas, tanto en pericarpio como en grano entero, fueron las originarias de Ecuador y Perú.











 nova página do texto(beta)
nova página do texto(beta)


