Introducción
La salinidad en los suelos es, después de la sequía, el segundo fenómeno que mayores impactos negativos causa en el desarrollo y la productividad de las plantas (Ghosh, 2016). El cambio climático, que genera alta evaporación y desecación de los suelos, la erosión en zonas costeras que permite la entrada del agua del mar, así como la inadecuada irrigación de los suelos, hacen que este fenómeno se agrave más cada día (Hussain et al., 2017).
Las principales afectaciones en las plantas asociadas con la salinidad son el déficit hídrico impuesto por la mayor osmolaridad del suelo, el daño celular infligido por la excesiva acumulación de iones en los tejidos vegetales y el desbalance nutricional por la modificación de la absorción de nutrientes esenciales (Reddy et al., 2017). La salinidad influye en el metabolismo del nitrógeno y de los azúcares, disminuye la fotosíntesis y aumenta el estrés oxidativo. Todos estos trastornos implican una afectación en el crecimiento y desarrollo de las plantas, y por tanto, una disminución del rendimiento (Orosco-Alcalá et al., 2018).
El arroz (Oryza sativa L.) es la fuente principal de alimento de más de un tercio de la población mundial, pero su crecimiento y desarrollo es seriamente afectado por la salinidad, especialmente durante el inicio de las etapas vegetativa y reproductiva (Ghaffari et al., 2013). Existen varias estrategias para revertir los efectos adversos que provoca el estrés salino en este cultivo, entre ellas se encuentran la utilización de cultivares tolerantes, la mejora del manejo del agua de irrigación y el uso de productos bioactivos capaces de estimular el crecimiento y desarrollo de las plantas, dentro de los cuales se encuentran las oligosacarinas (Núñez et al., 2018).
El Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias Agrícolas (INCA) de Cuba ha desarrollado varios productos a base de oligosacarinas, que constituyen alternativas nacionales que se han utilizado como reguladores del crecimiento, estimuladores de los rendimientos y protectores de los cultivos contra factores de estrés biótico y abiótico (Falcón et al., 2015); entre ellos destaca la mezcla de oligogalacturónidos denominada comercialmente como Pectimorf® (Pm), un estimulante del enraizamiento, crecimiento y diferenciación celular de diferentes especies vegetales.
El objetivo de la presente revisión fue recopilar información sobre los efectos del estrés salino en el desarrollo del cultivo del arroz, así como analizar la información relacionada con los efectos de la aplicación exógena de una mezcla de oligogalacturónidos en plantas sometidas a estrés abiótico, en especial a estrés salino.
Aspectos generales de la salinidad de los suelos
La salinidad de los suelos es el factor que más influye en el establecimiento de las poblaciones humanas (Hussain et al., 2017). Se estima que más de 800 millones de hectáreas de tierra en todo el mundo se ven afectadas por la alta salinidad (Munns y Tester, 2008), las cuales incluyen 397 y 434 millones de hectáreas de suelos salinos (el catión predominante es Ca2+) y sódicos, respectivamente (Hasanuzzaman et al., 2014).
El aumento de la salinidad del suelo puede ser causado por varios factores, incluyendo la evaporación, precipitación y erosión de las rocas. Con pocas excepciones, las plantas terrestres son glicófitas y la mayoría no puede tolerar concentraciones de sales mayores de 50 mM (Smékalová et al., 2013)
El origen de los distintos tipos de sales en el suelo puede ser natural o antrópico. Los suelos con problemas naturales de salinidad están localizados en áreas con balance negativo de lluvia/evaporación. Además de las adversas condiciones climáticas, se deben considerar otros factores, como las aguas salinas subterráneas, las tierras bajas cercanas a las costas, los pantanos y lagunas litorales, así como las áreas cercanas a minas y bóvedas salinas (Lamz y González, 2013).
Por otra parte, el proceso de salinidad es también una consecuencia del desarrollo de la sociedad humana, debido a incorrectas prácticas agrícolas en el suelo y mal manejo de las aguas para el riego y de la fertilización, lo cual es conocido como proceso de salinidad atrófica o secundaria (Orosco-Alcalá et al., 2018).
El Na+ puede atrapar las moléculas de agua del suelo, lo que provoca que disminuya el agua de hidratación para otros nutrimentos, afectando también la estructura del suelo al disgregar sus partículas. En los suelos salinos se reduce la absorción y translocación de los micronutrientes K+ y Ca2+, los cuales se requieren para mantener la selectividad y la integridad de la membrana celular de las raíces de las plantas (Martínez et al., 2011).
Efectos del estrés salino en las plantas
Los primeros síntomas del estrés salino en las plantas son la disminución de la velocidad de crecimiento, seguido por la muerte de los tejidos, la que comienza a manifestarse como zonas dispersas de quemaduras en las hojas (zonas necróticas); a continuación, se presenta inhibición del desarrollo de los meristemos y yemas, pérdida de turgencia, caída de hojas y finalmente, cuando la planta no logra superar la condición de estrés ocurre la marchitez irreversible (Tadeo, 2000).
El exceso de sales modifica las actividades metabólicas de la pared celular, que causan la deposición de diversos materiales como lignina y suberina, lo que limita la elasticidad, las paredes se vuelven rígidas y, en consecuencia, disminuye la eficiencia de la presión de turgencia durante el alargamiento celular (Ali et al., 2004; Byrt et al., 2017).
La salinidad retarda el crecimiento de las plantas a través de su influencia sobre varios procesos fisiológicos, tales como fotosíntesis, conductancia estomática, ajuste osmótico, absorción de iones, síntesis de proteínas, síntesis de ácidos nucleicos, actividad enzimática y balance hormonal; además, puede afectar el proceso de transporte de iones y agua, lo que promueve toxicidad iónica y desbalance nutricional; en consecuencia, las variables de crecimiento como masa seca, altura de planta y área foliar, entre otras, son severamente afectadas por la presencia de sales (Orosco-Alcalá et al., 2018).
El retraso del crecimiento se debe a la disminución del potencial osmótico del suelo y, en consecuencia, de su potencial hídrico, a la toxicidad iónica, la cual normalmente está asociada con la absorción excesiva de iones Na+ y Cl-, lo que provoca un desequilibrio nutricional debido a la interferencia de los iones salinos con la absorción de los nutrientes esenciales que requiere la planta (Nawaz et al., 2010).
El estrés salino daña severamente el aparato fotosintético (Senguttuvel et al., 2014). La consecuencia fundamental del NaCl es la producción en exceso de las especies reactivas de oxígeno (ERO), tales como oxígeno atómico (1O2), radical superóxido (O2 -), peróxido de hidrógeno (H2O2) y radical hidroxilo (OH·), que pueden causar en las plantas reacciones fitotóxicas como la peroxidación de lípidos, degradación de proteínas y mutaciones en el ADN (Joseph y Jini 2011). Un incremento de las ERO puede provocar estrés oxidativo a través de la oxidación de los compuestos celulares (Khan et al., 2016); durante tales episodios, varias vías de utilización de NADPH (especialmente en el ciclo de Calvin) resultan bloqueadas por inhibición de enzimas clave, como consecuencia, el nivel de NADP+ disminuye, y en ausencia de su aceptor final, la cadena de transporte electrónico se reduce, ya que la cantidad de fotoelectrones producidos en los fotosistemas I y II no puede ser enteramente canalizada a las rutas fisiológicas de óxido-reducción (Foyer y Noctor 2016).
La producción de ERO es una de las principales causas de disminución de la productividad, además de lesiones y muerte que acompañan al estrés en la planta; mecanismos existentes en las células de las plantas pueden estimular la regulación de la sobreproducción de ERO, contrarrestando el estrés oxidativo que se produce; estos mecanismos incluyen antioxidantes enzimáticos como superóxido dismutasa (SOD), catalasa (CAT), peroxidasa (POD), ascorbato peroxidasa y deshidroascorbato reductasa y no enzimáticos como ácido ascórbico (AA, vitamina C), α-tocoferol (vitamina E), glutatión y β-caroteno (Huang et al., 2013).
Mecanismos de tolerancia a la salinidad
La tolerancia es una propiedad desarrollada por las plantas durante el proceso evolutivo, para poder perpetuar las especies en condiciones donde hay factores de estrés climáticos o edáficos constantes, o que se repiten periódicamente (Blum, 2018).
Para definir el concepto de tolerancia a la salinidad es necesario establecer dos aspectos fundamentales, uno biológico y otro agronómico. Desde el punto de vista biológico, la tolerancia en una especie o cultivar es aquel nivel de salinidad hasta el cual las plantas son capaces de completar su ciclo de desarrollo y producir semillas viables; desde el punto de vista agronómico, la tolerancia se define como la habilidad de las plantas de sobrevivir y producir rendimientos económicos en condiciones de estrés, y se expresa como la relación entre el rendimiento de un cultivar en condiciones salinas, con respecto a su rendimiento en condiciones normales (Munss y Gilliham, 2015); en este sentido, se ha mencionado que en la evolución de los mecanismos de tolerancia y adaptación de las plantas a los diferentes agentes estresantes, puede observarse la existencia de grados de sensibilidad y de tolerancia muy diferentes entre las diversas especies, e incluso variedades o ecotipos dentro de una misma especie, lo anterior evidencia la diversidad de estrategias que han desarrollado las plantas para mantener una respuesta altamente refinada ante una amplia gama de estreses, a los cuales se encuentran rutinariamente expuestas (Reyes-Pérez et al., 2013).
Entre los mecanismos que explican la capacidad de las especies vegetales para tolerar el estrés salino se encuentran el ajuste osmótico, la exclusión de iones a nivel radical y la retención de iones en las vacuolas, la eliminación del exceso de sales a través de glándulas o estructuras especializadas y la pérdida de sales a través de la caída de las hojas y pérdida de los frutos (Blum, 2018) (Figura 1).
Como se mencionó anteriormente, el estrés salino incrementa las ERO, y para minimizar los efectos tóxicos de éstas, las plantas han desarrollado mecanismos finamente regulados de protección enzimáticos y no enzimáticos. Estos mecanismos atrapan e inactivan eficientemente los radicales libres de oxígeno, logrando el balance entre la producción y la destrucción de las mismos (Choudhury et al., 2017). La habilidad de las plantas de sobreponerse al estrés oxidativo depende de sus capacidades de desencadenar tales mecanismos de respuesta de manera eficaz en los diferentes organelos celulares. Los niveles de los antioxidantes se incrementan después de la exposición de las plantas al estrés ambiental biótico o abiótico, incluyendo la salinidad (Kibria et al., 2017).
Características generales del cultivo del arroz
El arroz (Oryza sativa L.) es una monocotiledónea perteneciente a la familia Poaceae. Es uno de los cereales de mayor producción a nivel mundial y constituye una de las bases de la alimentación humana (John y Fielding, 2014; Onyango, 2014; Zhang et al., 2014).
Es una gramínea anual, de tallo cilíndrico, compuesto de nudos y entrenudos; sus hojas son alternas, envainadoras, con el limbo lineal, agudo, largo y plano. En el punto de unión de la vaina y el limbo se encuentra una lígula membranosa, bífida y erguida con una serie de cirros largos y sedosos en el borde inferior (Degiovanni et al., 2010).
Las raíces son delgadas, fibrosas y fasciculadas; posee dos tipos de raíces, seminales, que se originan de la radícula y son de naturaleza temporal, y raíces adventicias secundarias, que tienen una libre ramificación y se forman a partir de los nudos inferiores del tallo joven; estas últimas sustituyen a las raíces seminales. Sus flores son de color verde blanquecino dispuestas en espiguillas, cuyo conjunto constituye una panoja grande, terminal, estrecha y colgante después de la floración, y se encuentran organizadas en una inflorescencia en forma de panícula que se localiza sobre el vástago terminal (Figura 2). El grano de arroz es el ovario maduro (Wei y Huang, 2019).
Morfología y anatomía de las raíces
Las raíces de las plantas de arroz, además de ser el soporte mecánico, posibilitan la incorporación del agua y los nutrientes, permitiéndoles crecer en un medio hostil y competitivo, donde los suplementos son limitados y variables (Pierik y Testerink, 2014).
Como se mencionó anteriormente, durante su desarrollo, la planta de arroz emite dos clases de raíces: las seminales (o temporales) y las adventicias (o permanentes); se denominan también, primarias y secundarias, respectivamente. Las raíces seminales son poco ramificadas, viven un corto tiempo después de la germinación y son reemplazadas por las raíces adventicias. Las raíces adventicias brotan de los nudos subterráneos de los tallos jóvenes, en el arroz flotante brotan de los nudos del tallo que está sumergido en el agua y, en algunos casos, también de los nudos aéreos. En los primeros estadios de crecimiento las raíces son blancas, poco ramificadas y relativamente gruesas; a medida que la planta crece, éstas se alargan, adelgazan, se vuelven flácidas y ramifican en abundancia; cuando ya están maduras, las raíces adventicias son fibrosas, emiten raíces secundarias y éstas a su vez producen pelos radicales. Es frecuente que estas raíces formen verticilos en los nudos que están sobre la superficie del suelo (Wei y Huang, 2019). Las puntas de las raíces están protegidas por una masa de células semejante a un dedal, llamada coleorriza, su función es facilitar la penetración de la raíz en el suelo (Degiovanni et al., 2010).
La anatomía de las raíces adventicias del arroz es similar a la de las plantas acuáticas, aunque difiere de ellas en los pelos absorbentes que posee en abundancia. Consta de seis diferentes estructuras: epidermis, exodermis, esclerénquima, parénquima cortical, cofia y cilindro vascular. Este último se organiza junto con otros componentes, como son la endodermis, periciclo, floema, xilema y médula (Degiovanni et al., 2010).
Efectos del estrés salino en el crecimiento y desarrollo de plantas de arroz
Se prevé que los rendimientos futuros del arroz están en peligro debido a su alta sensibilidad a la salinidad de los suelos, la cual se estima que aumentará como consecuencia de los efectos adversos asociados al cambio climático global (Radanielson et al., 2018).
Las respuestas de las plantas de arroz al estrés salino son complejas y dependen de la duración y el tipo de dicho estrés, la etapa de desarrollo del arroz, la duración del día y otros factores. El estrés de la salinidad está dominado por los iones Na+ y Cl- (Serrano et al. 1999) que afectan el crecimiento y desarrollo del arroz al crear estrés iónico, osmótico y oxidativo (Hussain et al., 2017).
Generalmente, se clasifica como cultivo sensible a la sal, pero la extensión de su sensibilidad varía durante las diferentes fases de crecimiento. Se considera que es menos sensible durante la germinación y el ahijamiento activo; o sea, en la aparición de los hijos secundarios y terciarios que emergen secuencialmente del primero, segundo y tercer entrenudo de los tallos primarios (CIAT, 1985), mientras que muestra una mayor sensibilidad durante el inicio de las fases vegetativa y reproductiva (Ghaffari et al., 2013).
Durante el período temprano de estrés salino, el arroz se enfrenta al estrés osmótico y disminuye el desarrollo de las hojas, mientras que en un estrés a largo plazo las plantas de arroz experimentan estrés iónico y provoca la senescencia temprana de las hojas más viejas (Hussain et al., 2017). El efecto de la salinidad en el arroz es múltiple, lo que conduce a la inhibición de la germinación, dificultades en el establecimiento del área de cultivo, disminución en la producción de materia seca, retraso en la formación de semillas e incluso puede producirse esterilidad. (Ghosh, 2016).
Influencia del estrés salino en la morfología y el crecimiento de las raíces
Las raíces de las plantas desempeñan un papel fundamental en el crecimiento y el desarrollo, así como en la absorción de los nutrientes minerales, mantenimiento del equilibrio adecuado de la planta y síntesis de hormonas; además, las raíces están intrínsecamente relacionadas con la percepción del estrés y los mecanismos de señalización que conectan los factores del suelo con el metabolismo de toda la planta (Cunha et al., 2016).
Las raíces son el sitio objetivo principal para la percepción de la señal de estrés salino y podrían actuar como un sistema de alerta temprana para la planta. Al exponerse al estrés las raíces inician un efecto desencadenante que podría conducir a la activación de diversos mecanismos de adaptación al estrés en plantas (Saini et al., 2018).
El estrés osmótico y la toxicidad iónica asociados con la salinidad pueden inducir diferentes tipos de respuestas en las raíces (Cunha et al., 2016). El primero surge de la reducción inducida por el NaCl del potencial de soluto de la solución del suelo, lo que a su vez reduce la conductancia hidráulica y, por lo tanto, la absorción de agua y soluto por las plantas, mientras que el segundo componente surge de la acumulación de cantidades nocivas de Na+ en las células y tejidos de la planta, que afectan negativamente su crecimiento y desarrollo (Assaha et al., 2017); los iones salinos transportados por el flujo de la transpiración desde la raíz hasta las hojas pueden llegar a acumularse en los espacios intercelulares y provocar la deshidratación celular, o bien en el citoplasma e inhibir numerosas actividades enzimáticas clave en el metabolismo, llegando a producir muerte celular y senescencia de las hojas (Munns y Tester, 2008).
Las plantas de arroz controlan el transporte de sales inicialmente mediante la captación selectiva de los iones por las células de la raíz, entrando en la raíz junto con el agua a través de rutas simplásticas y apoplásticas (Hussain et al., 2017). Las funciones de absorción y soporte del sistema radical son una garantía importante para la producción de granos en el arroz. La morfología y la fisiología de la raíz están estrechamente asociadas con el crecimiento y desarrollo de la parte aérea. Entre los nutrientes esenciales requeridos para el crecimiento del arroz, el carbono inorgánico se absorbe principalmente por las hojas en forma de CO2, los otros elementos minerales esenciales se absorben principalmente a través de la superficie de la raíz desde el suelo. La raíz es la base del desarrollo del arroz (Wu y Cheng, 2014).
Oligogalacturónidos y sus efectos en las plantas
En la actualidad existe una tendencia mundial hacia una agricultura sostenible, minimizando el uso de productos químicos que desequilibran el medio ambiente y causan directamente daños a la salud animal y humana (Febles-González et al., 2011). El uso de bioestimulantes en la producción agrícola se ha convertido en una práctica internacional, y actualmente ha cobrado auge la utilización de productos ecológicamente inocuos y de fácil obtención, como los oligogalacturónidos (OGAs).
Los OGAs son, dentro de las oligosacarinas, unos de los más estudiados; son liberados de los polisacáridos pécticos que componen la pared celular de las plantas, durante la degradación de estas estructuras por las enzimas pécticas de la propia planta o las provenientes de los microorganismos que invaden los tejidos vegetales (Falcón et al., 2015). Son oligosacáridos lineales de unidades de ácido D-galacturónico unidas por enlaces del tipo α (1-4). El anillo piranósido del ácido D-galacturónico aparece en la conformación de silla 4C1, correspondiente a su forma más estable. Los enlaces glicosídicos en los C-1 y C-4 están además en la posición axial-axial y el número de residuos de D-galacturonatos que contiene el oligosacárido define su grado de polimerización (Schools et al., 1995) (Figura 3).
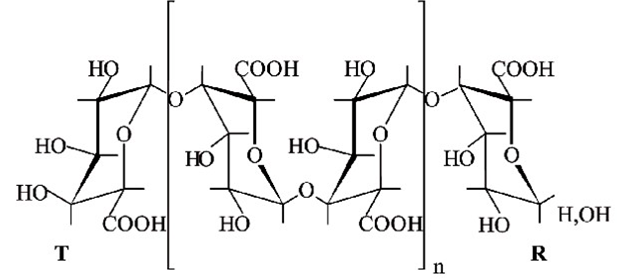
Figura 3: Estructura de los oligogalacturónidos. T: extremo terminal, R: extremo reductor. Grado de polimerización = 2n + 2.
Los indicadores más importantes a considerar en la macromolécula son el grado de esterificación, grado de polimerización, masa molar, contenido y lugar de unión de los azúcares neutros y distribución de los sustituyentes no urónicos (Lara et al., 2018; Tho et al., 2002). El grado de polimerización (GP) de estas moléculas es el factor estructural de mayor importancia en la definición de su función biológica (Cabrera et al., 2013), siendo los de GP entre 10 y 12 los más activos (Falcón et al., 2015).
Los OGAs regulan muchos de los procesos fisiológicos que intervienen en la formación de órganos en las plantas, están involucrados en el crecimiento y formación de raíces laterales, formación de raíces adventicias y diferenciación de las células del periciclo, además de que ejercen un efecto inductor sobre los procesos de diferenciación de embriones somáticos (Lara et al., 2018). No se han informado efectos sinérgicos ni antagónicos en la actividad biológica entre estos oligosacáridos, por lo que hay autores que aceptan como válido utilizar en sus investigaciones mezclas de estos compuestos (Messiaen y Van Cutsem, 1999).
El grupo de Productos Bioactivos del Instituto Nacional de Ciencias Agrícolas, en Mayabeque, Cuba, desarrolló una mezcla de oligogalacturónidos denominada comercialmente como Pectimorf® (Pm). Este producto está constituido por una mezcla de OGAs con grado de polimerización entre 9 y 16 moléculas de ácido galacturónico, obtenido a partir de desechos de la industria citrícola; es un estimulador del crecimiento, que se produce por la degradación parcial de la pared celular de la corteza de los cítricos; presenta la capacidad de activar los mecanismos de defensa y modificar el crecimiento y desarrollo de las plantas. Esta mezcla tiene una fracción molar que oscila entre 10.4 y 7.2 % (Cabrera et al., 2003).
El Pectimorf® ha sido utilizado satisfactoriamente en diferentes procesos biotecnológicos como embriogénesis somática en caña de azúcar (Saccharum spp.) (Nieves et al., 2006) y mandarina (Citrus reshni Hort. et Tan.) Cleopatra (Hernández et al., 2007). Por otra parte, la adición al medio de cultivo de la mezcla de oligogalacturónidos estimuló el número de brotes por explante en la micropropagación acelerada de Anthurium cubense (Montes, 2000). Se ha demostrado que el Pectimorf® estimula el enraizamiento y favorece la posterior aclimatación de las plantas in vitro de plátano FHIA-18 (Borges et al., 2015) y de brotes de papaya cv. Maradol Roja (Posada et al., 2016). El Pectimorf® (10 mg L-1) estimuló también el enraizamiento de margullos o acodos en las variedades de Ficus benjamina Golden King y Nítida (Dominí y Benítez, 2004) y en peciolos de violeta africana (Saintpaulia ionantha L.) (Falcón y Cabrera, 2007).
En cuanto al enraizamiento de esquejes semileñosos de guayaba (Psidium guajava L.), el tratamiento con 20 mg L-1 de Pectimorf® incrementó no sólo el número de raíces por esqueje, sino también el porcentaje de sobrevivencia de las plantas del cv. Enana Roja cubana (Martínez et al., 2007; Ramos et al., 2013).
En hortalizas, se ha informado que el tratamiento a las semillas con Pectimorf® incrementó la longitud radical de plantas de lechuga (Álvarez et al., 2011) y de rábano (Terry-Alfonso et al., 2014) y estimuló el crecimiento de posturas de tomate (Costales et al., 2007). De igual manera, el tratamiento de las semillas y la aspersión foliar en la floración estimuló el rendimiento de la habichuela (Vigna unguiculata L.) variedad Lina (Nápoles et al., 2016).
Estos resultados demuestran el efecto beneficioso que la aplicación de Pectimorf® ejerce en el crecimiento y desarrollo de las plantas, especialmente su efecto en el crecimiento radical, lo cual debe influir positivamente en el comportamiento de las plantas cultivadas en condiciones de estrés hídrico y salino.
Oligogalacturónidos como protectores de las plantas ante factores de estrés abiótico
Se han realizado diferentes estudios con el Pectimorf® relacionados con la protección de las plantas contra diferentes tipos de estrés (Falcón et al., 2015). Ante condiciones de déficit hídrico se ha informado que las aplicaciones foliares de Pectimor® (150 mg ha-1) a los 20 y 35 días después de la siembra favorecieron el crecimiento del cultivo en cuanto a la masa seca aérea, de raíz y área foliar (Dell’Amico et al., 2017)
El potencial del Pectimorf® ha sido evaluado en la protección de plantas de tomate contra el estrés por metales pesados, al aplicar una dosis de 60 kg ha-1 de Pectimorf® a un suelo con altos niveles de Cu2+ cultivado con plantas de tomate cv. Amalia, se estimuló el alargamiento de la raíz principal y se lograron niveles de extracción de iones Cu2+ de 25, 47 mg kg-1, lo cual favoreció el proceso de fitoextracción de este ión metálico por plantas hiperacumuladoras (Cartaya et al., 2016).
Existe poca información del papel de los OGAs ante estrés salino en el cultivo del arroz. Núñez et al. (2018) informaron que diferentes concentraciones de Pectimorf® (0, 10 y 20 mg L-1) fueron aplicadas tanto por tratamiento a las semillas de arroz cv. INCA LP-7 durante 24 horas como por adición a la solución nutritiva Hoagland suplementada con NaCl 100 mmol L-1, una vez germinadas las semillas. El tratamiento salino por 13 días sólo disminuyó significativamente la longitud de las raíces y del vástago de las plántulas, siendo revertida total y parcialmente dicha inhibición, respectivamente, por el tratamiento a las semillas con 20 mg L-1.
Conclusiones
Los efectos adversos que el estrés salino provoca en las plantas de arroz y en especial, en el sistema radical, deben tener una especial atención, dado el papel que poseen las raíces como órgano de absorción de agua y nutrientes. En la actualidad, aunque se utilizan diversos productos para mitigar los efectos adversos que el estrés salino provoca en las plantas de arroz, se deben tener en cuenta las características demostradas de los oligogalacturónidos para estudiar el papel de los mismos como protectores de las plantas ante este tipo de estrés y profundizar en los mecanismos fisiológicos y bioquímicos que estos compuestos utilizarían para ejercer dicha protección.











 nueva página del texto (beta)
nueva página del texto (beta)




