INTRODUCCIÓN
Los fertilizantes químicos han sido un factor determinante para aumentar la productividad agrícola mundial (Alexandratos y Bruinsma, 2012) y se pronostica que de 2015 a 2020 la demanda de fuentes de N, P2O5 y K2O crecerán anualmente en promedio 1.5, 2.2 y 2.4 %, respectivamente (FAO, 2017). El fósforo es uno de los nutrientes esenciales para el crecimiento de las plantas y tiene un papel fundamental en procesos como la generación de energía, síntesis de ácidos nucleicos, fotosíntesis, reacciones redox, metabolismo de carbohidratos y fijación de nitrógeno (Hanif et al., 2015); sin embargo, su alta tasa de fijación química, velocidad de difusión lenta y fracción sustancial de P orgánicamente ligado al suelo hacen que sea uno de los nutrientes menos disponibles para los cultivos (Wu et al., 2013). Con frecuencia, el P es el elemento más limitante para el crecimiento y desarrollo de las plantas debido a su escasa disponibilidad (Dar et al., 2017).
Para obtener rendimientos altos en los cultivos, el P a menudo se aplica excesivamente, lo que lleva a acelerar la degradación del suelo y la eutrofización de cuerpos de agua (Liu y Lal, 2014). Los fertilizantes de liberación lenta fueron desarrollados y han sido ampliamente usados para mejorar la eficiencia de uso de los nutrientes, permiten reducir la lixiviación de éstos y las emisiones de gases de efecto invernadero (Yuan, 2014); sin embargo, el revestimiento con polímeros, que es la tecnología dominante en la producción de estos fertilizantes, hace que estos fertilizantes sean caros, ya que implica complicados procesos de producción que incluyen el calentamiento, la separación por tamaño de los fertilizantes y la fusión y nebulización de polímeros (Trenkel, 2010).
A pesar de la necesidad de desarrollar opciones alternativas para diferentes usos, los esfuerzos de investigación durante las últimas décadas no han tenido resultados fructíferos (Selva Preetha y Balakrishnan, 2017). Se ha estudiado la viabilidad de utilizar materiales naturales, como las arcillas y zeolitas, para la liberación lenta de nutrientes (Bhardwaj et al., 2012; Yuan, 2014). La viabilidad de utilizar organoarcillas como fertilizantes de liberación lenta de nutrientes ha sido investigada por diversos autores (Berber et al., 2014; Bhardwaj et al., 2012; Malekian et al., 2011; Romero-Mendez et al., 2019). Dentro de las organoarcillas se destacan las organobentonitas (OB) por sus altas propiedades de adsorción y capacidad de intercambio iónico (Pandey y Ramontja, 2016) y han sido propuestas como fertilizantes de liberación lenta (Yuan, 2014); éstas son sintetizadas por sorción de un tensioactivo catiónico sobre una bentonita, que carga de negativa a positiva la superficie externa y el espacio de las capas intermedias (Ceyhan et al., 1999), lo que hace posible la adsorción de formas aniónicas como el fosfato; sin embargo, a pesar de estos resultados promisorios, el efecto de la liberación de fósforo con estos materiales no ha sido estudiado, tampoco su efecto en el crecimiento de las plantas.
El uso de cultivos hidropónicos permite aumentar el control de los factores que intervienen en el funcionamiento de las raíces (Podar, 2013); además, los cálculos se hacen por el principio de balance de masas, donde la masa de nutrientes está en la solución o en las plantas (Bugbee, 2004), por lo que es posible evaluar la aplicación de los fertilizantes de lenta liberación en un medio líquido sin interferencias del suelo. El objetivo del presente trabajo fue determinar el comportamiento de un fertilizante preparado por medio de adsorción de iones fosfato sobre una organobentonita y su efecto en el crecimiento de plantas de lechuga (Lactuca sativa L.) en un medio hidropónico.
MATERIALES Y MÉTODOS
Preparación del fertilizante
La preparación del material fertilizante se realizó en laboratorio en la Facultad de Agronomía y Veterinaria de la Universidad Autónoma de San Luis Potosí, con una bentonita por adsorción del surfactante catiónico bromuro de hexadeciltrimetilamonio (HDTMA C19H42BrN, Aldrich Chemicals), 364.45 g mol-1, de acuerdo con la metodología propuesta por Jacobo-Azuara et al. (2006), que consiste en obtener una organobentonita (OB) y el material fertilizante organobentonita-fosfato (OBP). Los 140.4 mg g-1 de P adsorbido en la OBP se determinaron por la diferencia entre la concentración final e inicial.
Establecimiento y conducción del experimento
En el Centro de Hidroponía de la Facultad de Agronomía y Veterinaria se estableció, en marzo del 2018, un experimento con plantas de lechuga en un sistema hidropónico de raíz flotante en un invernadero tipo túnel de 9 × 5 m. La temperatura media fue de 23.5 °C y una luminosidad media de 17,417 lux (400 μmol m-2 s-1). Se utilizaron semillas de la variedad Montemar sembradas en febrero en un sustrato Sunshine Mix 3® en charola de poliestireno de 200 cavidades, se regó diariamente con agua de pozo con pH de 7.5 y CE de 0.6 dS m-1 y se fertilizó con solución Steiner (Steiner, 1961). A los 36 días después de la siembra se realizó el trasplante en un sistema hidropónico, se lavaron las raíces para retirar el sustrato adherido y se colocó una planta en un recipiente de plástico con 100 mL de solución nutritiva Steiner con la siguiente composición en meq L-1: 6 NO3 -, 0.5 H2PO4 -, 3.5 SO4 2-, 3.5 K+, 2 Mg2+ y 4.5 Ca2+.
Los fertilizantes utilizados fueron Ca(NO3)2·٤H2O, KNO3, MgSO4·٧H2O, K2SO4 y H3PO4. Los micronutrientes se añadieron con Carboxy Micro®, el cual aporta 5 % de Fe, 2.5 % de Zn, 1 % de Mn y 0.5 % B en forma quelatada EDDHA. La aireación de la solución se llevó a cabo con una bomba de pecera (Elite Maxima® 2.5 PSI), con una aportación de oxígeno de entre 3 y 5 mg L-1. En este medio, las plantas de cada experimento tuvieron un período de adaptación de cinco días previos a la aplicación de los tratamientos.
Tratamientos
Se evaluaron ocho tratamientos en un sistema hidropónico de raíz flotante con diferentes proporciones de P aportado con OBP (%) en soluciones Steiner con o sin P reducido (%): 1) 0/100, 2) 25/75, 3) 50/50, 4) 75/25, 5) 25/0, 6) 50/0, 7) 75/0 y 8) 100/0. En los tratamientos con P reducido y en el 100/0, la cantidad de OBP agregada se calculó de tal forma que la suma del P adsorbido más el disuelto en la solución inicial fuera igual a la de P en la solución Steiner (0.5 meq L-1). El diseño experimental fue completamente al azar con seis repeticiones por tratamiento; se consideró cada planta como la unidad experimental.
La duración del experimento fue de 13 días, un tiempo intermedio, basado en experimentos con fertilizantes de lenta liberación. Se consideró el tiempo de 15 días en columnas de suelo, de acuerdo con Bhardwaj et al. (2012), Bhardwaj y Tomar (2011) y King y Balogh (2000). Durante el experimento se agregó diariamente agua desionizada para mantener constante el volumen inicial y se renovó la solución nutritiva cada vez que la conductividad eléctrica (CE) descendió a valores comprendidos entre 0.4 y 0.5 dS m-1 (Bugbee, 2004), lo cual se realizó de 1 a 5 veces. Los días 1, 3, 5, 7, 9, 11 y 13 se determinó el P en la solución nutritiva por el método del ácido ascórbico (APHA, 1985) con un espectrofómetro (Genesys 10UV, ThermoScientific®, Waltham, Massachusetts, EUA) en una muestra de 1 mL de cada recipiente.
Variables respuesta
Las variables determinadas cada 24 horas fueron: consumo de agua, CE de la solución nutritiva (Medidor Orion® 155, ThermoScientific®, Waltham, Massachusetts, EUA), materia seca en g de raíz, de hojas y total, las cuales se determinaron después de colocar la planta en una estufa de secado de aire forzado (Omron®, Osaka, Japón) a 70 ºC durante 72 h hasta obtener peso constante con balanza digital (Ohaus PAJ4102N Gold Series, Parsippany, NJ, EUA), área foliar en cm2 determinada con el software imageJ (Rasband, 2014) y P total (mg L-1) en hojas por el método del ácido vanado-molibdofosfórico (Alcántar y Sandoval, 1999) en una muestra representativa de todas las hojas de la planta.
Experimento en laboratorio
Simultáneamente, en laboratorio se realizó un experimento sin plantas para evaluar por separado la liberación de P de los mismos tratamientos, que fueron colocados en recipientes de plástico cerrados y a temperatura ambiente; de cada tratamiento se establecieron cuatro repeticiones. Se determinó el P en solución los días 1, 3, 5, 7, 9, 11, 13, 20 y 35 por el procedimiento anteriormente descrito. A partir de la concentración inicial de P, se consideró como P liberado la cantidad de P que se incrementó cada día en la solución.
Las concentraciones medidas durante el experimento sin plantas se utilizaron como referencia para estimar la concentración de P que estaba disponible en el transcurso del experimento con plantas. El consumo de fósforo por las plantas en cada unidad experimental fue la diferencia de la concentración de este elemento en la solución nutritiva en los experimentos con y sin las plantas.
Análisis estadístico
Con los datos obtenidos en los dos experimentos se realizó análisis de varianza y una prueba de comparación de medias entre tratamientos (Tukey, P ≤ 0.05) con el programa SAS versión 9.1 (SAS Institute, 2004).
RESULTADOS Y DISCUSIÓN
El P liberado por el material fertilizante, al utilizar fertilizante químico de alta solubilidad, mostró inicialmente la concentración calculada con la solución Steiner 0/100 (16 mg L-1), 75/25 (12 mg L-1), 50/50 (8 mg L-1) y 25/75 (4 mg L-1) (Figura 1). Al considerar el análisis estadístico de los tratamientos con OBP (T5-T8) se observó que la liberación fue de menor a mayor concentración del contenido aplicado y que el uso del fertilizante soluble no intervino en la liberación. También se observó que el mayor contenido de P liberado por la OBP en los 35 días fue con 100/0 (7.27 mg L-1) y el menor contenido con 25/0 (2.18 mg L-1). La liberación de P de la OBP se inició desde el día 13 y se observó que el mayor contenido liberado fue a los 35 días con 100/0 (7.27 mg L-1) y el menor contenido con 25/0 (2.18 mg L-1). Los resultados anteriores sugieren que la liberación de P ocurre en forma lenta. Resultados similares obtuvieron Bansiwal et al. (2006), quienes al estudiar la liberación lenta de P con una zeolita modificada con surfactante y KH2PO4 encontraron que la liberación de P por la zeolita modificada fue por 1080 h (45 días) y en el caso de KH2PO4 por 264 h (11 días). En el presente estudio el fertilizante OBP liberó gradualmente P durante los 35 días evaluados y el contenido de P se incrementó con el mayor contenido de OBP.

Figura 1 Comportamiento del contenido de fósforo aplicado con organobentonita fosfatada (OBP)/Fertilizante en solución Steiner (FSS) en agua desionizada sin plantas. Medias de los tratamientos con letras iguales dentro de cada uno de los días no son estadísticamente diferentes (Tukey, P ≤ 0.05).
El consumo de fósforo (Figura 2), desde los primeros días hasta el último día, fue mayor para los tratamientos con fertilizante soluble (0/100, 25/75, 50/50, 75/25); ésto es debido a que el fertilizante soluble aplicado estuvo disponible desde el inicio (Figura 3), a diferencia de los que contenían OBP, pues éste liberó P en menor cantidad y más lentamente (Figura 1). Los silicatos modificados con tensioactivos adsorben fosfato que pueden liberar lentamente; sin embargo, ésto depende de la cantidad cargada (Bhardwaj et al., 2014), además de la naturaleza hidrófoba, que hace que los compuestos contenidos sean menos solubles en agua, y la alta relación de la arcilla orgánica, que dificulta la disolución de los solutos dentro de un granulado, haciendo más lento el mecanismo de difusión (Yuan, 2014). Al final de la evaluación se detectó que a mayor cantidad de fertilizante soluble aplicado en los tratamientos el consumo por la planta se incrementó; fue en los tratamientos de OBP sin fertilizante soluble donde el consumo de P fue menor, sin notar diferencias estadísticas entre ellos. Johnston et al. (2014) mencionaron que existe una correlación positiva significativa entre el incremento en la aplicación de P y el contenido total en el medio radical; de este modo, al aplicar más P la raíz ésta lo tiene más disponible, consumiéndolo en mayor cantidad, como ocurrió en los tratamientos con fertilizante soluble (0/100, 25/75, 50/50, 75/25); sin embargo, la OBP también liberó gradualmente una cantidad de P que la planta consumió. En este sentido, Trenkel (2010) mencionó que la liberación lenta se asocia con el retraso del mecanismo de liberación de nutrientes. Lo ideal sería hacer coincidir su liberación con los requisitos nutricionales del cultivo o ampliar la disponibilidad que los fertilizantes de alta solubilidad (Bernardi et al., 2016).

Figura 2 Consumo de fósforo por las plantas durante el experimento de los tratamientos con organobentonita fosfatada (OBP)/Fertilizante en solución Steiner. Medias de los tratamientos con letras iguales dentro de cada uno de los días no son estadísticamente diferentes (Tukey, P ≤ 0.05).
El contenido de fósforo en la planta (Figura 3) en el tratamiento con fertilizante soluble 0/100 fue de 6.6 g kg-1, 17.3 % más que los tratamientos 25/75 y 50/50, 40.8 % más que 75/25 y 100/0 y 50.1 % más que 25/0, 50/0 y 75/0. Cabe señalar que los tratamientos con OBP/fertilizante soluble 50/50 (4.6 g kg-1) y 75/25 (3.9 g kg-1) no fueron estadísticamente diferentes al de 100/0 (3.7 g kg-1), el cual es el tratamiento con mayor contenido de OBP. Aun así, los menores contenidos de P en hojas se presentaron en los tratamientos que tuvieron menores concentraciones de P en la solución nutritiva. En este sentido, Veronica et al. (2017) mencionaron que las concentraciones de P en hojas se incrementan a mayor contenido de P disponible para las raíces. Pérez et al. (1977) reportaron contenidos totales de 4 a 5 g kg-1 en el tejido de plantas de lechuga cultivadas por 25 días en una solución universal de Steiner y de 2 g kg-1 para lechugas cultivadas en una solución sin P, en las que se observaron síntomas marcados de deficiencia. En el presente experimento sólo los tratamientos 25/0, 50/0 y 75/0 tuvieron valores inferiores a éstos (respectivamente 2.3, 2.7 y 3.2 g kg-1). Este efecto se puede atribuir a la baja concentración de P en la solución nutritiva de estos tratamientos, lo cual provocó una baja absorción del nutriente.
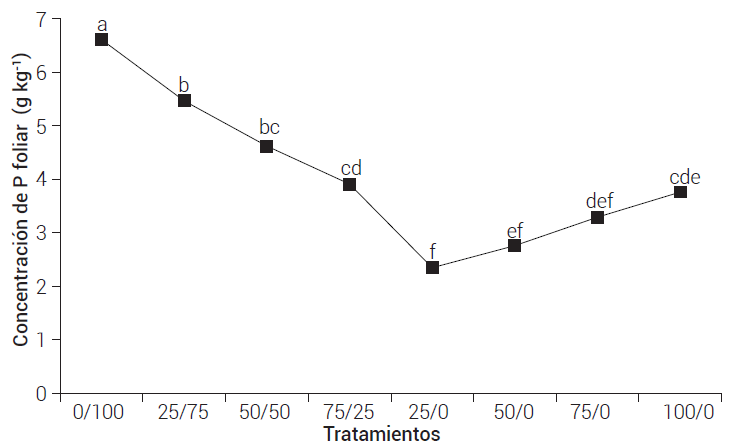
Figura 3 Concentración de fósforo total en hojas de los tratamientos con organobentonita fosfatada (OBP)/Fertilizante en solución Steiner. Medias de los tratamientos con letras iguales no son estadísticamente diferentes (Tukey, P ≤ 0.05).
En la acumulación de materia seca en la raíz no hubo diferencias significativas con la aplicación de los tratamientos de P (Figura 4). Veronica et al. (2017)) mencionaron que en el cultivo de arroz la acumulación de materia seca en raíz depende de la variedad y de la cantidad de P aplicado. Esto puede ser atribuido a que una disminución de P afecta menos el crecimiento de la raíz que el de la parte aérea (Dar et al., 2017; Fageria y Moreira, 2011), debido a que reduce el tamaño de hojas, ya que los fotoasimilados se translocan hacia la raíz (Balemi y Negisho, 2012).

Figura 4 Materia seca de hojas, raíz y total de los tratamientos con organobentonita fosfatada (OBP)/Fertilizante en solución Steiner (FSS). Medias de los tratamientos con letras iguales para cada estructura no son estadísticamente diferentes (Tukey, P ≤ 0.05).
La acumulación de materia seca en las hojas con la aplicación de los tratamientos 0/100, 25/ 75 y 50/0 tuvo los valores más altos; sin embargo, para esta variable, el tratamiento 0/100 fue 27.7 % mayor que los tratamientos 25/75 y 50/0, que fueron estadísticamente iguales al resto. Ésto está asociado con una reducción del crecimiento de la hoja bajo un estrés por P (Cakmak et al., 1994), debido a una disminución de la división celular y elongación de las células, lo que afecta el tamaño final de la hoja (Kavanová et al., 2006).
En la materia seca total el tratamiento 0/100 obtuvo los mayores valores, 28 % más que 75/25 y 100/0; sin embargo, éstos fueron estadísticamente iguales a los demás tratamientos. El crecimiento de raíz y parte aérea son afectados directamente por la disponibilidad de P (Wissuwa, et al., 2005); en este sentido, una aplicación de menor cantidad de P reduce la tasa de crecimiento y limita fuertemente la acumulación de biomasa (Hodges y Constable, 2010), pero ello depende de la variedad y de la cantidad de P aplicado (Veronica et al., 2017).
El área foliar del tratamiento 0/100 fue 23.5 % mayor que el del resto de los tratamientos. La disminución de P también reduce el área foliar en el cultivo de frijol (Hernández et al., 2007) y en arroz (Veronica et al., 2017). De acuerdo con Hodges y Constable (2010), el P en menor cantidad reduce la expansión de las hojas, y con ello disminuye el área foliar total. En el presente trabajo, ésto pudo ser debido a que los siete tratamientos que mostraron menor área foliar tenían un contenido de P aplicado en forma de fertilizante de lenta liberación, a diferencia del 100 % del fertilizante soluble, por lo que al tratarse de un periodo corto de 13 días no logró liberarse mayor cantidad de P, como se aprecia en la Figura 1 a los 35 días, lo que afectó el área foliar.
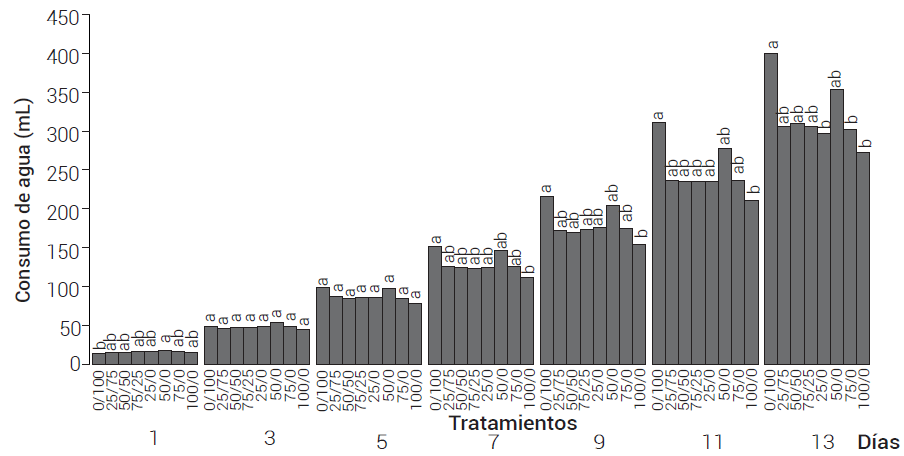
El consumo de agua (Figura 5) en el primer día con el tratamiento 50/0 fue 21 % mayor que con el tratamiento 0/100. En los días tres y cinco no se detectaron diferencias entre tratamientos. A partir del séptimo día se observó una diferencia de 26 a 32 % entre el tratamiento 0/100 y la máxima cantidad de OBP aplicada (100/0). En la última fecha de evaluación, a los 13 días, la diferencia se hizo evidente en los tratamientos 25/0, 75/0 y 100/0, comparados con el 0/100, que tuvo un consumo total de 400 mL. Hodges y Constable (2010) indicaron que bajo condiciones de baja disponibilidad de P decrece el suministro de agua por las raíces. En este caso, el menor consumo de agua en estos tratamientos con OBP puede ser atribuido a este efecto.
CONCLUSIONES
La organobentonita libera en forma lenta su contenido de P. La bentonita al modificarse con un surfactante adsorbe P, que posteriormente libera gradualmente, lo que indica que puede ser utilizado como un fertilizante de lenta liberación, ya que contribuye a incrementar la retención y absorción de P en el medio utilizado.











 nueva página del texto (beta)
nueva página del texto (beta)