INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) es un cultivo con gran diversidad genética que incluye germoplasma con características agronómicas de interés, como la resistencia a condiciones climáticas adversas, resistencia a plagas y enfermedades y una alta calidad nutricional (de Carvalho et al., 2000); sin embargo, algunos genes que confieren características específicas pueden estar o no presentes en el germoplasma del frijol común y el mejoramiento convencional puede tomar mucho tiempo. Cuando los genes de resistencia o genes asociados a proporcionar ventajas agronómicas no se encuentran dentro de los parientes silvestres o especies compatibles para realizar cruzas sexuales, es posible recurrir a fuentes alternativas de resistencia vía ADN recombinante como método alternativo de mejoramiento genético.
El control de enfermedades ocasionadas por micoparásitos en cultivos como el frijol, particularmente aquellos que se encuentran en el suelo, ha sido un tema largamente abordado. Diferentes tipos de control como el químico, biológico y mejoramiento genético han sido empleados con mayor o menor éxito, dependiendo de la virulencia del patógeno, la eficiencia del organismo antagonista, el permiso de uso del producto químico en países determinados, el desarrollo de resistencias y la existencia de genes de resistencia (Sallam et al., 2008).
El control biológico es una alternativa complementaria eficiente y económica para el control de enfermedades foliares y las ocasionadas por patógenos del suelo (Infante et al., 2009). El género Trichoderma incluye varias especies que sirven como agentes de control biológico con efecto estimulante en los cultivos e inductor de resistencia localizada y sistémica en plantas, a diferentes patógenos (Harman, 2000; Martínez-Medina et al., 2010). Trichoderma es considerado un hongo antagonista de hongos fitopatógenos, ya que posee diferentes mecanismos de acción, como la competencia directa por espacio y nutrientes, producción de metabolitos, antibióticos y parasitismo directo en los hongos que le permiten controlar su crecimiento y por tanto la enfermedad (Ezziyyani et al., 2004).
Los hongos micorrizógenos como Rhizophagus intraradices se utilizan como biofertilizantes; es decir, insumos biológicos que favorecen el desarrollo de cultivos y plantaciones sin los problemas de contaminación que ocasionan los insumos químicos (Guerrero, 1996). Según Sieverding y Barea (1991), los objetivos que persigue el uso práctico de hongos formadores de micorrizas en sistemas de producción vegetal son: a) hacer un uso más eficiente del fósforo del suelo y de los fertilizantes fosfóricos, b) optimizar la productividad de los suelos y cultivos con niveles bajos de insumos, c) hacer posible y rentable la producción vegetal en condiciones adversas, d) ayudar a establecer cultivos en suelos erosionados o degradados y e) formar agregados en el suelo para mejorar su estructura y porosidad. Aunque el principal beneficio es de carácter nutricional, una planta puede obtener ventajas adicionales de la micorriza como la tolerancia a patógenos, tolerancia a estrés hídrico, tolerancia a salinidad, detoxificación, entre otros; se trata de una simbiosis multifuncional, cuya actividad gira alrededor de la interacción planta-hongosuelo (Guerrero, 1996).
Rhizobium tropici es una especie rizobial aún poco estudiada, originalmente aislada de nódulos de raíz en frijol común y especies de Leucaena en Sudamérica. La especie puede establecer simbiosis con varios hospederos, incluyendo a las fabáceas autóctonas de América y Australia. El interés en la evolución de R. tropici es el resultado de su cercano parecido genético con las agrobacterias, lo que indica la interesante posibilidad de descubrir el vínculo entre la simbiosis y la patogenicidad. En términos agronómicos, la alta estabilidad genética del plásmido simbiótico (pSym), la tolerancia al estrés ambiental y la alta capacidad de fijación del nitrógeno de algunas cepas de élite han dado lugar a un mayor uso de cepas de R. tropici en inoculantes (Gomes et al., 2015; López-Ortiz et al., 2012). La fijación simbiótica del nitrógeno atmosférico y fijación de nutrientes en leguminosas se lleva a cabo a través de nódulos que se desarrollan en la raíz de las plantas (Lloret y MartínezRomero, 2005), lo que favorece la asimilación de nitrógeno y las hace más competitivas en suelos con baja fertilidad, por lo que mantener esta relación simbiótica es de enorme relevancia para la productividad del cultivo.
En los últimos tiempos, el desarrollo de organismos genéticamente modificados con genes de defensa contra hongos fitopatógenos ha sido implementado a través de modelos de tecnología recombinante que proporcionaron tolerancia/resistencia como en tabaco (Nicotiana tabacum) a Alternaria longipes (Terras et al., 1995), tomate (Solanum lycopersicum) a Alternaria solani (Parashina et al., 2000), canola (Brassica napus) a Leptosphaeria maculans (Wang et al., 1999) y papa (Solanum tuberosum) a Verticillium dahliae (Gao et al., 2000) y frijol común a Colletotrichum lindemuthianum (Espinosa-Huerta et al., 2013).
De acuerdo con la Ley de Bioseguridad de Organismos Genéticamente Modificados (Secretaría de Sadud, 2005), en México todos los modelos tecnológicos de ADN recombinante que soliciten un permiso de liberación al ambiente en etapa experimental deberán realizar un análisis de riesgo ambiental para establecer los posibles riesgos que las características de esta tecnología pudieran ocasionar al medio ambiente, a la diversidad biológica y a la sanidad vegetal, animal y acuícola.
El frijol cv. Flor de Mayo Anita genéticamente modificado con el gen defensina de Arabidopsis thaliana (FMA-pdf1.2) ha sido analizado por sus características para conferir tolerancia de amplio espectro contra hongos fitopatógenos como Colletotrichum lindemuthianum (Espinosa-Huerta et al., 2013). Los objetivos del presente estudio fueron evaluar las interacciones entre cinco líneas homocigotas del cv. Flor de Mayo Anita modificadas genéticamente con el gen defensina (FMA-pdf1.2), con los microorganismos Trichoderma harzianum, Rhizobium tropici y Rhizophagus intraradices, bajo la hipótesis de que la defensina pudiera ocasionar inhibición en la interacción entre la planta de frijol modificada y los microorganismos benéficos dentro de un ambiente confinado.
MATERIALES Y MÉTODOS
Preparación de inóculo
La cepa de T. harzianum se sembró en placas con medio PDA a partir de un inóculo previamente aislado e identificado molecularmente (Sánchez-García et al., 2017), el cual se incubó durante 6 d a 25 ºC, en oscuridad. Después de la incubación se adicionaron de 5 a 10 mL de agua desionizada estéril sobre la placa para remover las conidias y la suspensión se colocó en un matraz Erlenmeyer adicionado con 100 mL de agua desionizada estéril.
La cepa de R. tropici se inoculó en medio YMB a partir del crecimiento de una colonia definida en cajas Petri con el mismo medio, el cual se incubó durante 5 d a 28 ºC en oscuridad, de acuerdo con el protocolo utilizado por Martínez-Romero et al. (1991); de esta suspensión se tomaron de 5 a 10 mL y se colocaron en un matraz Erlenmeyer que contenía 100 mL agua desionizada estéril. El conteo de bacterias se realizó por medio de una cámara de Neubauer (hematocitómetro)
Cultivo de frijol en sustrato con inóculo de T. harzianum y R. tropici
Cinco líneas T5 homocigotas (L2, L3, L4, L7 y L9) cv. Flor de Mayo Anita (Castellanos et al., 2003), transformadas genéticamente con el gen defensina (FMA-pdf1.2) (Espinosa-Huerta et al., 2013) fueron germinadas en macetas con sustrato Sunshine® Mix No. 3. Al sustrato se le aplicó un riego ligero y se realizaron cinco perforaciones de 5 cm de profundidad para la adición del inóculo de esporas de T. harzianum (106 conidias mL-1) o de bacteria R. tropici (106 UFC mL-1). Se colocó una semilla de frijol, previamente desinfestada con hipoclorito de sodio, por maceta. Las condiciones ambientales fueron un fotoperiodo de 16 h luz y 8 h de oscuridad, un intervalo de temperatura a lo largo del día de entre 15 y 32 ºC y una iluminación provista por la luz solar a través del techo de cristal en invernadero.
Cuantificación poblacional de inóculo de T. harzianum presente en el sustrato
A los 46 días después de la siembra se muestreó 1g de sustrato de las macetas de cada una de las líneas de frijol y se colocó en un matraz Erlenmeyer con 100 mL de agua doble desionizada, se mantuvo en agitación a 150 rpm durante media hora y se procedió a realizar el conteo de unidades formadoras de colonias (UFC) de T. harzianum en una cámara de Neubauer.
Conteo de nódulos en plantas de frijol
A los 40 días después de la siembra se retiró la planta de la maceta procurando mantener la raíz íntegra, se sacudió el sustrato presente de este tejido y se enjuagó con agua para facilitar el conteo. Una vez que la raíz se encontró libre de sustrato, se colocó en una charola y se agregó un poco de agua para evitar su deshidratación. La raíz se dividió longitudinalmente, se tomó una tercera parte y se contó el número de nódulos presentes (Grageda C. O. A., 2014; Com. Pers.) 1 .
Inoculación con R. intraradices
Rhizophagus intraradices (Micorriza INIFAP®) (INVAM, 2017), cepa aislada de huerto de naranja en Nuevo León, México y ampliamente usada en diversos cultivos, fue inoculado en semillas provenientes de poblaciones tolerantes o resistentes a C. lindemuthianum (cepas 448 o 1472) de las cinco líneas modificadas de frijol FMApdf1.2 (L2, L3, L4, L7 y L9), y en semillas del cv. Flor de Mayo Anita no modificado. La inoculación se realizó con 0.1 g de biofertilizante micorrízico, el cual contenía 100 esporas g-1. El sustrato fue una mezcla tierra lama:arena (1:1) previamente esterilizada. Se procedió a la siembra y se llevó a cabo un muestreo destructivo a los 45 días después de la misma.
Las plantas fueron extraídas de los vasos para realizar los muestreos. Las raíces se humedecieron para retirar el sustrato sin dañar la raíz, y proceder a la detección de infección radical. La cuantificación de infección radical se realizó mediante el procedimiento de Kormanik y McGraw (1982) modificado, las raíces se sometieron a un aclareo, seguido de una tinción con azul tripano y se observaron al microscopio para detectar estructuras del hongo micorrízico (hifas, vesículas y arbúsculos). En cada unidad experimental se determinó el porcentaje de colonización en un total de 15 raicillas analizadas.
Diseño de experimento y análisis estadístico
Los experimentos de interacción entre cada organismo benéfico y las líneas modificadas se realizaron de manera independiente bajo un diseño completamente al azar. Cada microorganismo benéfico (T. harzianum, R. tropici o R. intraradices) fue inoculado en las cinco líneas de frijol modificado genéticamente con el gen pdf1.2 (L2, L3, L4, L7 y L9) y el testigo no modificado Flor de Mayo Anita, en al menos tres repeticiones. La unidad experimental fue una maceta con una planta. El análisis estadístico consistió en un análisis de varianza y comparación de medias a través de la prueba de Duncan (α = 0.05), mediante el paquete estadístico Minitab®.
RESULTADOS Y DISCUSIÓN
Cuantificación poblacional de T. harzianum
La evaluación de la concentración final de T. harzianum presente en el suelo que estuvo en contacto con las plantas FMA-pdf1.2 L2, L3, L4, L7 y L9 mostró un incremento a los 46 días después de la inoculación con respecto a la concentración inicial aplicada (Figura 1). Aunque el incremento de la concentración de Trichoderma en las plantas FMA no modificadas fue significativamente mayor en comparación con las poblaciones de frijol FMA-pdf1.2; en ambos casos lograron un aumento en la concentración final en un espectro de 3.6 × 105 a 4.6 × 105 UFC mL-1. La comparación de medias entre poblaciones de frijol FMA-pdf1.2 indicó un comportamiento homogéneo en la concentración final de UFC de Trichoderma, por lo que la disminución en la colonización no parece deberse únicamente a la defensina recombinante, pues se encontraron diferencias importantes en los niveles de expresión transcripcional en cada línea FMA-pdf1.2 (Espinosa-Huerta et al., 2013). De acuerdo con Salas-Marina et al. (2011), la inoculación de Trichoderma atroviride en raíces de Arabidopsis promueve la expresión de genes de resistencia como PR-1a (función desconocida), PR-2 (β-1, 3-glucanasa), PDF1.2 (defensina), LOX-1 (lipoxygenasa 1) y ATPCA (peroxidasa a) en hojas y raíces a partir de las 96 h de su inoculación; esto sugiere que la inoculación de T. harzianum en raíces de frijol podría promover vía señalización, la expresión de otros genes de defensa y que se haya detonado un efecto sinergístico transitorio entre éstos y la defensina recombinante que pudieran reducir la capacidad de reproducción (UFC) de T. harzianum en las plantas FMA-pdf1.2.
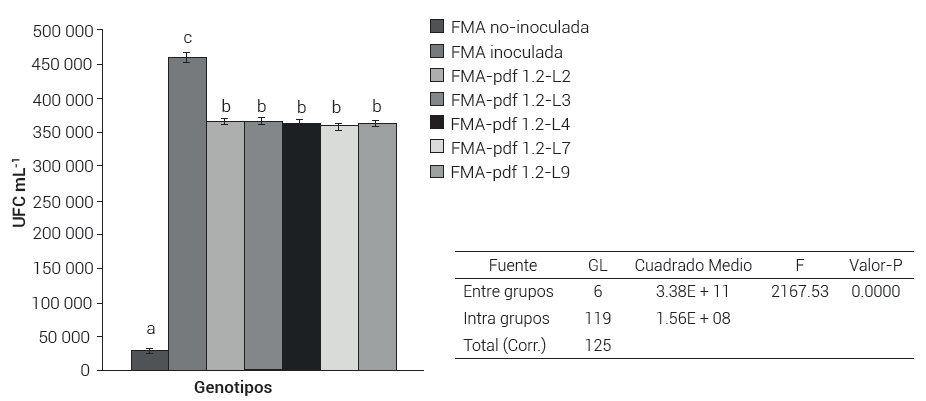
Figura 1. Contenido poblacional de Trichoderma harzianum a los 46 días después de la inoculación en plantas de frijol. Testigo FMA: Frijol Flor de Mayo Anita no modificada; FMA-pdf1.2-L2 a L9: líneas de frijol Flor de Mayo Anita modificadas con el gen pdf1.2 e inoculadas. Medias con letras distintas indican diferencias estadísticas significativas Duncan (0.05).
Conteo de nódulos en plantas de frijol inoculadas con Rhizobium tropici
Las plantas de frijol inoculadas presentaron un efecto de simbiosis con la bacteria R. tropici y visualmente no se percibieron diferencias en la densidad de nódulos formados en las raíces de plantas no modificadas y las plantas de las líneas FMA-pdf1.2 (Figura 2); sin embargo, hay diferencias estadísticas significativas entre las poblaciones de frijol FMA-pdf1.2 y la población de plantas de frijol no modificado, así como entre las poblaciones de las líneas L3 y L7 (P = 0.0019) (Figura 3). En este sentido, se observó una correlación entre la producción de defensina de estas líneas y su capacidad para formar nódulos, ya que de acuerdo con Espinosa-Huerta et al. (2013), la línea L3 mostró una reducción en los niveles de expresión transcripcional del gen pdf1.2 de hasta 30 % con respecto a la línea L7.

Figura 2. Formación de nódulos en raíces de frijol inoculadas con Rhizobium tropici. A. Raíces de plantas de frijol Flor de Mayo Anita no modificada; B. Línea de frijol FMA-pdf1.2-L9.
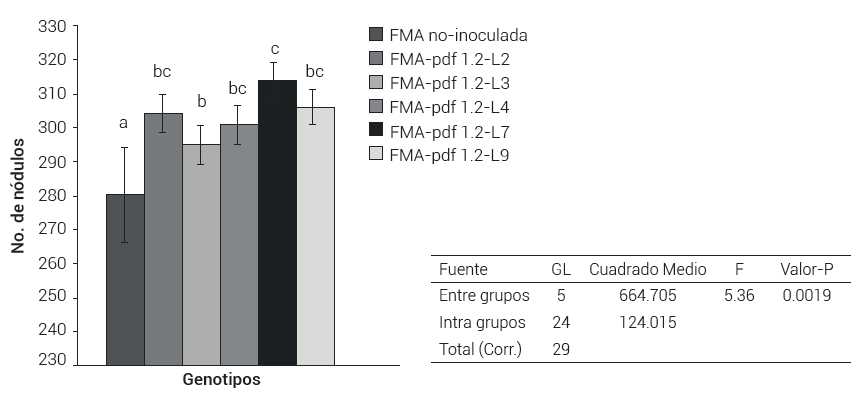
Figura 3. Conteo de nódulos presesentes en plantas de frijol Flor de Mayo Anita a los 40 días posteriores a su inoculación con Rhizobium tropici. FMA-inóculo testigo: Frijol sin transformar inoculado y FMA-pdf1.2-L2 a L9: Líneas de frijol modificadas con el gen pdf1.2 inoculadas. Medias con letras distintas indican diferencias estadísticas significativas Duncan (0.05).
Los valores de número de nódulos de todas las líneas FMA-pdf1.2 y el frijol no modificado se encontraron dentro del intervalo definido por el CIAT (1987) como Excelente (> 80) para un frijol de hábito de crecimiento indeterminado como lo es Flor de Mayo Anita. Los valores promedio del número de nódulos por planta oscilaron entre 280 y 313, por lo que se puede concluir que la relación simbiótica entre las poblaciones de líneas de frijol FMA-pdf1.2 y la bacteria benéfica fijadora de nitrógeno R. tropici se ve favorecida por efecto de la defensina.
Si bien la proteína que codifica el gen pdf1.2 es específica para el control de hongos y no se esperaba efecto sobre bacterias, era importante evaluarlo con Rhizobium sp., particularmente por tratarse de una relación simbiótica esencial con frijol desde el punto de vista de producción agrícola. La capacidad de las líneas FMA-pdf1.2 para formar nódulos fue mayor que en las plantas de frijol no modificadas. No es claro el efecto que pudo haber tenido la expresión de la proteína PDF1.2 en la formación de nódulos a favor de las líneas modificadas.
Colonización de R. intraradices en raíces de frijol
Derivado de la inoculación de R. intraradices en poblaciones de líneas de frijol FMA-pdf1.2 que habían mostrado resistencia a C. lindemuthianum (patotipos 1472 y 448) en un bioensayo previo (Espinosa-Huerta et al., 2013), se observó que las poblaciones de plantas de frijol Flor de Mayo Anita no modificadas mostraron una baja colonización del hongo en las raíces (25 %) y ésta se vió más reducida de manera inconsistente en las raíces de las líneas de frijol FMA-pdf1.2 en sus tres repeticiones 45 días posterior a su germinación (Cuadro 1). Es posible que en este caso se trate de una baja especificidad de R. intraradices por la planta hospedera, o bien que las condiciones experimentales no hayan favorecido la colonización.
Cuadro 1. Porcentaje de infección radical por Rhizophagus intraradices en plantas de frijol Flor de Mayo Anita modificado con el gen defensina pdf1.2.
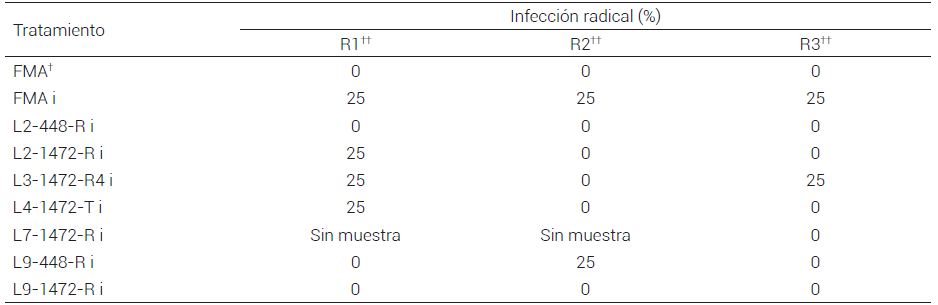
† FMA:Flor de Mayo Anita, i: inoculado con Rhizophagus intraradices. 448 y 1472 son cepas de Colletotrichum lindemuthianum para las cuales las líneas de frijol modificadas fueron R: resistentes o T: tolerantes. †† Réplica de experimento.
Aun cuando los niveles de colonización micorrízica fueron menores en las poblaciones de líneas FMA-pdf1.2, la colonización no mostró diferencias entre poblaciones de líneas de frijol FMA-pdf1.2 (Figura 4); asimismo, esta reducción no afectó el desarrollo de las plantas; es decir, tanto las plantas colonizadas como las no colonizadas tuvieron un desempeño similar en su desarrollo.

Figura 4. Colonización de raíces de frijol inoculadas con Rhizophagus intraradices. A. Raíces de plantas de frijol Flor de Mayo Anita no modificadas; B. Línea modificada genéticamente FMA-pdf1.2-L9-448-R.
Estos resultados contrastan con los obtenidos por Stewart et al. (2007), quienes reportaron que plantas de N. tabacum transformadas con los genes de péptidos antimicrobianos MSI-99 (transformación de cloroplastos) y D4E1 (transformación nuclear) fueron probados por su habilidad para formar asociaciones micorrízicas comparadas con el genotipo silvestre; no observaron efectos deletereos en el porcentaje de colonización con Gigaspora rosea o Glomus mosseae; además, las líneas de tabaco transformadas que expresaban MSI-99 en cloroplastos tuvieron un porcentaje mayor de colonización que el genotipo silvestre. Los resultados indican que las asociaciones micorrízicas en tabaco no fueron afectadas negativamente por la expresión de los genes probados (Stewart et al., 2007).
En el caso de las líneas de frijol FMA-pdf1.2, en las que la transformación es nuclear y la expresión de la proteína defensina es constitutiva, el hongo arbuscular R. intraradices estuvo expuesto a la proteína, a diferencia de la defensina expresada en cloroplastos (MSI-99). La proteína codificada por el gen pdf1.2 tiene la habilidad de inhibir hongos, por lo que existe la posibilidad de que ocurra una limitación de la colonización de la micorriza con R. intraradices a nivel de espacios intercelulares entre células corticales y en el apoplasto intracelular.
Evaluación de riesgo ambiental en organismos no-blanco
La hipótesis de un posible riesgo donde la proteína PDF1.2 expresada en los tejidos del frijol afectaría a microorganismos benéficos en el agroecosistema experimental con la consecuente pérdida de su biodiversidad y limitaciones en su efecto benéfico fue originalmente planteada para reunir todos los posibles elementos que establecerían el nivel del riesgo y un posible daño durante la liberación al ambiente; sin embargo, la caracterización del riesgo (probabilidad de la exposición al riesgo y las consecuencias de esta exposición) estableció que si bien la defensina se expresa de manera constitutiva en la planta de frijol y ésta tiene contacto con microorganismos benéficos, resultando en algunos casos con reducciones en el nivel de colonización o UFC con respecto a las plantas no modificadas (T. harzianum y R. intraradices), la defensina no interfirió en la respuesta de reconocimiento para el establecimiento de simbiosis de estos hongos benéficos antagonistas de patógeno y micorrízico y, si bien afectó la abundancia alcanzada por sus poblaciones, no las erradicó; por lo tanto, se considera que la probabilidad de que estos hongos benéficos sean inhibidos completamente por la defensina dentro del agroecosistema es baja. Asimismo, el componente bacteriano R. tropici encargado de la fijación de nitrógeno a través de la formación de nódulos no vió afectada negativamente su capacidad nodulante; por el contrario, ésta se favoreció en comparación con las plantas no modificadas. Por lo anterior, se establece que las caracterísiticas del frijol FMA-pdf1.2 no representan un riesgo para este organismo bajo las condiciones probadas.
CONCLUSIONES
Las líneas de frijol modificadas con el gen pdf1.2 que confiere resistencia de amplio espectro contra hongos patógenos mostraron un fenotipo diferencial con respecto a la capacidad de crecimiento en la rizósfera y al establecimiento de la asociación simbiótica con los microorganismos benéficos T. harzianum, R. tropici y R. intraradices. La nodulación por R. tropici se favorece por la presencia de la defensina en las plantas FMA-pdf1.2 en contraste con las plantas no modificadas, mientras que la colonización de R. intraradices y T. harzianum se inhibe en baja proporción por la defensina, sin riesgo de que se eliminen las poblaciones. En términos de evaluación de riesgo ambiental, el efecto de la defensina PDF1.2 sobre organismos benéficos como T. harzianum, R. intraradices y R. tropici en cuanto a su capacidad para reconocer, sobrevivir, desarrollarse e infectar plantas del frijol FMA-pdf1.2 es limitado, por lo que su efecto en un agroecosistema experimental abierto puede ser mínimo.











 nova página do texto(beta)
nova página do texto(beta)


