INTRODUCCIÓN
La roya del tallo, causada por el hongo Puccina graminis f. sp. tritici Erikss. & Hennin, es una enfermedad importante del trigo harinero (Triticum aestivum L.) y representa una amenaza potencial en la mayoría de las regiones productoras de este cereal alrededor del mundo (Randhawa et al., 2018b). En variedades susceptibles, la enfermedad puede causar pérdidas del rendimiento de 40 % en países como India, Pakistán, Bangladesh, China, Kenia, Etiopía y Brasil (Dubin y Brennan, 2009). La roya del tallo se ha controlado principalmente a través de la incorporación de resistencia al germoplasma de trigo y mediante la erradicación del hospedante alterno (Berberis spp.) de P. graminis f. sp. tritici (Huerta-Espino et al., 2011; Singh et al., 2011a).
En México, la incidencia de roya del tallo ha disminuido considerablemente y sólo se encuentra en niveles significativamente bajos desde que se liberó la variedad Yaqui 50 y otras variedades portadoras del gen Sr2, entre otros; además, no se han observado cambios en las razas de roya del tallo en México en los últimos 40 años y las infecciones naturales son prácticamente inexistentes (Huerta-Espino et al., 2011; Singh et al., 2006); sin embargo, la raza TTKSK (Ug99) que ha causado daños severos, principalmente en el continente africano, representa una amenaza potencial en México (García-León et al., 2018).
Se han identificado 59 genes de resistencia para roya del tallo (McIntosh et al., 2017), la mayoría de los cuales son de raza específica y confieren un efecto mayor en la resistencia desde la etapa de plántula hasta la etapa de planta adulta; sin embargo, este tipo de resistencia es poco durable ya que el patógeno puede evolucionar hacia virulencia y vencer estos genes de resistencia que generalmente se usan individualmente. Por otra parte, los genes de raza no específica confieren resistencia en planta adulta y sus efectos individuales son menores, pero cuando se conjuntan tres o más suman sus efectos y se heredan como una característica cuantitativa (Johnson, 1981).
La resistencia parcial, o de infección lenta (Niederhauser et al., 1954), también se conoce como resistencia de raza no específica y generalmente es asociada con la resistencia durable y referida comúnmente como resistencia de planta adulta porque se expresa como un desarrollo lento de la enfermedad en el campo, comparativamente con un testigo susceptible (Herrera-Foessel et al., 2014). La acumulación de genes que confieren resistencia parcial explota los efectos aditivos de este tipo de genes (ZárateCastrejón et al., 2018). Diversos estudios han revelado que las combinaciones de tres a cinco genes de resistencia resultan en niveles de infección cercana a la inmunidad y en resistencia estable a través de diferentes ambientes (Rodríguez-García et al., 2019; Singh et al., 2000; Singh et al., 2011b); así mismo, se pueden lograr niveles altos de resistencia a royas cuando un gen de raza específica efectivo se combina con genes de planta adulta (Basnet et al., 2015)
Se han catalogado y designado pocos genes de planta adulta con efectos individuales menores. Los conocidos como Sr2/Lr27/Yr30/Pbc1, Sr57/Lr34/Yr18/Pm38/Stb1/ Ltn1, Sr58/Lr46/Yr29/ Pm39/Ltn2 y Sr55/Lr67/Yr46/ Pm46 muestran un efecto pleiotrópico; es decir, confieren resistencia a múltiples enfermedades como roya del tallo, roya de la hoja (Puccinia triticina Erikss.), roya amarilla (P. striiformis f. sp. tritici Westend) y cenicilla polvorienta (Blumeria graminis (DC) Speer f. sp. tritici emend. É. J. Marchal) (Herrera-Foessel et al., 2014).
Se han transferido al trigo harinero diversos genes de resistencia a roya del tallo provenientes de ancestros silvestres, tales como Sr21, Sr22 y Sr35, a partir de Triticum monococcum (Kerber and Dyck, 1973; McIntosh et al., 1984; The, 1973); Sr24, Sr25, Sr26 y Sr43 a partir de Thinopyrum ponticum (McIntosh et al., 1977; Niu et al., 2014) o Sr38 proveniente de T. ventricosum (Bariana and McIntosh, 1993).
La resistencia genética a royas es el método más seguro y amigable ambientalmente para reducir las pérdidas de rendimiento, comparado con el control químico. Debido a que las razas virulentas de la roya del tallo continúan representando una amenaza seria en la producción mundial de trigo, es necesario y con propósitos de prevención, identificar y caracterizar nuevos genes de resistencia. En este sentido, la línea avanzada de trigo harinero Kijil (KLEIN DON ENRIQUE*2/3/FRET2/WBLL1//TACUPETO F2001), desarrollada por el programa de mejoramiento genético de trigos harineros del Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT), ha mostrado niveles altos de resistencia a roya del tallo en plántula y planta adulta. El objetivo de esta investigación fue determinar el número de genes de plántula y planta adulta que están confiriendo la resistencia a roya del tallo en la población F6 de la cruza Apav #1 × Kijil.
MATERIALES Y MÉTODOS
Material vegetal
Se utilizó una población F6 conformada por 99 familias derivadas de la cruza Apav #1 × Kijil. Apav #1 es una línea altamente susceptible a la roya del tallo, derivada de la cruza Avocet S × Pavon 76 (Randhawa et al., 2018a). Kijil proviene de la cruza KLEIN DON ENRIQUE*2/3/FRET2/ WBLL1//TACUPETO F2001 y en el presente estudio mostró niveles altos de resistencia a la raza RTR de roya del tallo (la más común en México) en plántula en el invernadero y en planta adulta en campo. La población se desarrolló mediante una cruza simple y la F2 se obtuvo del grano cosechado proveniente de tres plantas F1 . Las poblaciones F2 de cada planta F1 fueron evaluadas fenotípicamente, dos de éstas fueron correctas y se eliminó la progenie de la tercera planta. De las dos poblaciones F2 restantes se cosechó al azar un número suficientemente grande de espigas que se trillaron en masa para avanzar a la siguiente generación. En la generación F4 se generaron líneas puras a partir de la cosecha individual de 200 espigas, las cuales se sembraron en espiga por surco para obtener la F5 . La progenie de las 200 espigas por surco se cosechó en masa para dar origen a la generación F6 . En todas las generaciones se aplicó fungicida para evitar la pérdida de plantas susceptibles.
Evaluación de las familias en plántula
Las 99 familias de Apav #1 × Kijil y los progenitores se evaluaron en etapa de plántula en el invernadero de royas del Centro Internacional de Mejoramiento de Maíz y Trigo durante el mes de junio de 2017. Se sembraron ocho semillas por familia en charolas de plástico (20 × 30 × 6 cm) a las cuales se les agregó una mezcla de tierra preparada y peat moss (60/40 v/v) y con una plancha de acero se formaron 24 orificios por charola sobre el sustrato; adicionalmente, se sembró un juego con 20 líneas diferenciales del Laboratorio de Enfermedades de Cereales (CDL) de Minnesota, EUA (Jin et al., 2007). Las charolas se acomodaron en un diseño de bloques completos al azar y se mantuvieron en el invernadero con temperaturas de 20 a 25 ºC. Las plántulas se inocularon 10 días después de la siembra (dds), cuando las plántulas desarrollaron la segunda hoja, a través de aspersiones de urediniosporas de la raza RTR suspendidas en aceite mineral Soltrol 170® (Chevron Phillips Chemical Company) a una concentración de 1 × 10-6 esporas mL-1. La fórmula de avirulencia/ virulencia de RTR es: Sr7a, 9e, 10, 12, 13, 14, 22, 23, 24, 25, 26, 27, 29, 30, 31, 32, 33, 35, Dp2, H, Gt, Wld, W3560, AgI / Sr5, 6, 7b, 8a, 8b, 9a, 9b, 9d, 9f, 9g, 11, 15, 17, 21, 28, 34, 36, Pl (Singh, 1991). Las plántulas se colocaron dentro de una cámara de rocío durante 9 h y 3 h de luz a 20 ºC y después de 16 h se trasladaron al invernadero en donde se mantuvieron a 24 ºC durante el día y 12 ºC durante la noche.
Los tipos de infección en las familias y los progenitores se registraron 14 días después de la inoculación (ddi) mediante la escala de 0 a 4 de Roelfs et al. (1992), donde las plantas con tipos de infección 0, ; (fleck), 1, 2 y X se consideran resistentes, mientras que los tipos de infección 3 y 4 se utilizan para designar plantas susceptibles. Los signos + y – describen si el tamaño de la uredinia es más grande o más pequeño, respectivamente, comparado con el tamaño normal.
Evaluación de las familias en planta adulta
Las familias F6 y los progenitores resistente y susceptible (Apav y Kijil) se evaluaron por su resistencia en planta adulta en un ensayo en bloques completamente al azar con una sola repetición en la estación experimental del CIMMYT en Ciudad Obregón, Sonora durante los ciclos 2015-2016 y 2016-2017. En campo, cada familia F6 se sembró en parcelas que incluyeron aproximadamente 70 plantas dispuestas en dos filas paralelas de 1 m. Los bloques fueron constituidos por 25 familias. A un lado de cada parcela y alrededor del lote experimental se sembró una mezcla de genotipos susceptibles a la raza RTR de roya del tallo, que sirvieron como fuente de inóculo.
Para hacer una eficiente evaluación y clasificación de las familias F6 por su reacción a la roya del tallo fue necesario crear epidemias artificiales mediante tres inoculaciones, por medio de una suspensión de urediniosporas de la raza RTR (Singh, 1991). Las urediniosporas fueron suspendidas en aceite mineral Soltrol® 170 (Chevron Phillips Chemical Company) y asperjadas con un atomizador manual. La severidad de la enfermedad se registró cuando el progenitor susceptible (Apav) alcanzó niveles de 80 a 100 %; se utilizó la escala de Cobb modificada (Peterson et al., 1948) y la respuesta del hospedante a la infección se determinó de acuerdo con Roelfs et al. (1992), donde: R = resistente, uredinias diminutas; MR = resistencia moderada, uredinias pequeñas; MS = susceptibilidad moderada, uredinias pequeñas de tamaño moderado y S = susceptible, uredinias grandes.
Clasificación de familias
Con base en la severidad de la enfermedad y la respuesta a la infección, las familias F6 fueron clasificadas en tres categorías fenotípicas, de acuerdo con Singh y Rajaram (1992): líneas homocigotas parentales tipo resistentes (LHPTR), líneas homocigotas parentales tipo susceptible (LHPTS) y líneas con respuesta diferente a los dos padres (OTROS).
Análisis genético
Los experimentos en campo se llevaron a cabo con una sola repetición, es decir; una serie sencilla; la estimación del número de genes se realizó mediante el análisis de segregación mendeliana tradicional y las frecuencias fenotípicas observadas se compararon con las frecuencias fenotípicas esperadas mediante la prueba de ji-cuadrada (X2 ) (Singh y Rajaram, 1992); técnica utilizada en otros trabajos de investigación de la misma naturaleza (Huerta et al., 2012; Ponce-Molina et al., 2018).
Análisis molecular
El ADN de los progenitores y las familias se extrajo de tejido foliar de aproximadamente 20 plantas por familia sembradas en invernadero a través del método CTAB (bromuro de cetiltrimetilamonio) (Dreisigacker et al., 2016). Los progenitores se analizaron con cinco marcadores moleculares ligados a genes de resistencia de planta adulta: 1) marcador de repeticiones de secuencia simple (SSR) Xgwm533 ligado al gen Sr2 (Spielmeyer et al., 2003); 2) marcador de secuencia polimórfica amplificada y cortada (CAPS) csLV46G22 ligado al gen Sr58 (Lagudah, Com. Pers.) 1 ; 3 y 4) marcador de secuencia de sitio marcado (STS) csLV34 (Lagudah et al., 2006) y marcador de polimorfismo de nucleótido único (SNP) Lr34SNP, respectivamente (Lagudah et al., 2009), ligados al gen Sr57; y 5) Lr67SNP-TM4 ligado al gen Sr55 (Moore et al., 2015). Adicionalmente, los progenitores se analizaron con el marcador CAPS VENTRIUP-LN2 ligado al gen de raza específica Sr38 (Helguera et al., 2003). Los marcadores Xgwm533, csLV46G22 y VENTRIUP-LN2 resultaron polimórficos entre los progenitores, por lo que se usaron para genotipar toda la población con el uso de los protocolos de PCR de Helguera et al. (2003) y Dreisigacker et al. (2016).
RESULTADOS
Análisis genético y molecular en plántula
El progenitor susceptible Apav #1 mostró el tipo de infección 3+ mientras que el progenitor resistente Kijil mostró el tipo de infección ; (fleck). El análisis de segregación mendeliana indicó que al clasificar las familias en resistentes y susceptibles, la resistencia en Kijil está condicionada por cuatro genes de raza específica (Cuadro 1). Con base en el análisis molecular, uno de los cuatro genes de raza específica se identificó como Sr38, ya que Kijil resultó positivo para el marcador VENTRIUP-LN2. Para observar la segregación del gen Sr38 en las 99 familias éstas se analizaron con el marcador VENTRIUP-LN2. Un total de 37 familias resultaron positivas al marcador VENTRIUP-LN2, de las cuales, 32 se agruparon como resistentes y cinco como susceptibles (Cuadro 1). Las 32 familias resistentes expresaron los tipos de infección ;, 0;, ;1-, ;1, 2, 22+ y X, lo cual indica que los tipos de infección son consistentes con los resultados del marcador.
Las 62 familias negativas al marcador VENTRIUPLN2 se agruparon en 44 resistentes y 18 susceptibles de acuerdo con el tipo de infección. Las resistentes mostraron los tipos de infección ;1, ;1-, ;, 2, 22+ y X- y las susceptibles 3+ y 33+. Con base en el análisis de segregación de las 62 familias, se dedujo que existen dos genes que confieren resistencia a roya del tallo en plántula (Cuadro 1)
Cuadro 1. Número de genes de resistencia de plántula a roya del tallo en la población de 99 familias F6 de Apav #1 × Kijil, estimado a través del análisis de segregación mendeliana durante el ciclo 2016-2017 en Ciudad Obregón, Sonora.

†Falsos positivos.
Al reclasificar las 44 familias resistentes y negativas a VENTRIUP-LN2, se observó que existen familias que agrupan tres tipos consistentes de infección: 25 familias registraron ;1, 12 presentaron 22+ y 7 X-. De acuerdo con los tipos de infección, los genes se designaron temporalmente como SrKj;1, SrKj22+ y SrKjX-, los cuales corresponden al segundo, tercero y cuarto gen que confieren resistencia a roya del tallo en plántula. El análisis molecular no identificó a dichos genes.
Efecto de los genes Sr38, SrKj;1, SrKj22+ y SrKjX- en planta adulta
Para corroborar el efecto del gen Sr38 en planta adulta en las 32 familias agrupadas como resistentes en plántula, se mostró que 22 presentaron un nivel de infección en planta adulta de 0 a 1 % (R), muy similar a Kijil (1 % R), mientras que las 10 restantes presentaron severidades en un intervalo de 5 a 20 % (R-MR). Las familias portadoras de los genes SrKj;1, SrKj22+ y SrKjX- presentaron intervalos de severidad de 1 a 30 % (R-MR), de 30 a 60 % (MR) y de 1 a 30 % (R-MR), respectivamente.
Análisis genético y molecular en planta adulta
De las 99 familias, se identificaron 23 que resultaron susceptibles en plántula, las cuales se utilizaron para realizar el análisis genético. La severidad final de roya del tallo en Kijil fue 1 % (R) y 100 % (S) para Apav # 1. El análisis genético indicó que la resistencia a roya del tallo en la población proveniente de Apav #1 × Kijil está conferida por tres genes de resistencia de planta adulta (Cuadro 2). De las 23 familias, 21 fueron positivas al marcador csLV46G22, ligado a Sr58, y mostraron severidades de 30 a 90 % (MS-S); una de esas familias presentó 5 % (MS) de infección. Sólo 10 familias resultaron positivas a los marcadores de Sr2 + Sr58 y el intervalo de severidad fue de 60 a 100 % (MS-S). Las dos familias restantes fueron negativas a ambos marcadores y presentaron severidades de 90 y 100 % (S).
Cuadro 2. Número de genes de resistencia de planta adulta (APR) a roya del tallo en la población F6 Apav#1 × Kijil, estimado a través del análisis de segregación mendeliana en Ciudad Obregón, Sonora, ciclo 2016-2017.

La distribución de frecuencias de las familias para severidad de roya del tallo resultó de tipo discreta con tendencia a la resistencia, lo cual puede explicarse por la presencia de los genes de raza específica que confieren un nivel alto de protección en la etapa adulta de la planta (Figura 1)
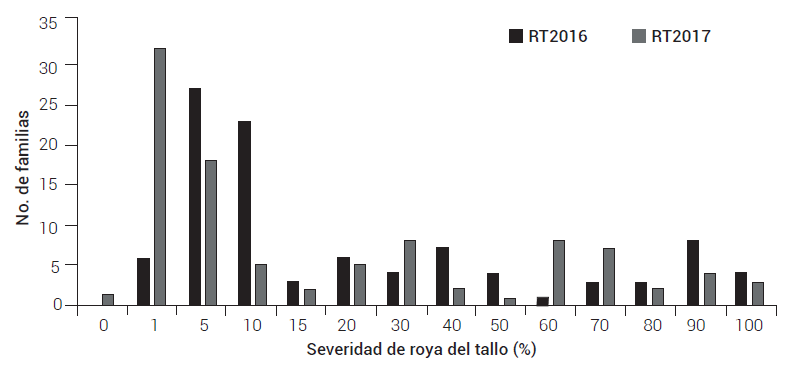
Figura 1. Distribuciones de frecuencias de la severidad de roya del tallo en la población de 99 familias F6 de Apav #1 × Kijil en ensayos de campo en Ciudad Obregón, Sonora, ciclos 2015-2016 (RT2016) y 2016-2017 (RT2017).
En el Cuadro 3 se muestra el número de familias positivas y negativas a los marcadores ligados a los genes Sr2, Sr38 y Sr58. No fue posible cuantificar el efecto individual de cada uno de esos genes en planta adulta, ya que las familias portadoras de esos genes también portan otros genes de raza específica.
DISCUSIÓN
El análisis de segregación mendeliana indicó que la resistencia a la roya del tallo en la población derivada de Apav #1 × Kijil en plántula está determinada por cuatro genes de raza específica. De acuerdo con el marcador molecular VENTRIUP-LN2, un primer gen se identificó como Sr38 y los otros tres se denominaron temporalmente SrKj;1, SrKj22+ y SrKjX-. El segmento del cromosoma 2NS/2AS que contiene los genes de resistencia Sr38/Yr17/Lr37 fue incorporado al trigo harinero VPM1 a partir de T. ventricosum (Tausch) Cess. Estos genes de raza específica confieren resistencia a roya del tallo (Sr38), roya amarilla (Yr17) y roya de la hoja (Lr37) (Bariana y McIntosh, 1993; Helguera et al., 2003) y han sido una fuente de resistencia ampliamente utilizada en los programas de mejoramiento. Actualmente, el gen Sr38 no provee resistencia contra el grupo de razas TTKSK (Ug99), pero es efectivo contra otras razas presentes en Norteamérica, especialmente en la etapa de planta adulta (Zhang et al., 2014).
En el presente estudio, la evaluación fenotípica en plántula indicó que las familias resistentes y positivas a Sr38 expresaron los tipos de infección ;, 0;, ;1-, ;1, 2, 22+ y X, mientras que aquellas susceptibles y positivas al marcador mostraron los tipos de infección 3+ y 33+ C, lo que indica falsos positivos para el marcador. Los resultados aquí obtenidos se encuentran dentro de los tipos de infección reportados para Sr38: X con pústulas más grandes hacia la base de la hoja (McIntosh et al.,1995), ;, 2, 3 (Jin et al., 2007), X+ y 3+ (Singh et al., 2008), 0;, ;, ;1, ;13-, ;13, ;3, 3; (Zhang et al., 2014) y 0; a ;13-C (Turner et al., 2016). Zhang et al. (2014) reportaron que Sr38 fue el gen más frecuente en los trigos duros y harineros que evaluaron; así mismo, mencionaron que es posible que este gen no se haya observado en otros estudios debido a que el fenotipo que expresa a menudo es confuso. Afortunadamente, el marcador VENTRIUPLN2 es un marcador de diagnóstico efectivo para detectar el segmento del cromosoma 2NS/2AS y en el presente estudio se corroboró la efectividad de tal marcador.
Las líneas resistentes en plántula y positivas a Sr38 presentaron en planta adulta un intervalo de severidad de 0 a 20 % (R-MR), mientras que las familias portadoras de los genes SrKj;1, SrKj22+ y SrKjX- expresaron niveles de severidad de 1 a 30 % (R-MR), de 30 a 60 % (MR) y de 1 a 30 % (R-MR), respectivamente. Se observó que todos los genes confirieron un alto nivel de resistencia en planta adulta en la población derivada de Apav #1 × Kijil, excepto SrKj22+. Estos resultados concuerdan con los de Zhang et al. (2014), quienes reportaron que Sr38 fue el gen más efectivo en planta adulta al presentar un promedio de severidad de 5.2 % en las líneas que portaban sólo este gen, lo cual representó menos de la mitad del valor del segundo gen más efectivo, que fue Sr31, que mostró severidad de 13 %. Adicionalmente, Pathan y Park (2007) postularon la combinación de los genes Sr31 + Sr38 en diversos cultivares evaluados, los cuales proporcionaron niveles altos de resistencia en planta adulta, al mostrar niveles de severidad de 20 a 40 %, más bajos que aquellos donde el cultivar portaba esos genes de manera individual, lo que sugiere un efecto de interacción entre éstos o la presencia de genes adicionales.
El análisis de segregación mendeliana en planta adulta indicó que la resistencia a roya del tallo en Kijil está conferida por tres genes de resistencia de planta adulta, de los cuales se detectó la presencia de Sr2 y Sr58 con base en el análisis con marcadores moleculares. Las familias positivas a Sr58 mostraron severidades de 30 a 90 % (MS-S) y sólo una presentó 5 % (MS) de infección. Estos resultados están relacionados con los obtenidos por García-León et al. (2018), quienes identificaron al gen Sr58 en los genotipos LC-150, Huites M95 y Bonza 63, que mostraron severidades de 0, 10 y 70 %, respectivamente, lo que indica que LC-150 y Huites M95 portan genes no identificados que incrementan la efectividad de Sr58. Los mismos autores encontraron la combinación de Sr2 + Sr58 en el genotipo Apav-14, el cual mostró 40 % de severidad y la combinación Sr2 + Sr57 + Sr58 en el progenitor Cacuke mostró el menor nivel de resistencia, correspondiente a 80 % de severidad, a pesar de portar tres genes de efecto aditivo. Estos resultados son similares a los obtenidos en el presente estudio, ya que las familias positivas a Sr2 + Sr58 presentaron un intervalo de severidad de 60 a 100 % (MS-S). Los efectos de Sr2 y Sr58 podrían verse enmascarados por la presencia de algún otro gen, lo que impide que expresen un nivel de resistencia adecuado.
La disminución de la incidencia de roya del tallo a niveles insignificantes en México y en la mayor parte del mundo repercutió en la disminución de la investigación para buscar fuentes de resistencia contra esta enfermedad; sin embargo, se ha seleccionado germoplasma para resistencia a roya del tallo en México para desarrollar epidemias artificiales con la raza RTR de P. graminis f. sp. tritici. De acuerdo con los resultados derivados de la presente investigación, Kijil puede ser una fuente potencial de resistencia a roya del tallo para ser usada en programas de mejoramiento, ya que confiere altos niveles de resistencia en plántula y planta adulta.
CONCLUSIONES
La resistencia en plántula y planta adulta en la población derivada de la cruza Apav #1 × Kijil está conferida por cuatro genes de raza específica denominados Sr38, SrKj;1, SrKj22+ y SrKjX-, mientras que la resistencia en planta adulta está conferida por tres genes de raza no específica, entre ellos los genes Sr2 y Sr58.











 nueva página del texto (beta)
nueva página del texto (beta)



