INTRODUCCIÓN
En México se cultivaron 202,631 ha de mango en 2018 y el estado de Sinaloa cuenta con la segunda mayor superficie, la cual alcanza 29,506 ha, con una producción anual de 195,969 t. El 72 % de cosecha se concentra en los municipios El Rosario y Escuinapa (SIAP, 2019). Las variedades más cultivadas son Kent, Ataulfo, Tommy Atkins y Keitt; esta última ha adquirido interés en el sur de Sinaloa por ser de maduración tardía (agosto-septiembre). Observaciones empíricas señalan que si se amplía el periodo de cosecha y los frutos tienen mayor vida útil se mejoraría la rentabilidad de la variedad. Con este propósito se planteó el uso de giberelinas (GAs) y citocininas, que tienen un papel importante en la retención, el crecimiento y el retraso de la senescencia de los frutos (Sebastian et al., 2019). El ácido giberélico (AG3) se ha aplicado en precosecha para retrasar la maduración en diversos frutos, entre ellos pérsimo (Diospyros kaki) (Maurer et al., 2019) y plátano (Musa spp.) (Duguma et al., 2014). Las citocininas, con su acción antisenescente (Osugi y Sakakibara, 2015), se han usado en uva (Vitis vinifera L.) (Botelho et al., 2003).
La aplicación de biorreguladores vegetales mejora la retención y la vida útil de los frutos del mango (Ahmed et al., 2012). Siddiqui et al. (2013) señalaron que la aplicación en postcosecha de AG3 (de 100 a 150 ppm) retrasó la maduración de mango Himsagar, redujo la respiración, retrasó la degradación de clorofila y mantuvo más tiempo la firmeza de los frutos que el testigo. Nkansah et al. (2012) aplicaron AG3 25 mg L-1, lo que mejoró el amarre y la calidad de frutos de mango Keitt.
No obstante el efecto fisiológico de las citocininas para retrasar la senescencia de los frutos, estos compuestos no han tenido tanta aplicación en la agricultura como las GAs. Las citocininas están involucradas en el amarre y crecimiento de los frutos de mango mediante el movimiento de metabolitos a los sitios de aplicación (Kulkarni et al., 2017). Pujari et al. (2016) aplicaron en mango Alphonso forclorfenuron (CPPU) 4 ppm en dos ocasiones, 14 y 30 d después de la floración, lo que provocó incrementos en retención y peso de los frutos, sin diferencia en calidad. Suman et al. (2017) documentaron que el uso de biorreguladores vegetales tiende a convertirse en un componente importante de los procedimientos agrotécnicos para mejorar el rendimiento (Pérez-Barraza et al, 2018) y calidad de los cultivos, especialmente de frutales.
El beneficio de una cosecha tardía de mango puede ser afectado a medida que los frutos permanecen más tiempo en el árbol, debido a la incidencia de antracnosis [Colletotrichum gloeosporioides (Penz.) Penz. y Sacc.]. En el sur de Sinaloa, México, la cosecha de mango Keitt coincide con el periodo más cálido y húmedo del año, lo que provoca incremento de esta enfermedad. Bajo estas condiciones deben establecerse medidas preventivas para obtener fruta aceptable, incluso para mercados locales (Noriega et al., 2014). Akem (2006) explicó que la antracnosis en mango es reconocida como la enfermedad postcosecha más distribuida en el mundo y limita la producción, especialmente en lugares con alta humedad durante el periodo de cosecha.
En México son escasos los antecedentes sobre la aplicación en precosecha de giberelinas y citocininas para retrasar la maduración del mango; por ello, se estableció el presente estudio con el propósito de determinar su efecto en el crecimiento, la abscisión previa a la cosecha, la calidad y vida útil de frutos de mango Keitt en el sur de Sinaloa, México.
MATERIALES Y MÉTODOS
Sitio, tratamientos y diseño experimental
El estudio se realizó en 2016 en un huerto comercial de mango Keitt de 7 años de edad, localizado a 22º 54’ 37” N y 105º 53’ 08” O en el municipio El Rosario, Sinaloa, México. Se utilizaron los productos comerciales Biogib® (Arysta- GBM®) como fuente de giberelinas (10 %) y Agromil Plus® (Agoenzymas®) como fuente de citocininas (citocininas 2082 ppm, giberelinas 31 ppm, auxinas 31 ppm y vitaminas 948 ppb); además, el fungicida comercial Manzate® (Mancozeb 80 %, de UPL Agro México). Los tratamientos (Cuadro 1) se distribuyeron en un diseño completamente al azar con tres repeticiones y un árbol como unidad experimental.
Las mezclas de los tratamientos fueron asperjadas a los frutos en el árbol con una bomba de motor (Arimitsu® modelo SD-260DII, Osaka, Japón) en cuatro ocasiones por la mañana: el 3 de mayo, 6 de junio, 2 de julio y 6 de agosto de 2016, lo que corresponde a 115, 81, 55 y 20 d antes de cosecha.
Variables precosecha
Se midió longitud y diámetro de fruto en cm bajo un diseño de un factor con medidas repetidas en el tiempo. En cada árbol (tres por tratamiento) se seleccionaron cinco frutos uniformes, se etiquetaron, enumeraron y se midieron con vernier digital (Calipper®, DC002-300; México) en dos ocasiones, antes de iniciar la aplicación de tratamientos (3 de mayo) y cuando los frutos alcanzaron madurez fisiológica (26 de agosto). El diseño antes mencionado se usó para evaluar la caída de fruto en las fechas del 26 de agosto y 4 y 26 de septiembre. Al concluir cada conteo, en tres árboles por tratamiento, los frutos caídos fueron retirados del árbol para evitar mezclarlos con el conteo siguiente.
Variables postcosecha
El 26 de agosto se cosecharon 42 frutos en madurez fisiológica por tratamiento (14 frutos por árbol), se trasladaron al Laboratorio de Calidad de Frutas y Hortalizas del Centro de Investigación en Alimentación y Desarrollo A. C., Culiacán y se almacenaron en condiciones de mercadeo (20 ± 2 ºC y 85 a 90 % HR). Las variables destructivas firmeza, sólidos solubles totales (SST), acidez titulable (AT) y relación sólidos/acidez se evaluaron bajo un diseño de dos factores (biorreguladores y tiempo), mientras que para las variables no destructivas color externo y severidad de antracnosis se utilizó un diseño de un factor con medidas repetidas en el tiempo. Los análisis se realizaron a partir de la cosecha cada 3 d durante 15 d, excepto severidad de antracnosis que se evaluó cada 6 d durante 18 d. La firmeza se midió con un penetrómetro digital (Chatillon® DFGS 100; Largo, Florida, USA) adaptado a una base Chatillon® TCD 200 y equipado con un punzón de 8 mm de diámetro; se realizaron tres lecturas (repeticiones) en base, centro y ápice del fruto, los valores se registraron en newtons (N) (Bourne, 1980).
Los SST y AT se analizaron de acuerdo con la metodología descrita por la AOAC (1998) y los resultados se expresaron en ºBrix y porcentaje de ácido cítrico, respectivamente. Con los valores de ambas variables se calculó la relación SST/acidez (RSA). El color externo se midió con un espectrofotómetro de mano (Minolta® CM2600D, Tokio, Japón) y los resultados se expresaron en ángulo de matiz (ºHue) (Konica Minolta, 2017). La severidad de antracnosis se evaluó de acuerdo con Carrillo-Fasio et al. (2005), con la escala siguiente: 0 = sano, 1 = trazas (manchas cloróticas sobre la fruta), 2 = ligero (lesiones oscuras de 1 a 5 mm de diámetro), 3 = moderado (lesiones oscuras de 6 mm en adelante) y 4 = severo (lesiones oscuras hundidas con presencia de estructuras fungosas). Para determinar el porcentaje de severidad se utilizó la fórmula:
Donde: S = severidad de antracnosis; n = número de frutos con la misma escala; v = número de la escala (0, 1, 2, 3 ó 4); N = número de frutos totales y V = número de la escala mayor (4). La severidad se reportó en porcentaje de frutos con daño.
Los datos de las variables estudiadas se analizaron mediante análisis de varianza y prueba de rangos múltiples de Tukey (P ≤ 0.05) con el paquete MINITAB versión 17.0 (Minitab® Inc. E.U.A.).
RESULTADOS Y DISCUSIÓN
Crecimiento del fruto
El análisis de varianza de diámetro y longitud de fruto fue significativo para biorreguladores, tiempo y su interacción (Cuadro 2). Esto significa que los valores promedio de diámetro y longitud no son independientes del tiempo de muestreo en que se hallan, ni de los compuestos aplicados o la interacción entre ellos.
El diámetro y longitud de los frutos fue similar en el primer tiempo de registro. Para el segundo tiempo los biorreguladores se habían aplicado en cuatro ocasiones y el efecto mayor se encontró en AG3 + Ap y AG3 + Ap + M, con diferencia significativa con respecto al testigo (Figura 1A y B). El incremento con respecto al testigo fue 1.2 y 1.9 cm en diámetro y 2.6 y 3.6 cm en longitud, respectivamente.
El papel de las citocininas y giberelinas en el crecimiento de los frutos está ampliamente documentado (Hedden y Sponcel, 2015; Osugi y Sakakibara, 2015). Sasaki y Utsunomiya (2002) señalaron que en mango Irwin cuatro aplicaciones de AG3 y forclorofenurón (CPPU), después de la caída fisiológica normal del fruto, incrementaron su crecimiento. Kulkarni et al. (2017) destacaron que una aplicación exógena de CPPU actúa en la división temprana de las células del fruto, mientras que las giberelinas promueven el crecimiento, lo que crea puntos de demanda de agua y nutrientes en las células (Kumari et al., 2018). El Gamal et al. (2015) registraron 11 % menos caída de fruto en mango Keitt con aplicaciones de AG3 40 ppm. De acuerdo con Kumar et al. (2014), la actividad de las hormonas vegetales no se restringe sólo a una etapa de crecimiento del fruto, pues es una red compleja donde varias hormonas están implicadas en el control de diversos aspectos del crecimiento y desarrollo. En el presente trabajo, la mejor respuesta para el crecimiento de los frutos de mango Keitt se logró con la mezcla de AG3 + Ap, con o sin Manzate.
Caída de frutos
El análisis de varianza para caída de frutos fue significativo para biorreguladores, tiempo de muestreo y su interacción (Cuadro 2). En el primer tiempo de muestreo, la caída de frutos fue similar para biorreguladores y testigo; en el segundo, la caída fue mayor en Ap y testigo, sin diferencia significativa con el resto de los tratamientos. En el tercer muestreo la caída se incrementó en todos los tratamientos, en los árboles tratados con Ap y testigo fue mayor, significativamente diferente a las mezclas AG3 + Ap y AG3 + Ap + M, que registraron la menor caída. Se puede señalar que los valores promedio de caída de fruto no son independientes del tiempo de muestreo en que se encuentran (Figura 2). Los tratamientos Ap + M, AG3, AG3 + M, AG3 + Ap y AG3 + Ap + M redujeron la caída de fruto en,38, 51, 51, 60 y 68 %, respectivamente, con referencia al testigo.
Cuadro 2 Valores P del análisis de varianza de datos de variables analizadas en frutos de mango Keitt.

SST:sólidos solubles totales
ATacidez titulable
RSArelación sólidos/acidez

Figura 1 Promedio (± EE) de diámetro (A) y longitud (B) de frutos de mango Keitt tratados con diferentes biorreguladores.Mediciones al iniciar la aplicación de biorreguladores y al momento de cosecha. Medias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05); DSH: diferencia significativa honesta.
Las auxinas, giberelinas y citocininas intervienen en procesos fisiológicos diversos para reducir la caída de frutos (Kumar et al., 2014). La aplicación de biorreguladores a frutos jóvenes de mango causó la movilización de metabolitos a los sitios de aplicación, lo que incrementó el vigor en los frutos y resistencia a la abscisión (Suman et al., 2017). Benjawan et al. (2006) señalaron que las giberelinas afectan la producción de ácido abscísico (ABA) y por lo tanto reducen la caída de frutos. Nkansah et al. (2012) reportaron que las aspersiones foliares de AG3 incrementan la biosíntesis de ácido indolacético (AIA) en los tejidos de las plantas, lo que evita la separación de las células en las zonas de abscisión. En su estudio, Duguma et al. (2014) mencionaron que AG3 retrasó la síntesis de etileno y en consecuencia redujo la caída de frutos. Por otra parte, Abdel-Kader et al. (2012) documentaron que los bioreguladores pueden actuar como elicitores, lo que induce resistencia en las plantas para controlar enfermedades que provocan caída de frutos. Ploetz (2009; Com. Pers.) 1 afirmó que la antracnosis es la principal enfermedad del mango y causa pérdidas directas al rendimiento. Tradicionalmente, el control de antracnosis en precosecha se realiza mediante la aplicación de fungicidas (Noriega et al., 2014). De acuerdo con Kumar et al. (2007), en la India la caída de frutos de mango provocada por antracnosis es controlada eficientemente con mancozeb (ingrediente activo de Manzate), como se evidenció en el presente estudio.
Características físicas del fruto
El análisis de varianza de firmeza y ángulo de matiz externo (ºHue) del mango fue significativo para biorreguladores, tiempo de muestreo e interacción entre ambos (Cuadro 2). Los valores de firmeza y ºHue tuvieron comportamiento similar durante el almacenamiento de los frutos. En los primeros 9 d los valores no se modificaron para AG3 solo o mezclado. A partir del día 6, en los tratamientos sin AG3, la firmeza y ºHue descendieron más rápido que en el resto de los tratamientos (Figura 3A y B). La mezcla de AG3 + Ap + M concluyó con frutos de mayor firmeza significativamente diferentes a los del testigo, Ap y Ap + M (Figura 3A). Los tratamientos con AG3 solo o mezclado con Ap y M finalizaron con valores de firmeza superiores a 50 N, considerada como mínima para madurez comercial. En cuanto al color, AG3 solo o mezclado con Ap y M fueron significativamente diferentes al testigo, Ap y Ap + M (Figura 3B) con valores de ºHue entre 106.8 y 108.5, que indican tonalidad verde.
Jawandha et al. (2012) trataron frutos de Zizyphus mauritiana Lamk en postcosecha con 60 ppm de AG3, lo que incrementó en 10 d su vida útil, comparada con los frutos testigo, atribuible a la baja actividad de las enzimas pectinmetilesterasa (PME) y poligalacturonasa (PG). Maurer et al. (2019) reportaron que en Diospyros kaki, AG3 retrasó los cambios en la pared celular que acompañan al ablandamiento de los frutos; asimismo, disminuyó la solubilización de polímeros de pectina y se redujo la actividad de exo-poligalacturonasa y endo-1,4-p-glucanasa.
Siddiqui et al. (2013) trataron frutos de mango Himsagar con AG3 100 ppm y observaron retención de color verde durante 9 d de almacenamiento. Duguma et al. (2014) percibieron retraso en el cambio de color de frutos de plátano tratados con AG3 en comparación con frutos del grupo control, atribuible al efecto retardante del AG3 en la síntesis de etileno y en la respiración. Como se conoce, el etileno acelera la degradación de la clorofila y promueve la síntesis de pigmentos carotenoides (Wan Zaliha et al., 2016). Por su parte, Suman et al. (2017) establecieron que la aplicación de AG3 en cítricos retrasa la degradación de clorofila, lo que inhibe la síntesis del carotenoide β-criptoxantina. En resumen, el AG3 reduce la actividad de enzimas específicas relacionadas con el ablandamiento y pérdida del color verde de los frutos durante la maduración (Beniwal et al., 2018).
Características químicas del fruto
El análisis de varianza para SST (ºBrix), AT y RSA fue significativo para los factores biorreguladores y tiempo de análisis en postcosecha. La interacción entre ambos factores fue significativa para SST y RSA, mas no para AT (Cuadro 2). Los SST no variaron en los primeros 6 d de almacenamiento. En el noveno día los valores de ºBrix aumentaron en todos los tratamientos, con mayor valor en el testigo. A los 12 y 15 d los tratamientos sin AG3 incrementaron significativamente los valores de ºBrix con respecto a los tratamientos donde se incluyó AG3 (Figura 4A). La AT mantuvo un perfil homogéneo durante el almacenamiento, con valores más altos en AG3 + Ap y AG3 + Ap + M (Figura 4B); asimismo, la RSA fue uniforme durante los primeros 6 d de almacenamiento; después, los valores se incrementaron en el testigo, Ap y Ap + M (Figura 4C). Al concluir el almacenamiento, los frutos tratados con AG3 + Ap + M redujeron los SST en 3.7 ºBrix y la RSA en 27 unidades, con incremento de AT en 0.21 % de ácido cítrico comparado con los frutos testigos, indicadores que se relacionan con retraso de la maduración.
Wan Zaliha et al. (2016) documentaron que auxinas, citocininas y giberelinas regulan o retardan la maduración de los frutos; en su estudio, señalaron que la aplicación en postcosecha de 150 mg L-1 de AG3 en plátanos mantuvo sin variación la concentración de SST durante 16 d y atribuyeron este resultado a un retraso en la producción de etileno; asimismo, Taduri et al. (2017) señalaron que en mango Amrapali AG3 a 75 ppm, aplicado 20 d antes de la cosecha, presentó efecto inhibitorio en la síntesis de etileno y retardó la actividad de enzimas responsables de la maduración, lo que incrementó la vida útil de los frutos. Maurer et al. (2019) establecieron que la producción de etileno es uno de los primeros indicadores de la maduración de los frutos. Botelho et al. (2003) encontraron un efecto sinérgico de tidiazuron (TDZ) y AG3 para retrasar la maduración de frutos de uva, como se observó para frutos de mango en el presente estudio. El comportamiento de la firmeza, el color externo, los SST, la acidez titulable y la relación SST/acidez, mostró que la maduración de los frutos fue más lenta en la combinación AG3 + Ap + M, lo que significó incremento de la vida útil.
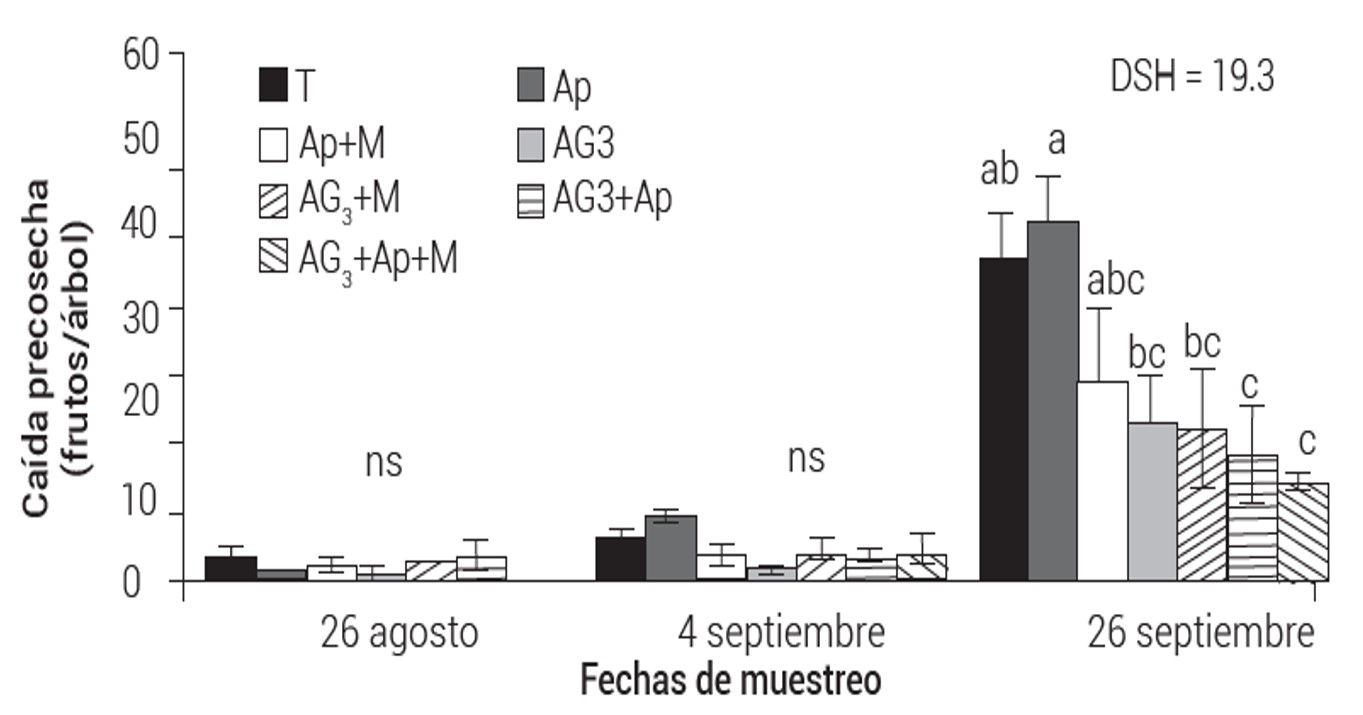
Figura 2 Media de caída de frutos (± EE) de mango Keitt tratados en precosecha con diferentes biorreguladoresMedias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). DSH: diferencia significativa honesta.

Figura 3 Medias (± EE) de firmeza (A) y ángulo de matiz en color externo (B) en frutos de mango Keitt tratados con diferentes biorreguladores en precosecha y almacenados en condiciones de mercadeo a 20 ± 2 °C y 85-90 % de HRMedias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). DSH: diferencia significativa honesta.

Figura 4 Medias (± EE) de sólidos solubles totales (SST), acidez titulable (AT) y relación sólidos/acidez (RSA) en frutos de mango Keitt con tratamientos de biorreguladores en precosecha y almacenados en condiciones de mercadeo a 20 ± 2 ºC y 85-90 % de HR.Medias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). DSH: diferencia significativa honesta.
Severidad de antracnosis
El análisis de varianza de severidad de antracnosis fue significativo para los factores biorreguladores, tiempo y su interacción (Cuadro 2). A partir del día 6 de almacenamiento, el testigo mantuvo significativamente mayor incidencia de la enfermedad que los biorreguladores solos o mezclados (Figura 5). Al concluir el almacenamiento los tratamientos Ap, Ap + M, AG3, AG3 + M, AG3 + Ap y AG3 + Ap + M redujeron en 41.3, 54.3, 54.3, 69.5, 58.7 y 76 % la incidencia de antracnosis con respecto al testigo, respectivamente.
Una ilustración del daño ocasionado por Colletotrichum gloeosporioides (Penz.) Penz. y Sacc., al concluir el almacenamiento, se presenta en la Figura 6, lo que tiene correspondencia con los datos de severidad de la Figura 5.

Figura 5 Severidad de antracnosis (± EE) en frutos de mango Keitt con tratamientos de biorreguladores en precosecha y almacenados en condiciones de mercadeo a 20 ± 2 ºC y 85-90 % de HRMedias con letras iguales no son estadísticamente diferentes (Tukey P ≤ 0.05). DSH: diferencia significativa honesta.
La antracnosis es una enfermedad que aumenta durante el almacenamiento de los frutos, producto de los cambios fisiológicos durante la maduración y senescencia (Akem, 2006). Maurer et al. (2019) señalaron que la aplicación foliar de AG3 50 ppm en frutos de pérsimo (Diospyrus kaki) en postcosecha, disminuyó 30 % el daño provocado por Alternaría alternata. Los autores documentaron que AG3 está implicado en la modulación de ácido salicílico, hormona de defensa que media los sistemas de transducción de señales, y en consecuencia, estimula tanto la resistencia adquirida localizada como la resistencia sistémica adquirida. Sandoval-Chávez et al. (2015) señalaron que el ablandamiento de los frutos promueve el desarrollo de patógenos y la pared celular juega un papel importante en el reconocimiento de éstos para el despliegue de las respuestas de defensa. La mezcla de los biorreguladores con Manzate resultó el mejor tratamiento para reducir antracnosis. Noriega et al. (2014) documentaron que este fungicida es eficaz para el control de la enfermedad con una toxicidad aguda muy baja.
CONCLUSIONES
La aplicación precosecha de fitorreguladores a base de citocininas y giberelinas incrementó el tamaño del fruto de mango Keitt. El uso de AG3 en precosecha redujo la caída de fruto; asimismo, puede mejorar la calidad y la vida útil del mango Keitt cuando se combina con citocinina y se protege a los frutos con fungicida.











 nova página do texto(beta)
nova página do texto(beta)





