INTRODUCCIÓN
Ralstonia solanacearum (Smith, 1896) Yabuuchi et al., 1996 emend. Safni et al., 2014 es uno de los fitopatógenos bacterianos de mayor importancia a nivel mundial (Mansfield et al., 2012). En Morelos y otras partes de México ha causado pérdidas a los productores de tomate (Solanum lycopersicum) (Hernández-Romano et al., 2012; Perea et al., 2011), así como a productores de plátano (Musa × paradisiaca) (Obrador-Sánchez et al., 2017). Tiene un amplio rango de hospederos que infectan a más de 200 especies vegetales de al menos 44 familias taxonómicas (Hayward, 1991). La infección por R. solanacearum causa marchitez, que con frecuencia culmina con la muerte de la planta de una a tres semanas posteriores al inicio de los síntomas.
El tratamiento para combatir esta enfermedad se basa en antibióticos como oxitetraciclina, gentamicina y estreptomicina (McManus et al., 2002; Stockwell y Duffy, 2012). Este método de control no está alineado con el desarrollo sustentable de la agricultura, ya que elimina indiscriminadamente bacterias del suelo, muchas de ellas benéficas para el desarrollo vegetal (Falkowski et al., 2008; Sharma et al., 2013). La aplicación de antibióticos favorece la selección de bacterias portadoras de genes de resistencia que reducen la eficacia de estos compuestos y potencialmente contribuyen al problema de la resistencia antimicrobiana en el tratamiento clínico de las enfermedades bacterianas humanas (Economou y Gousia, 2015; López et al., 2009; Thiele-Bruhn, 2003; You y Silbergeld, 2014). Esta situación resalta la necesidad de desarrollar nuevas estrategias de control, no agresivas para el ambiente ni para la salud humana y que contribuyan a mejorar la productividad de los cultivos agrícolas (Sundin et al., 2016).
Los bacteriófagos, virus que infectan bacterias, representan una alternativa para el control de fitopatógenos bacterianos (Frampton et al., 2012; Jones et al., 2007; Żaczek et al., 2015). Existen reportes de la efectividad de estos agentes para combatir la marchitez bacteriana del tomate (Bae et al., 2012; Bhunchoth et al., 2015; Fujiwara et al., 2011; Kalpage y De Costa, 2014); sin embargo, es importante analizar cada nuevo aislamiento, ya que algunos bacteriófagos pueden modificar la virulencia de la bacteria hacia la planta (Addy et al., 2012a; b; c).
Como parte del análisis de los bacteriófagos se evalúan sus características fisicoquímicas, biológicas y genómicas. El análisis fisicoquímico evalúa su estabilidad frente a cambios en el pH, temperatura, composición salina del medio, etc. Con el análisis biológico se evalúa la capacidad para inhibir la proliferación bacteriana, el rango de hospederos o la modificación de la virulencia bacteriana. El análisis genómico permite identificar genes asociados con comportamientos lítico o temperado y detectar genes que puedan modificar la virulencia del hospedero (Jassim y Limoges, 2014).
El objetivo de este trabajo fue analizar características fisicoquímicas (estabilidad en soluciones con diferente composición salina a diferentes valores de pH) y biológicas (capacidad inhibitoria hacia R. solanacearum) del bacteriófago ФRSP y determinar la presencia de propiedades que apoyen su utilidad como un agente potencial de biocontrol de la marchitez bacteriana causada por R. solanacearum.
MATERIALES Y MÉTODOS
Cepa bacteriana y condiciones de crecimiento
La cepa de R. solanacearum se aisló en Coatlán del Río, Morelos (Hernández-Romano et al., 2012). Se cultivó en NBY (peptona de caseína, 5 g L-1; extracto de carne, 3 g L-1; extracto de levadura, 2 g L-1; K2HPO4 (anhidro), 2.0 g L-1; KH2PO4, 0.5 g L-1; sacarosa, 25 g L-1; MgSO4•7H2O, 0.001 M) (Evtushenko y Takeuchi, 2006) a 30 ± 2 ºC y en agitación (250 rpm) por 24 h bajo condiciones aerobias en un agitador (Innova® 44, New Brunswick, Canadá).
Aislamiento del bacteriófago ФRSP
El bacteriófago ФRSP se aisló de agua de cultivos de tomate infectados por R. solanacearum. Se mezclaron 50 mL de la muestra de agua a analizar con 20 mL de cultivo líquido de R. solanacearum de 12 a 16 h de crecimiento en NBY. La mezcla se incubó por 16 h en condiciones aerobias, en agitación a 200 rpm y 30 ºC. La detección de bacteriófagos se hizo tomando una alícuota de 1 mL, la cual se centrifugó a 10,000 × g por 3 min; posteriormente, se filtró el sobrenadante con una membrana de 0.45 µm. Del filtrado se prepararon ocho diluciones decimales en las que se utilizó NBY estéril como diluyente. Se preparó una suspensión bacteriana tras mezclar 8 mL de NBY con agar suave (NBY con agar bacteriológico al 0.7 %) fundido y a 40 ºC, con 50 µL de un cultivo de R. solanacearum en NBY líquido con un máximo de 24 h de crecimiento.
La mezcla se vertió en una caja de Petri de 90 × 15 mm y se dejó solidificar por 15 min. En diferentes secciones de la caja de Petri se colocó una alícuota de 10 µL de cada una de las diluciones de la muestra filtrada, se dejó secar el líquido sin extenderlo, se incubó a 30 ºC por 24 h y se observó la presencia de placas de lisis. El fago se purificó tomando una placa de lisis y colocándola en un cultivo líquido de R. solanacearum con 16 a 24 h de crecimiento, se incubó por 24 h y centrifugó a 10,000 × g por 3 min. El sobrenadante se filtró en una membrana de 0.45 µm y la concentración del bacteriófago se determinó como se explica en la siguiente sección.
Titulación de las soluciones fágicas
Para determinar la concentración de las soluciones fágicas se utilizó la técnica del doble agar (Kropinski et al., 2009) modificada. Se utilizaron tubos con 8 mL de NBY con agar suave a 40 ºC. Bajo condiciones de esterilidad, se prepararon ocho diluciones decimales de la solución fágica a titular, se tomaron 15 µL de la misma y se diluyeron con 135 µL de medio NBY estéril. A cada dilución se le adicionaron 50 µL de un cultivo de R. solanacearum de 16 a 24 h de crecimiento, esta mezcla se colocó en el tubo con agar suave a 40 ºC, se mezcló y el contenido se vertió en una caja de Petri que se dejó solidificar e incubar por 24 h a 30 ± 2 ºC. Se identificaron aquellas cajas que presentaron entre 30 y 150 placas de lisis (pfu’s, “plate forming units”) y se calculó el título aplicando la siguiente ecuación:
Cada titulación se hizo por triplicado. La titulación se consideró adecuada si era evidente el efecto de dilución y el coeficiente de variación era menor a 20 %.
Estabilidad del bacteriófago ФRSP en diferentes soluciones acuosas
La estabilidad se evaluó en los siguientes medios: 1) NBY, 2) buffer SM (Tris-HCl, 50 mM; NaCl, 0.1 M; MgSO4·7H2O, 8 mM; gelatina, 0.002 %), 3) solución de sulfatos y fosfatos (K2SO4, 0.27 g L-1; MgSO4·7H2O, 0.44 g L-1; KH2PO4, 0.14 gL-1) y 4) solución de sulfatos y fosfatos 5X (K2SO4, 1.35 g L-1; MgSO4·7H2O, 2.20 g L-1; KH2PO4, 0.70 g L-1). De cada una de estas soluciones, se tomaron 990 µL y se mezclaron con 10 µL de una solución del fago ΦRSP con una concentración de 1 × 1011 pfu’s/mL en medio NBY. A intervalos de aproximadamente una semana se determinó el título de cada solución. Estas evaluaciones se realizaron a temperatura ambiente y por triplicado.
Microscopía electrónica
Mediante una solución fágica con un título de 1 × 108 pfu’s/mL los bacteriófagos fueron sedimentados por centrifugación a 40,000 × g por 1 h. La pastilla se resuspendió en buffer SM. Diluciones de esta suspensión (1:10 y 1:50) se colocaron durante 3 min en rejillas cubiertas con Formvar-carbon e inmediatamente se eliminó el exceso. Las muestras se contrastaron por tinción negativa con acetato de uranilo 3 % y se observaron en un microscopio electrónico de transmisión (JEOL 1011, JEOL, Inc., Peabody, MA, USA).
Estabilidad del bacteriófago ФRSP bajo diferentes condiciones de pH
Para evaluar la estabilidad del bacteriófago ФRSP a distintos valores de pH, se seleccionó la solución en la que el bacteriófago presentó mayor estabilidad (solución de sulfatos y fosfatos 5X) y en diferentes alícuotas se ajustó el pH a valores de 2.0 a 12.0, con incrementos de una unidad. A 1.0 mL de cada alícuota se le adicionaron 10 µL de una solución del fago ΦRSP con una concentración de 1 × 1011 pfu’s/mL. Se mezcló perfectamente por inversión y se dejó incubar 1 h a temperatura ambiente para después determinar el título fágico en cada solución. La estabilidad a cada valor de pH se evaluó por triplicado.
Efecto del bacteriófago ΦRSP sobre el cultivo bacteriano en medio líquido
Se preparó un cultivo líquido de R. solanacearum en medio NBY con 16 a 24 h de crecimiento. Se centrifugó y la pastilla se resuspendió en medio mineral con glucosa [(NH4)2SO4, 0.060 g L-1; KNO3, 0.38 g L-1; KH2PO4, 0.50 g L-1; K2HPO4, 2.0 g L-1; MgSO4·7H2O, 2.25 g L-1; CaCl2, 0.02 g L-1; glucosa, 5.0 g L-1] y se ajustó a una densidad óptica de 0.370 ± 0.001 a 600 nm. De esta suspensión bacteriana se utilizaron 250 µL para inocular un reactor de 50 mL que contenía 24.75 mL de medio mineral con glucosa. Una vez inoculados con la bacteria, los reactores se colocaron en el sistema RTS-1C (Biosan, BS-010160-A02, Riga, Republic of Latvia) y se incubaron por 24 h a 30 ºC y 2000 rpm, inoculando el fago ΦRSP 8 h después de la inoculación bacteriana, momento en el que se iniciaba el crecimiento exponencial de la curva de crecimiento bacteriano.
Para establecer la multiplicidad de infección (MOI, Multiplicity of infection) se determinó la concentración bacteriana en el biorreactor al momento de la inoculación fágica, que fue de 2 × 106 ufc/mL. Con este dato y con el título de la solución fágica de trabajo (2.3 × 109 pfu’s/mL) se determinó el volumen de solución fágica a tomar para utilizar MOI’s de 10-2, 10-4 y 10-6. Cuando fue necesario, se prepararon diluciones de la solución fágica. En todas las cinéticas la densidad óptica se registró cada 15 minutos a 850 nm. Cada condición se evaluó por triplicado.
RESULTADOS Y DISCUSIÓN
Morfología de bacteriófago ФRSP
El bacteriófago ФRSP genera placas de lisis de 0.2 a 0.5 cm de diámetro después de 24 h de incubación y continúan creciendo mientras las condiciones de humedad en el medio sean adecuadas (Figura 1). La morfología de este bacteriófago es compatible con la de los miovirus, presenta una cabeza icosaédrica y una cola rígida que posee una vaina (Figura 1, flecha) y un tubo (Figura 1, punta de flecha), lo que concuerda con la descripción de Ackermann (2011).
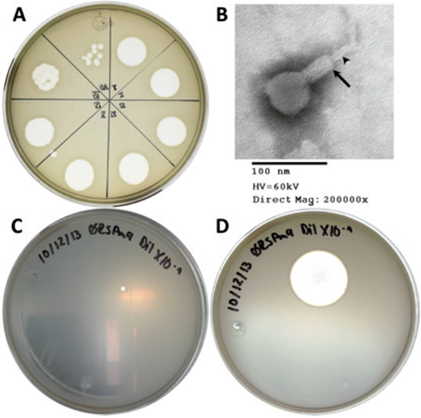
Figura 1 Placas de lisis y morfología microscópica del bacteriófago ΦRSP. A) Resultado de la prueba de detección de fagos en la muestra de agua analizada. Cada división corresponde a una dilución decimal I: 10-1, II: 10-2, III: 10-3, etc. En la dilución 10-8 (división VIII) se detectan 10 placas individuales. B) Imagen de la partícula fágica obtenida por microscopía electrónica de transmisión. C) y D) Misma placa de lisis a las 24 h y dos semanas de incubación, respectivamente.
El bacteriófago ΦRSP presenta una relativa facilidad para difundir en la capa de agar suave e infectar nuevas bacterias. Esta característica puede resultar conveniente para el biocontrol, pues sugiere que las características intrínsecas del fago le permiten difundir con facilidad, lo que incrementa su capacidad para encontrar y eventualmente destruir a células bacterianas de R. solanacearum, ya sea en el suelo o en sustratos de cultivos semi-hidropónicos; o bien, para actuar con efectividad en presencia de biopelículas (Abedon y Yin, 2009; Gallet et al., 2009; 2011).
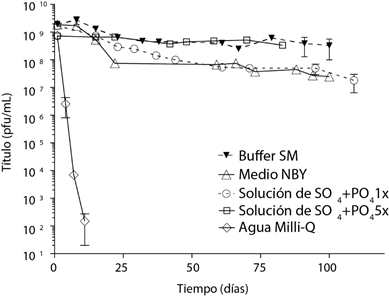
Estabilidad del bacteriófago ΦRSP en distintas soluciones
El bacteriófago ΦRSP fue estable en la solución de sulfatos y fosfatos, su estabilidad aumentó cuando la concentración de las sales se quintuplicó (Figura 2). En NBY y en solución de sulfatos y fosfatos 1X se observó una caída en la concentración de alrededor de un orden de magnitud durante los primeros 30 d. Esta caída no se observó cuando se quintuplicó la concentración de las sales en la solución de sulfatos y fosfatos (5X). En esta solución la concentración se mantuvo prácticamente sin cambios durante 83 d. En el agua Milli-Q el fago fue muy inestable, no detectándose después de 20 d, lo que señala la importancia de las sales para estabilizar al bacteriófago. Estos resultados muestran que el bacteriófago ΦRSP es más estable en una solución de sulfatos y fosfatos, cuya composición y concentración de sales es similar a la utilizada en los cultivos de tomate hidropónico. Los intervalos de concentraciones de cada sal en las que el fago es estable son: K2SO4 de 0.27 g L-1 a 1.35 g L-1; MgSO4·7H2O de 0.44 g L-1 a 2.20 g L-1; KH2PO4, 0.14 g L-1 a 0.70 g L-1, lo que abre la posibilidad de aplicarlo a través del sistema de riego automatizado.
Estabilidad del bacteriófago ΦRSP a distintos valores de pH
Dado que el bacteriófago ΦRSP presentó la mayor estabilidad en la solución de sulfatos y fosfatos 5X, se evaluó su estabilidad a diferentes valores de pH en esta solución, como se describe en la metodología. El bacteriófago fue estable en un intervalo de pH de 4 a 11 (Figura 3). A valores de pH menores o iguales a 3, o mayores o iguales a 12, el fago no se detectó después de 1 h de exposición. Esto podría ser consecuencia de cambios proteicos conformacionales o de la distribución de cargas eléctricas de los residuos de aminoácidos que afectan la unión del fago con su receptor (Di Russo et al., 2012). El perfil de estabilidad frente al pH es característico de cada bacteriófago; en algunos casos los fagos son estables en un intervalo de pH, y caen drásticamente fuera de éste (Jepson y March, 2004; Jin et al., 2012), mientras que en otros la estabilidad varía gradualmente y presenta un máximo a cierto valor de pH (Jin et al., 2012; Knezevic et al., 2011; Yang et al., 2010).
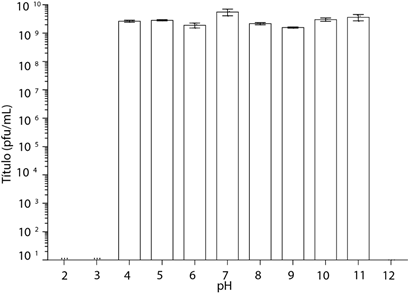
Figura 3 Estabilidad del bacteriófago ΦRSP a distintos valores de pH. El fago es estable entre valores de pH de 4 a 11.
El perfil de estabilidad que presenta el bacteriófago ΦRSP es muy similar al que se presenta en el bacteriófago KHP30 (Uchiyama et al., 2013); en ambos casos, la estabilidad se reduce drásticamente después de un valor de umbral. Estos resultados sugieren que el bacteriófago ΦRSP será estable bajo las condiciones que se presentan en los cultivos de tomate, donde los productores de esta hortaliza utilizan soluciones con un pH cercano a la neutralidad, pero con frecuencia tienen que ajustar el pH de las soluciones nutritivas, lo que provoca ligeros cambios temporales en este parámetro.
Efecto del bacteriófago ΦRSP sobre el crecimiento bacteriano
Cuando el bacteriófago ΦRSP se adicionó a cultivos líquidos de R. solanacearum que se encontraban al inicio de la fase de crecimiento exponencial se inhibió el crecimiento microbiano (Figura 4). Los perfiles de densidad óptica mostraron una reducción significativa del crecimiento bacteriano en presencia del bacteriófago y se anuló completamente el incremento en la densidad óptica a una MOI de 10-2. En las MOI´s de 10-4 y 10-6 se formaron aglomerados de detritus celulares que generaban lecturas dispersas en la densidad óptica, estos aglomerados rápidamente sedimentaban cuando el tubo se dejaba en reposo. Se obtuvo un resultado similar a las tres multiplicidades de infección (MOI´s) utilizadas (10-2, 10-4, 10-6), lo que indica que el bacteriófago ejerció su efecto lítico, incluso cuando se utilizó un fago por cada millón de bacterias presentes en el medio.
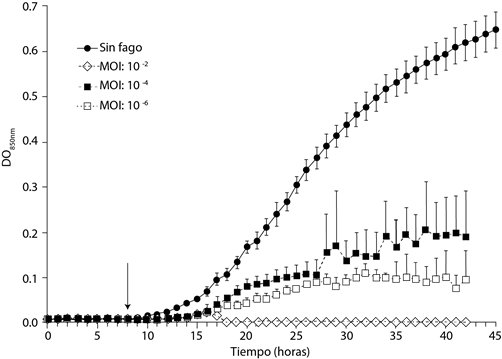
Figura 4 Efecto inhibitorio del bacteriófago ΦRSP sobre cultivos líquidos de R. solanacearum con diferentes multiplicidades de infección (MOI´s). La flecha indica el punto en el que se adicionó el fago al cultivo. El bacteriófago impide el crecimiento bacteriano, aun bajo condiciones en las que se utiliza un bacteriófago por cada millón de bacterias.
Para el caso de los experimentos en los que se utilizó una MOI de 10-2, se adicionaron 22 µL (5.2 × 107 fagos) de una solución fágica de concentración 2.37 × 109 pfu’s/mL, a 25 mL (5.2 × 109 bacterias) de una suspensión bacteriana de concentración 2.1 × 108 ufc/mL. De esta forma, la concentración de fagos que ejerció el máximo efecto inhibitorio fue de 2.09 × 106 pfu’s/mL. Para el caso de la MOI de 10-6, se adicionaron 22 µL (5.2 × 103 fagos) de una solución fágica de concentración 2.37 × 105 pfu’s/mL, a la misma cantidad de bacterias. En este experimento la concentración fágica fue de 209 pfu’s/mL.
En reportes previos se obtuvieron resultados similares en los que se utilizaron MOI’s de 0.5 y 5.0 (Fujiwara et al., 2011) o de 0.1, 1.0 y 10 (Ma et al., 2018), valores muy elevados que podrían limitar el tratamiento con bacteriófagos a gran escala debido a la gran cantidad de fagos requeridos, lo que incrementaría los costos de producción. Recientemente se ha reportado que algunos bacteriófagos tienden a presentar un comportamiento lítico frente a uno lisogénico cuando las multiplicidades de infección son bajas, gracias a que existen sistemas de comunicación que permiten a los bacteriófagos censar su densidad poblacional (Erez et al., 2017). Los resultados muestran que la capacidad inhibitoria del fago ΦRSP se presenta en valores de MOI de 10-2 a 10-6, lo que resulta de utilidad práctica, ya que bajas concentraciones del fago podrían tener un efecto protector, lo que reduciría los costos del tratamiento con este tipo de agentes de biocontrol.
Se ha secuenciado el genoma completo de este bacteriófago (GenBank MH252365) y no se han encontrado genes que codifiquen para factores de virulencia conocidos, tampoco se ha detectado un módulo de lisogenia funcional; estas características genómicas concuerdan con el comportamiento lítico que presenta in vitro. Adicionalmente, se ha evaluado al fago frente a 18 cepas bacterianas aisladas de la rizosfera de plantas de tomate, así como frente a seis cepas de R. solanacearum aisladas en Morelos y el Estado de México en diferentes años, en las que se observó actividad lítica frente a todas las cepas del fitopatógeno, pero hacia ninguno de los aislamientos bacterianos de la rizosfera.
CONCLUSIONES
El bacteriófago ΦRSP presenta características fisicoquímicas y biológicas que lo señalan como un potencial agente de biocontrol para combatir la marchitez bacteriana causada por R. solanacearum en tomate. Este bacteriófago es estable en soluciones salinas con una composición química de sulfatos y fosfatos similar a las que se utilizan en las soluciones nutritivas de los cultivos de tomate, así como a valores de pH en un intervalo de 4.0 a 11.0; además, es capaz de difundir en ambientes similares a los recubrimientos bacterianos e inhibir el crecimiento de R. solanacearum en cultivos líquidos a multiplicidades de infección de 10-2, 10-4 y 10-6. Estas características sugieren que durante su aplicación en campo permanecerá viable y limitará el crecimiento de R. solanacearum, aún cuando se aplique a bajas concentraciones.











 nueva página del texto (beta)
nueva página del texto (beta)