Introducción
La jamaica, como se le conoce en México a Hibiscus sabdariffa L., es una planta que se cultiva anualmente en las regiones tropicales y subtropicales del país. La estructura de la planta con mayor valor comercial son los cálices, a partir de los cuales se prepara la tradicional “agua de jamaica”. Los cálices de Hibiscus sabdariffa contienen abundantes cantidades de compuestos fenólicos, entre los que destacan las antocianinas, ácidos fenólicos, y otros flavonoides del tipo flavonoles y proantocianidinas (Borrás-Linares et al., 2015; Reyes-Luengas et al., 2015). Las diferentes actividades biológicas y propiedades medicinales asociadas con los cálices de jamaica se deben a sus compuestos fenólicos (Zhang et al., 2014a); la elevada actividad antioxidante se atribuye principalmente a la presencia de sus antocianinas (Jabeur et al., 2017), por lo que la evaluación del contenido de estos compuestos es de importancia como atributo de calidad, debido a que los consumidores prefieren cálices que, además de tener el sabor ácido característico, pigmenten intensamente el “agua fresca de jamaica”, la que tendrá mayor contenido de antioxidantes. Una dieta rica en antioxidantes se ha relacionado con menor incidencia de enfermedades crónico-degenerativas (Shahidi y Ambigaipalan, 2015).
El contenido de compuestos fenólicos está relacionado con el genotipo, y se encuentra estrechamente asociado con el color de los cálices (Christian y Jackson, 2009) por la presencia de las antocianinas; sin embargo, el ambiente de producción también afecta el contenido de estos compuestos (Jaakola y Hohtola, 2010). Una variación de hasta 70 % en el contenido de compuestos fenólicos solubles totales y antocianinas, al variar la localidad de producción, fue reportada para variedades de jamaica cultivadas en Senegal (Juliani et al., 2009). La temperatura y la luminosidad son los componentes ambientales más estudiados, ya que afectan los factores de transcripción relacionados con la síntesis y acumulación de antocianinas (Jaakola, 2013); en el caso particular de la jamaica, el fotoperiodo es también relevante, ya que el cultivo es sensible a este factor.
Los cálices de H. sabdariffa se caracterizan por presentar elevada acidez, que se atribuye a la presencia de diferentes ácidos carboxílicos, entre los que destacan los ácidos succínico y oxálico, además del ascórbico (Wong et al., 2002). La acidez es determinante para el sabor de las bebidas preparadas a partir de los cálices de esta planta, por lo que se relaciona con la aceptabilidad por el consumidor (Bechoff et al., 2014); sin embargo, a pesar de la importancia de la acidez en la aceptabilidad de los productos elaborados a partir de los cálices, poco se ha estudiado la relación entre la composición de los ácidos orgánicos, la acidez y la influencia del ambiente de producción sobre estas variables.
En México, la producción comercial de cálices de H. sabdariffa se realiza a partir de genotipos denominados criollos, que además de presentar bajos rendimientos, difieren fenotípicamente en forma, tamaño, color (Torres-Morán et al., 2011), y contenido de compuestos fenólicos de interés nutracéutico. Un factor relevante para mejorar la competitividad del cultivo de jamaica en México es la obtención de variedades mejoradas adaptadas a las diferentes zonas productoras; de igual relevancia es identificar los sitios de producción con mayor potencial para la acumulación de bioactivos en los cálices. Por lo anterior, los objetivos del trabajo fueron evaluar los efectos del genotipo, el ambiente y su interacción en los contenidos de compuestos fenólicos, antocianinas, y el porcentaje de acidez titulable, así como, el perfil por cromatografía líquida de alta resolución (HPLC) de antocianinas y ácidos carboxílicos de cadena corta, como atributos de calidad en dos genotipos de jamaica.
Materiales y métodos
Material vegetal y sitios de estudio
Se utilizaron los genotipos de Hibiscus sabdariffa L. Negra Quiviquinta (NQ) (cálices oscuros) y UAN 8 (cálices claros), sembrados en tres localidades de estados mexicanos con tradición en la producción de jamaica. La información sobre el nombre de las localidades y algunas de sus variables agroclimáticas se presenta en el Cuadro 1.
Cuadro 1 Coordenadas geográficas y algunas variables ambientales de las localidades en las que se cultivaron las variedades de jamaica.
| Estado | Localidad | Coordenadas geográficas | Altitud (msnm) |
FTP (h) |
TMA (ºC) |
PPMA (mm) |
|
|---|---|---|---|---|---|---|---|
| LN | LO | ||||||
| Colima | Comala | 19º 18’ 19.36” | 103º 45’ 12.03” | 735 | 12.96 | 25.3 | 842 |
| Puerta de Anzar | 19º 07’ 14.81” | 103º 32’ 57.00” | 466 | 12.95 | 26.6 | 623 | |
| Trapichillos | 19º 09’ 38.00” | 103º 31’ 32.00” | 552 | 12.95 | 24.8 | 1045 | |
| Nayarit | Jala | 21º 5’ 23.15” | 104º 26’ 18.32” | 1071 | 13.06 | 23.2 | 881 |
| Quiviquinta | 22º 43’ 45.98” | 105º 20’ 7.10” | 97 | 13.15 | 27.4 | 1162 | |
| Xalisco | 21º 27’ 2.71” | 104º 53’ 55.94” | 1194 | 13.08 | 22.8 | 1255 | |
| Oaxaca | Los Limones | 16º 01’ 34.27” | 97º 29’ 34.95” | 101 | 12.78 | 22.1 | 1007 |
| Río Grande | 16º 00’ 37.57” | 97º 26’ 0.63” | 70 | 12.78 | 27.3 | 1221 | |
| Sta. María Tonameca | 15º 44’ 47.69’’ | 96º 32’ 46.56’’ | 37 | 12.77 | 26.8 | 790 | |
FTP: fotoperiodo; TMA: temperatura media anual; PPMA: precipitación media anual.
Manejo del cultivo
Los experimentos se establecieron en monocultivo bajo condiciones de temporal en el ciclo PV 2015. La siembra se realizó una vez establecido el temporal, en la primera semana de julio. El manejo agronómico aplicado en los experimentos fue el que se practica en cada región de producción. La fórmula de fertilización utilizada fue 40N-40P-00K. Se aplicaron 100 unidades de N por ha; 50 % a los 20 días después de la siembra (dds) y el resto en la floración. El fósforo se aplicó a los 20 dds. El control de malezas se efectuó de manera manual. La principal plaga que se presentó fue la hormiga arriera (Atta sp.), que se controló con aplicación del insecticida Patrón (Imidacloroprid 0.35 %) al esparcir 100 g de polvo alrededor de cada agujero o “casa de arriera”.
Preparación del extracto acuoso
Se empleó la metodología descrita por Galicia-Flores et al. (2008). A 2.5 g de cálices secos se le adicionaron 100 mL de agua destilada; la mezcla se llevó a ebullición por 15 min; se separó el extracto por decantación. El procedimiento se realizó por duplicado. Se reunieron los extractos y se filtraron con papel Whatman No. 4 para aforar a 200 mL con agua destilada. Los extractos se almacenaron en refrigeración y fueron analizados dentro de los tres días inmediatos. A partir de estos extractos se realizaron todas las determinaciones, excepto la cuantificación y análisis de ácidos carboxílicos.
Porcentaje de acidez titulable (PAT)
Se determinó con el método 942.15 descrito por la AOAC (2015). Una alícuota de 10 mL de extracto se diluyó a 200 mL con agua destilada. Se usó fenolftaleína como indicador y se tituló con NaOH (JT Baker®) 0.1 N previamente valorada. El PAT se expresó en función del ácido cítrico y en base seca. Esta determinación se realizó por triplicado.
Contenido total de antocianinas (AT)
Se midió la absorbancia del extracto acuoso previamente preparado a 520 nm en un espectrofotómetro (PerkinElmer® Lambda 25 UV/Vis, Waltham, MA, USA). Para su cuantificación se elaboró una curva estándar (Y = 0.0464x-0.0034; R2 = 0.9997) con cianidina 3-glucósido (Polyphenols®, Nw). El contenido se expresó como mg equivalentes de cianidina 3-glucósido (EC3G) por 100 g de materia seca (mg EC3G 100 g-1 MS) (Galicia-Flores et al. (2008).
Compuestos fenólicos solubles totales (CFST)
Se usó el método de Folin-Ciocalteu (Singleton y Rossi, 1965). A 100 µL del extracto acuoso se adicionaron 125 µL de reactivo Folin-Ciocalteu (Sigma Aldrich, MA), se agitó y dejó reaccionar por 6 min en oscuridad; después se neutralizó con 1250 µL de carbonato de sodio al 19 %. El volumen se ajustó a 3 µL con agua destilada. La muestra se agitó y se mantuvo por 90 min en oscuridad. La absorbancia se midió en un espectrofotómetro (PerkinElmer Lamda 25 UV/Vis, Walthon, MA, USA) a una longitud de onda de 760 nm. Los resultados se expresaron en mg equivalentes de ácido gálico por 100 g de muestra seca (mg EAG 100 g-1 MS) para lo cual se elaboró una curva patrón (Y = 0.0023X - 0.0015; R2 = 0.999) de ácido gálico (20-100 ppm).
Perfil de antocianinas por cromatografía líquida de alta resolución (HPLC)
Se utilizó un equipo PerkinElmer® Series 200 equipado con una columna C18 hypersil ODS (200 × 4.6 mm, 5 µm). La metodología de análisis empleada fue la descrita por Fossen et al. (2001), que utiliza un sistema de gradientes con dos eluyentes: A, ácido fórmico (Merck):agua (JT Baker) (1:9 v/v); y B, ácido fórmico:agua:metanol (JT Baker) (1:4:5 v/v/v). Todos los disolventes utilizados fueron grado HPLC. Una alícuota del extracto acuoso filtrada en un acrodisco de nylon 0.45 mm (Titan2®) se guardó en un vial ámbar a 4 ºC hasta su análisis. El volumen de muestra inyectado fue de 10 mL, la velocidad de flujo 1.2 mL min-1 y el tiempo de corrida de 21 min. La temperatura de la columna se mantuvo a 25 ºC y la detección de las antocianinas se efectuó a 520 nm en un detector UV-vis con arreglo de diodos. La identidad de las antocianinas se obtuvo mediante los espectros de UV-visible obtenidos con el detector de arreglo de diodos, el uso de estándares comerciales (cianidina 3-glucósido, Sigma) y la información de trabajos publicados (Ifie et al., 2018; Rodríguez-Medina et al., 2009).
Extracción de ácidos carboxílicos de cadena corta
Los cálices secos se molieron en un molino de martillos (IKA®, modelo MF 10, China), equipado con una malla de 0.5 mm. Las harinas se deshidrataron hasta llegar a peso constante en una estufa de convección a 40 ºC. La extracción se realizó a partir de 0.5 g de harina y 25 mL de agua bidestilada. La mezcla se colocó en baño ultrasónico (Branson® 2510, Dallas, TX, USA) durante 15 min y posteriormente en agitación por 30 min (Gyratory Shaker®, modelo G10, Belle Mead, NJ, USA), para después refrigerarse a 4 ºC por 90 min. La muestra se filtró en papel Whatman No. 4 y se aforó a 25 mL con agua bidestilada. Una alícuota de 2 mL de esta muestra se filtró con acrodisco (Titan2) de membrana de nylon de 0.45 µm, y se colocó en vial ámbar para mantenerlo en refrigeración a 4 ºC hasta su análisis por HPLC.
Análisis de ácidos carboxílicos de cadena corta por HPLC
Se utilizó el mismo equipo de HPLC usado para el análisis de antocianinas. Las condiciones de trabajo se estandarizaron según lo descrito por Cen et al. (2007), con algunas modificaciones. Como fase móvil se empleó una mezcla de fosfato de potasio 0.01M (pH 2.4, ajustado con ácido fosfórico) y metanol grado HPLC en proporción 95:5 (v/v). Se utilizó una columna C18 Hypersil ODS (200 × 4.6 mm, 5 µm) a 30 ºC, el flujo de elución fue 1.0 mL min-1, con un tiempo de corrida de 10 min y un volumen de inyección de 10 µL. La detección se realizó a una longitud de onda de 214 nm con el mismo detector utilizado para antocianinas. Se utilizaron estándares comerciales de los ácidos orgánicos málico, cítrico, oxálico, succínico y tartárico (Sigma, USA) para preparar las curvas patrón y calcular el contenido de cada ácido en el extracto.
Análisis estadístico
Los resultados del contenido de CFST, AT y PAT fueron sometidos a un análisis combinado mediante el modelo de efectos principales aditivos e interacción multiplicativa (AMMI, por sus siglas en inglés), mediante el método de medias ajustadas, para estimar la influencia del genotipo, la localidad y su interacción. Luego se realizó una comparación múltiple de medias con la prueba de Tukey (P ≤ 0.05) para identificar diferencias estadísticas entre los genotipos y las localidades evaluadas. El paquete estadístico empleado fue SAS System Versión 9.4.
Resultados y discusión
El análisis AMMI mostró que todos los factores de variación debidos a tratamientos (genotipo, ambiente y la interacción entre ambos) tuvieron un efecto significativo (P ≤ 0.01) en las variables evaluadas (Cuadro 2). De acuerdo con las sumas de cuadrados, los contenidos de CFST y AT estuvieron influenciados principalmente por el genotipo; este factor explicó 67 % de la variación observada; la localidad y la interacción G × A fueron responsables de 16 y 17 %, respectivamente, de la variación restante en el CFST, y 21 y 12 % de la variación en el contenido de AT. Al respecto, Ottai et al. (2004) reportaron un efecto altamente significativo de la localidad, el genotipo y la interacción entre ambos factores sobre el contenido de AT en variedades de jamaica cultivadas en Egipto.
Cuadro 2 Sumas de cuadrados resultantes del análisis AMMI para contenido de compuestos fenólicos solubles totales (CFST), antocianinas totales (AT) y porcentaje de acidez titulable (PAT) de cálices deshidratados de dos genotipos de Hibiscus sabdariffa cultivados en nueve localidades.
| Fuente de variación | GL | Sumas de cuadrados | |||||
|---|---|---|---|---|---|---|---|
| CFST | % | AT | % | PAT | % | ||
| Genotipo (G) | 1 | 8,070,287** | 67 | 2,815,248** | 68 | 47** | 4 |
| Ambiente (A) | 8 | 1,971,888** | 16 | 843,075** | 21 | 799** | 77 |
| Interacción (G × A) | 8 | 2,007,202** | 17 | 463,566** | 12 | 194** | 19 |
**Significancia P ≤ 0.01.
En contraste, el porcentaje de acidez titulable (PAT) fue mayormente afectado por el ambiente (77 %), seguido de la interacción (19 %) y del genotipo (5 %) (Cuadro 2). Ottai et al. (2004) reportaron un efecto elevado de la localidad (89 %) en los valores de PAT en cálices de Jamaica; sin embargo, Salinas-Moreno et al. (2012) reportaron una correlación significativa entre el cultivar y el nivel de acidez titulable, con un número más amplio de cultivares, crecidos en un mismo sitio.
Los estudios sobre efecto del ambiente de producción en la composición fenólica de los cálices y su acidez son escasos; la mayoría se han realizado en países como Egipto (Ottai et al., 2004) y Senegal (Juliani et al., 2009), que son grandes productores de cálices de jamaica. Para otros cultivos de clima templado se ha reportado mayor acumulación de antocianinas en ambientes de alta luminosidad y baja temperatura (Jaakola y Hohtola, 2010), pero en cultivos como la jamaica, con adaptación a ambientes tropicales donde prevalecen alta temperatura y elevada luminosidad, no se ha estudiado con detalle el efecto de estos dos factores, por lo que es un área que requiere mayor investigación.
Contenido de compuestos fenólicos solubles totales (CFST)
La variación del CFST por localidad en los genotipos NQ y UAN 8 se muestra en la Figura 1. El genotipo fue el principal factor de variación para esta variable, ya que NQ presentó niveles 25 % más altos que UAN 8. Los coeficientes de variación de 7.0 y 9.0 % mostraron en ambos genotipos una variación semejante a través de los ambientes. La localidad de Santa María Tonameca, Oaxaca fue la más favorable para la acumulación de CFST en ambos genotipos. En las que menor acumulación se observó fue en Comala, Colima para NQ y Río Grande, Oaxaca para UAN 8. Los valores de CFST obtenidos en este estudio son comparables a los reportados por Juliani et al. (2009) en variedades cultivadas en Senegal (1000 a 3300 mg EAG 100 g-1 MS) determinados en cálices molidos y metanol acuoso como disolvente de extracción, y a los encontrados por Reyes-Luengas et al. (2015) en cálices enteros de variedades mexicanas utilizando agua como disolvente de extracción (1550 a 3650 mg EAG 100 g-1 MS).
Contenido de antocianinas totales (AT)
El promedio de AT por ambientes para NQ fue 718 ± 184 mg EC3G 100 g-1 MS, que superó 2.2 veces al registrado para UAN 8 (323 ± 73 mg EC3G 100 g-1 MS), por lo que el efecto del genotipo fue determinante para esta variable. El genotipo NQ en las localidades de Xalisco y Quiviquinta, Nayarit fue el que acumuló mayor contenido de AT, mientras que en las localidades Los Limones, Oaxaca y Comala, Colima registró los valores más bajos. En UAN 8, los valores mayores de AT se observaron en Jala y Xalisco, Nayarit y los menores se presentaron en Puerta de Anzar, Colima y Los Limones, Oaxaca (Figura 2). La variación en el contenido de AT entre localidades para el genotipo NQ fue de hasta 220 %, mucho mayor a la mencionada (70 %) por Juliani et al. (2009), pero similar a la reportada por Ottai et al. (2004), quienes informaron diferencias de hasta 194 %. El valor de AT (1099 ± 34 mg EC3G 100 g-1 MS) reportado para cálices de jamaica rojo oscuro (Reyes-Luengas et al., 2015) es parecido al observado para NQ en las localidades de Quiviquinta y Xalisco, Nayarit.
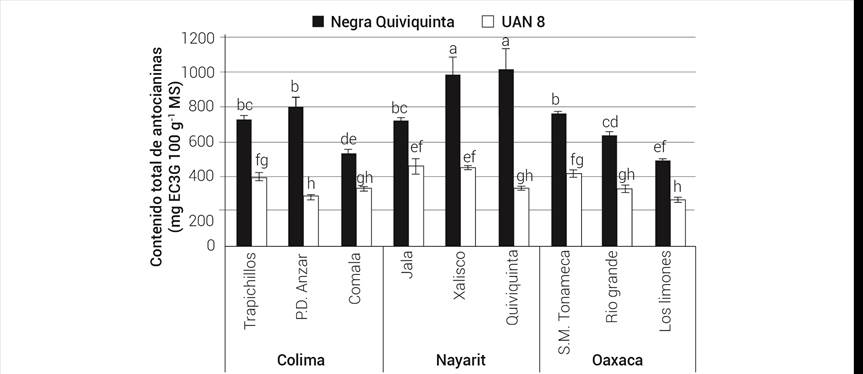
Figura 2 Efecto del genotipo y del ambiente sobre el contenido de antocianinas totales (AT) en los cálices de dos variedades de Hibiscus sabdariffa.
La localidad más favorable para la acumulación de AT en ambos genotipos fue Xalisco, Nayarit en tanto que Los Limones, Oaxaca fue la menos favorable. De acuerdo con la información del Cuadro 1, la principal diferencia entre ambas localidades fue el fotoperiodo, con un valor más alto en Xalisco. La jamaica es un cultivo sensible a este factor y requiere un periodo de 12.5 a 13.5 h luz por día para que ocurra la inducción floral. No se localizaron reportes publicados de que esta variable esté asociada con la acumulación de antocianinas en jamaica; sin embargo, Ifie et al. (2018) reportaron 30 % más antocianinas en los cálices de jamaica de una variedad cultivada en la estación seca (octubre-marzo) con respecto a la estación húmeda (marzo-julio). Los autores no precisan si estas diferencias se originan por las condiciones de temperatura y luminosidad prevalecientes en cada estación. En la ruta biosintética de antocianinas participan varias enzimas, de las cuales, la inicial es la fenilalanina amonio liasa (PAL) y la terminal, la antocianidina 3 glucosil transferasa (3GT) (Zhang et al., 2014b). La sensibilidad de cada una de estas enzimas a factores como luz y temperatura varía según la especie. En Hibiscus sabdariffa se ha reportado que la PAL no es sensible a la luz, en tanto que la chalcona sintasa es muy sensible (Mizukami et al., 1989), por lo que se requieren más estudios para entender la participación de los factores del ambiente antes señalados en la síntesis y acumulación de antocianinas en esta especie.
El uso de genotipos con alto contenido de fitoquímicos es conveniente para la industria que utiliza los cálices de jamaica como fuente de productos de valor nutracéutico y medicinal. La variedad Negra Quiviquinta cumple con este criterio al tener un elevado contenido de CFST, en los que están incluidas las antocianinas. La fracción de CFST también contiene compuestos astringentes, como proantocianidinas y ácidos fenólicos, diferente a la de antocianinas (Reyes-Luengas et al., 2015) que contribuyen al sabor y palatabilidad de sus derivados.
Perfil cromatográfico de antocianinas
El perfil de antocianinas fue similar entre los genotipos de jamaica evaluados (NQ y UAN 8) y estuvo representado por cinco antocianinas, de las cuales delfinidina 3-sambubiósido (D3S, pico 2) y cianidina 3-sambubiósido (C3S, pico 5) fueron las de mayor proporción relativa (Figura 3). Los picos 1 y 3 no fueron identificados; sin embargo, según Ifie et al. (2016), el pico 3 podría corresponder a delfinidina 3-glucósido. El pico 4 corresponde a cianidina 3-glucósido, que presentó el mismo tiempo de retención y espectro de UV-visible que el estándar comercial. El perfil de antocianinas (número de antocianinas presentes), no se modificó entre localidades, únicamente los porcentajes relativos. La variación entre localidades para las antocianinas D3S y C3S se muestra en el Cuadro 3. Independientemente del genotipo, D3S mostró una variación entre 52.2 y 71.6 %, en tanto que C3S varió desde 23.5 hasta 37.0 %. Para NQ, la mayor variación se presentó en las localidades de Nayarit y Colima, mientras que en UAN 8 fue en las localidades de Colima y Oaxaca.

Figura 3 Perfil cromatográfico de antocianinas identificadas en el extracto acuoso de cálices de Hibiscus sabdariffa del genotipo Negra Quiviquinta. Las antocianinas detectadas fueron: 1) no identificada, 2) delfinidina 3-sambubiósido, 3) delfinidina 3-glucósido, 4) cianidina 3-glucósido y 5) cianidina 3-sambubiósido.
Cuadro 3 Contenido relativo de las antocianinas predominantes (D3S y C3S) en extractos acuosos de cálices deshidratados de dos genotipos de Hibiscus sabdariffa cultivados en diferentes localidades.
| Variedad | Estado | D3S (%) | C3S (%) |
|---|---|---|---|
| Negra Quiviquinta | Oaxaca | 60.0 - 62.2 | 34.2 - 37.0 |
| Nayarit | 61.6 - 71.6 | 23.5 - 30.8 | |
| Colima | 58.6 - 63.7 | 29.4 - 34.1 | |
| UAN 8 | Oaxaca | 52.7 - 62.5 | 31.1 - 43.2 |
| Nayarit | 55.2 - 63.7 | 31.7 - 40.5 | |
| Colima | 53.5 - 71.4 | 24.7 - 41.9 |
3S: delfinidina 3-sambubiósido; C3S: cianidina 3-sambubiósido.
Los porcentajes relativos de las antocianinas dominantes en los genotipos de jamaica son comparables con lo reportado por Borrás-Linares et al. (2015) y Galicia-Flores et al. (2008) para genotipos nacionales, aunque estos últimos autores reportaron una variación más amplia en los porcentajes de D3S (46 a 82 %) y C3S (18 a 54 %). Estos resultados se pueden atribuir al efecto del ambiente de cada localidad. Aunque también el método de deshidratación de los cálices puede influir. El proceso de deshidratación de los cálices a temperaturas elevadas y periodos prolongados de exposición a la luz podría causar la degradación de estos metabolitos, con un efecto mayor en D3S por ser más susceptible que C3S (Leyva et al., 2012).
Porcentaje de acidez titulable (PAT)
El efecto dominante del factor ambiental sobre el PAT (Cuadro 2), atributo del sabor agradable de los extractos acuosos de H. sabdariffa se muestra con los resultados de la interacción G × A (Figura 4). Ninguna de las variedades predominó con alto PAT en todos los ambientes evaluados. En las localidades de los estados de Colima y Oaxaca los valores de PAT fueron menores, donde sólo UAN 8 en Comala, Colima sobresalió con 25.7 % y en Río Grande, Oaxaca con 24.3 %. Fue en la localidad Los Limones, Oaxaca donde se registraron los PAT más bajos para ambos genotipos (11.3 y 16.1 %).
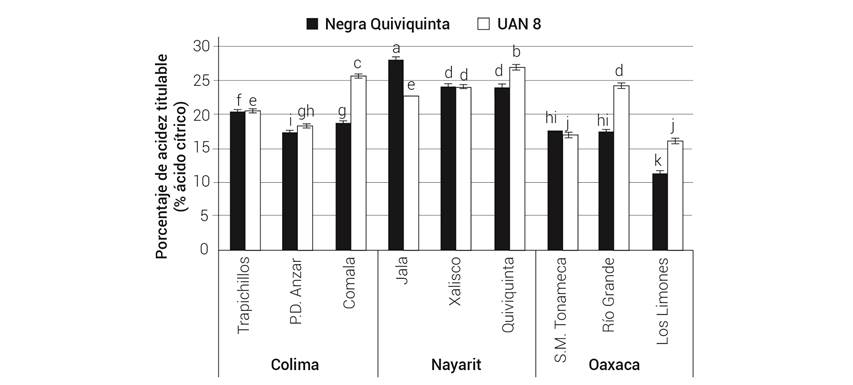
Figura 4 Efecto del genotipo y localidad en el porcentaje de acidez titulable de los cálices en dos genotipos de Hibiscus sabdariffa.
Los resultados obtenidos muestran que el nivel de acidez en los genotipos de jamaica cambia en función del sitio de producción, posiblemente porque el ambiente afecta la expresión génica de enzimas involucradas en la síntesis de los ácidos orgánicos. Trabajos como los de Galicia-Flores et al. (2008) y Salinas-Moreno et al. (2012) en variedades de H. sabdariffa cultivadas en un mismo sitio, reportan mayor acidez en las variedades de cálices claros en relación con las de cálices oscuros, lo cual coincide con lo encontrado en el presente estudio. Los consumidores prefieren variedades cuyos cálices presenten una acidez elevada, por lo que para este propósito, las localidades más adecuadas serían las del estado de Nayarit.
Análisis de ácidos carboxílicos (AC)
El perfil cromatográfico de los AC presentes en los genotipos NQ y UAN 8 estuvo integrado por seis picos que fueron identificados como: 1) ácido oxálico, 2) ácido tartárico, 3) ácido málico, 4) ácido cítrico y 5) ácido succínico, además de la presencia de otro ácido que no fue identificado (NI) (Figura 5). El contenido promedio de AC fue igual (P ≥ 0.05) entre genotipos (Cuadro 4). En ambos, el ácido oxálico se encontró en menor concentración y el succínico en mayor. Los contenidos de los ácidos oxálico, tartárico, málico y succínico fueron similares entre genotipos. El efecto de localidad sobre el contenido de los ácidos carboxílicos analizados fue mayor en la variedad NQ que en UAN 8, al presentar la variedad NQ mayores variaciones entre las diferentes localidades en el contenido de cada uno de los ácidos analizados.

Figura 5 Perfil cromatográfico de ácidos carboxílicos de cálices de Hibiscus sabdariffa L. (genotipo NQ, localidad Comala). La identidad de los picos es: 1) ácido oxálico, 2) ácido tartárico, 3) ácido málico, 4) ácido cítrico y 5) ácido succínico. NI: no identificado.
Cuadro 4 Concentración de ácidos orgánicos identificados en extractos acuosos de dos variedades de Hibiscus sabdariff a L., cada una crecida en cinco localidades.
| Genotipo | Localidad | Ácidos orgánicos de bajo peso molecular | Total | ||||
| Oxálico | Tartárico | Málico | Cítrico | Succínico | |||
| mg 100 g-1 MS | |||||||
| NQ | Comala | 1.6 ± 0.0 f† | 82.9 ± 0.2 ab | 56.7 ± 0.7 de | 13.0 ± 0.5 d | 600.5 ± 2.5 b | 754.5 ± 3.5 b |
| Jala | 2.4 ± 0.1 de | 79.1 ± 1.4 b | 56.4 ± 0.6 de | 19.1 ± 0.6 b | 569.2 ± 16.8 bc | 726.2 ± 16.7 bc | |
| L. Limones | 2.1 ± 0.1 ef | 38.6 ± 1.9 d | 60.5 ± 2.3 cd | 20.5 ± 0.2 a | 199.0 ± 8.1 g | 320.5 ± 4.1 h | |
| Quiviquinta | 17.7 ± 0.3 a | 78.2 ± 0.8 b | 62.9 ± 13.3 cd | 14.2 ± 0.0 c | 373.3 ± 7.8 e | 546.3 ± 22.2 e | |
| Río Grande | 3.0 ± 0.1 bc | 47.5 ± 0.4 c | 37.2 ± 0.1 f | 6.9 ± 0.1 g | 802.9 ± 9.2 a | 897.4 ± 8.6 a | |
| Promedio | 5.3 ± 6.9 A | 65.2 ± 20.6 A | 54.7 ± 10.6 A | 14.7 ± 5.4 A | 509.0 ± 231 A | 649.0 ± 209.6 A | |
| UAN 8 | Comala | 2.9 ± 0.1 c | 47.1 ± 0.8 c | 78.1 ± 1.3 bc | 9.0 ± 0.1 ef | 553.3 ± 6.9 cd | 690.4 ± 4.7 c |
| Jala | 2.8 ± 0.1 cd | 87.2 ± 3.7 a | 111.7 ± 4.1 a | 9.6 ± 0.4 e | 313.9 ± 10.4 f | 525.1 ± 2.2 ef | |
| L. Limones | 1.8 ± 0.0 f | 45.0 ± 1.2 cd | 31.3 ± 1.4 f | 9.2 ± 0.0 ef | 524.3 ± 2.5 d | 611.5 ± 2.4 d | |
| Quiviquinta | 3.2 ± 0.1 bc | 82.7 ± 1.6 ab | 90.6 ± 0.8 b | 8.4 ± 0.1 f | 308.2 ± 5.4 f | 493.0 ± 2.7 fg | |
| Río Grande | 3.5 ± 0.1 b | 45.0 ± 1.3 cd | 40.1 ± 1.7 ef | 6.4 ± 0.2 g | 361.2 ± 5.4 e | 456.0 ± 2.6 g | |
| Promedio | 2.8 ± 0.6 A | 61.4 ± 21.6 A | 70.4 ± 32.1 A | 8.5 ± 1.3 B | 412.2 ± 118 A | 555.2 ± 89.5 A | |
| DSH Genotipos | 4.4 | 18.7 | 22.5 | 3.5 | 162.4 | 151.4 | |
| DSH Localidades | 0.5 | 6.5 | 18.0 | 1.1 | 33.6 | 38.0 | |
†: Valores con la misma letra en la misma columna no son estadísticamente diferentes (P ≤ 0.05), de acuerdo con la prueba de Tukey. Las letras mayúsculas representan las diferencias entre genotipos y letras minúsculas las diferencias entre localidades. DSH: diferencia significativa honesta.
En NQ el contenido más elevado de AC se presentó en la localidad de Río Grande, Oaxaca; el menor se observó en la localidad de Los Limones, Oaxaca. El genotipo UAN 8 mostró el mayor contenido de AC cuando se cultivó en Comala, Colima, y el menor se presentó en Río Grande, Oaxaca.
La presencia de ácidos como cítrico, málico, tartárico, oxálico, succínico, fórmico, acético e hibísico ha sido reportada previamente en cálices de H. sabdariffa (Ibrahim et al., 2015; Wong et al., 2002). Estos ácidos se consideran los principales responsables de la acidez de los extractos acuosos de cálices de jamaica. La predominancia de un ácido puede depender de varios factores; según Cisse et al. (2009), los ácidos málico y oxálico son predominantes y pueden representar hasta 70 % del total de ácidos carboxílicos de cadena corta (ACCC) en cálices de H. sabdariffa. Wong et al. (2002) señalaron que los ácidos succínico y oxálico fueron los más abundantes en un genotipo cultivado en Malasia, con contenidos de 510 y 430 mg 100 g-1, respectivamente. Ibrahim et al. (2015) también reportaron la predominancia de los ácidos oxálico (342.5 mg 100 g-1) y succínico (449 mg 100 g-1). En la presente investigación los ácidos predominantes fueron el succínico, málico y tartárico, en tanto que el oxálico fue el que se encontró en menor concentración. Las diferencias pueden atribuirse al genotipo y a la interacción genotipo ambiente, que puede alterar la proporción relativa de los principales ácidos en los cálices de jamaica. Hasta ahora no existen trabajos del análisis de ACCC en los cálices de jamaica que consideren como factores el tipo de suelo y la fertilización.
Conclusiones
La composición fenólica y acidez de los cálices de jamaica fueron modificadas por los factores genotipo, localidad y su interacción. El factor principal que afectó el contenido de antocianinas y compuestos fenólicos solubles totales fue el genotipo, mientras que la acidez fue modificada principalmente por el ambiente de producción. De acuerdo con las variables contenido de antocianinas totales y porcentaje de acidez, el mejor genotipo fue Negra Quiviquinta y la localidad de Xalisco, Nayarit, la que más favoreció los niveles mayores de estas variables de calidad. De los ácidos carboxílicos, el succínico fue el que se encontró en mayor concentración. Los contenidos relativos de las antocianinas y de los ácidos carboxílicos identificados se vieron alterados por efecto de la localidad.











 nova página do texto(beta)
nova página do texto(beta)



