Introducción
El café (Coffea arabica) es considerado el motor económico de muchos países localizados en las zonas tropicales del mundo, y representa el segundo producto más comercializado a nivel mundial, sólo después del petróleo (Figueroa-Hernández et al., 2015). El aumento en el consumo mundial del café es impulsado principalmente por la creciente demanda en los países productores y en los mercados emergentes como Rusia, China y Corea del Sur, entre otros, siendo México el onceavo productor a nivel mundial de café (SAGARPA, 2018). En México el café representa una actividad estratégica que emplea a más de 500 mil productores, en cerca de 690 mil hectáreas de 12 entidades federativas y 391 municipios que involucra exportaciones por 897 millones de dólares estadounidenses al año, además de que es el principal productor de café orgánico del mundo, cultivado en el 10 % de la superficie nacional. Adicionalmente, la cadena de valor del café vincula directa e indirectamente a cerca de tres millones de personas (Figueroa-Hernández et al., 2015).
Las especies de café con mayor importancia económica son arábica (Coffea arabica) y robusta (Coffea canephora) (FAS/USDA, 2013). En grano, el contenido de cafeína de arábica oscila entre 0.9 y 1.5 % mientras que robusta tiene ente entre 2 y 4.5 % en base seca.
Si bien hay discrepancia con respecto a los posibles efectos benéficos del café en la salud humana (Valdés et al., 2018), en los últimos años, y con nuevas metodologías para determinar concentraciones de compuestos nutracéuticos en granos y sus efectos en el metabolismo de células humanas, se ha comprobado que este grano puede contribuir a prevenir enfermedades cardiovasculares y neurológicas, servir como fuente de antioxidantes y mejorar el desempeño del cuerpo humano en general (Echeverri et al., 2005).
La cafeína se encuentra no sólo en el grano de café, sino también en la pulpa de los frutos, en raíces y hojas de la planta (Zheng y Ashihara, 2004). En hojas de café se ha observado que la concentración de cafeína es más alta durante las etapas tempranas de desarrollo (130 μmol mg-1 PS) y disminuye a medida que avanza la maduración y senescencia de la hoja (73.6 μmol mg-1 PS) (Campa et al., 2017).
De acuerdo con Clifford (1985), dentro de los compuestos presentes en el grano de café y que han generado mayor interés por sus propiedades antioxidantes, se encuentran los ácidos clorogénicos (40 ácidos, en grupos de isómeros con sustituciones en 1-, 3-, 4- ó 5- del ácido quínico). Su actividad antioxidante se ha asociado con la prevención de enfermedades como cáncer y diabetes (Kamiyama et al., 2015). Estudios recientes han revelado que los ácidos clorogénicos del café, principal fuente de ácidos clorogénicos de la dieta humana, regulan la presión sanguínea, lo que previene la hipertensión (Loader et al., 2017); además, el ácido clorogénico 5-cafeoil-quinico (5-CQA) es el que está en mayor concentración en los granos de café (Marín-García y Puerta-Quintero, 2008).
Los nutrimentos concentrados en una planta varían por diferentes causas, como la diferencia entre la absorción de nutrimentos y el crecimiento de la planta, así como a las fluctuaciones de estos elementos en la solución del suelo, afectadas por la lluvia, lo que produce mayor concentración o una dilución de los nutrimentos en los tejidos de la planta (Sadeghian y Salamanca, 2015). La translocación de los nutrimentos en la planta afecta la concentración de éstos en los diferentes tejidos, y en el caso de las hojas los requerimientos de nutrimentos cambian en su ciclo de vida y están estrechamente definidos por la etapa anual de la planta (Meza y Pire, 2008); un ejemplo de ello es la demanda de Ca y Mg, la cual no es tan alta en comparación con la de N y K; no obstante, son fundamentales para el desarrollo y desempeño adecuado del cultivo del café (Kadri et al., 2016) y cuya translocación de la solución del suelo a la planta y a la fijación de estos nutrientes en la biomasa del cultivo se reflejan en la edad y etapa fenológica de este cultivo (Ramírez et al., 2002; Sadeghian y Salamanca, 2015); además, las biomoléculas como clorofilas y azúcares fluctúan de acuerdo con la etapa de crecimiento y desarrollo de la hoja en la planta (Taiz et al., 2014). En las plantas de café, cuando las hojas terminan de crecer se convierten en fuentes potenciales de nutrimentos que son movilizados hacia los frutos y raíces, lo que conlleva a la reducción de éstos en la hoja (Sadeghian y Salamanca, 2015).
Carbohidratos como la glucosa son responsables de proporcionar sustrato para el desarrollo de flores y frutos (Rennie y Turgeon, 2009); además, la clorofila es uno de los antioxidantes con una amplia gama de beneficios, con efectos antigenotóxicos, anticancerígenos y antioxidantes (Nagini et al., 2015), y junto con los nutrimentos, algunos esenciales para la nutrición de la planta, también son necesarios para la salud humana; un ejemplo es el potasio, que es esencial para controlar el equilibrio de sal en el cuerpo humano, el zinc cuya importancia radica en el funcionamiento adecuado del sistema inmune o el calcio, el cual es importante en la estructura y formación ósea; éstos se encuentran en las plantas y las infusiones como el té (Camellia sinensis) y son fuentes importantes en la dieta humana (Misra et al., 2016), lo que hace necesario el estudio de estos en plantas con potencial beneficio a la salud como es la hoja del café (Campa et al., 2012).
Al ser Coffea arabica variedad Caturra roja uno de los tipos más cultivados en el país, es necesario generar un perfil detallado de nutrimentos y otros compuestos de interés nutracéutico, por lo que el objetivo de esta investigación fue medir el área foliar, concentraciones de clorofilas, cafeína, ácido clorogénico (5-CQA), azúcares reductores, así como macro y micronutrimentos en la variedad antes mencionada.
Materiales y métodos
Material vegetal y condiciones del experimento
El presente trabajo se realizó con plantas de café arábica (Coffea arabica) var. Caturra provenientes de la finca La Laja, ubicada en la congregación La Laja, municipio de Tlaltetela, Veracruz, México, que se localiza en la zona montañosa central del estado de Veracruz, a una latitud de 19º 17’ 10.8” N, longitud de 96º 56’ 51.9” O y a una altitud entre 1130 y 1250 msnm. Las plantas se cultivaron en sombra, se implementó el método tradicional selectivo (siembra, fertilización y poda), con plantaciones de 2000 a 2500 arbustos por hectárea, en suelos tipo cambisol. Las condiciones climáticas durante el periodo del experimento indicaron que el mes más seco fue febrero con una precipitación de 46 mm, y en junio la precipitación alcanzó su pico, con 358 mm. La precipitación anual fue de 1964 mm, donde destacaron los meses de mayo a octubre con mayores precipitaciones, las temperaturas mínimas promedio fueron de 9 ºC en el mes de febrero y máxima de 35 ºC en los meses de marzo y abril. La humedad relativa osciló entre 59 y 98 %, de acuerdo con datos generados por la estación climatológica de Huatusco, clave CLICOM 30342.
Se utilizaron plantas de café con cinco años de edad, de las cuales se muestrearon 10 de forma aleatoria en las hojas muestreadas del tercer par después de las hojas apicales. Las etapas del ciclo anual del cultivo evaluadas fueron: vegetativa (enero), floración (abril) y fructificación (noviembre).
Medición del área foliar
El área foliar se determinó con el uso de un medidor óptico de área foliar (Modelo CI-202, Washington, USA) que determina indirectamente el índice de área foliar (IAF) en cm2.
Cuantificación de clorofila a, b y total
Las determinaciones se realizaron en hojas maduras de café mediante la metodología descrita por Harborne (1984). El material vegetal se colocó en acetona al 80 % hasta su maceración (24 h), el contenido de clorofila se expresó con base en el peso de biomasa fresca (PBF) y se realizó en un espectrofotómetro (ThermoFisher®, Genesys 10S UV-VIS; China) a una absorbancia de 645 y 665 nm.
Concentración de 5-CQA y cafeína
El ácido clorogénico (5-CQA) se analizó en un HPLC (Dionex, ICS 3000; San José, CA, USA) equipado con un detector UV/VIS a una longitud de onda de 325 nm con una fase móvil isocrática compuesta de 75 % agua grado HPLC y 25 % metanol acidificado con H3PO4 con un flujo de 1.2 mL min-1, mediante una columna fase reversa Acclaim™ 120 C18 5 µm 4.6 × 150 mm (ThermoFisher® Sunnyvale, CA, USA) y una guarda columna ZORBAX C18 5 μm, 10 × 2 mm (Agilent technologies, Santa Clara, CA, USA), con una variación del método DIN 10767 (German Institute for Standardization, 1992).
La concentración de cafeína se determinó mediante una variación de la NMX-F-182-SCFI-2011 (Secretaría de Economía, 2011), que consistió en extraer la cafeína de la muestra mediante un termoreactor (Hach, DRB200; Loveland, CO, U.S.A.) a 135 ºC durante 5 min, la cuantificación se realizó en un HPLC Dionex ICS 3000 equipado con un detector UV/vis a una longitud de onda de 272 nm con una fase móvil isocrática compuesta de 75 % agua grado HPLC y 25 % metanol acidificado con H3PO4 que aplicó un flujo de 1.5 mL min-1 a través de una columna Acclaim™ 120 C18 5 µm 4.6 × 150 mm de la marca ThermoFisher® con H3PO4; se realizaron tres extracciones para correr las muestras por triplicado. Los resultados fueron expresados como porcentaje de peso de la materia seca (% PMS). Las curvas de calibración para ácidos clorogénicos y cafeína se realizaron con ocho puntos de concentración, (0.1, 0.08, 0.065, 0.05, 0.04, 0.02 y 0.005 %) por duplicado para comprobar la linealidad de los métodos. Para las respectivas curvas de calibración se utilizó ácido clorogénico ≥ 95 % CAS 327-97-9 (Sigma-Aldrich; Saint Louis, MO, USA) y cafeína ≥ 99 % CAS 58-08-2 C1778 (Sigma-Aldrich Saint Louis, MO, USA).
Cuantificación de carbohidratos
La cuantificación de carbohidratos se realizó con una variación de la norma ISO-11292-1195 (International Organization for Standardization, 1995) en un HPLC Dionex ICS 3000 equipado con un detector electroquímico, columna CarboPac PA1 2 × 250 mm, de la marca ThermoFisher® por medio de un flujo isocrático de 0.5 mL min-1 con agua grado HPLC como fase móvil y NaOH 300 mM para la reacción electroquímica postcolumna; los análisis se realizaron por triplicado. Los resultados fueron expresados como porcentaje de peso de la materia seca (% PMS), se realizó una curva de calibración con estándares de arabinosa, galactosa, glucosa, xilosa y fructuosa ≥ 95 %, marca Sigma-Aldrich (Saint Louis, MO, USA) en nueve diferentes concentraciones (0.1, 0.2, 0.5, 0.8, 1, 2, 3, 4 y 5 %).
Análisis de minerales
La concentración de los nutrimentos P, K, Ca, Mg, Fe, Cu, Zn, Mn, Fe y B se realizó siguiendo la metodología descrita por Alcántar y Sandoval (1999) por espectrofotometría de absorción atómica, el contenido de nitrógeno se realizó por el método micro-Kjeldahl (Bremner, 1965). Los resultados se expresan en g kg-1 para macronutrimentos y en mg kg-1 para micronutrimentos.
Análisis estadístico
Con los datos obtenidos se realizó un análisis de varianza con prueba de comparación de medias de Tukey (P ≤ 0.05) por medio del paquete estadístico SAS Ver. 9.3 (SAS Institute, 2011).
Resultados
Las plantas de café presentaron la mayor área foliar (64.25 cm2) en la etapa de floración, con diferencias estadísticas significativas con respecto a las otras etapas (Figura 1).
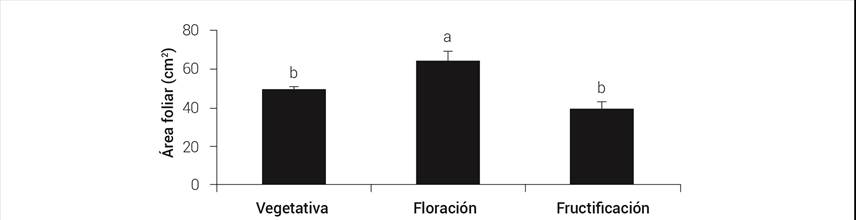
Figura 1 Área foliar en las distintas etapas del ciclo anual de café var. Caturra Rojo. Líneas sobre las barras ± DE con letra distinta indican diferencias estadísticas significativas (P ≤ 0.05).
Durante la etapa de floración de la planta de café se encontró la mayor concentración en clorofila a (2.11 mg g-1 PMF), b (0.79 mg g-1 PMF) y total (2.93 mg g-1 PMF), con diferencias estadísticamente significativas entre las etapas del ciclo anual analizadas (Figura 2).
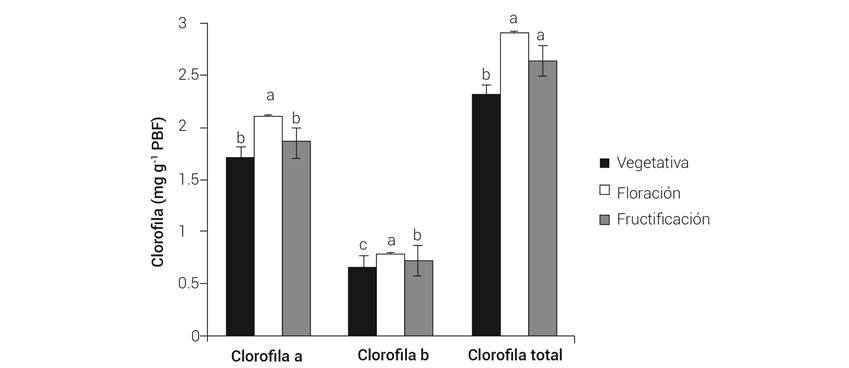
Figura 2 Concentración de clorofilas en hojas de café var. Caturra Rojo en las distintas etapas del ciclo anual. Líneas sobre las barras ± DE con letra distinta en cada tipo de clorofila indican diferencias estadísticas significativas (P ≤ 0.05).
La cafeína de las hojas de café durante las diferentes etapas del ciclo anual no presentó diferencias estadísticas significativas; sin embargo, los ácidos clorogénicos presentaron mayor concentración (1.02 %) en la etapa de floración (Cuadro 1).
Cuadro 1 Contenido de cafeína y ácido clorogénico (5-CQA) en hojas café var. Caturra Rojo durante el ciclo anual del cultivo.
| Etapa | Cafeína | 5-CQA |
|---|---|---|
| % ± DE | ||
| Vegetativa | 0.96 ± 0.03 a | 0.08 ± 0.01 b |
| Floración | 1.02 ± 0.06 a | 1.03 ± 0.06 a |
| Fructificación | 0.82 ± 0.05 a | 0.12 ± 0.01 b |
Medias con letra distinta en cada columna indican diferencias
estadísticas significativas (P ≤ 0.05).
Durante la etapa vegetativa, se observó en las hojas de café la mayor concentración en glucosa (9.65 %) y fructuosa (1.74 %). En cuanto al contenido de los otros azúcares no se observaron diferencias estadísticas significativas (Cuadro 2).
Cuadro 2 Contenido de azúcares reductores en hojas de café var. Caturra Rojo durante el ciclo anual del cultivo.
| Etapa | Arabinosa | Galactosa | Glucosa | Xilosa | Fructosa |
|---|---|---|---|---|---|
| % ± DE | |||||
| Vegetativa | 3.51 ± 0.20 a | 2.30 ± 0.13 a | 9.65 ± 0.20 a | 2.72 ± 0.13 a | 1.74 ± 0.13 a |
| Floración | 4.02 ± 0.08 a | 2.78 ± 0.13 a | 3.14 ± 0.08 b | 2.72 ± 0.13 a | 0.67 ± 0.13 b |
| Fructificación | 4.02 ± 0.20 a | 2.28 ± 0.13 a | 2.00 ± 0.20 b | 2.84 ± 0.10 a | 0.36 ± 0.13 b |
Medias con letra distinta en cada columna indican diferencias estadísticas significativas (P ≤ 0.05).
Durante la floración los macronutrimentos estuvieron en mayor concentración, mientras que en la etapa de fructificación, con excepción del nitrógeno, éstos se encontraron en las menores concentraciones (Figura 3).
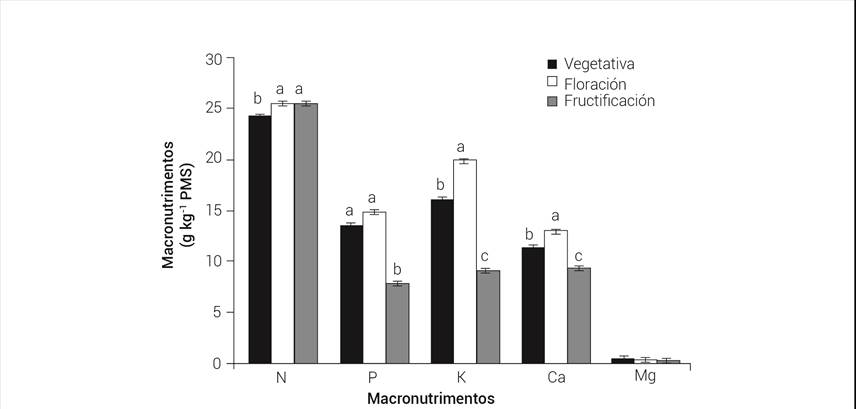
Figura 3 Concentración de macronutrimentos en hojas de café var. Caturra Rojo durante las etapas del ciclo anual del cultivo. Líneas sobre las barras con letra distinta en cada macronutrimento indican diferencias estadísticas significativas (P ≤ 0.05).
Las hojas de café durante la etapa vegetativa de la planta mostraron la mayor concentración de hierro (144.70 mg kg-1), en la floración destacaron por su concentración el cobre (6.56 mg kg-1), el zinc (11.04 mg kg-1) y el boro (35.02 mg kg-1) mientras que el manganeso fue el más abundante en las tres etapas evaluadas del cultivo, y el boro fue igual en las etapas de fructificación y floración de las hojas de café (Figura 4).
Discusión
De acuerdo con Valbuena et al. (2016), el índice de área foliar está relacionado con el desarrollo vegetativo, la eficiencia en la fotosíntesis, el uso del agua y nutrimentos, así como con la evapotranspiración.
Acosta et al. (2008) observaron diferencias altamente significativas en el área foliar de frijol (Phaseolus vulgaris L.) entre etapas del ciclo anual, con los valores más altos 20 días después del inicio de la floración, lo que coincide con los resultados obtenidos en café; además, las hojas protegen yemas, flores y frutos contra la radiación y condiciones climáticas perjudiciales. Rodríguez et al. (2016) observaron en el mismo genotipo utilizado en este estudio que la menor área foliar se encontró en la etapa de fructificación, lo que coincide con lo aquí encontrado, donde Caturra Rojo mostró la mayor área foliar (25.4 cm2) durante la floración, y señalan que durante la fructificación la formación y desarrollo de frutos requieren mayor energía y fotoasimilados, lo que compite con el crecimiento de las hojas, por lo que es en esta etapa donde se observa el menor desarrollo foliar.
DaMatta et al. (2002) observaron una correlación positiva entre la cafeína y el contenido de nitrógeno en hojas de café, por lo que es probable que la mayor concentración de clorofila en la etapa vegetativa de la variedad Caturra Rojo (3.263 mg g-1 PF) esté más ligada a efectos de temperatura y formación de hojas que al contenido de nitrógeno.
En las plantas de café Caturra Rojo la mayor concentración de ácido clorogénico (5-CQA) se encontró en la etapa de floración (1.053 %). Çιrak et al. (2007) encontraron que para que se presente la floración en las plantas se requiere de altos niveles de ácidos clorogénicos. Jeszka-Skowron y Zgoła-Grześkowiak (2014) reportaron concentraciones de 0.86 a 6.84 mg mL-1 de ácidos clorogénicos totales en el té verde, mientras que en hojas de café en este estudio se han encontrado concentraciones de 0.80 a 10.53 mg mL-1 de ácidos clorogénico (5-CQA), muy similares a lo reportado en hojas de té.
Campa et al. (2017) encontraron que las hojas más jóvenes de café arábica presentan la mayor concentración de cafeína (130 μmol mg-1), y que los niveles van disminuyendo a medida que las hojas maduran (91.7 μmol mg-1) y envejecen (73.6 μmol mg-1), lo que sugieren que, aunque en menor medida, la síntesis de cafeína sigue existiendo incluso después de la maduración de la hoja. Las hojas muestreadas en este estudio fueron del tercer par después de las hojas apicales, por lo que se consideran hojas que llegaron a la maduración, con un contenido de 1 % de cafeína, por lo que es probable que se encuentre mayor concentración de cafeína en hojas más jóvenes de las mismas plantaciones, por lo que se sugiere realizar evaluaciones de las hojas de diferentes edades en las plantaciones en estudio.
La disminución de glucosa y fructuosa durante la floración y fructificación en hojas de café revela la demanda de estos azúcares para el desarrollo de flores y posteriormente de frutos, lo que está de acuerdo con los resultados de Praxedes et al. (2006) quienes encontraron que la concentración de azúcares en la hoja aumenta con las condiciones de sequía y bajas temperaturas, lo que ayuda a la planta de café a regular la actividad fotosintética y fotorrespiratoria de acuerdo con las condiciones ambientales en las cuales se encuentre el cultivo, principalmente la temperatura (Mosquera-Sánchez et al., 1999). De acuerdo con Rennie y Turgeon (2009), los carbohidratos se exportan a partir de las hojas fotosintéticas, proporcionando el sustrato para el desarrollo y mantenimiento de los tejidos vegetales no fotosintéticos.
Por su parte, los minerales tienen funciones nutrimentales que son específicas en el metabolismo de las plantas; éstos funcionan como osmorreguladores, activadores de reacciones enzimáticas y constituyentes de estructuras orgánicas (Bustos et al., 2008).
De acuerdo con Reis et al. (2009), el nitrógeno en la planta del café tiene una fuerte relación de la hoja a la fruta, y es por ello que las plantas de café tienen un año de alto rendimiento, seguido por uno de baja producción, debido al agotamiento de reservas de asimilados y nutrimentos, en particular el N y K. Estudios realizados por Ramírez et al. (2002) mostraron que durante los primeros 90 días posteriores a la floración se acumula en las hojas el 50 % de los requerimientos totales de los nutrimentos, y que una vez que las hojas finalizan su expansión se convierten en potenciales exportadoras de nutrientes ya que la degradación de los compuestos contenidos en las células foliares maduras implica la translocación de fotoasimilados y nutrientes minerales móviles hacia órganos de demanda como frutos y raíces, con la consecuente disminución de éstos en la hoja.
Sadeghian y Salamanca (2015) observaron que en plantaciones de café las concentraciones foliares de Mn, Fe, B, Zn y Cu durante el periodo comprendido entre la floración y la fructificación cambiaron sin que se manifestara un patrón, por lo que atribuyeron estos cambios a las variaciones climáticas y a la disponibilidad de agua, lo que concuerda con lo observado en los resultados del presente estudio, donde la acumulación de los micronutrimentos no mostraron un patrón definido.
Meza y Pire (2008) opinan que la disminución en la concentración de micronutrimentos es debida a que el aumento de los requerimientos de la planta es mayor que la absorción de los mismos, lo que ocasiona la condición conocida como dilución de la concentración de nutrientes en los órganos de la planta.
Los principales minerales necesarios fisiológicamente para los procesos biológicos, funciones metabólicas, desarrollo y crecimiento son el calcio (Ca), magnesio (Mg), sodio (Na) y potasio (K), los cuales sirven para el mantenimiento del pH, la presión osmótica, producción de energía y en la mayoría los aspectos de la vida (Chekri et al., 2012).
Conclusiones
Las hojas de café Caturra Rojo en la etapa vegetativa presentaron las concentraciones más altas de glucosa, fructuosa y hierro, en la floración se presentó la mayor área foliar, contenido de cafeína, ácido clorogénico, galactosa, fósforo, potasio, magnesio, nitrógeno, zinc y boro, mientras que en la fructificación sobresalió el contenido de arabinosa y xilosa. Las hojas de café durante la floración tienen mayor potencial para utilizarse con fines nutracéuticos.











 nueva página del texto (beta)
nueva página del texto (beta)



