Introducción
Diferentes especies botánicas muestran acción reguladora sobre un gran número de plagas y enfermedades que perjudican a la agricultura y a la salud humana. Actualmente existe la necesidad de hacer frente al problema de la resistencia a los antibióticos y a la disminución del uso de fungicidas químicos en la agricultura, que ha llevado a los investigadores del área de alimentos, farmacéutica y agricultura a buscar nuevas fuentes, principalmente de origen vegetal, que contengan sustancias con actividad antimicrobiana (Medina et al., 2017; Sharifi-Rad et al., 2017) que ayuden a combatir enfermedades tanto en el ser humano como en la agricultura, mostrando grandes ventajas como eficacia, seguridad, bajos costos y disminución de la contaminación ambiental (Thombre et al., 2013).
Algunas bacterias como Escherichia coli, Micrococcus luteus, Salmonella enterica y Staphylococcus aureus pueden ser parte de la contaminación de los alimentos o del agua, y al ser consumidos por el ser humano ocasionan enfermedades que podrían causar hasta la muerte. Según estudios publicados por la Organización Mundial de la Salud (OMS), se estima que cada año enferman en el mundo 600 millones de personas -aproximadamente 1 de cada 10 habitantes- por ingerir alimentos contaminados y que 420 mil mueren por esta misma causa. Las infecciones diarreicas, que son las más comúnmente asociadas al consumo de alimentos contaminados, hacen enfermar cada año a 550 millones de personas y provocan 230 mil muertes. Los principales agentes causales involucrados en casos de hospitalización son Salmonella y Escherichia coli enterohemorrágica (OMS, 2017). En muchos países, sin embargo, se desconoce la incidencia exacta de las enfermedades ocasionadas por la ingestión de alimentos u otros causales, debido en parte a limitaciones del servicio de información epidemiológica y a dificultades por parte de los laboratorios para identificar los agentes causales.
La infección por E. coli se trasmite generalmente por consumo de agua o alimentos contaminados, como productos cárnicos poco cocidos y leche cruda, hortalizas y semillas germinadas crudas contaminadas (OMS, 2018; Solomon et al., 2002). M. luteus puede comportarse como patógeno oportunista en pacientes inmunodeprimidos; puede causar neumonía, meningitis, artritis séptica, bacteremia, sepsia relacionada con cateterismo y peritonitis vinculada con diálisis peritoneal ambulatoria continua (Winn et al., 2006). La salmonelosis es un grupo de infecciones producidas por bacilos del género Salmonella. Se asocia a síndromes febriles y manifestaciones gastrointestinales o sistémicas, donde gran parte es ocasionada por S. enterica (OMS, 2017). S. aureus forma comúnmente parte de la microflora humana, puede producir enfermedad mediante dos mecanismos, uno se basa en proliferar y propagarse por los tejidos, y el otro en su capacidad para producir toxinas y enzimas celulares (Lowy, 1998).
Las especies del hongo fitopatógeno Fusarium son conocidas como patógenos de plantas y alimentos; sin embargo, también pueden causar infecciones oportunistas en el hombre (Benadof, 2010). Las especies de Fusarium se encuentran en los cultivos antes de la cosecha y también persisten en los productos almacenados, si la actividad del agua lo permite se desarrollarán causando alteraciones y pueden producir micotoxinas. En la agricultura han llegado a ser fuente de grandes pérdidas económicas puesto que generalmente pueden afectar a los cultivos contaminándolos, marchitándolos, produciendo cambios de color, pudriéndolos o induciciendo necrosis vasculares; por ejemplo, F. verticillioides afecta al maíz (Zea mays), F. oxysporum f.sp. lycopersici daña al tomate (Solanum lycopersicum), F. tapsinum ataca al sorgo (Sorghum bicolor) y F. oxysporum afecta al maguey tequilero (Agave tequilana var. azul Weber) (Carrillo-Fasio et al., 2003; Pharand et al., 2002). Por lo tanto, es necesario buscar nuevas alternativas, sobre todo de origen orgánico o alternativo, para controlar, prevenir o combatir este tipo de microorganismos y consecuentemente, evitar posibles epidemias tanto para los cultivos como para el hombre.
Bajo este contexto, las plantas de la familia Lamiaceae, a la cual pertenece el género Vitex, son una fuente importante de moléculas bioactivas como glucósidos iridoides, flavonoides, derivados de diterpenoides, fitoesteroides, que han mostrado tener propiedades antimicrobianas (Medina et al., 2017; Meena et al., 2010; Sharifi-Rad et al., 2017; Sharma et al., 2017). Dentro de este género se encuentra la planta nativa de México Vitex mollis Kunth (Lamiaceae), comúnmente conocida como uvalamo. La mayoría de los estudios relacionados con esta planta han sido enfocados a la corteza del árbol o al fruto de uvalamo (Dimayuga et al., 1998). De acuerdo con Meena et al. (2011), algunas culturas indígenas de México consumían la fruta de V. mollis, así como otras partes de la planta, para tratar fiebre, diarrea, disentería y cólicos abdominales; sin embargo, las hojas y los tallos tienen escasos estudios, a pesar de que son los comúnmente utilizados para el tratamiento de diversos padecimientos como diarrea y disentería (Osuna et al., 2005), como antiespasmódico (Osuna et al., 2005), antiprotozoario (Tapia-Pérez et al., 2003), antioxidante (Cuevas-Juárez et al., 2014; Ruiz-Terán et al., 2008) y antiinflamatorio (Medina et al., 2017; Meena et al., 2011; Morales-Del Río et al., 2015; Ramírez-Cisneros et al., 2015); además, se ha sugerido la uvalama para el tratamiento de picaduras de escorpión y para aliviar los dolores menstruales (Meena et al., 2011). Por lo tanto, el objetivo de esta investigación fue determinar el efecto inhibitorio de extractos de V. mollis contra diferentes bacterias y especies de Fusarium de importancia en la salud humana y en la agricultura, así como determinar la composición química general de los extractos de las hojas y los tallos de la planta.
Materiales y métodos
Material vegetal y microbiológico
Las hojas y tallos de V. mollis Kunth se colectaron en enero de 2015 en el estado de Jalisco, México en las coordenadas 20º 21.6’ N y 102º 48’ O, a una altitud de 1800 m. La identificación taxonómica de la planta se realizó en el Instituto de Botánica de la Universidad de Guadalajara con número de registro 192,156. Las cepas bacterianas utilizadas fueron Escherichia coli (ATCC 25922), Micrococcus luteus (ATCC 9341), Salmonella enterica (ATCC 9270) y Staphylococcus aureus (ATCC 6638). Las diferentes especies de Fusarium pertenecen a la colección de hongos del Laboratorio de Fitopatología del Centro Universitario de la Ciénega de la Universidad de Guadalajara. Se utilizaron cuatro especies: F. verticillioides aislado de maíz, F. oxysporum f.sp. lycopersici aislado de tomate, F. tapsinum aislado de sorgo y F. oxysporum aislado de agave tequilero.
Obtención de extractos
Las hojas y los tallos recolectados se secaron en estufa a 45 ºC durante 48 h para posteriormente ser pulverizados. Se pesaron 4 g de cada una de las muestras y se adicionaron 15 mL de solvente (agua, metanol, acetona o hexano) homogeneizando por 20 s (IKA, Ultra-Turrax®, T-25 DS1, China). Después de sonicar por 20 min, las muestras se centrifugaron a 1753 × g durante 15 min a 4 ºC. Los sobrenadantes se filtraron y al sedimento obtenido se le realizó una segunda extracción a la que se le adicionaron 30 mL de solvente (agua, metanol, acetona o hexano) repitiendo los pasos desde la homogeneización. Una vez reunidos los sobrenadantes de los extractos, se procedió a la concentración de éstos en un rotavapor (Heidolph, 4003 VAC Senso T, Schwabach, Alemania); posteriormente, se resuspendieron en sus respectivos solventes para tener una concentración final homogénea en cada uno de ellos de 30 mg mL-1 (Morales-Del Río et al., 2015).
Análisis fitoquímico
El análisis fitoquímico se realizó a los extractos empleando técnicas simples, rápidas y selectivas para la determinación de fenoles y taninos (ensayo de cloruro férrico), flavonoides (ensayo de Shinoda), saponinas (prueba de espuma), alcaloides (ensayo de Dragendorff), triterpenos (ensayo de Liebermann-Buchard) y cumarinas (ensayo de Baljet) (Sánchez et al., 2010).
Cuantificación de fenoles totales
Se realizó por la técnica de Folin Ciocalteu (Mullen et al., 2007). Se tomaron 50 μL de extracto y se agregaron 3 mL de agua desionizada y 250 μL de Folin 1 N. Se dejó reposar por 5 min. Posteriormente, se adicionaron 750 μL de Na2CO3 al 20 % y 950 μL de agua desionizada. Se dejó reposar por 30 min y se determinó la absorbancia a 765 nm. Se realizó una curva con ácido gálico. Los resultados se expresaron como mg equivalentes de ácido gálico por g de muestra seca (mg EAG/g muestra seca).
Cuantificación de flavonoides totales
Los flavonoides totales se determinaron por el método reportado en Maksimović et al. (2005). Se tomaron alícuotas de 0.1 mL de extracto y fueron adicionadas a 1.4 mL de agua desionizada y 0.5 mL del reactivo de flavonoides (133 mg de tricloruro de aluminio, 400 mg de acetato de sodio en 100 mL de solvente constituido por 140 mL metanol, 50 mL agua y 10 mL ácido acético). Después de 30 min a temperatura ambiente se midió la absorbancia a 415 nm. Se realizó una curva utilizando el estándar quercetina. Los resultados se expresaron como mg equivalentes de quercetina por g de muestra seca (mg EQ/g muestra seca).
Actividad antibacteriana
Se utilizó la técnica de microdilución con la obtención de la concentración inhibitoria mínima (CIM). Se preparó el inóculo mediante reactivación de las cepas con solución de caldo Muller Hilton (CMH) y se incubó a 37 °C durante 24 h. Posteriormente, se ajustó cada cepa a 1 × 106 CFU mL-1 y se midió su densidad óptica a 600 nm con base en la escala 1 de McFarland (McFaddin, 2000). En microplacas de 96 pozos se hicieron microdiluciones de los extractos esterilizados a través de un filtro Millipore (0.45 μm); posteriormente, se adicionaron 100 µL del microorganismo en todos los pozos y se obtuvo un volumen final en cada uno de 200 µL, con concentraciones finales de extracto desde 30 × 103 hasta 3 μg mL-1. Transcurrido el tiempo de incubación se leyeron las placas a 600 nm para determinar la susceptibilidad del microorganismo, todo esto por triplicado (Peterson y Shanholtzer, 1992). La CIM se determinó identificando la dilución que no presentó crecimiento microbiano en comparación con el control (caldo + microorganismo). Se consideraron también otros controles como caldo puro, caldo + solvente y caldo + extractos.
Actividad antifúngica
Se determinó la actividad antifúngica mediante el método de dilución en agar (Del Toro-Sánchez et al., 2010). Se prepararon medios de cultivo papa-dextrosa-agar (PDA 39 g L-1) en cajas de Petri a las cuales se adicionaron los respectivos extractos a cuatro concentraciones (0, 30, 60, 90 y 120 µg mL-1). Antes de inocular las especies de Fusarium en las cajas con extractos, éstos se sometieron a un crecimiento previo de 48 a 72 h; posteriormente, se adicionaron 5 mL de agua bidestilada estéril y se raspó la superficie del cultivo fúngico sin rayar el medio sólido. Después de la homogenización, se tomaron 20 µL de suspensión micelial y se depositaron suavemente en el centro de la caja de Petri, se dejó secar 10 min en una campana de flujo laminar de bioseguridad clase IIA y se incubó durante 4 d a 28 ± 1 ºC. Se tomaron como controles cajas de Petri con medio PDA inoculadas con el hongo sin extracto y con los solventes. Los resultados se reportaron como porcentaje de inhibición obtenido por la comparación de los diámetros miceliales (medidos con un Vernier) de los controles con las muestras según la siguiente fórmula:
Adicionalmente, con los datos obtenidos se graficaron curvas de concentración contra porcentaje de inhibición y se calculó la concentración fungicida media (CF50).
Análisis estadístico
El análisis estadístico realizado fue con tres repeticiones con diseño completamente al azar y arreglo multifactorial y se aplicó un análisis de varianza (ANOVA) y la prueba DMS, (Diferencia Minima Significativa) (P ≤ 0.05) mediante el programa Statgraphics Centurión XV v.15.2.06.
Resultados
Análisis fitoquímico
Los fenoles o taninos, así como los flavonoides, fueron los compuestos más abundantes en los extractos acuosos y metanólicos de hoja y tallo (Cuadro 1), estos resultados coinciden con los obtenidos por Medina et al. (2017), quienes reportaron que los compuestos mayoritarios presentes en extractos metánolicos de V. mollis corresponden a fenoles. Los resultados sugieren que la hoja presenta fenoles o taninos hidrolizables, mientras que los de tallo tienen tanto hidrolizables como del tipo catecol. Las cumarinas sólo se identificaron en los extractos acuosos y metanólicos de tallos. Las hidroxicumarinas sencillas son solubles en agua y en soluciones alcohólicas. Las pirano y furanocumarinas son solubles en los mismos solventes, pero también en disolventes orgánicos no polares; por lo tanto, de acuerdo con los resultados obtenidos, los extractos acuosos y metanólicos presentan cumarinas del tipo hidroxicumarinas, ya que en el extracto apolar (hexánico) no se detectó la presencia de estos compuestos. Los triterpenos fueron los compuestos mayoritarios detectados en los extractos hexánicos, principalmente en los de tallo. No se lograron detectar saponinas y alcaloides en ningún extracto de las diferentes partes de la planta.
Cuadro 1 Análisis fitoquímico de los extractos de hoja y tallo de Vitex mollis.
| Extractos de hoja | Extractos de tallo | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Acuoso | Metanólico | Acetónico | Hexánico | Acuoso | Metanólico | Acetónico | Hexánico | ||
| Fenoles y/o taninos | ++a/b | +++a/b | ++a/b | + a/b | +++a | +++a | ++a | + a | |
| Flavonoides | +++ | +++ | + | + | +++ | +++ | ++ | + | |
| Saponinas | - | - | - | - | - | - | - | - | |
| Alcaloides | - | - | - | - | - | - | - | - | |
| Triterpenos | - | - | + | ++ | - | - | + | +++ | |
| Cumarinas | - | - | - | - | + | + | - | - | |
a) Fenoles o taninos hidrolizables. b) Fenoles o taninos tipo catecol. a/b) Ambos tipos de fenoles y taninos. Presencia abundante [+++], presencia moderada [++], presencia leve [+], ausencia [-].
Con respecto a la cuantificación de fenoles totales, los extractos metanólicos y acuosos tanto de hoja (37.91 ± 1.56 y 20.91 ± 0.86 mg EAG/g muestra seca, respectivamente) como de tallo (33.46 ± 0.77 y 29.46 ± 0.99 mg EAG/g muestra seca, respectivamente) presentaron la mayor cantidad (Figura 1). Un comportamiento similar se observó en los flavonoides en los extractos metanólicos y acuosos de hoja (21.67 ± 1.23 y 12.47 ± 1.11 mg EQ/g muestra seca, respectivamente) y tallo (26.83 ± 0.51 y 22.21 ± 0.65 mg EQ/g muestra seca, respectivamente), donde los extractos del tallo fueron los que sobresalieron con este tipo de compuestos. Los flavonoides forman parte de los fenoles; por lo tanto, estos resultados demuestran que la mayor cantidad de los fenoles son del tipo flavonoide, ya que la cantidad de flavonoides es mayor al 50 % en todas las muestras con respecto a los fenoles, excepto en los extractos hexánicos (Figura 1).
Actividad antibacteriana
De los cuatro tipos de extractos evaluados (acuoso, metanólico, acetónico y hexánico), los extractos hexánicos no presentaron inhibición en los microorganismos analizados (E. coli, M. luteus, S. enterica y S. aureus). Los extractos metanólicos presentaron mayor inhibición contra las bacterias estudiadas, le siguieron los acetónicos y posteriormente los acuosos (Cuadro 2); por lo tanto, los diferentes extractos obtenidos presentaron diferencias significativas entre ellos (P = 0.00023). Por otra parte, los tallos de V. mollis fueron más efectivos que las hojas, por lo que el factor tejido de la planta fue significativo (P = 0.0082) demostrando por la prueba DMS que los extractos de los tallos inhiben el crecimiento bacteriano con mayor actividad.
Cuadro 2 Concentración inhibitoria mínima (CIM) de extractos acuosos, metanólicos, acetónicos y hexánicos de Vitex mollis contra Escherichia coli, Micrococcus luteus, Salmonella enterica y Staphylococcus aureus.
| Bacteria | Solvente | Parte de la planta | CIM (μg mL-1) |
|---|---|---|---|
| Escherichia coli | Agua | Hoja | 820 |
| Agua | Tallo | 770 | |
| Metanol | Hoja | 95 | |
| Metanol | Tallo | 80 | |
| Acetona | Hoja | 130 | |
| Acetona | Tallo | 100 | |
| Hexano | Hoja | ND | |
| Hexano | Tallo | ND | |
| Micrococcus luteus | Agua | Hoja | 410 |
| Agua | Tallo | 315 | |
| Metanol | Hoja | 75 | |
| Metanol | Tallo | 32 | |
| Acetona | Hoja | 160 | |
| Acetona | Tallo | 110 | |
| Hexano | Hoja | ND | |
| Hexano | Tallo | ND | |
| Salmonella enterica | Agua | Hoja | 220 |
| Agua | Tallo | 180 | |
| Metanol | Hoja | 60 | |
| Metanol | Tallo | 28 | |
| Acetona | Hoja | 145 | |
| Acetona | Tallo | 115 | |
| Hexano | Hoja | ND | |
| Hexano | Tallo | ND | |
| Staphylococcus aureus | Agua | Hoja | 610 |
| Agua | Tallo | 555 | |
| Metanol | Hoja | 95 | |
| Metanol | Tallo | 75 | |
| Acetona | Hoja | 165 | |
| Acetona | Tallo | 110 | |
| Hexano | Hoja | ND | |
| Hexano | Tallo | ND |
ND: no detectado.
Salmonella enterica fue la bacteria más inhibida por el extracto metanólico de tallo (CIM = 28 μg mL-1), le siguieron M. luteus (CIM = 32 μg mL-1), S. aureus (CIM = 75 μg mL-1) y E. coli (CIM = 80 μg mL-1) (Cuadro 2). Kuete (2010) clasifica la potencia de las CIM de los extractos de plantas en significativo (< 100 μg mL-1), moderado (100 < CIM ≤ 625 μg mL-1) y débil (> 625 μg mL-1); por lo tanto, al considerar esta clasificación, los extractos metanólicos tanto de tallo como de hoja son significativos para todos los microorganismos estudiados. Los extractos acetónicos tuvieron potencia inhibitoria moderada para todas las bacterias, los extractos acuosos tienen potencia moderada para M. luteus, S. enterica y S. aureus, mientras que para E. coli fue débil.
Actividad antifúngica
De acuerdo con los resultados obtenidos, se observó que los extractos que presentaron mejor porcentaje de inhibición contra las diferentes especies de Fusarium fueron los metanólicos y acuosos, le siguieron los acetónicos y en menor medida los hexánicos. De forma general, la concentración más alta estudiada (120 μg mL-1) presentó mayor inhibición en la mayoría de las especies de Fusarium analizadas. La parte de la planta que mejor efecto inhibitorio presentó fue la de tallo, y el Fusarium más afectado frente a los extractos de V. mollis fue F. verticillioides aislado de maíz.
El efecto inhibitorio en F. verticillioides de extractos de hoja y tallo de V. mollis se puede observar en las Figuras 2 y 3, con aproximadamente 62 y 91 % de inhibición con el extracto metanólico, respectivamente. No se observaron diferencias significativas (P ≥ 0.05) entre las concentraciones de 90 y 120 μg mL-1 en los extractos metanólicos de hoja (Figura 2). En los de tallo, las concentraciones 60 y 90 μg mL-1 no presentaron diferencias significativas (P ≥ 0.05) (Figura 3). Se observa el mismo comportamiento en los extractos acuosos que inhiben tan solo 7 y 12 % menos en hojas y tallos, respectivamente, en comparación con los metanólicos.
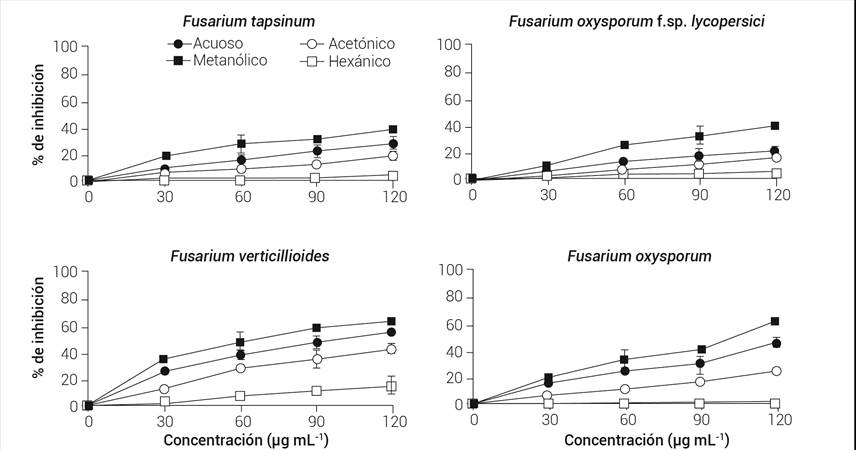
Figura 2 Porcentajes de inhibición de los extractos de hoja de Vitex mollis sobre las diferentes especies de Fusarium. Valores promedio de tres repeticiones ± desviación estándar.
Fusarium oxysporum f.sp. lycopersici presentó 39 y 51 % de inhibición de hoja (Figura 2) y tallo (Figura 3), respectivamente; en los extractos metanólicos no se encontraron diferencias significativas entre las concentraciones intermedias de las hojas, mientras que en las de tallo fueron las dos concentraciones mayores las que no tienen diferencias significativas (P ≥ 0.05). En comparación con los extractos metanólicos, los extractos acuosos presentaron 19 y 23 % menos inhibición en hoja y tallo, respectivamente. En este último solvente, no hubo diferencias significativas entre las concentraciones de 60, 90 y 120 μg mL-1 en los extractos de hoja (P ≥ 0.05); sin embargo, todas las concentraciones analizadas de tallo fueron significativamente diferentes entre ellas (P ≤ 0.05), mostrando la mejor actividad inhibitoria la de mayor concentración.

Figura 3 Porcentajes de inhibición de los extractos de tallo de Vitex mollis sobre las diferentes especies de Fusarium. Valores promedio de tres repeticiones ± desviación estándar.
Por otra parte, F. tapsinum fue otro de los hongos que se inhibió en menor proporción por los extractos de V. mollis, junto con F. oxysporum f.sp. lycopersici. Los extractos metanólicos de hoja presentaron aproximadamente 38 % de inhibición (Figura 2) y los de tallo 55 % (Figura 3), no hubo diferencias significativas (P ≥ 0.05) con respecto a F. oxysporum f.sp. lycopersici. El mismo comportamiento fue observado en los extractos acuosos en ambos hongos.
Finalmente, F. oxysporum fue el segundo hongo más inhibido por los extractos de V. mollis, presentando 63 y 80 % de inhibición con los extractos metanólicos de hoja (Figura 2) y tallo, respectivamente (Figura 3). En este mismo solvente todas las concentraciones estudiadas mostraron diferencias significativas (P ≤ 0.05) en los extractos de ambas partes de la planta, la concentración más alta fue la que produjo mejor porcentaje de inhibición. Los extractos acuosos de hoja presentaron 17 % menos inhibición en comparación con los metanólicos, mientras que se observó 15 % menos en tallos.
El orden de los hongos inhibidos por la concentración más alta de los extractos, tanto metanólicos como acuosos de tallo de V. mollis fue: F. verticillioides > F. oxysporum > F. tapsinum > F. oxysporum f.sp. lycopersici; sin embargo, solo se logró determinar la concentración fúngica media (CF50) de F. verticillioides (Cuadro 3) en hoja y tallo de los extractos acuosos y metanólicos, así como los de tallo en estos mismos solventes en F. oxysporum. De acuerdo con los resultados, el extracto que obtuvo la mejor actividad antifúngica fue el metanólico de tallos (29.8 μg mL-1).
Cuadro 3 Concentración fungicida media (CF50) de los extractos de Vitex mollis sobre hongos filamentosos del género Fusarium .
| Microorganismo | Acuoso | Metanólico | Acetónico | Hexánico | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Hoja | Tallo | Hoja | Tallo | Hoja | Tallo | Hoja | Tallo | ||||
| F. verticillioides | 110.01 | 51.3 | 40.5 | 29.8 | ND | ND | ND | ND | |||
| F. oxysporum f. sp. lycopersici | ND | ND | ND | 117.8 | ND | ND | ND | ND | |||
| F. tapsinum | ND | ND | ND | 109.0 | ND | ND | ND | ND | |||
| F. oxysporum | ND | 85.1 | ND | 52.9 | ND | ND | ND | ND | |||
Datos expresados en μg mL-1. ND: no determinado debido a que no alcanzó el 50 % de inhibición en la concentración más alta utilizada (120 μg mL-1).
Discusión
Según algunas investigaciones, el efecto antimicrobiano de los extractos de plantas se debe a ciertos compuestos, entre ellos los fenólicos (Medina et al., 2017). La actividad antimicrobiana de los compuestos fenólicos ha sido ampliamente investigada en una gran variedad de microorganismos (Delgado-Vargas et al., 2010). Los fenoles del tipo flavonoide como flavonoles y flavan-3-ol, y taninos, son los polifenoles a los que se les ha atribuido mayor actividad antimicrobiana debido a que son capaces de presentar diversos mecanismos como suprimir factores de virulencia microbiana como la inhibición de formación de biopelículas, reducción de la adhesión de los ligandos receptores, atacan las paredes y membranas celulares, inactivan enzimas esenciales, intervienen en el sistema de síntesis de proteínas y del material genético y neutralizan toxinas, entre otros (Aron y Kennedy, 2008; Daglia, 2012).
La deducción anterior concuerda con los resultados de Rodriguez-Maturino et al. (2015) quienes atribuyen a los compuestos fenólicos la actividad antifúngica en Alternaria alternata y Fusarium oxysporun mediante extractos fenólicos del chiltepín (Capsicum annuum var. glabriusculum). Lo anterior coincide en que los extractos metanólicos de V. mollis en el presente estudio tuvieron la mayor concentración de flavonoides y fueron los que dieron la mejor respuesta inhibitoria contra las bacterias y hongos estudiados, también coincide que en los extractos hexánicos la cantidad de flavonoides fue mínima teniendo muy baja inhibición contra los microorganismos; sin embargo, a pesar de este comportamiento, al ser extractos crudos los utilizados en este estudio, no se puede afirmar que estos compuestos sean los responsables de dicha actividad hasta realizar estudios más específicos con muestras más puras.
Son escasos los estudios antibacterianos realizados con V. mollis; sin embargo, Delgado-Vargas et al. (2010) utilizaron extractos del fruto con diferentes solventes contra bacterias Gram positivas y Gram negativas, entre ellas E. coli y S. aureus. La CIM más efectiva obtenida en el estudio anterior fue de 4 μg mL-1. Recientemente Medina et al. (2017) evaluaron extractos metanólicos de hojas de V. mollis contra S. aureus, la concentración más efectiva fue de 62.5 μg mL-1. En ambos estudios las CIMs obtenidas fueron mayores a las del presente estudio (28 μg mL-1) en los mismos microorganismos, lo que indica una gran diferencia en potencia de inhibición, dependiendo de la parte de la planta administrada. Otros estudios señalan que el extracto de V. mollis a partir de hojas a una dosis de 16 μg mL-1 no es activo contra las bacterias enteropatógenas (Osuna et al., 2005).
Comparando con otras plantas del género Vitex, Kumar et al. (2006) encontraron que los extractos metanólicos a razón de 0.2 g mL-1 de hojas de V. negundo L. presentaron un efecto antibacteriano sobre Bacillus subtilis, M. luteus, S. aureus y E. coli. Similares microorganismos se estudiaron por Choudhary et al. (2011) con la misma especie de la planta, inhibiendo a una concentración de 10 mg mL-1, concentraciones más altas que las del presente estudio.
Con los estudios anteriores se puede deducir que existen diferencias en las cantidades de extracto para la inhibición de bacterias debido al origen de la planta, el órgano de la planta evaluada o la diferencia en la especie; por ejemplo, V. mollis estudiada por Delgado-Vargas et al. (2010) fue recolectada en el Valle de Culiacán, Sinaloa, México, mientras que en el presente estudio la planta se recolectó en la región Ciénega del estado de Jalisco. Los diferentes tipos de clima, suelo, altitud, entre otros, podrían ser factores que propicien estas diferencias. Por otra parte, los estudios mencionados anteriormente utilizaron distintas partes de la planta, algunos fueron realizados con los frutos, otros con las hojas y con los tallos.
Es bien sabido que las distintas partes de la planta poseen compuestos diferentes, lo que puede influir en las variaciones de los estudios de bioactividad (Montes-de-Oca-Márquez et al., 2017); lo mismo ocurriría si se trata de diferentes especies, como en el caso de Vitex negundo L, sin embargo, V. mollis de la región Ciénega de Jalisco, requiere cantidades muy pequeñas de extracto para inhibir a E. coli, S. enterica, S. aureus y M. luteus; por lo tanto, puede considerarse una buena fuente de metabolitos para este fin.
En el presente trabajo también se planteó demostrar que V. mollis podría presentar actividad antifúngica analizando extractos de tallo y hoja obtenidos con solventes de distinta polaridad, dos polares (acuoso y metanólico), uno medianamente polar (acetónico) y uno no polar (hexánico). Al analizar los resultados de este estudio y conjuntarlos con los resultados de Rodríguez et al. (2000) se infiere que el efecto del extracto de V. mollis frente a las cuatro especies de Fusarium fue más eficaz cuando se utilizaron los tallos y se aplicaron los solventes acuosos o metanólicos; por lo tanto, la polaridad de los extractos fue de gran relevancia para el estudio. Bajo este contexto, De Oliveira et al. (2012) demostraron también que la polaridad de extractos de Vitex cymosa juega un papel importante en la inhibición del insecto Sitophilus zeamais (Motschulsky, Curculionidae:Coleoptera) conocido como el gorgojo del maíz. Cuando se utilizaron extractos metanólicos de ramas de esta planta, causaron la mayor mortalidad de gorgojos; sin embargo, extractos con diclorometano permitieron su supervivencia. Esto sugiere que los compuestos responsables tanto de la actividad insecticida como de la actividad antimicrobiana de plantas del género Vitex tienden a ser polares.
Por otra parte, el mayor efecto inhibitorio de los extractos de V. mollis en el desarrollo del micelio se reportó sobre F. verticillioides, un hongo que afecta al maíz al causar pudrición de la mazorca y puede producir micotoxinas en el grano (De la Torre-Hernández et al., 2014). Estas micotoxinas son estables durante el procesamiento de los alimentos, no se degradan durante la fermentación del maíz y son resistentes al proceso de enlatado y horneado (Castelo et al., 1998; Marasas et al., 2000; Scott y Lawrence, 1995). En consecuencia, se han estudiado extractos metanólicos de diferentes plantas inhibiéndolos en un intervalo de 28 a 90 % (Ruiz-Bustos et al., 2009; Suárez-Jiménez et al., 2007); sin embargo, las concentraciones utilizadas en estas investigaciones son entre 5 y 30 veces más altas que las utilizadas en el presente estudio; por lo tanto, V. mollis es un buen inhibidor del hongo Fusarium y representa una alternativa a considerar en el manejo integrado de enfermedades causadas por el fitopatógeno Fusarium.
Conclusiones
Existen diferencias en la composición química y su efecto como antimicrobiano de las diferentes partes de Vitex mollis (hojas y tallos). Los extractos metanólicos de los tallos de V. mollis fueron los inhibidores más efectivos de bacterias y del hongo Fusarium, por lo tanto, los tallos pueden ser una buena fuente de compuestos antimicrobianos. Dentro del campo del manejo sustentable integral de fitopatógenos de manera orgánica, puede representar un recurso natural de bajo costo, que evita la pudrición de las plantas causado por Fusarium y además se puede plantear la aplicación de los extractos para evitar el daño ecológico al suelo, obteniendo con ello productos orgánicos menos dañinos también para el humano.











 nova página do texto(beta)
nova página do texto(beta)



