Introducción
Las plantas de agave (Agave angustifolia Haw.) constituyen la principal materia prima para la elaboración del mezcal que se produce en Oaxaca y en otros estados de la República Mexicana. Anualmente se exportan alrededor de 750,000 L de mezcal con certificación a Asia, Europa, Estados Unidos y Canadá (Madrigal, 2009; Martínez-Hernández et al., 2008). La falta de un sistema eficiente de propagación y repoblación limita el aprovechamiento racional de esta especie, y en el peor de los casos puede provocar una reducción peligrosa de sus poblaciones debido a la sobreexplotación de cultivares, principalmente silvestres (Domínguez et al., 2008a).
Illsley et al. (2004) reportaron que A. angustifolia presenta problemas de fecundación, determinada por el fenómeno de protandria. Asimismo, esta especie ha sido reportada con una floración única después de un largo ciclo vegetativo (de 8 a 12 años) y con una baja eficiencia en la producción de semillas y germinación de las mismas (Arzate-Fernández y Mejía-Franco, 2011).
Las plantas obtenidas por semilla presentan variabilidad genética y lento desarrollo; el porcentaje de éxito en el trasplante es bajo en relación con la propagación mediante los hijuelos, los cuales se mantienen uniformes genéticamente. También pueden formarse hijuelos en las inflorescencias, llamados bulbilos, pero cuando el quiote (nombre regional de la inflorescencia) es eliminado para aprovechar la piña (nombre regional del tallo de esta planta) no se logra la propagación por este método. Por tanto, se requieren acciones que aseguren la permanencia del recurso y permitan la planeación de áreas para su aprovechamiento sustentable (Domínguez et al., 2008b).
El cultivo in vitro de tejidos ha sido considerado una alternativa exitosa para la clonación masiva de plántulas de A. angustifolia, en el que destaca la embriogénesis somática (Arzate-Fernández y Mejía-Franco, 2011). Los embriones somáticos (ES) obtenidos in vitro son frágiles y muy pequeños, además de ser incapaces de soportar las condiciones ambientales extremas, por lo que para su manipulación deben ser protegidos con un material sintético altamente hidratado que se adapte perfectamente a su estructura morfológica, y que también les proporcione los nutrimentos necesarios para mantenerlos viables en su nuevo endospermo. Este método tiene la ventaja de que los ES no están sujetos a la desecación, lo cual constituye la principal causa de los bajos valores de conversión a plántulas (García, Com. pers.1).
El ES encapsulado se ha considerado como un principio para la producción de semillas sintéticas (SS). La matriz del encapsulado, además de brindarles protección contra daños mecánicos, debe ser lo suficientemente blanda para que al germinar el ES pueda romper la cubierta y emerger de ella. Los hidrogeles o matrices poliméricas que recubren el material vegetal encapsulado deben ser capaces de retener los nutrientes con los que éste se alimenta; más aún, deben permitir el intercambio gaseoso resultante de la respiración del embrión. En los procesos de encapsulación para producir SS se utiliza alginato como un material de recubrimiento pues sus gránulos ofrecen la ventaja de no ser tóxicos (Redenbaugh, 1993).
Otras ventajas de la producción de SS son las facilidades de almacenamiento, transporte, manipulación y obtención de material libre de virus, las cuales pueden coadyuvar durante su siembra directa en invernadero o en campo (Pradhan et al., 2011), y favorecer aspectos de propagación masiva, conservación y aprovechamiento sustentable del agave mezcalero (Domínguez et al., 2008b; García, 2007).
A la fecha no hay reportes previos sobre la producción y conservación de embriones somáticos (ES) de A. angustifolia mediante su encapsulación para la obtención de semillas sintéticas (SS). Por ello, los objetivos del presente estudio fueron: i) Inducir y madurar ES in vitro, a partir del cultivo in vitro de ejes embrionarios cigóticos (EEC) de A. angustifolia; ii) Encapsular ES para la producción de SS; iii) Evaluar el efecto de la concentración de la matriz de alginato de sodio, del tiempo de inmersión al agente acomplejante y de la concentración del medio de cultivo MS, sobre el porcentaje de germinación y sobrevivencia de la SS; iv) Evaluar el efecto de 6-bencilaminopurina (BAP) sobre el porcentaje de germinación y sobrevivencia de la SS; y v) Adaptar a condiciones de invernadero rústico las plantas regeneradas a partir de SS.
Materiales y métodos
Material vegetal
Se utilizaron semillas maduras de Agave angustifolia Haw., las cuales fueron colectadas de plantas silvestres en el municipio de Zumpahuacán, Estado de México. De esas semillas se obtuvieron los ejes embrionarios cigóticos (EEC), los cuales se utilizaron como explante inicial.
Inducción y maduración de embriones somáticos (ES) in vitro
De acuerdo con el procedimiento descrito por Arzate-Fernández y Mejía-Franco (2011), a partir de los EEC maduros (Figura 1A) de A. angustifolia se indujo callo embriogénico (CE) (Figura 1B). Para la inducción de CE se usaron las sales del medio de cultivo MS (Murashige y Skoog, 1962) a 25 % de su concentración, suplementado con las vitaminas L2 (Phillips y Collins, 1979), 13.57 µmol de 2,4- diclorofenoxiacético (2,4-D), 4.4 µmol de 6-bencilaminopurina (BAP), 60 g L-1 de sacarosa y 8.0 g L-1 de agar, mismos que se incubaron en completa oscuridad durante 8 semanas. Una vez formados los CE, con o sin embriones somáticos (ES) en estadio globular (Figura 1C, D), éstos se transfirieron a un medio MS a 50 % de su concentración con 30 g L-1 de sacarosa y 0.45 µmol de 2,4-D, y se incubaron por 9 semanas más hasta lograr la maduración de los ES (Figura 1E).

Figura 1 Embriogénesis somática indirecta y producción de semilla sintética de Agave angustifolia Haw. A) Eje embrionario cigótico. B) Inducción de callo embriogénico en MS al 25 % adicionado con 13.57 µmol de ácido 2,4-diclorofenoxiacético (2,4-D), 4.4 µmol de 6-bencilaminopurina (BAP) y 60 g L-1 de sacarosa, incubados en completa oscuridad. C), D) y E) Inducción y maduración de embriones somáticos en un medio MS a 50 % suplementado con 0.45 µmol de ácido 2,4-diclorofenoxiacético (2,4-D) y 30 g L-1 de sacarosa. F) Embriones somáticos en estadio cotiledonar listos para su encapsulación, establecidos en medio MS a 50 % adicionado con 30 g L-1 de sacarosa y sin reguladores de crecimiento, obtenidos 120 d después de iniciado su cultivo in vitro. G) Encapsulación de embriones somáticos de Agave angustifolia para producir semilla sintética mediante una solución de alginato de sodio y como agente gelificante una solución de cloruro de calcio. H) Semilla sintética de Agave angustifolia Haw., en donde se observa un embrión somático.
Fuente de embriones somáticos (ES) para producción de semilla sintética (SS)
Los embriones somáticos de A. angustifolia obtenidos del callo embriogénico (CE) fueron usados como material vegetativo experimental para su encapsulación y producción de la semilla sintética (SS). Con la finalidad de homogeneizar el material vegetal experimental, se seleccionaron aquellos ES en estadio cotiledonar (Figura 1F).
Preparación del endospermo sintético
Previo a la encapsulación de los ES se evaluó la consistencia de la matriz de alginato de sodio (MAS) (C6H7O6Na) a tres concentraciones (3, 4 y 5 %), y como agente gelificante se usó cloruro de calcio (CaCl2·2H2O) a 75 mM. Ambas soluciones fueron preparadas según el protocolo de Lee-Espinosa et al. (2009) con ligeras modificaciones, a saber: el alginato de sodio se disolvió en una solución que contenía las sales del medio basal MS a 50 % y otra a 100 % para constituir así el endospermo sintético, suplementadas con 6-bencilaminopurina (BAP: 0.0, 4.4 y 8.8 µmol).
Encapsulación de embriones somáticos (ES)
Para la producción de SS se usó el protocolo reportado por Lee-Espinosa et al. (2009). Con el fin de procurar una condición fisiológica similar, los ES en estadio cotiledonar se transfirieron por 15 d a un medio MS a 50 % de su concentración suplementado con 30 g L-1 de sacarosa y sin reguladores del crecimiento.
Para el proceso de encapsulación, los ES fueron colectados bajo condiciones asépticas en una campana de flujo laminar, y se suspendieron en el endospermo sintético previamente elaborado. Posteriormente, con la ayuda de una micropipeta (5000 µL) se extrajeron de la solución, y de manera individual se expusieron al agente gelificante elaborado a base de cloruro de calcio durante 15 y 30 min, considerados como tiempos de inmersión (TI). El agente gelificante estuvo en constante agitación a 150 rpm para procurar la forma esférica de las SS (Figura 1G, H). Para la recuperación de las SS, éstas se colectaron con ayuda de un colador metálico (previamente esterilizado), y se lavaron dos veces con agua destilada esterilizada.
Condiciones de incubación y germinación de las semillas sintéticas (SS) de A. angustifolia
Las semillas sintéticas se transfirieron a cajas Petri vacías y esterilizadas, y se mantuvieron incubadas a 25 ± 2 °C, durante todo el experimento in vitro, hasta su conversión a plántula. Una vez desarrolladas las primeras hojas, se transfirieron a un sustrato con composta y arena (1:1), contenido en un recipiente de vidrio.
Adaptación de las plántulas regeneradas in vitro a partir de semillas sintéticas (SS)
A las plántulas de A. angustifolia regeneradas in vitro a partir de SS, se les retiraron los residuos del endospermo sintético y sustrato. Posteriormente fueron colocadas en macetas de 7.62 cm de diámetro que contenían el mismo sustrato y la proporción usada en la germinación de las SS. Las macetas fueron cubiertas con bolsas de polietileno por un periodo de 21 d y mantenidas en las mismas condiciones de incubación a 25 ± 2 °C con fotoperiodo de 16 h, antes de transferirlas a condiciones de invernadero rústico.
Análisis estadístico
Se probaron 36 tratamientos resultantes de la combinación de los cuatro factores estudiados y sus niveles correspondientes, a saber: 1) Concentración de alginato de sodio (3, 4 y 5 %); 2) Concentración de sales en el medio de cultivo MS (50 y 100 %); 3) Concentración de BAP (0.0, 4.4 y 8.8 µmol), y 4) Dos tiempos de inmersión (15 y 30 min) en el agente gelificante (CaCl2). Se evaluó su efecto en el porcentaje de germinación y sobrevivencia de las SS. Para cada tratamiento se usaron 10 SS, en el que cada SS se consideró como una unidad experimental. La comparación estadística de las medias de los tratamientos se hizo mediante la prueba de t de Student (P < 0.05) con los resultados porcentuales de las variables respuesta previamente transformados con la función arc sen Vx. El estadístico empleado para el cálculo de t fue tc = √n (Xi-X)/s ; donde Xi es la media de las 10 SS por tratamiento, X y s la media y desviación estándar de cada columna (4) y concentración de sales del medio de cultivo MS (50 y 100 %), y n es el número de medias por columna (9) (Cuadro 2).
Resultados y discusión
Efecto de la composición del endospermo sintético sobre el porcentaje de germinación y sobrevivencia de semillas sintéticas (SS)
Para la germinación y sobrevivencia de SS de A. angustifolia, los resultados demostraron que los factores: concentración del medio MS, porcentaje de alginato de sodio, concentración de BAP y dos tiempos de inmersión (TI), tuvieron un efecto significativo; la concentración del medio MS a 100 % mostró mayor impacto porque en algunos tratamien tos se presentaron 100 % de germinación y sobrevivencia de las SS (Cuadro 1). Lo anterior se presentó con el tiempo de inmersión de 15 min de los embriones somáticos en el agente gelificante y en una concentración de 4.4 µmol de BAP.
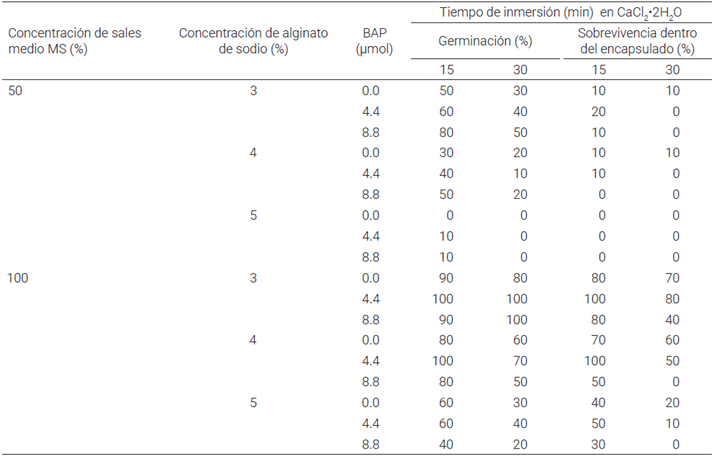
Cuadro 1 Efecto de la concentración de alginato de sodio (C66H7O6Na) diluido en medio de cultivo MS (50 o 100 %) suplementado con tres concentraciones de 6-bencilaminopurina (BAP) y con 15 y 30 min de inmersión en cloruro de calcio (CaCl2·2H2O), sobre la germinación y sobrevivencia de semilla sintética (SS) de Agave angustifolia Haw.
†Resultados porcentuales transformados; Área sin color = concentración de sales medio MS (50 %); Área gris = concentración de sales medio MS (100 %); * = P ≤ 0.05.
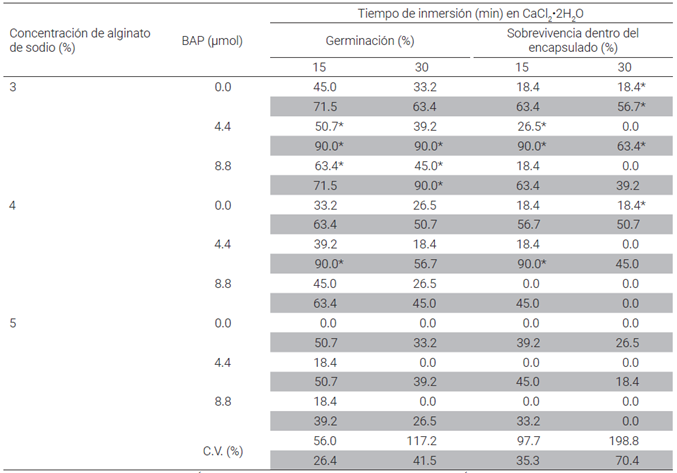
Cuadro 2 Comparativo estadístico del efecto de la concentración de alginato de sodio (C66H7O6Na) diluido en medio de cultivo MS (50 o 100 %) suplementado con tres concentraciones de 6-bencilaminopurina (BAP) y con 15 y 30 min de inmersión en cloruro de calcio (CaCl2·2H2O), sobre la germinación y sobrevivencia de semilla sintética (SS)+ de Agave angustifolia Haw.
En relación con la concentración de alginato de sodio, se observó que con 3 y 4 %, combinado con la mínima con centración de BAP (4.4 µmol) y con tiempo de inmersión de 15 min en CaCl2, se logró inducir 100 % de germinación de las semillas sintéticas (Figura 2A, B). Por el contrario, cuando se utilizó 5 % de alginato de sodio en medio MS a 50 % en ausencia de BAP, no se logró respuesta germinativa (Cuadro 1).
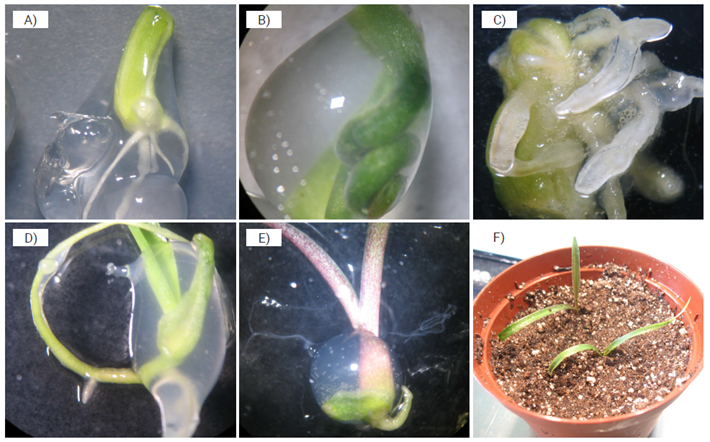
Figura 2 Germinación, crecimiento y adaptación de plántulas de Agave angustifolia. A) Germinación de una semilla sintética en 3 % de alginato de sodio disuelto en MS a 100 % con 4.4 µmol de BAP y 15 min de inmersión, 30 d después del encapsulado. B) Germinación de una semilla sintética en 4 % de alginato de sodio disuelto en MS a 100 % con 4.4 µmol de BAP y 15 min de inmersión, 54 d después del encapsulado. C) Plántula en 3 % de alginato de sodio disuelto en MS a 50 % sin BAP y 15 min de inmersión, 40 d después del encapsulado. D) Presencia de raíces en una semilla sintética después de 20 d del encapsulado. E) Plántula regenerada a partir de una semilla sintética. F) Adaptación de plántulas de Agave angustifolia en condiciones ex vitro 30 d después de su trasplante a maceta.
Por otro lado, en 3 % de alginato de sodio pero con una concentración del MS a 50 %, sin el regulador de crecimiento (BAP) y 15 min de inmersión en cloruro de calcio, se observó una sobrevivencia de sólo 10 % de las SS (Cuadro 1), que requirieron hasta 40 d para su germinación (Figura 2C), por lo cual este tratamiento podría considerarse una opción para su almacenamiento a largo plazo. La resistencia mecánica de un encapsulado excesivamente duro provoca que parte de la energía disponible del ES se use para romper el endospermo sintético.
Es decir, las altas concentraciones de alginato de sodio, así como también una excesiva exposición de los ES a los iones calcio pueden ocasionar una mayor adsorción y penetración del cloruro de calcio, lo que provoca una inhibición temporal de su crecimiento y con ello una disminución en su respuesta germinativa a corto plazo (Dolce et al., 2002). Esto sugiere que mientras más tiempo permanezca la gota de alginato de sodio en la solución de cloruro de calcio, mayor cantidad de iones Ca++ son atraídos para contribuir a la formación de la matriz sintética de la cápsula hasta alcanzar la estabilización del proceso de polimerización completa (Lee-Espinosa et al., 2009).
El uso del alginato de sodio como matriz de encapsulación para la obtención de semillas sintéticas (SS) ha sido reportada exitosamente en Apium graveolens y Daucus carota (Onishi et al., 1994), Siberian ginseng (Choi y Jeong, 2002), así como en especies forestales y cítricos (Dolce et al. , 2002) y Laelia anceps (Lee-Espinosa et al. , 2009), entre otras, debido a sus características como viscosidad moderada, baja toxicidad y rápida gelificación. En los resultados aquí obtenidos se pudo observar una relación directa entre la consistencia de la matriz de encapsulación a 3 % y el tiempo de germinación; así, cuando la consistencia de la cápsula fue blanda, el tiempo a germinación fue de 25 d, lo cual resulta ventajoso en campo debido a que su respuesta es relativamente más rápida si se compara con los 45 d requeridos para germinar una semilla sexual en condiciones naturales.
Sin embargo, a medida que aumentó la concentración de alginato de sodio así como el tiempo de inmersión a 30 min en cloruro de calcio, se observó una disminución del porcentaje de germinación en comparación con el tiempo de exposición de 15 min en cloruro de calcio (Cuadro 1). En el mismo cuadro se puede observar que en los tratamientos con 4 y 5 % de alginato de sodio y 30 min de inmersión en el agente gelificante, combinados con 8.8 µmol de BAP en cualquiera de las concentraciones del medio MS, las semillas sintéticas (SS) no sobrevivieron, posiblemente por una mayor dureza de la cápsula provocada por la concentración del alginato de sodio.
En el porcentaje de germinación se observó una relación inversa entre la concentración del alginato de sodio y la concentración de BAP. Así, a medida que aumentó la concentración de alginato de sodio a 5 % y de BAP a 8.8 µmol, disminuyó el número de SS que lograron germinar. Estos resultados coinciden con los reportados por Lee-Espinosa et al. (2009) quienes mencionan que la magnitud de elongación del eje hipocótilo-raíz y de sobrevivencia de los embriones somáticos (ES) están ligados con la concentración de reguladores de crecimiento, pues a medida que se incrementa la concentración del regulador de crecimiento disminuye el porcentaje de germinación y, por tanto, la sobrevivencia de los ES.
Esto puede ser resultado del estadio fisiológico de los ES en el momento de su encapsulación, porque si se encapsulan en un estadio avanzado como el designado en el presente estudio entonces se requiere menor concentración de reguladores de crecimiento, puesto que la cápsula es absorbida en menor tiempo por el ES. Esto podría resolverse con la estandarización de los protocolos de maduración de los ES para lograr mejores porcentajes de germinación de las SS.
Así, si se considera el efecto de los tres factores independientemente de la concentración de sales del medio de cultivo MS, se puede observar que los tratamientos con 3 y 4 % de alginato adicionado con 4.4 µmol de BAP y con 15 min de inmersión en CaCl2 alcanzaron hasta 100 % de germinación y sobrevivencia de las SS con producción de raíces (Cuadro 1; Figura 2A, D), mientras que aquellas cuyo endospermo sintético careció de BAP (o contenían hasta 8.8 µmol) presentaron menores porcentajes de germinación (90 %) y sobrevivencia (80 %).
Análisis estadístico
Mediante la prueba t de Student (P < 0.05) se detectó que el tratamiento con 3 % de alginato de sodio diluido en el medio MS a 100 % suplementado con 4.4 µmol de BAP y 15 o 30 min de inmersión en CaCl2 fue significativamente diferente del resto de los tratamientos probados, para las variables: porcentaje de germinación y porcentaje de sobrevivencia de la cápsula de las SS (Cuadro 2). En el mismo tratamiento de alginato pero diluido en MS a 50 % y con 15 min de inmersión se observó una ligera respuesta en ambas variables. Los altos valores del coeficiente de variación (CV) (Cuadro 2) obtenidos en las variables respuesta aquí estudiadas, impactan en la confiabilidad de los resultados obtenidos, los cuales fueron comparativamente mucho mayores en los tratamientos con MS a 50 % que los registrados con MS a 100 %, razón por la cual se puede afirmar con un menor margen de error, que el mejor tratamiento resultó ser el de menor porcentaje de alginato de sodio (3 %) diluido en MS a 100 % con 4.4 µmol de BAP y 15 o 30 min de inmersión en CaCl2.
Adaptación ex-vitro de las plantas regeneradas a partir de semillas sintéticas
Se observó que la aparición de la primera raíz fue a los 20 d después del trasplante. En general, 80 % de las semillas sintéticas (SS) de A. angustifolia presentaron formación de raíces dentro de las cápsulas; sin embargo, las plántulas que carecían de ellas fueron transferidas a un medio MS a 50 % sin reguladores de crecimiento para inducir su formación, a fin de lograr su mejor adaptación en invernadero.
Reportes previos han señalado que diferentes especies de Agave no presentan complicaciones para su adaptación ex-vitro y alcanzan rangos de éxito de 70 a 100 % (Aureoles-Rodríguez et al., 2008; Das, 1992; Salazar et al., 2009). En el presente estudio, 100 % de las plantas regeneradas a partir de las SS (Figura 2E) lograron adaptarse a condiciones ex-vitro y una vez adaptadas (Figura 2F) no mostraron signos de variaciones morfológicas.
Conclusiones
En el presente estudio se logró por primera vez la encap sulación de embriones somáticos en estadio cotiledonar en alginato de sodio, donde la combinación más apropiada para una mayor sobrevivencia de las semillas sintéticas (SS) de Agave angustifolia fue el endospermo sintético formulado con alginato de sodio a 3 %, con el medio MS a 100 % y 4.4 µmol de BAP y 15 o 30 min de inmersión en cloruro de calcio. Todas las plantas regeneradas a partir de SS se adaptaron a las condiciones ex-vitro y no mostraron variaciones morfológicas.











 nueva página del texto (beta)
nueva página del texto (beta)


