Introducción
México es uno de los principales exportadores de mango (Mangifera indica L.) ya que la calidad de los frutos es de excelente aceptabilidad en los mercados de Estados Unidos, Canadá, Japón, Reino Unido y los Países Bajos (SAGARPA, 2014). Sin embargo, la necesidad de explorar nuevos mercados continúa y otros países de Europa tienen un importante potencial como consumidores. Actualmente, el transporte de mango a Europa es por vía marítima con una duración de 18 a 20 d a 13 oC, condiciones en las que el fruto llega en estado avanzado de madurez y solo deja de 2 a 3 d para comercializarlo en su mayoría en mercados cercanos al desembarque (Osuna et al., 2007). Por ello se requiere combinar tecnologías que permitan reducir la velocidad de maduración de los frutos y prolongar su vida post-cosecha, para permitir distribuir el mango mexicano al resto de países de Europa.
El 1-metilciclopropeno (1-MCP) es un compuesto químico que actúa como antagonista del etileno y retrasa la maduración de frutas y hortalizas; su efectividad es dependiente del cultivar, temperatura de aplicación, dosis, duración del tratamiento y grado de madurez, principalmente. Además, si los frutos son expuestos a tratamientos post-cosecha previos a la aplicación del antagonista, su respuesta puede variar (Blankenship y Dole, 2003). La aplicación de 1-MCP en mangos de las variedades Kent (Osuna-García et al., 2005), Keitt (Osuna-García et al., 2007; Osuna-García et al., 2009) y Tommy Atkins (Pereira Bomfim et al., 2011) ha retrasado el proceso de maduración al disminuir la pérdida de firmeza y peso, al retrasar el aumento de sólidos solubles totales y el desarrollo de color en la pulpa de los frutos. Para mango Ataulfo solo existe un reporte donde la aplicación de 1-MCP a 400 y 800 nL L-1 combinado con una película comestible (PC) retrasó la velocidad de respiración y la actividad de las enzimas poligalacturonasa y carboximetilcelulasa, pero no de la α-galactosidasa, β-galactosidasa y β-glucosidasa, y sin haber encontrado diferencias en el tiempo de maduración entre los frutos tratados con 1-MCP y los testigos no tratados (Muy et al., 2009).
Para entender el efecto del 1-MCP en la conservación de frutas, actualmente se realizan investigaciones sobre su relación con la expresión de genes que codifican para las enzimas ACC sintasa, ACC oxidasa y receptores del etileno durante la maduración post-cosecha. El tomate (Solanum lycopersicum L.) var. Micro Tom (Severo et al., 2015), las manzanas (Malus domestica L.) de las vars. Empire, McIntosh y Cortland (Jung y Watkins, 2014) y el plátano (Musa x paradisiaca L.) cv. Brazil (Zhu et al., 2015) tratados con 1-MCP, exhibieron un retraso en la expresión de genes que intervienen en la biosíntesis de etileno lo que favoreció la vida de anaquel de estos frutos. Sin embargo, se ha reportado una acción menos efectiva de este gas en otros cultivares como el brócoli (Brassica oleracea L.) var. Italica (Ma et al., 2009), la 2 (Prunus salicina Lindl.) cv. Tengan Blue (Khan y Singh, 2009), la manzana Granny Smith (Asif et al., 2009) y el mango Ataulfo (Muy et al., 2009).
Existen reportes escasos sobre el efecto del 1-MCP en la biosíntesis de etileno en frutos de mango, los cuales se enfocan principalmente en el efecto favorable para retrasar la velocidad de respiración, el desarrollo de color y la pérdida de firmeza; tampoco existen publicaciones que reporten efectos negativos ni de su efecto en la biosíntesis del etileno para entender su acción. En relación con lo anterior, el objetivo del presente estudio fue evaluar el efecto de dosis de 1-MCP en mango Ataulfo aplicado a diferentes temperaturas, en diferentes estados de madurez, con y sin tratamiento hidrotérmico, sobre parámetros fisiológicos, fisicoquímicos y transcritos que intervienen en la síntesis de etileno durante su almacenamiento para simular el traslado a Europa.
Materiales y métodos
Experimento 1
Se cosecharon frutos de mango Ataulfo en las huertas del poblado Cinco de Mayo, Municipio de Tepic, Nayarit (Latitud 21o 03' 33'' N, Longitud: 105o 18' 33'' O), en las temporadas 2013 y 2014. Los frutos cosechados eran de color verde claro con 3⁄4 de color amarillo, acidez titulable de 4.9 % como ácido cítrico y un contenido de sólidos solubles totales de 5.3 oBrix. Las frutas con tratamiento hidrotérmico se introdujeron en agua a 46.1 oC por 75 min y posteriormente en tratamiento de hidroenfriado a 21 oC por 30 min el mismo día de la cosecha.
Los frutos se dividieron en seis lotes de 50 frutos cada uno, correspondientes a seis tratamientos. Se emplearon dos lotes como testigo: el primero fue mango sin tratamiento hidrotérmico (SH0), y el segundo fue de mango con tratamiento hidrotérmico (CH0), ambos sin 1-MCP. El tercer y cuarto lotes de frutos fueron tratados con 1-MCP a 300 nL L-1, sin (SH300) y con tratamiento hidrotérmico (CH300). A los dos lotes restantes se les aplicó 600 nL L-1 de 1-MCP sin (SH600) y con tratamiento hidrotérmico (CH600). La aplicación de 1-MCP (SmartFreshTM Technology, AgroFresh Inc. PA, USA), fue al momento del día de cosecha y se realizó en un cuarto de refrigeración a 13 ± 1 oC.
La exposición al 1-MCP se realizó en cámaras de 225 L herméticamente selladas, con un ventilador en su interior para homogenizar el tratamiento con 1-MCP por 24 h; después de ese tiempo todos los frutos fueron almacenados en una cámara de refrigeración con recirculación de aire, por 20 d a 13 ± 1 oC y de 85 a 90 % de humedad relativa (HR) para simular el traslado a Europa y luego transferidos a 25 ± 2 oC (de 85 a 90 % HR) hasta su maduración para simular las condiciones de mercadeo. Se midió cada 2 d la velocidad de respiración (VR) y velocidad de producción de etileno (VPE) durante la simulación de transporte a Europa y diariamente durante la simulación de mercadeo; las variables firmeza, pH, acidez titulable (AT), sólidos solubles totales (SST) y porcentaje de madurez, se midieron los días 1 y 20 en refrigeración, y 3 d después de su traslado a 25 ± 2 oC.
Experimento 2
Con el mejor tratamiento del experimento 1 y sin aplicación del tratamiento hidrotérmico, se muestrearon frutos en una madurez de cosecha determinada que fue: color verde claro (sin presencia de pigmentos amarillos), acidez titulable de 5.3 % de ácido cítrico y sólidos solubles totales de 3.9 oBrix. Se analizaron tres lotes de 50 frutos cada uno: a) Frutos tratados con 1-MCP a 600 (SH600); b) Frutos tratados con 1000 nL L-1 (SH1000) a 20 ± 1 oC por 24 h y c) Frutos testigo sin 1-MCP (SH0). Los mangos se almacenaron como en el primer experimento.
Para evaluar el efecto del 1-MCP en la biosíntesis de etileno durante el almacenamiento, cada 3 d se midió el contenido del ácido 1-aminociclopropano-1-carboxílico (ACC) y la actividad de la enzima ácido 1-aminociclopropano-1-carboxílico oxidasa (ACC oxidasa, EC 1.14.17.4). Las variables firmeza, pH, AT, SST y porcentaje de madurez se midieron como se mencionó anteriormente. Así mismo se evaluó la expresión del transcrito de la enzima ACC oxidasa (ACO-1) y un receptor de etileno (Mi-ETR1), de frutos sin (SH0) y con 1-MCP (SH600, SH100), solo cuando los frutos se almacenaron a 25 ± 2 oC por 1, 3, 4 y 5 d.
Métodos de análisis
Las variables velocidad de respiración (VR) y velocidad de producción de etileno (VPE) se midieron por el método de (Tovar et al., 2001), en frutos individuales que se colocaron en recipientes herméticos por 1 h para VR y 12 h para VPE, a estos últimos se les colocó una sustancia absorbente de CO2 (solución saturada con NaOH marca Analytika), con el objeto de disminuir la concentración de CO2 en el interior del recipiente y no afectar la maduración de los frutos.
Se tomó 1 mL de gas del espacio de cabeza y se analizó en un cromatógrafo de gases (HP® modelo 6890, USA) con una columna HP-plot (15 m x 0.53 mm y 40 μm de espesor de película), un detector de ionización de flama (FID) y un detector de conductividad térmica (TCD). La temperatura del puerto de inyección y de los detectores fue de 250 oC. Dentro de este mismo sistema se utilizó H2 (30 mL min-1) y aire (400 mL min-1). La temperatura del horno fue una rampa de 60 a 80 oC, la cual cambió a una velocidad de 30 oC min-1. El gas acarreador fue N2 con un flujo de 7 mL min-1. Se usó un patrón de calibración de ultra alta pureza (5.0) certificado Praxair® con 11.3 μmol mol-1 de etileno, 2.01 cmol mol-1 de CO2, 10.10 cmol mol-1 de O2 y N2 para balancear la mezcla. La concentración de CO2 y etileno se calculó usando una relación directamente proporcional al área obtenida de los estándares (áreas de un promedio de 10 inyecciones) a la concentración respectiva, con el área de la muestra problema. La VR se expresó en mL CO2 kg-1 h-1 y la VPE en μL kg-1 h-1.
La actividad de la ACC oxidasa se determinó in vivo, en 0.5 g de tejido de mango en forma de discos de 1 mm de espesor y 8 mm de diámetro, los cuales se incubaron con 0.7 mL de ACC 0.1 mM (Sigma) por 4 h a 25 oC, en un vial con septa y con agitación constante. Después de las 4 h de incubación, 1 mL del gas del espacio libre de cabeza del vial se inyectó al cromatógrafo de gases (Cua y Lizada, 1990). Se determinó la cantidad de etileno producida, y se expresó en nmoL etileno h-1.
El ACC se extrajo de 2 g de pulpa de mango con etanol (80 % v/v), se centrifugó a 12,325 Xg por 30 min en una centrífuga ALC® modelo PM180R (Italia) y el sobrenadante se evaporó para eliminar el etanol. El ACC extraído se recuperó con 2 mL de agua desionizada y se hizo una purificación previa del extracto haciéndolo pasar a través de 2 g de resina Dowex 50W-X8, 50-100 mesh, H+ form (Sigma) en agitación por 20 min y se agregaron 5 mL de NH4OH 0. 1N. Se tomó1mL de la solución y se colocó en unvial de 20mL que contenía o no2.5n molde ACCy 1mL de HgCl2 5mM; después se sellaron los viales y se colocaron en hielo.
Para la conversión de ACC a etileno se agregaron cinco gotas de hipoclorito alcalino (NaOCl al 5 %). La eficiencia de conversión de ACC a etileno en cada muestra fue determinada con la réplica, la cual contenía 2.5 nmol de ACC como estándar interno. La cantidad de ACC en la muestra se calculó como la cantidad de etileno liberada en la muestra dividida por la eficiencia de conversión (Lizada y Yang, 1979) y se reporta en nmoL g-1 de muestra fresca.
La firmeza de los mangos se determinó con un penetrómetro Shimpo® modelo FGV-50 (Japón) con un puntal cilíndrico de 10 mm de diámetro. A cada fruto se le hicieron cortes de 1 cm de grosor a cada lado del mismo, y ahí se efectuaron tres mediciones en las partes apical, central y pedúnculo y los datos se expresaron en newtons (N). Los sólidos solubles totales (SST) se determinaron en pulpa fresca homogeneizada, una porción de la cual se colocó en tela y se exprimió para obtener el jugo y medir los SST en un refractómetro (Atago®, Modelo AD-13, Japón).
La acidez titulable (AT) se determinó por el método volumétrico 942.15 AOAC (2005). Los resultados se expresaron en porcentaje de ácido cítrico. El pH se midió directamente en la pulpa homogeneizada con un potenciómetro (Jenco®, Modelo 1671, Rumania). El color externo se midió con la escala siguiente: 1 = verde, 2 = verde con tonos amarillos, 3 = igual cantidad de verde y amarillo, 4 = amarillo con tonos verdes, 5 = amarillo, 6 = amarillo con tonos naranjas. Se utilizaron 20 frutos por tratamiento y los resultados se reportan en por ciento de frutos situados en cada uno de los estados de madurez (Montalvo et al., 2007).
La técnica de Northern Blotting se usó para el análisis de transcritos de ACC oxidasa (ACO-1) en frutos de los tratamientos SH0 y SH600 en los días 1, 3, 4 y 5 después de estar almacenados a 25 ± 2 oC y para los frutos SH1000 sólo a los 5 d a 25 ± 2 oC. El análisis del receptor de etileno (Mi-ETR1) se hizo en los días 4 y 5 a 25 ± 2 oC. La extracción y separación por electroforesis del ARNm fue realizada de acuerdo con la técnica propuesta por López-Gómez y Gómez-Lim (1992). La transferencia de los transcritos del gel de electroforesis a la membrana de nailon se llevó a cabo según (Sambrook y Russell, 2001).
La sonda de transcritos de la ACC oxidasa se obtuvo del plásmido pKYCPACO-1 en E. coli (López-Gómez et al., 2009). La sonda del transcrito del receptor de etileno de mango (Mi-ETR1) se realizó con el DNA plasmídico de E. coli, la cual contenía el vector pBLUESCRIPT (M13+/ M3-) con resistencia a kanamicina y el fragmento de interés (Gutiérrez et al., 2001). Las sondas purificadas fueron marcadas radioactivamente con el isótopo [α 32 P] dCTP 3000 Ci/mmol. Una vez marcadas las sondas, se procedió a la hibridación de éstas con el ARNm previamente obtenido del mango Ataulfo durante toda la noche a 65 oC con agitación constante. Las membranas fueron colocadas sobre películas de autorradiografía (Amersham Hyperfilm MP) en oscuridad a -80 oC por 24 h. Las películas fueron reveladas en un equipo Kodak® modelo X-OMAT 1000A (Rochester, NY, USA).
Para el primer experimento se utilizó un diseño de bloques completos al azar, con arreglo factorial (2 x 3) para evaluar el tratamiento hidrotérmico (con y sin) y tres concentraciones de 1-MCP (0, 300 y 600 nL L-1); los bloques fueron los días de almacenamiento. Para el segundo experimento el diseño también fue en bloques al azar para evaluar tres concentraciones de 1-MCP y el bloqueo también se hizo en función de los días de almacenamiento. Los datos se analizaron estadísticamente mediante un análisis de varianza (ANOVA, por sus siglas en inglés), con comparaciones de medias por la prueba de LSD (P ≤ 0.05), con empleo del paquete estadístico SAS (The SAS System for Windows®, Version 9.0 Institute, Inc. Cary, NC. 2002).
Resultados y discusión
Velocidad de respiración y producción de etileno
Durante los 20 d de almacenamiento a 13 ± 1 oC no se detectó etileno en los frutos SH y CH (Figuras 1A y B), lo que se puede atribuir a la baja actividad metabólica de los mangos por efecto de la temperatura de refrigeración, lo cual coincide con lo reportado por (Montalvo et al., 2007) quienes no detectaron etileno en frutos de mango Ataulfo almacenados por 4 d a 13 ± 1 oC. Hubo efecto significativo (P < 0.05) en la VPE por las concentraciones de 1-MCP aplicadas en los frutos SH. Al día siguiente de transferir los frutos a 25 ± 2 oC (20 d a 13 ± 1 oC + 1 d a 25 ± 2 oC), se detectó etileno en los frutos SH0 (0.038 μL kg-1 h-1) y SH300 (0.036 μL kg-1 h-1) sin diferencias significativas (P > 0.05) entre estos dos tratamientos (Figura 1A). En los frutos de SH600 la detección de VPE fue 1 d después, siendo estadísticamente diferente (P < 0.05) y con menor producción de esta fitohormona (0.022 μL kg-1 h-1) que los frutos de SH0 y SH300. Esto significa que el 1-MCP a 600 nL L-1 redujo la VPE en estos frutos debido a la disminución en la actividad de las enzimas reguladoras de la biosíntesis del etileno o de la expresión genética de las mismas (Villalobos-Acuna et al., 2011; Yang et al., 2013).
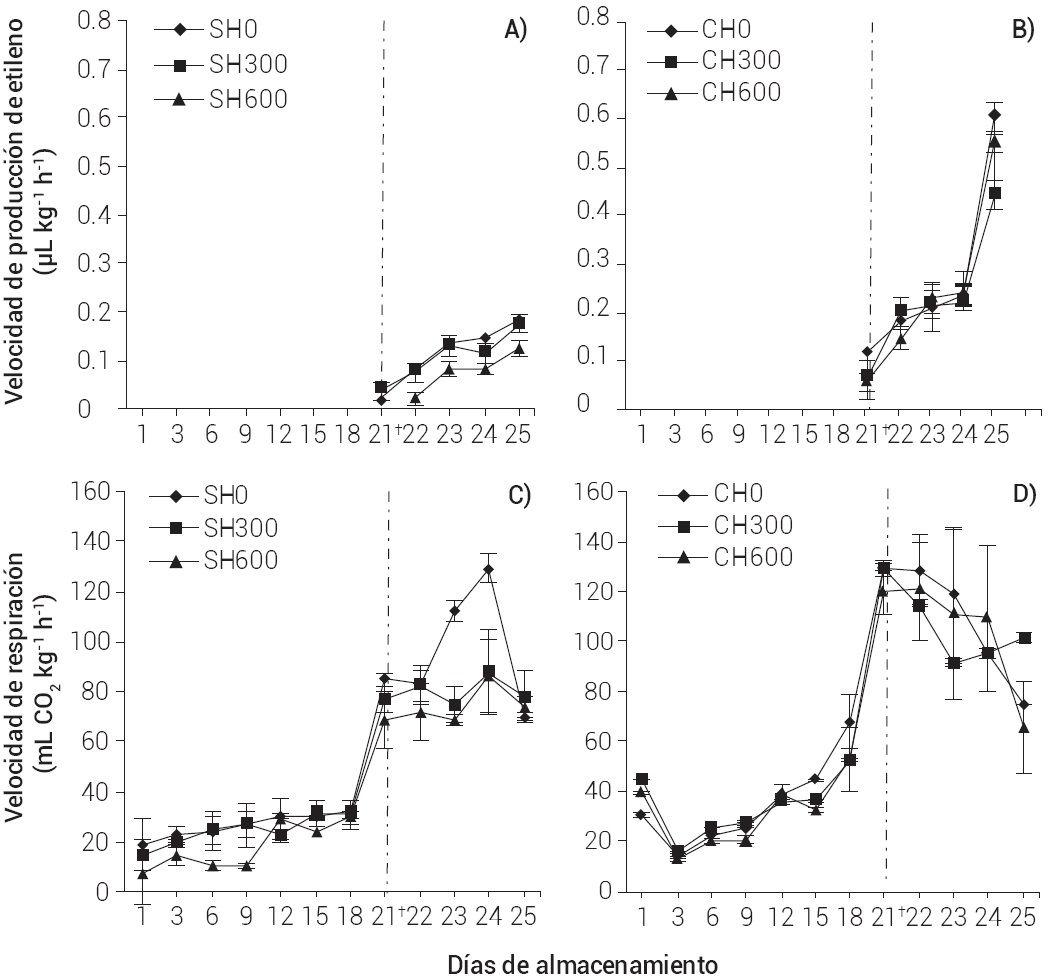
Figura 1 Velocidad de respiración y velocidad de producción de etileno en mango de la var. Ataulfo sin (SH) y con (CH) tratamiento hidrotérmico, tratado con 0 (SH0, CH0), 300 (SH300, CH300) y 600 (SH600, CH600) nL L-1 de 1-MCP por 24 h a 13 ± 1 oC, almacenado por 20 d a 13 ± 1 oC y después a 25 ± 2 oC (†).
Respecto a los frutos CH, una vez que los frutos fueron trasladados a 25 ± 2 oC (Figura 1B), la producción de etileno aumentó significativamente durante su maduración, y al final del almacenamiento (día 5 a 25 ± 2 oC) la VPE fue de 0.54 a 0.59 μL kg-1 h-1, sin diferencias significativas (P > 0.05) entre tratamientos. Datos parecidos reportó (Zóffoli, 2000) para duraznos (Prunus persica L.) y nectarinas (Prunus persica var. Nucipersica), quien no encontró efecto del 1-MCP sobre la producción de etileno en los frutos con tratamiento hidrotérmico y discute que el uso de agua caliente previo a la aplicación de 1-MCP acelera el metabolismo de los frutos; este mismo comportamiento se observa aquí en los mangos CH (Figura 1B). Recientemente se encontró que el tratamiento hidrotérmico (48 oC, 10 min) y la aplicación de 1-MCP en durazno, por un lado inducen la expresión de algunos genes de la maduración, pero se inhiben otros, lo que indica la complejidad intrínseca en el control de la maduración (Jiang et al., 2014).
La velocidad de respiración (VR) se mantuvo baja durante el almacenamiento a 13 ± 1 oC independientemente de que los frutos fueran CH y SH, tratados o no con 1-MCP (Figuras 1C y D). Aunque, se observa que durante el almacenamiento por 3, 6 y 9 d a 13 ± 1 oC, la VR (de 7.75 a 10.58 mL CO2 kg-1 h-1) en los frutos SH600 fue significativamente menor (P ≤ 0.05) que en los frutos SH0 y SH300 (de 18.64 a 26.88 y de 14.90 a 27.06 mL CO2 kg-1 h-1, respectivamente).
Los frutos CH0 presentaron una VR más alta (67.92 mL CO2 kg-1 h-1) a los 18 d en comparación con los otros tratamientos, es posible que en este periodo de almacenamiento el 1-MCP y la temperatura estuvieran ejerciendo una disminución en la VR. Una vez transferidos a 25 ± 2 oC, la VR aumentó en todos los frutos hasta llegar a 129.12 mL CO2 kg-1 h-1 para frutos SH0, a 87.83 mL CO2 kg-1 h-1 para frutos SH300 y a 86.71 mL CO2 kg-1 h-1 para frutos SH600 a los 4 d a 25 ± 2 oC (máximo climaterio), con diferencias significativas (P < 0.05). En cambio, para los frutos CH0, CH300 y CH600 la máxima VR fue de 129.37, 129.56 y 119.86 mL CO2 kg-1 h-1 respectivamente, 1 d después del traslado a 25 ± 2 oC y sin diferencias significativas entre tratamientos (P > 0.05).
El rápido aumento de la VR al cambiar de temperatura de almacenamiento evidencia el efecto de temperatura en la VR debido al aumento en la actividad metabólica, efecto que ya se ha reportado en mango Keitt (Osuna et al., 2007). El efecto del 1-MCP en la VR sólo se observó en los frutos SH. Estos resultados coinciden con el efecto del 1-MCP observado en la VPE; así como en lo reportado por (Li et al., 2013), quienes observaron que el tratamiento de 500 nL L-1 de 1-MCP por 18 h a 20 oC en pera (Pyrus bretschneideri Reld cv. Laiyang), disminuyó la VR durante los primeros días de almacenamiento y retrasó la aparición del pico climatérico, debido a la disminución en la actividad de las enzimas que intervienen en la respiración.
El efecto significativo (P < 0.05) del tratamiento hidrotérmico en la VR también fue evidente, ya que hubo una mayor velocidad de producción de CO2 independientemente del tratamiento con 1-MCP, en comparación con los frutos SH. Los resultados son similares a los que reporta (Osuna et al., 2007), estos autores no encontraron diferencias en la VR del mango Keitt CH, tratado con 1-MCP, y explicaron que el tratamiento hidrotérmico acelera la actividad enzimática del metabolismo respiratorio y la producción de etileno; por ende, al aplicar el 1-MCP su efectividad se ve disminuida y ello repercute en un aumento en la VR.
El efecto estadístico principal (P < 0.05) del 1-MCP en la VPE y VR, estuvo en función de la concentración y del tratamiento hidrotérmico. A mayor concentración de 1-MCP usada y sin tratamiento hidrotérmico, se retrasó la respiración y producción de etileno; pero no tiene efecto este antagonista si los frutos son tratados con hidrotérmico indicando que la tecnología es viable sólo para frutos SH. Respecto al factor tratamiento hidrotérmico, este fue significativo (P < 0.05) por sí mismo, ya que la VPE y VR fueron más altas en los frutos CH, independientemente de la concentración de 1-MCP aplicada, lo que indica que este tratamiento afecta la eficiencia del 1-MCP y no es recomendable aplicarse en esta variedad si se desea trasladar a Europa. La interacción entre factores no fue significativa (P > 0.05).
Características fisicoquímicas
El tratamiento hidrotérmico y el 1-MCP influyeron estadísticamente (P < 0.05) en la firmeza del mango Ataulfo (Cuadro 1). Cuando la firmeza fue medida a los 20 d a 13 ± 1 oC, se pudo constatar que la firmeza había disminuido de 125.2 o 130.4 N hasta 41 N para los frutos SH0, a 45.9 N para los frutos de SH300 y a 47.7 N para los frutos de SH600; por tanto, el 1-MCP a la dosis de 600 nL L-1 tuvo efecto significativo (P < 0.05) en la firmeza de estos frutos. Se ha reportado que la retención de firmeza en mango Ataulfo tratado con 1-MCP, se debe a que este gas disminuye la actividad de las enzimas poligalacturonasa y carboximetilcelulasa (Muy et al., 2009).
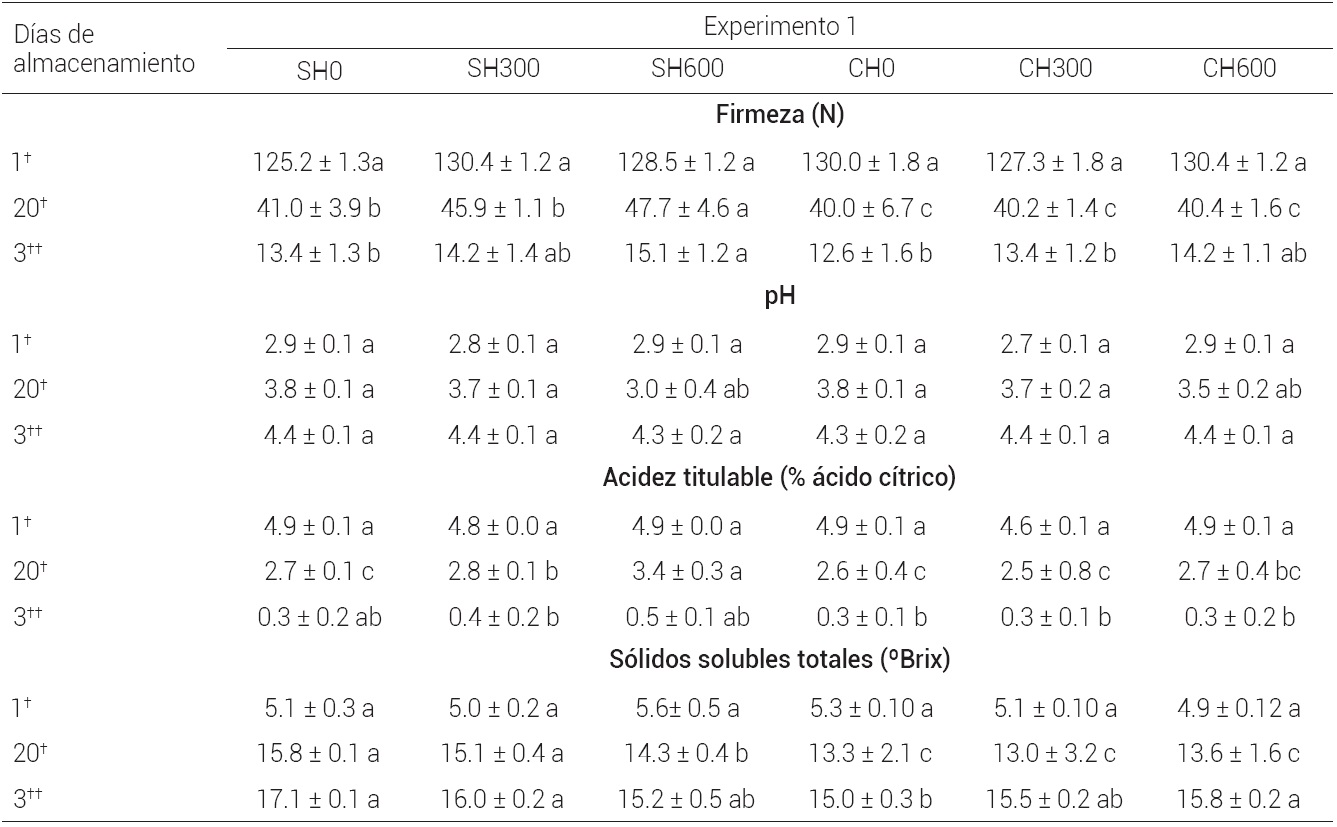
Medias con diferente letra (a, b, c) por fila son estadísticamente diferentes (P ≤ 0.05). †Mango almacenado a 13 ± 1 ºC por 20 d. ††Mango almacenado a 25 ± 2 ºC, previo a 20 d a 13 ± 2 ºC.
Cuadro 1 Características fisicoquímicas en mango var. Ataulfo sin (SH) y con (CH) tratamiento hidrotérmico, tratado sin 0 (SH0, CH0) y con 300 (SH300, CH300) o 600 (SH600, CH600 ) nL L-1 de 1-MCP por 24 h a 13 ± 1 oC, luego almacenado por 20 d a 13 ± 1 oC, y después a 25 ± 2 oC.
Posteriormente cuando los frutos se trasladaron a 25 ± 2 oC y pasaron 3 d de su almacenamiento, la firmeza fue estadísticamente igual (P > 0.05) en los frutos SH0 y SH300, aunque los frutos SH600 tuvieron una firmeza ligeramente mayor. Es probable que a 25 ± 2 oC con el aumento de la actividad metabólica por efecto de la temperatura y mayor velocidad de producción de etileno (VPE) (Figura 1A), la pérdida de firmeza se haya acelerado en frutos de SH0 y SH300, ya que se ha demostrado que el etileno regula la actividad de las enzimas que degradan la pared celular (Ketsa et al., 1998).
En los frutos CH la firmeza disminuyó de 127 o 130.4 N a 40.0 o 40.2 N a los 20 d de almacenamiento a 13 ± 1 oC. Hubo una pérdida de firmeza estadísticamente (P < 0.05) mayor que en los frutos SH, alcanzando valores de 12.6 o 14.2 N cuando se almacenaron a 25 ± 2 oC (3 d), sin diferencia significativa (P ≥ 0.05) entre todos tratamientos CH. Esto se atribuye a que en estos frutos la VPE fue mayor (Figura 1B) y, como se ha indicado en otros trabajos, la actividad de las enzimas que degradan la pared celular son dependientes de la producción de etileno (Ketsa et al., 1998). Los resultados coinciden con lo reportado por (Osuna et al., 2007) donde en mango Keitt tratado con CH (46 oC por 110 min) y 1-MCP (300 nL L-1) no se observó efecto del 1-MCP en la retención de firmeza.
El efecto principal (P < 0.05) encontrado en la firmeza de los factores evaluados fue muy importante, ya que se pudo comprobar que el 1-MCP a 600 nL L-1 mantiene los frutos ligeramente más firmes, pero sólo si los frutos no son tratados hidrotérmicamente. Si el mango Ataulfo se trata con hidrotérmico, la pérdida de firmeza se acelera aun cuando los frutos tengan 1-MCP; por tanto el hidrotérmico afecta de manera importante la efectividad del 1-MCP en la firmeza de los frutos.
La acidez titulable (AT) disminuyó y el pH aumentó durante el almacenamiento en refrigeración de los frutos (Cuadro 1). Este cambio en la AT y pH se debe a que en los frutos en estado verde, el contenido de ácidos orgánicos es mayor; sin embargo, a medida que maduran, los ácidos orgánicos disminuyen ya que son sustratos importantes en el metabolismo respiratorio (Tsouvaltziz et al., 2007). En consecuencia, la AT disminuye y el pH aumenta. Al inicio del almacenamiento (día 1) los valores de la AT fueron de 4.6 a 4.9 % (día 1) con un pH de 2.7 a 2.9 en todos los frutos; este valor disminuyó a los 20 d a 13 ± 1 oC hasta 2.5 a 2.8 %, con pH de 3.5 a 3.7 para los frutos SH0, SH300, CH0, CH300 y CH600, sin diferencias significativas (P > 0.05) entre tratamientos. Para los frutos SH600 la disminución de la AT fue 3.4 % con un pH de 3.0, lo cual se atribuye a que el 1-MCP logró reducir la VR de estos frutos (Figura 1C), proceso fisiológico inversamente relacionado con el contenido de ácidos orgánicos (Tsouvaltziz et al., 2007).
Después del traslado a 25 ± 2 oC, la AT fue de 0.3 a 0.5 % y los valores de pH fueron de 4.3 a 4.4 sin diferencias significativas (P > 0.05) entre tratamientos. Según lo reportado por (Amornputti et al., 2014), el 1-MCP no muestra un efecto importante en variables tales como la AT, pH y sólidos solubles totales (SST); estos autores encontraron en frutas durian (Durio zibethinus) cv. Monthong un efecto ligero del 1-MCP sobre los SST, AT y firmeza, y los relacionaron con una disminución de la respiración. Por su parte (Osuna et al., 2007) mencionan que el tratamiento hidrotérmico disminuye en mayor proporción la AT, lo que coincide con lo encontrado en este trabajo.
Los SST aumentaron en los todos frutos evaluados (Cuadro1). Los valores iniciales (día 1) de SST fueron de 4.9 a 5.6 oBrix y al término de este almacenamiento (20 d a 13 ± 1 oC), los SST fueron de 15.1, 15.8 y 14.3 oBrix para frutos de SH0, SH300 y SH600, respectivamente. Para los frutos CH en el mismo periodo a 13 ± 1 oC, los SST fueron de 13.0 a 13.6 oBrix, sin diferencias significativas (P > 0.05) entre todos los tratamientos.
Cuando los frutos se trasladaron a 25 ± 2 oC y alcanzaron la madurez de consumo, los SST para los frutos SH0 fueron de 17.1 oBrix, de 16.0 oBrix para los frutos de SH300 y de 15.0 a 15.8 oBrix en los frutos de SH600, CH0, CH300 y CH600. Se observó un retraso en el aumento de los SST en los frutos SH600. Según (Blankenship y Dole, 2003), el 1-MCP puede retrasar los cambios en los SST al disminuir el metabolismo respiratorio y ablandamiento de los frutos.
El análisis factorial arrojó que en la acidez titulable, sólo el tratamiento hidrotérmico presentó efecto significativo (P < 0.05), siendo menos ácidos los frutos cuando se tratan hidrotérmicamente; esto es congruente con la mayor producción de CO2 en los frutos CH. En el pH y SST no se encontró efecto (P > 0.05) de ninguno de los factores principales evaluados. En general, las características fisicoquímicas se mantienen con valores aceptables cuando los frutos son sometidos a hidrotérmico y 1-MCP, condiciones benéficas que aseguran que los frutos mantienen su calidad cuando maduran.
El desarrollo del color característico de la madurez de los frutos SH0 y SH300 fue 100 % con tonalidades amarillo intenso después de 20 d a 13 ± 1 oC + 3 d a 25 ± 2 oC de almacenamiento, con signos de senescencia (pérdida de agua, marchitamiento); los frutos de SH600 mostraron 75 % de frutos amarillos y 25 % de frutos amarillos con tonalidades verdes en el mismo muestreo, lo que destaca la efectividad significativa (P < 0.05) de la dosis del 1-MCP para retrasar la madurez del fruto expresado en el color (degradación de la clorofila y el desarrollo de carotenoides en la cáscara), pero solo si los frutos son SH. Similares resultados obtuvieron (Amornputti et al., 2014) en fruta durian cv. Monthong.
En los frutos CH también se observó que 1-MCP retrasó el desarrollo de tonalidades amarillas durante el almacenamiento a 13 ± 2 oC, pero después de 2 d de haber sido transferidos a 25 ± 2 oC todos los frutos desarrollaron 100 % de color amarillo sin diferencias estadísticas significativas (P > 0.05). Los resultados coinciden con lo encontrado por (Osuna et al., 2007) en mango Keitt con y sin tratamiento hidrótermico y tratados con 1-MCP, en los que reportaron frutos SH que mostraron un efecto antagonista del etileno en el color de la pulpa, pero no así para los frutos CH. Esto debido a una acelerada síntesis de carotenoides inducida por el tratamiento hidrotérmico, antes de la aplicación de 1-MCP en los frutos. Sólo los frutos de mango Ataulfo SH pueden tener 1 o 2 d más en mercadeo después de su almacenamiento de traslado a Europa.
Contenido de ACC y actividad de la ACC oxidasa
Hasta el día 8 de almacenamiento en refrigeración (Figura 2), el contenido de ACC se mantuvo por debajo de los 20 nmoL g-1 en todos los tratamientos, lo que se atribuye a la baja actividad de la enzima ACC sintasa por efecto de la baja temperatura (Montalvo et al., 2007), acompañado de una reducida biosíntesis de etileno y un lento proceso de maduración. Hubo efecto significativo (P < 0.05) de la concentración de 1-MCP. Los frutos SH0 (Figura 2A) tuvieron el menor contenido de ACC con un valor máximo de 19.67 nmol ACC g-1; sin embargo, a mayor dosis de 1-MCP se observó mayor síntesis de ACC con valores máximos de 35.85 y 49.04 nmoL ACC g-1 a los 18 d para los frutos SH600 y SH1000, respectivamente, y después un descenso (Figura 2B y C).
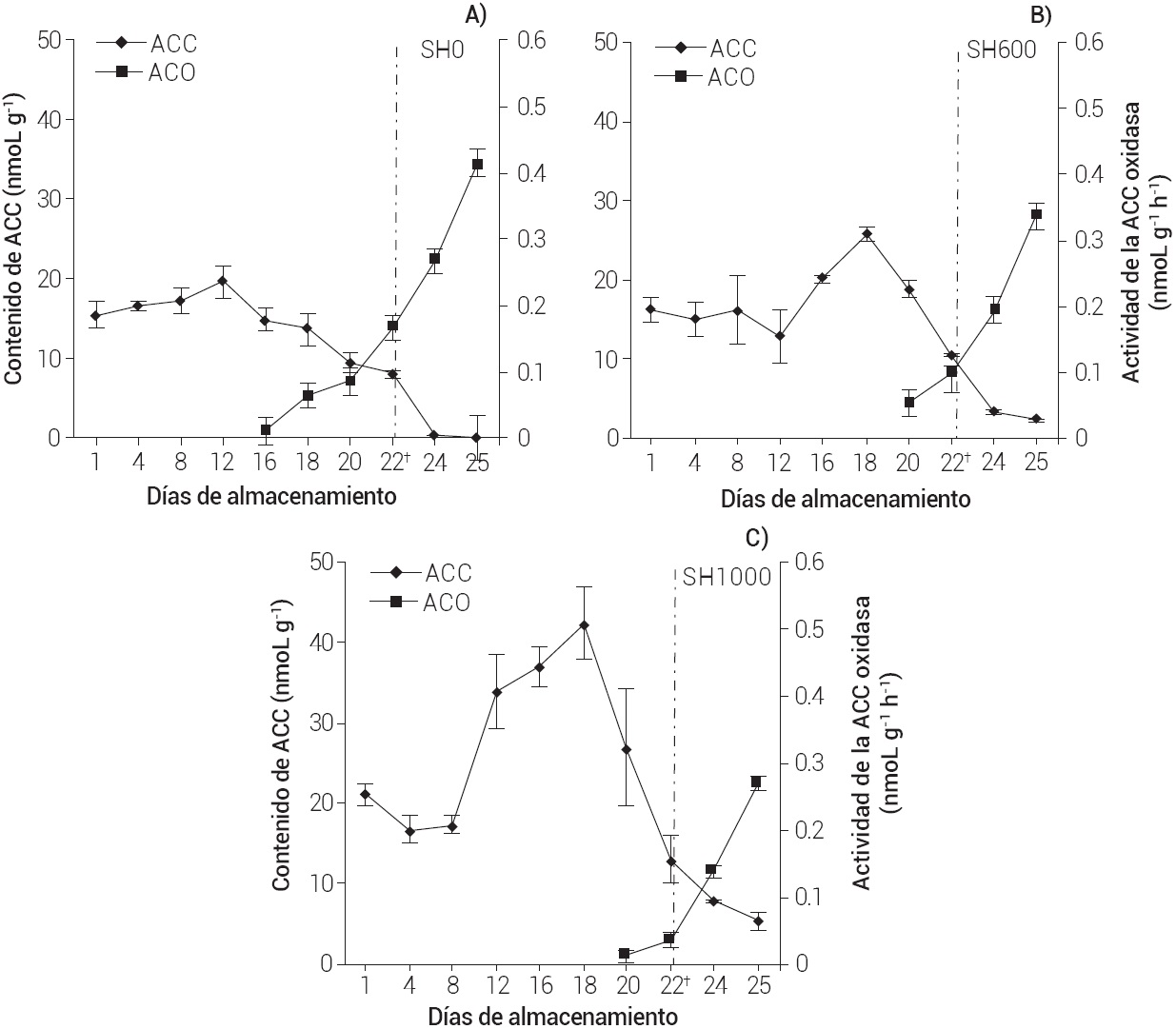
Figura 2 Contenido de ACC y actividad de la ACC oxidasa (ACO) en mango de la var. Ataulfo sin (SH) hidrotérmico, tratado con 0 (SH0), 600 (SH600) y 1000 (SH1000) nL L-1 de 1-MCP por 24 h a 20 ± 1 oC, almacenado por 20 d a 13 ± 1 oC y después a 25 ± 2 oC(†).
El mayor aumento del ACC en los frutos tratados con 1-MCP se atribuye a que el antagonista no disminuyó la actividad de la enzima ACC sintasa, pero sí redujo la actividad de la ACC oxidasa, lo que causó una mayor acumulación de ACC en estos frutos. Este resultado coincide con lo reportado por otros autores en manzana y pera respectivamente, que mencionaron que el 1-MCP no disminuye la expresión de algunos genes que codifican para la ACC sintasa (ACS3), al provocar una actividad normal de la enzima (Xie et al., 2014; Yang et al., 2013).
La disminución rápida del ACC en los frutos tratados con 1-MCP no coincidió con el aumento de la VPE para los mismos días. Ello se atribuye a que existen rutas alternas de degradación de ACC (ruta de la malonización) para producir ácido 1-(malonilamino) ciclopropano-1-carboxilico (MACC) en la biosíntesis de etileno, el cual se lleva acabo cuando el fruto se encuentra en estrés (cambio de temperatura de almacenamiento) y está asociado con el aumento de los niveles de ACC (Abeles et al., 1992). La disminución en el contenido de ACC en todos los tratamientos coincidió con el inicio de la actividad de la ACC oxidasa, y se observó que en los frutos en los que se aplicó la mayor concentración de 1-MCP se retrasó la actividad de la enzima; un comportamiento similar se reportó en brócoli (Ma et al., 2009) y ciruela (Khan y Singh, 2009).
El efecto estadístico principal del 1-MCP, arrojó que se llevó acabo la disminución en los compuestos involucrados en la biosíntesis de etileno (ACC y ACC oxidasa) para los frutos SH1000, y estuvo relacionado con el retraso en la evolución de las variables físicas y químicas medidas. Aunque, se observó un comportamiento similar en la firmeza, AT, pH y SST de los frutos respecto al experimento 1, el retraso de la maduración fue mayor en los frutos tratados con SH1000. Las pérdidas de firmeza y en AT disminuyeron más lentamente, y el pH y SST ascendieron de manera más lenta, en comparación con los frutos SH0 y SH600 (Cuadro 2). Esto coincidió con el porcentaje de frutos maduros, ya que 100 % de frutos SH0 y SH600 se tornaron color amarillo a los 3 d después de trasladarse a 25 oC con signos de senescencia (reducción de tamaño, marchitamiento); mientras que los frutos SH1000 maduraron 100 % sin signos de senescencia hasta los 27 d, lo que significa un aumento de 5 d de vida útil en comparación con los otros frutos, al considerar al color como variable de respuesta.
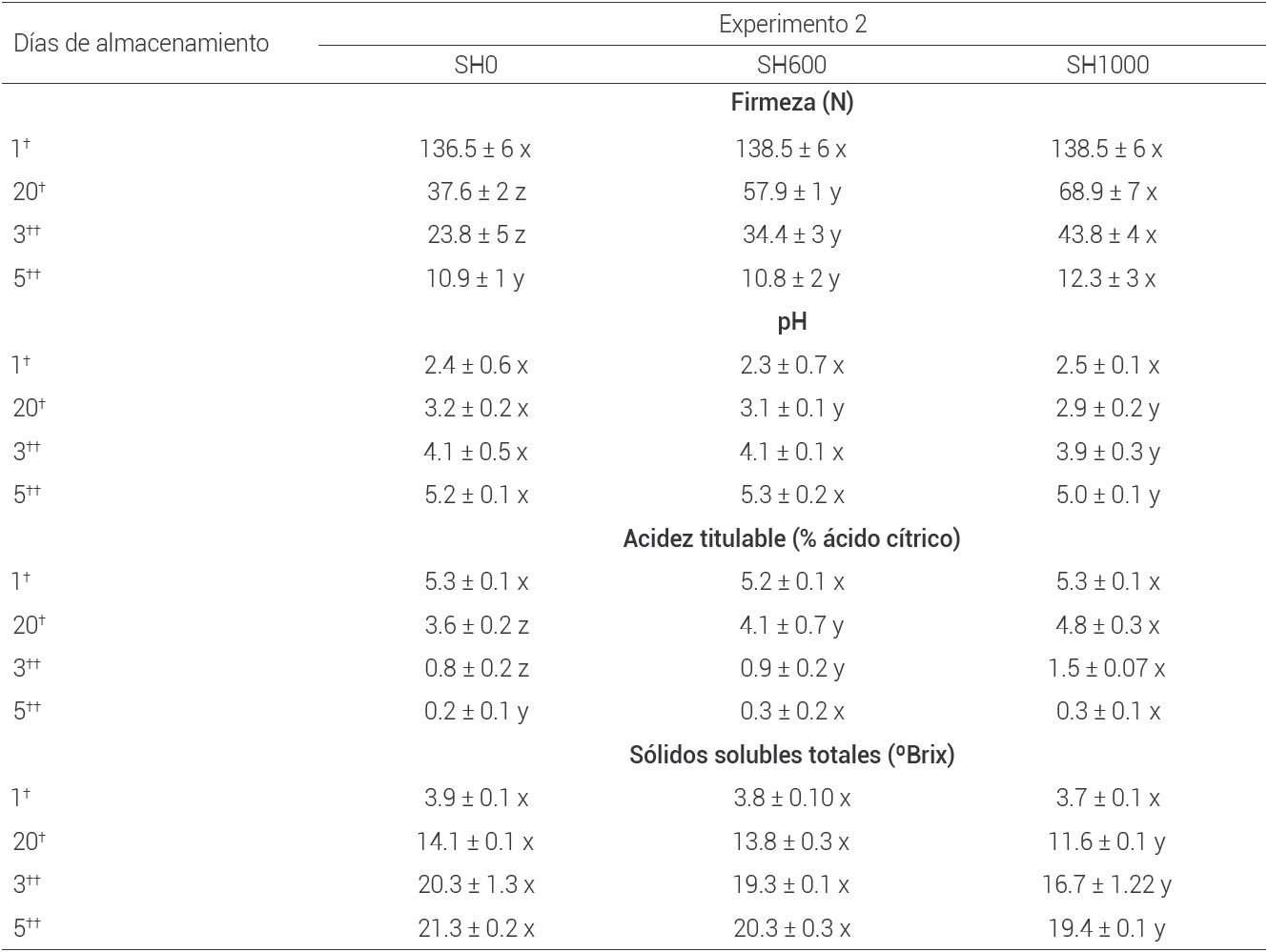
Medias con diferente letra (x, y, z) por fila son estadísticamente diferentes (P ≤ 0.05). †Mango almacenado a 13 ± 1 ºC por 20 d. ††Mango almacenado a 25 ± 2 ºC, previo a 20 d a 13 ± 2 ºC.
Cuadro 2 Características fisicoquímicas en mango var. Ataulfo sin (SH) tratamiento hidrotérmico tratados con 1-MCP por 24 h a 20 oC a 0 (SH0), 600 (SH600) y 1000 (SH1000) nL L-1, y posteriormente almacenado por 20 d a 13 ± 1 oC y después a 25 ± 2 oC.
Análisis de transcritos Mi-ETR y ACO-1
El análisis de los transcritos de la ACC oxidasa (ACO-1) en frutos SH0 y SH600 almacenados a 25 ± 2 oC muestra que la expresión de estos transcritos aumenta durante el tiempo de almacenamiento, pero se puede observar una menor expresión (mancha tenue) en los frutos SH600 a los días 1 y 3 de almacenamiento; sin embargo, a los 5 d no se observa diferencia en expresión entre frutos SH0, SH600 y SH1000 (Figura 3). De la misma manera, desde el día 4 de almacenamiento se observó la expresión del transcrito Mi-ETR1 (Figura 4) tanto en los frutos SH0 como en los frutos SH600, aunque la intensidad de expresión fue ligeramente menor en SH600, lo que coincide con la expresión del transcrito ACO-1. En el día 5 de almacenamiento los frutos control (SH0) tuvieron una expresión considerable del transcrito Mi-ETR1 con respecto a los frutos de SH600 y SH1000, lo cual indica que hubo efecto del 1-MCP en el retraso de transcripción de este gen en los frutos tratados.
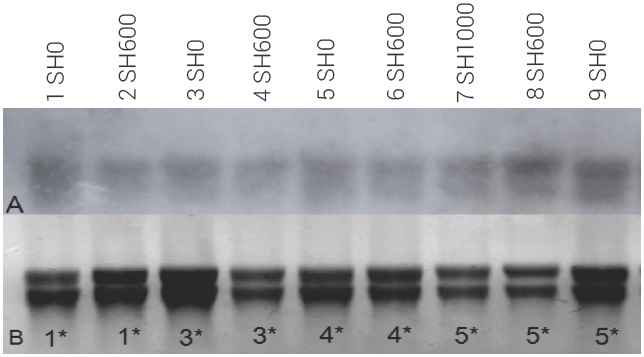
Figura 3 Ensayo de análisis Northern blot (A) del transcrito de ACC oxidasa (ACO-1) del mango var. Ataulfo testigo (SH0, carriles uno, tres, cinco y nueve), tratado con 1-MCP a 600 nL L-1 (SH600, carriles dos, cuatro, seis y ocho) y 1000 nL L-1 (SH1000, carril siete) por 24 h a 20 ± 2 oC. *Días uno a cinco de almacenamiento a 25 oC. Gel desnaturalizante con las mismas muestras (B).
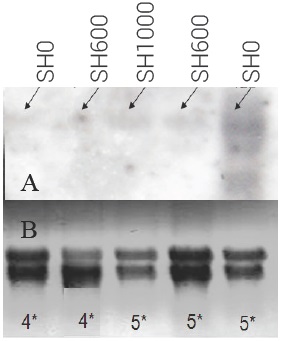
Figura 4 Ensayo de análisis Northern blot (A) del transcrito de receptor de etileno (Mi-ETR1) del mango var. Ataulfo testigo (SH0, carriles uno y cinco), tratado con 1-MCP a 600 nL L-1 (SH600, carriles dos y cuatro) y 1000 nL L-1 (SH1000, carril tres) por 24 h a 20 ± 2 oC. *Días cuatro a cinco de almacenamiento a 25 oC. Gel desnaturalizante con las mismas muestras (B).
Los estudios realizados en pera y manzana tratadas con 1-MCP sobre la expresión de los genes de ACC sintasa, ACC oxidasa y receptores de etileno, mostraron que el 1-MCP retardó el proceso de maduración por disminución y retraso de la expresión de los genes ACS1, ACO1 y ACO2, correspondientes de las enzimas evaluadas; así como la reducción en la expresión de genes receptores de etileno a nivel transcripcional (ETR1, ETR2, ETR5, ERSs, CTR1, EIN2A, EIL4 y ERFs).
Sin embargo, no hubo efecto del 1-MCP en la inhibición o retraso de la expresión de los genes ACS3, ACO3, y EIN2B, por lo que los autores concluyeron que si bien algunos genes se reprimen por el 1-MCP, otros pueden iniciar rutas metabólicas alternas de síntesis de etileno (Xie et al., 2014; Yang et al., 2013). Esto quiere decir que la expresión de algunos genes clave para retrasar la maduración de los frutos es variable y dependiente del fruto, lo que explica la inconstante efectividad del 1-MCP entre frutos y hortalizas (Xie et al., 2014).
En este segundo experimento y de acuerdo con el efecto principal encontrado por el 1-MCP, al aumentar la concentración de 1-MCP a frutos SH, la biosíntesis de etileno se retrasa en mayor proporción que en el experimento 1, debido a que hay un retraso en la expresión de transcritos involucrados en la síntesis etileno, hormona de la maduración; estos resultados permiten explicar el aumento adicional en la vida de anaquel de estos frutos.
Conclusiones
La dosis de 1000 nL 1-MCP L-1 sin tratamiento hidrotérmico logró retrasar el proceso de maduración 5 d en las mismas condiciones de simulación de traslado a Europa, al disminuir la actividad de la ACC oxidasa, expresión de transcritos de ACC oxidasa y receptor de etileno involucrados en la biosíntesis del etileno y la maduración de los frutos. Estos resultados contribuyen a facilitar el mercado de exportación del mango a Europa.











 nueva página del texto (beta)
nueva página del texto (beta)


