Introducción
El género Litsea (Lauraceae) comprende alrededor de 400 especies, la mayoría de ellas nativas de Asia oriental, del Archipiélago Malayo, Australia y Nueva Zelanda. En América se reconocen sólo ocho especies de este género, las cuales se distribuyen desde la costa este de los EE.UU., hasta las zonas montañosas de Costa Rica. En México, el género se distribuye en la mayoría de las zonas montañosas, excepto en las penínsulas de Baja California y Yucatán (Jiménez-Pérez y Lorea-Hernández, 2009). La especie con la distribución más amplia en México es Litsea glaucescens Kunth, un árbol o arbusto de 3 a 12 m de alto que se distribuye únicamente en cañadas húmedas de las zonas montañosas, desde el norte de México hasta Costa Rica, siempre asociado a los bosques de encinos (Quercus spp.).
A lo largo de su zona de distribución, esta especie recibe varios nombres comunes como laurel, laurel silvestre, laurelillo, laurel de olor, laurel de campo, laurel delgado,"ecapatli", "cuauhxihuitl" (en náhuatl); "wixi tika'a", "tu Káa", "yucú ñesachoetiaá" (mixteco) y "sanshiño" (mazahua). Las hojas de esta especie, al igual que las de la mayoría de las que integran el género Litsea, producen aceites esenciales que hacen que sea muy apreciada como condimento, además de tener varios usos medicinales (Jiménez-Pérez et al. 2011). Ya se ha demostrado la presencia de compuestos fenólicos con una alta actividad antioxidante en las hojas y madera de esta especie, lo cual valida su uso medicinal (Tapia-Torres et al. 2014).
Lo anterior hace que Litsea glaucescens sea una de las especies forestales no maderables de mayor interés en México. Por otro lado, en varias regiones del país el laurel silvestre es usado también para la elaboración de arreglos (ramos) ornamentales para la ceremonia católica del "Domingo de Ramos". Esto último ha causado un grave perjuicio a la especie, ya que la fecha en que son colectadas las ramas jóvenes coincide con el inicio de la floración, lo que hace que en las poblaciones sobreexplotadas la producción de semillas sea nula. Además, las plantas sometidas a esta colecta anual se ven alteradas en su hábito de crecimiento y nunca llegan a alcanzar un porte arbóreo (Dávila-Figueroa et al. 2011; Montañez-Armenta et al. 2011). Esto, aunado a otros factores como la constante deforestación, sequías e incendios forestales, ha colocado a esta especie en riesgo de extinción, y actualmente se encuentra protegida por la ley mexicana (NORMA Oficial Mexicana NOM-059-SEMARNAT-2010).
La biotecnología puede ofrecer herramientas muy interesantes para el manejo racional de las especies forestales, incluyendo aquellas que están amenazadas o cuyas poblaciones se reducen debido a la sobreexplotación. Una de estas herramientas es la propagación in vitro, la cual permite la producción masiva de ejemplares con fines de establecimiento de plantaciones comerciales, reforestación o explotación sostenible. En Litsea glaucescens se ha trabajado muy poco al respecto ya que hay sólo un reporte acerca de su multiplicación in vitro a través del cultivo de yemas axilares (Valle-Rodríguez et al., 2013).
En las especies forestales, la vía de regeneración in vitro que ha mostrado la mayor eficiencia es la embriogénesis somática, misma que ya se utiliza a nivel comercial con algunas especies, sobre todo coníferas (Grossnickle y Sutton, 1999). La mayoría de los protocolos de embriogénesis somática reportados para especies forestales son indirectos, ya que primero se requiere la generación de tejido calloso embriogénico, a partir del cual se generan los embriones somáticos en una segunda fase. A la fecha no existen reportes de sistemas de embriogénesis somática en el género Litsea. En la familia Lauraceae hay reportes en este sentido para el laurel europeo (Laurus nobilis) (Canhoto et al., 1999), así como para los géneros Cinnamomum (Shi et al., 2009), Ocotea (Moura-Costa et al., 1993; Catarina et al., 2003) y Persea (Pliego-Alfaro, 1988).
En este trabajo se reporta el desarrollo de un sistema eficiente para la regeneración in vitro del laurel silvestre (Litsea glaucescens), por la vía de la embriogénesis somática a partir de embriones cigóticos maduros.
Materiales y métodos
Colecta y desinfección del material vegetal
Se trabajó con frutos inmaduros y maduros de Litsea glaucescens Kunth colectados en la localidad de Barranca Obscura, localizada en la Sierra del Laurel (21º 46' 26.3 N, 102º 38' 31.0 O, 2357 msnm), y en la Estación Biológica Agua Zarca perteneciente a la Universidad Autónoma de Aguascalientes, localizada en la Sierra Fría (22º 05' 33.1 N, 102° 33' 23.2 O, 2171 msnm). Ambas localidades se encuentran en el Estado de Aguascalientes, México. Los frutos fueron llevados al laboratorio donde se lavaron con agua corriente y jabón desinfectante (Dermoclean®), se enjuagaron, secaron y almacenaron a 5 °C hasta su uso. Para la desinfección, los frutos se colocaron en etanol a 70 % por 1 min, se enjuagaron y se trataron por 25 min con una solución a 20 % de blanqueador comercial a base de hipoclorito de sodio (Cloralex®), esto en un recipiente sellado. En la campana de flujo laminar los frutos se enjuagaron cuatro veces con agua destilada estéril. Con ayuda de equipo de disección estéril se eliminó la pulpa del fruto y la testa de la semilla, con el fin de dejar sólo el embrión descubierto. Estos embriones fueron usados como explantes para la generación de tejido calloso.
Inducción de tejido calloso y diferenciación de embriones somáticos
Los embriones aislados y desinfectados fueron inoculados en medio basal de cultivo de Murashige y Skoog (MS), a pH 5.7, con 30 g L-1 de sacarosa y 8 g L-1 de agar (Sigma-Aldrich) como gelificante. Se probaron los siguientes tratamientos para la inducción de callo embriogénico: I1) medio basal; I2) medio basal con 4 g L-1 de carbón activado; I3) medio basal con 0.5 mg L-1 de benciladenina (BA); I4) medio basal con 1.0 mg L-1 de BA e I5) medio basal con 1.0 mg L-1 de cinetina. Se inocularon 20 embriones por tratamiento y el experimento completo se llevó a cabo tres veces.
Los cultivos se incubaron en la obscuridad a 25 ± 2 °C por 21 d y luego se transfirieron a condiciones de fotoperiodo 16:8 con luz fluorescente (lámparas luz de día, 54 μmol m-2 s-1) en las que se incubaron por otros 21 d. Pasado este tiempo de incubación, todas las líneas de tejido calloso generadas, independientemente del tratamiento del cual procedían, se transfirieron al medio de diferenciación (medio basal con 4 g L-1 de carbón activado). Las líneas de tejido calloso generadas se mantuvieron mediante subcultivos a este mismo medio cada 40 d, y se observaron periódicamente al microscopio óptico para verificar la presencia de embriones somáticos en sus diferentes estadios de desarrollo. Las líneas que presentaron embriones en etapa globular, de corazón y de torpedo, fueron consideradas como embriogénicas.
Por otro lado, con el fin de conocer la productividad del sistema de regeneración desarrollado, se inocularon 24 recipientes de cultivo con medio de diferenciación con exactamente 1 g de tejido calloso. A los 80 d de incubación se determinó el número de embriones generado por g de tejido calloso. Los embriones somáticos bien diferenciados generados de los experimentos anteriores fueron transferidos a los medios de maduración y germinación. Algunas muestras de estos tejidos fueron preparadas para su análisis por microscopía electrónica de barrido. Para esto, los tejidos se fijaron en glutaraldehido a 2 % por 24 h, luego se deshidrataron en etanol a 60, 70, 80, 90, 96 y 100 % por 15 min en cada etapa. Se utilizó un secador de punto crítico para eliminar la humedad remanente (Smadri®, Tousimis, USA). Las muestras ya secas se colocaron en cintas de grafito y se adhirieron a cilindros de aluminio. Luego se cubrieron con oro con un equipo Vacuum Desk II® (Denton, USA). Finalmente se observaron y fotografiaron con un microscopio electrónico de barrido JSM-5900lv® (Jeol, Japan).
Maduración y germinación de embriones somáticos
Se tomaron embriones somáticos bien diferenciados, en promedio de 3 mm de longitud y con una morfología normal, generados en el medio de diferenciación y se transfirieron a medios diseñados para promover su maduración y germinación. Con este fin se probaron los siguientes tratamientos: G1) medio basal con 5 g L-1 de carbón activado y 12 g L-1 de agar como gelificante; G2) medio basal a 50 % con 5 g L-1 de carbón activado y 12 g L-1 de agar; G3) medio basal con 5 g L-1 de carbón activado y 13 g L-1 de agar; G4) medio basal con 5 g L-1 de carbón activado y 14 g L-1 de agar y G5) medio basal con 6 g L-1 de carbón activado y 12 g L-1 de agar. Se probaron 20 embriones somáticos por cada tratamiento y el experimento completo se realizó tres veces. Los cultivos se incubaron a 25 ± 2 °C bajo un fotoperíodo 16:8 con luz fluorescente (luz de día, 54 μmol m-2 s-1). A los 40 d de incubación se registró el porcentaje de embriones germinados, así como de los que respondieron de otras maneras, ya sea creciendo y generando nuevamente tejido calloso, o multiplicándose a través de la embriogénesis somática secundaria.
Desarrollo de las plantas y transferencia a suelo
Los embriones germinados se transfirieron a medio basal a 50 % con 15 g L-1 de sacarosa y 8 g L-1 de agar como gelificante, con el fin de promover el crecimiento de las plantas. Cuando éstas alcanzaron una altura mínima de 7 cm se retiró el sello y se aflojó la tapa de los recipientes, y se dejaron 2 semanas en estas condiciones. Luego las plantas se sacaron de los recipientes, se les lavaron las raíces con agua corriente para eliminar los restos del medio de cultivo, y se plantaron en bolsas para vivero de 800 mL de capacidad con un substrato rico en materia orgánica tomado de bosques de encino ("tierra de encino"). Los recipientes con las plantas se cubrieron con una bolsa de plástico para mantener la humedad por otras dos semanas. Transcurrido este periodo las plantas fueron llevadas al invernadero. La tasa de supervivencia de las plantas se registró a los 60 d de haber sido transferidas al invernadero. Se consideró que la adaptación a las condiciones ex vitro fue exitosa cuando las plantas generaron hojas nuevas y reiniciaron su crecimiento.
Resultados y discusión
El método de desinfección empleado fue eficiente, ya que la contaminación en embriones obtenidos de semillas inmaduras fue menor a 10 %, mientras que en los procedentes de semillas maduras fue de alrededor de 15 %. Sin embargo, al utilizar embriones obtenidos a partir de semillas inmaduras como explante, la respuesta fue prácticamente nula debido a la necrosis causada por la oxidación de los tejidos. En contraste, los embriones provenientes de semillas maduras no sufrieron oxidación y con ellos se logró el establecimiento de cultivos in vitro en más del 80 % de los casos. Para esto fue esencial la eliminación de la testa de la semilla, ya que sin este procedimiento la respuesta se demoró hasta seis meses.
Inducción de tejido calloso embriogénico y diferenciación de embriones somáticos
La inducción de tejido calloso embriogénico mediante el uso de embriones procedentes de semillas inmaduras no fue posible debido a que todos los explantes se necrosaron por oxidación. En el caso de los embriones procedentes de semillas maduras, se logró la generación de tejido calloso embriogénico en los tratamientos con carbón activado y citocininas aunque con eficiencias diferentes (Cuadro 1).

MS = Medio de Murashige y Skoog a pH 5.7, con 30 g L-1 de sacarosa y 8 g L-1 de agar; CA = carbón activado; BA = benciladenina; †Los valores representan la media; ± ES (error estándar), datos tomados 80 d después de la transferencia del tejido a medio de diferenciación, MS con 4 g L-1 CA. Medias con letras iguales por columna no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 1 Generación de tejido calloso a partir de embriones cigóticos maduros de Litsea glaucescens y diferenciación de embriones somáticos a partir del mismo.
En el testigo, con medio basal sin reguladores del crecimiento ni carbón activado (I1), se observó sólo la germinación de los embriones cigóticos inoculados y la formación de plántulas, pero no la generación de tejido calloso. En el tratamiento con carbón activado (I2) se generó un tejido calloso friable y con presencia de clorofila en 18 % de los embriones inoculados (Figura 1A). En este caso, se comenzó a observar la aparición de embriones somáticos en el mismo medio en que se generó el tejido calloso, a partir del tercer subcultivo. En el resto de los embriones se generó un tejido calloso compacto, no embriogénico, que a las 2 o 3 semanas de su inducción se oxidó y necrosó.

Figura 1 Aspectos del proceso de la embriogénesis somática en Litsea glaucescens. A) Tejido calloso embriogénico generado a partir de un embrión cigótico cultivado en medio con carbón activado ; B) Aparición de embriones somáticos en etapas globular y de corazón en tejido calloso cultivado en el medio de diferenvciación; C) Embriones somáticos completamente diferenciados (etapa de torpedo) y D) Embrión somático mostrando el desarrollo normal de los cotiledones y la radícula.
En los tratamientos con BA se generó también tejido calloso friable, pero en este caso carente de clorofilas. El tratamiento con 1 mg L-1 de BA (I4) fue el más eficiente para la generación de tejido embriogénico, ya que éste se formó en 29 % de los embriones maduros inoculados. Sin embargo, esta eficiencia se redujo notablemente al usar 0.5 mg L-1 de BA (I3), en donde sólo ocurrió en 8 % de los casos.
En los tratamientos con BA, los embriones generados no se llegaron a diferenciar por completo. Esto sólo sucedió al transferir este tejido al medio sin citocininas y con carbón activado.
Finalmente, en el tratamiento con cinetina (I5) se generó también tejido calloso friable y no pigmentado en 13 % de los embriones inoculados. En este tratamiento sí se observó la diferenciación de embriones somáticos en el medio, pero la mayoría de ellos tenían una morfología anormal y estaban hiperhidratados. Es importante mencionar que previamente a los experimentos descritos, se probaron diversos tratamientos con auxinas, o auxinas combinadas con citocininas, para la inducción del tejido embriogénico a partir de embriones cigóticos maduros e inmaduros. Las auxinas que se probaron fueron el ácido 2, 4 diclorofenoxiacético (2, 4-D), el picloram y el ácido naftalenacético (ANA), solas o combinadas con cinetina. Esto se realizó debido a que en la gran mayoría de los sistemas de embriogénesis somática reportados en la literatura, la inducción del tejido embriogénico se logra con esos tratamientos (Gaj, 2004).
Sin embargo, en el caso de Litsea glaucescens la totalidad de los embriones cigóticos sometidos a tratamientos con las auxinas mencionadas se oxidaron y necrosaron. En ningún caso se observó la producción de tejido calloso. Por este motivo, se optó por cambiar el tipo de tratamientos usados para la inducción del tejido calloso embriogénico, para probar los tratamientos con citocininas sin los otros reguladores del crecimiento antes descritos. Si bien sólo en alrededor de 12 % de los sistemas de embriogénesis somático reportados se utilizan medios con citocininas, y en menos del 7 % se refieren a medios sin reguladores del crecimiento para la fase de inducción del tejido embriogénico (Gaj, 2004), en L. glaucescens éstos fueron los tratamientos que generaron resultados positivos.
En cuanto al uso de carbón activado en el medio de cultivo, este ingrediente detiene los procesos de oxidación al adsorber compuestos fenólicos e inactivar las enzimas polifenol oxidasas y peroxidasas (Pan y van Staden, 1998). Su efecto positivo en el proceso de embriogénesis somática ya se ha reportado para otras especies leñosas. Paiva-Neto et al. (2003) afirman que la presencia de carbón activado en el medio de cultivo es crítica para la generación de embriones somáticos al partir de embriones cigóticos como explante en Bixa orellana. Un resultado muy similar se ha reportado también para el género Quercus, en donde el carbón activado promovió notablemente el crecimiento de los embriones somáticos (Pintos et al. 2010).
Una vez que se transfirió el tejido calloso embriogénico al medio de diferenciación, los embriones somáticos iniciaron su desarrollo y en aproximadamente 45 d fue posible detectarlos visualmente. Los embriones somáticos generados a partir del tejido calloso obtenido en los medios con carbón activado (I2) y con BA (I3 e I4), mostraron un desarrollo aparentemente normal, con las etapas distintivas de este proceso, globular, de corazón (Figuras. 1B, 2A y B) y de torpedo (Figura 1C). La morfología de los embriones somáticos maduros generados a partir de tejido calloso inducido en los medios mencionados fue normal en la mayoría de los casos con cotiledones bien diferenciados y una radícula (Figura 1D).

Figura 2 Fotografías con microscopía electrónica de barrido del proceso de la embriogénesis somática en Litsea glaucescens. A) Aparición de embriones somáticos en etapas globular; B) Aparición de embriones somáticos en etapa de corazón en tejido calloso cultivado en el medio de diferenciación; C) Embrión somático en el que es visible ya la aparición de las primeras hojas verdaderas; y D) Embrión somático en el que es visible el alargamiento de la radícula.
Sin embargo, en los embriones generados a partir de tejido calloso inducido en medio con cinetina (I5) se observó una hiperhidratación y desarrollo anormal de los embriones, por lo que nunca llegaron a madurar ni a germinar. En cuanto a la productividad del sistema, se observó que cada gramo de tejido calloso embriogénico procedente de los tratamientos I2, I3 e I4, generó un promedio de 282 ± 14 embriones somáticos a los 80 d después de haber sido transferido al medio de diferenciación, sin presentar diferencias entre el tejido calloso procedente de los tres tratamientos mencionados (Cuadro 1).
No se obtuvieron datos similares para especies de la familia Lauraceae, pero la eficiencia es comparable a los 248 embriones por gramo de tejido calloso embriogénico reportados para Pinus halepensis (Montalbán et al., 2013), muy superior a los 21 embriones por gramo de tejido embriogénico reportados para Pinus taeda (Wei, 2001), y los 36.5 embriones por gramo de tejido embriogénico reportados para Abies cephalonica (Krajňáková et al., 2009).
Maduración y germinación de los embriones somáticos
En los tratamientos diseñados para la maduración y germinación de los embriones somáticos se observaron tres respuestas (Figura 3). Algunos embriones germinaron y en la mayoría de los casos se convirtieron en plantas normales. Los embriones que germinaron comenzaron a tornarse de color verde y a los pocos días eran visibles las primeras hojas verdaderas (Figura 2C). Posteriormente se observó el alargamiento de la radícula (Figura 2D). Otros embriones no germinaron, sólo crecieron, se hiperhidrataron y finalmente se volvieron a desdiferenciar para formar nuevamente tejido calloso. Un tercer conjunto de embriones generaron nuevos embriones somáticos sobre su superficie (embriogénesis secundaria). Sin embargo, los embriones secundarios eran más pequeños que los primarios y no se observó la germinación de los mismos. La frecuencia en la que se presentó cada una de estas respuestas varió entre los tratamientos probados.
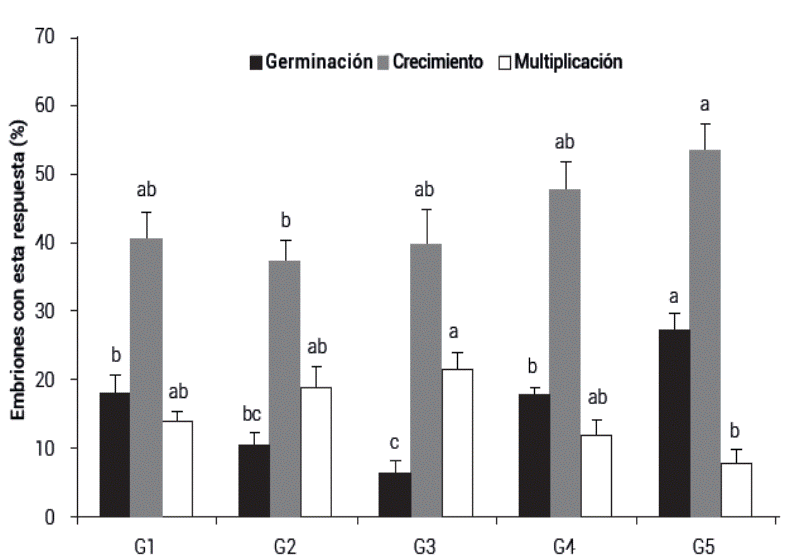
Figura 3 Germinación, crecimiento y multiplicación de embriones somáticos de Litsea glaucescens. Tratamientos: G1: Medio basal con 5 g L-1 de carbón activado y 12 g L-1 de agar como gelificante; G2: Medio basal a 50 % con 5 g L-1 de carbón activado y 12 g L-1 de agar; G3: Medio basal con 5 g L-1 de carbón activado y 13 g L-1 de agar; G4: Medio basal con 5 g L-1 de carbón activado y 14 g L-1 de agar, y; G5: Medio basal con 6 g L-1 de carbón activado y 12 g L-1 de agar. Se muestran promedios ± error estándar. Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
En cuanto a la germinación, la mayor respuesta se presentó en el medio basal con 6 g L-1 de carbón activado y 12 g L-1 de agar (G5), con una frecuencia de 27 %. En este medio fue también en donde se presentó la mayor frecuencia de embriones que sólo crecieron y volvieron a generar callo, sin germinar, con 53 %. La embriogénesis secundaria se presentó con mayor frecuencia (21 %) en el medio basal con 5 g L-1 de carbón activado y 13 g L-1 de agar (G3). En todos los medios probados para la germinación de los embriones se observó que algunos de ellos se oxidaron y necrosaron. Esto fue más evidente en el medio G2 donde se necrosó el 34 % de los embriones inoculados, que contrasta con el G5 en donde el fenómeno sólo se observó en 12 % de los casos.
Una característica en común que tenían todos los tratamientos en los que se logró la maduración y germinación de los embriones somáticos de laurel silvestre fue el uso de concentraciones de agar muy superiores a los 8 g L-1 comúnmente usados en el medio MS. En experimentos previos se probaron medios con esta concentración de agar, observándose resultados muy pobres en cuanto a la germinación de los embriones y una muy alta proporción de embriones hiperhidratados. Ya se ha reportado que el uso de altas concentraciones de gelificante disminuye la disponibilidad de agua en el medio (reduce su potencial hídrico). Esta condición favorece la maduración de los embriones somáticos en Pinus strobus (Klimaszewska et al., 2000).
Desarrollo de las plantas y transferencia a suelo
Los embriones somáticos germinados, reconocibles por haber adquirido un color verde y por el alargamiento de la radícula (Figura 4A), fueron transferidos a medio basal a 50 % con 8 g L-1 de agar como gelificante con el fin de estimular su conversión a plantas completas. Esto se logró en 87 % de los casos (Figura 4B), siendo una eficiencia de conversión superior al 63 % reportado para Cinnamomum pauciflorum, otro miembro de la familia Lauraceae (Kong et al., 2009). Las plantas generadas a partir de embriones somáticos fueron mantenidas in vitro en el medio señalado con el fin de que adquirieran un mayor vigor (aproximadamente 40 d), y posteriormente fueron adaptadas y transferidas a suelo en donde el 76 % de las plantas sobrevivió y reinició su crecimiento (Figura 4C).

Figura 4 Germinación y conversión en plántulas de embriones somáticos de Litsea glaucescens. A) Embriones somáticos germinados en el medio basal con 6 g L-1 de carbón activado y 12 g L-1 de agar; B) Plántula generada a partir de un embrión somático germinado cultivado en medio basal a 50 % con 8 g L-1 de agar y C) Plantas regeneradas creciendo en suelo 5 meses después de su transferencia.
Conclusiones
Se demostró la posibilidad de regenerar in vitro a la especie Litsea glaucescens a través de la embriogénesis somática partiendo de embriones cigóticos maduros y con un sistema indirecto que implica la generación primero de tejido calloso embriogénico. Este sistema de regeneración puede ser una herramienta importante para el manejo racional de esta especie, y es susceptible de ser escalado para generar una gran cantidad de plantas.











 nueva página del texto (beta)
nueva página del texto (beta)


