Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista fitotecnia mexicana
Print version ISSN 0187-7380
Rev. fitotec. mex vol.36 n.1 Chapingo Jan./Mar. 2013
Artículo de Revisión
Composición, fisiología y biosíntesis de la cutícula en plantas
Composition, physiology and biosynthesis of plant cuticle
Julio C. Tafolla-Arellano1, Alberto González-León1, Martín E. Tiznado-Hernández1, Lorenzo Zacarías García2 y Reginaldo Báez-Sañudo1*
1 Coordinación de Tecnología de Alimentos de Origen Vegetal, Centro de Investigación en Alimentación y Desarrollo, A. C. Km 0.6 carretera a la Victoria, Apdo. Postal 1735. 83000, Hermosillo, Sonora, México. Tel.: +52 (662) 289 2421; Fax +52 (662) 289 2400 ext. 227.
2Instituto de Agroquímica y Tecnología de Alimentos, Consejo Superior de Investigaciones Científicas. Avenida Agustín Escardino, 7. 46980, Paterna. Valencia, España. *Autor para correspondencia (rbaez@cascabel.ciad.mx, rbaez@ciad.mx)
Recibido: 11 de Mayo del 2012
Aceptado: 21 de Noviembre del 2013
Resumen
La cutícula es la capa protectora que se encuentra en la superficie más externa de las plantas y que interacciona con el ambiente, la cual se encuentra en todas las partes aéreas de las plantas superiores. La cutícula está constituida principalmente de dos tipos de polímeros lipofílicos, cutina y ceras cuticulares, los cuales son alterados tanto en su composición como ultraestructura por factores genéticos, fisiológicos y ambientales, tanto durante el crecimiento y desarrollo como durante la postcosecha, por lo que no se debe generalizar sobre su morfología y composición química. La cutícula desempeña un papel importante al actuar como una barrera que reduce la pérdida de agua y difusión de gases, evita la acumulación de agua y polvo, participa en las interacciones planta-insecto, participa en la traducción de señales para la activación de genes específicos, controla los cambios de temperatura, y provee soporte mecánico. Aun cuando se conoce mucho sobre la composición y ultraestructura de la cutícula, es relativamente poco lo que se conoce acerca de su biosíntesis. En la presente revisión se compila y analiza la información científica actual referente a la biosíntesis de la cutícula, que incluye los trabajos más recientes sobre las vías de transporte de los polímeros cuticulares a través de la pared celular, que es el fenómeno menos conocido.
Palabras clave: Cutícula, ceras, cutina, biosíntesis.
Abstract
The cuticle is a protective layer located in the outermost surface of all aerial tissues of higher plants and therefore, interacts with the environment. The cuticle is composed mainly of two types of lipophilic polymers, namely: cutin and cuticular waxes, which composition and ultrastructure can be altered by genetic, physiological and environmental factors, both during growth and development as well as during postharvest; its morphology and chemical composition cannot be generalized. The cuticle plays an important role acting as a barrier reducing water loss and gas diffusion, restraining water and dust accumulation, participating in the plant-insect interaction, as a component of the signal transduction leading to the activation of specific genes, controlling temperature fluctuations and providing mechanical support. Although the cuticle composition and ultrastructure is fairly well understood, relatively little is known about its biosynthesis. This review compiles and analyzes the latest scientific information concerning the cuticle biosynthesis, including the most recent studies about the transport of cuticle polymers through the plant cell wall, which is the least understood phenomena.
Key words: Cuticle, waxes, cutin, biosynthesis.
INTRODUCCIÓN
Las partes aéreas de las plantas superiores, que incluyen hojas, tallos, flores y frutos, están cubiertas completamente, con excepción de la apertura estomática, de una membrana continua lipídica extracelular denominada cutícula (Pighin et al., 2004; Cameron et al., 2006; Jeffree, 2006), la cual es sintetizada por las células epidérmicas (Bargel et al., 2006; Yeats et al., 2010). La cutícula es una estructura producto de la evolución de las plantas superiores que las aísla y protege del medio externo que les rodea (Shepherd y Griffiths, 2006; Reina-Pinto y Yephremov, 2009), que constituye un elemento estructural esencial, de importancia funcional y ecológica debido a que es la capa más externa de las células vegetales que interacciona con el ambiente (Kunst y Samuels, 2003; Jeffree, 2006).
La ultraestructura de la cutícula varía ampliamente entre especies de plantas, tipos de órgano y su estado de desarrollo, y está irreversiblemente asociada al crecimiento activo de los tejidos vegetales, ya que durante las etapas iniciales de desarrollo existe lo que se conoce como procutícula que luego origina a la cutícula madura durante las etapas finales de desarrollo (Petit-Jiménez et al., 2007; Isaacson et al., 2009). A pesar de esta variabilidad, todas las cutículas están constituidas principalmente de dos tipos de materiales lipofílicos: cutina y ceras cuticulares (Leide et al., 2007; Domínguez et al., 2009).
Principales polímeros que conforman a la cutícula
Desde un punto de vista morfológico, en un corte transversal observado desde el exterior se aprecia que la cutícula cubre la pared celular de las células epidérmicas. Está compuesta por una cubierta superior de ceras epicuticulares, seguida por otra capa inferior formada por cutina y ceras mezcladas con sustancias de la pared celular, pectinas, celulosa y otros carbohidratos, los cuales constituyen la capa cuticular (Kunst y Samuels, 2003; Jetter et al., 2006; Domínguez et al., 2011), como se ilustra en la Figura 1.
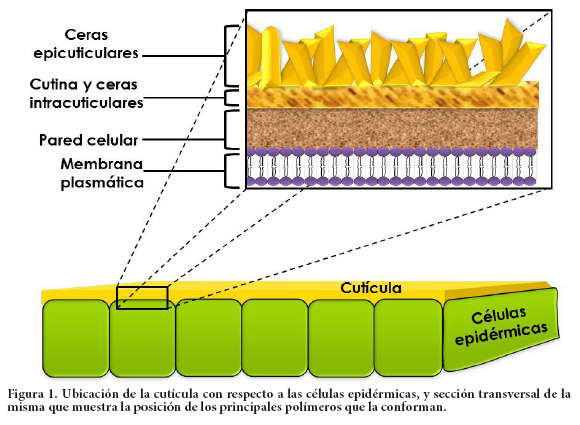
Cutina
El principal componente de la cutícula es la cutina, que constituye una proporción que varía desde 40 a 80 % del peso. Según la especie, la cantidad de cutina puede variar de pocos microgramos a más de 1000 μg cm-2 y su grosor puede variar desde menos de 1 hasta 10 μm o más (Domínguez et al., 2011; Yeats et al., 2012). La cutina es un polímero constituido principalmente por ácidos grasos de cadena media, los cuales se encuentran formando enlaces tipo éster entre sí, así como también glicerol (Suh et al., 2005; Panikashvili et al., 2007; Lee et al., 2009). Debido a los enlaces covalentes entre sus monómeros, la cutina resiste daños mecánicos y forma la estructura básica de la cutícula (Stark y Tian, 2006; Samuels et al., 2008). La cutina está formada casi exclusivamente por ácidos grasos de 16 carbonos, entre los cuales el ácido 10, 16-dihidroxihexadecanoico y su isómero posicional 9, 16-dihidroxihexadecanoico, constituyen los principales componentes (Bessire et al., 2007). Solamente una pequeña fracción de la cutina investigada está formada por ácidos grasos de 18 carbonos, entre ellos los ácidos 9, 10-epoxi-18-hidroxioctadecanoico y 9,10,18-trihidroxioctadecanoico, los más abundantes, aunque algunos derivados insaturados pueden estar presentes como componentes minoritarios en algunas cutinas (Heredia, 2003).
La caracterización reciente de la cutícula en Arabidopsis thaliana ha revelado que la cutina también puede contener ácidos α, ω-dicarboxílicos, componentes característicos de suberina, otro polímero importante en las plantas (Franke et al., 2005; Reina-Pinto y Yephremov, 2009). En algunas cutículas de plantas (por ejemplo, en Agave americana L.) se encuentra presente otro polímero denominado cutan, fracción no hidrolizable de la cutícula, ya sea alternado o en combinación con cutina, con algunos polisacáridos de la pared celular y con compuestos aromáticos (Pollard et al., 2008); está constituido de ácidos grasos poliinsaturados que varían entre 22 y 34 átomos de carbono, en su mayoría unidos entre sí mediante enlaces éter (Bargel et al., 2006; Domínguez et al., 2011).
Ceras epicuticulares e intracuticulares
La función esencial de limitar la pérdida de agua por la cutícula puede deberse a que es un complejo poliéster con ceras asociadas de naturaleza hidrofóbica y muy escasa reactividad, porque la mayoría de los grupos carboxílicos presentes en la membrana están esterificados con grupos hidroxilos alifáticos de otros ácidos grasos (Riederer, 2006; Domínguez et al., 2011). La separación física mediante solventes orgánicos y el análisis de sus componentes, han demostrado que las ceras intracuticulares están intercaladas dentro del polímero de la cutina y tienen una composición química distinta de las ceras epicuticulares que se encuentran en la superficie exterior de la cutina, en forma de una capa más o menos uniforme y amorfa o como cristales discontinuos (Bargel et al., 2006; Samuels et al., 2008; Domínguez et al., 2011).
Los componentes de las ceras son muy variados y normalmente constituyen de 20 a 60 % de la masa de la cutícula (Heredia, 2003). La cera cuticular es una mezcla compleja de compuestos alifáticos de cadenas lineales que varían entre 20 y 40 carbonos de tamaño; sin embargo, también se han identificado ésteres de cera con cadenas que van desde 36 hasta 70 carbonos (Reina-Pinto y Yephremov, 2009). Los principales componentes químicos de las ceras son n-alcanos, ésteres, alcoholes, aldehídos, cetonas y ácidos grasos de cadena larga en el caso de las epicuticulares, o de ácidos grasos de cadena corta en las intracuticulares (Kunst y Samuels, 2003; Cameron et al., 2006; Leide et al., 2011).
Entre las ceras se han encontrado algunos metabolitos secundarios como los triterpenoides, compuestos fenólicos (ácido cumárico y ferúlico, flavonoides, fenilpropanoides), polisacáridos (principalmente celulosa y pectina) y algunos polipéptidos (Stark y Tian, 2006; Jeffree, 2006; Riederer, 2006; Kunst y Samuels, 2009).
Por su parte, las ceras epicuticulares por lo general tienen una estructura microcristalina, y que se visualizan como una capa subyacente amorfa. Varias de las estructuras morfológicas clasificadas por Barthlott et al. (1998) como hélices, túbulos, cintas, varillas o placas, pueden estar presentes. Algunas de éstas pueden estar relacionadas con la presencia de determinados componentes de la cera. Los compuestos con cadena media tales como (β-dicetonas, bidroxi-(β-dicetonas, dioles y alcoholes secundarios, están asociados con los tubos, mientras que los alcoholes primarios se asocian con las placas. Los alcoholes primarios también están asociados con estructuras cristalinas (Shepherd y Griffiths, 2006). La importancia de la composición química de las ceras epicuticulares radica en la estrecha relación que existe con la morfología y ultraestructura de las mismas.
Cambios cuticulares durante el desarrollo vegetativo y periodo postcosecha de frutas y verduras
Existen varios estudios sobre la cutícula en tejidos vegetativos y durante el desarrollo y vida postcosecha de frutas, los cuales se describen a continuación. En cuanto a composición, se ha reportado que la fracción mayoritaria de ceras cuticulares en hojas y tallos de Arabidopsis (Jenks et al., 2002) y en Kalanchoe daigremontiana (Van Maarseveen et al., 2009) son los alcanos. Con respecto a los cambios ontogénicos de la cutícula, Báez et al. (1993) reportaron cambios fisiológicos y ultraestructurales durante la maduración y senescencia en mandarina (Citrus reticulata [Hort] Ex. Tanaka, cv Nules); por ejemplo, en frutos inmaduros la fracción de ácidos grasos fue la más abundante en ceras epicuticulares (50 a 55 %) e intracuticulares (70 a 35 %), y luego durante la maduración la proporción de ácidos grasos en ceras epicuticulares disminuyó y el contenido de alcanos con más de 26 carbonos aumentó considerablemente.
Asimismo, Petit-Jiménez et al. (2009), al analizar el efecto del tratamiento hidrotérmico sobre la ultraestructura de la cutícula de mango (Mangifera indica L.), observaron diferencias en el arreglo estructural de las ceras en la superficie cuticular entre los frutos con tratamiento hidrotérmico y el testigo sin tratar. En los frutos tratados se evidenció la formación tipo pergamino en la cutícula debido al efecto del calor, con placas alineadas en paralelo y en las ceras epicuticulares se detectó la presencia de estructuras de cristales en transición con una distribución irregular; en cambio, en los frutos no tratados no se observó el efecto pergamino en la cutícula, se constató la formación de placas enteras y de ceras epicuticulares del tipo amorfo. Al correlacionar los cambios en la composición de la cutícula con la pérdida de agua durante postcosecha en pimiento (Capsicum annuum L.), Parsons et al. (2012) concluyeron que las cadenas alifáticas lineales forman barreras cuticulares más impermeables que los complejos basados en isoprenoides. En líneas mutantes de tomate (Lycopersicum esculentum Mill. o Solanum lycopersicum), Kosma et al. (2010) correlacionaron los cambios cuticulares con producción de etileno, degradación de la pared celular y color. Los autores encontraron diferencias significativas entre frutos y etapas de desarrollo, por lo que concluyeron que la cutícula tiene una función importante en la vida de anaquel de los frutos.
En mango Petit-Jiménez et al. (2007) observaron cambios en la composición y ultraestructura de la cutícula durante el crecimiento, desarrollo y almacenamiento en tres variedades. En las ceras epicuticulares, la fracción de los alcanos fue la predominante durante el crecimiento (50 a 60 %), mientras que en la cosecha fue la de los ácidos grasos (38 a 46 %). Los alcoholes representaron la fracción minoritaria durante el crecimiento y almacenamiento de los frutos (2 a 4 %). Además, observaron diferencias significativas entre cultivares en la cantidad de cutícula por área ( 'Tommy Atkins' con 227 μg cm-2, 'Keitt' con 193 μg cm-2 y 'Kent' con 141 μg cm-2). La ultraestructura de las ceras mostró diferencias en la cosecha, ya que 'Tommy Atkins' y 'Kent' presentaron 82.6 % de zonas cristalinas, mientras que en 'Keitt' hubo 74.1 % de zonas amorfas.
Durante el almacenamiento de los frutos de mango también hubo cambios cuticulares, pues al tercer día se observó una disminución en el contenido de las ceras intracuticulares en todos los cultivares, seguida de un ligero incremento al sexto día, y luego de una nueva disminución en el noveno día. La masa de la cutícula se incrementó durante el crecimiento, con diferencias significativas entre cultivares ya que 'Tommy Atkins' alcanzó un valor máximo de 4513 ug a 45 días después de antesis (DDA), 'Kent' 2316 μg a 90 DDA y 'Keitt' 1609 μg a 135 DDA. Los autores concluyeron que la mayor eficiencia de la cutícula en regular la pérdida de agua ocurrió al momento de la cosecha y se relacionó con los cambios en la ultraestructura y contenido de las ceras cuticulares. Además, asociaron las diferencias con las características genéticas de los cultivares, ya que éstos habían crecido en las mismas condiciones ambientales y de manejo del huerto, y tenían la misma edad. Con base en lo anterior, es posible afirmar que la composición y ultraestructura de la cutícula varía en respuesta a factores genéticos, fisiológicos y ambientales, tanto durante el crecimiento y desarrollo como durante la postcosecha de los frutos.
FISIOLOGÍA DE LA CUTÍCULA
A pesar de que el material cuticular aparece como un componente minoritario en el total de la masa de hojas y frutos, desempeña funciones importantes debido a sus propiedades físicas, químicas, mecánicas y morfológicas, que lleva a cabo a lo largo del desarrollo de la planta y son relevantes para la vida de las plantas y frutos.
Tales funciones se describen a continuación: (A) Como barrera que reduce la pérdida de agua y difusión de gases (Riederer y Schreiber, 2001); (B) Induce desprendimiento de gotas de agua y partículas de polvo, así como de esporas, con la finalidad de mantener limpia y seca la superficie de la planta o del fruto (Jeffree, 2006; Samuels et al., 2008); (C) Por sus propiedades anti-adhesivas, influye en las interacciones planta-insecto (Müller, 2006), y ayuda a evitar la proliferación de microbios patógenos (Carver y Gurr, 2006; Reina-Pinto y Yephremov, 2009); (D) Involucrada en el reconocimiento de señales de patógenos e insectos (Chassot et al., 2008); (E) Tiene un papel termorregulador importante en las interacciones de las plantas con el ambiente (Stark y Tian, 2006) y proteje contra los rayos UV (Pfündel et al., 2006); (F) Funciona como soporte mecánico (Domínguez et al., 2009) y participa de manera indirecta en la correcta formación de los órganos en las primeras fases de desarrollo de la planta, ya que impide la adhesión incontrolada de las células epidérmicas de los órganos en formación (Riederer, 2006; Panikashvili et al., 2007; Leide et al., 2011). Tales funciones son esquematizadas en la Figura 2.
El rol de la cutícula en reducir la pérdida de agua parece ser su función primaria, ya que actúa como una eficaz barrera hidrofóbica protectora para minimizar la pérdida de agua por evapotranspiración y también la pérdida de otros gases (CO2, O2), y de esta forma permite que los estomas puedan regular este proceso (Jeffree, 2006; Riederer, 2006; Panikashvili et al., 2007). Sin embargo, no es absolutamente impermeable (Burghardt y Riederer, 2006; Isaacson et al., 2009) ya que en forma lenta el agua traspasa la cutícula y del mismo modo la atraviesan en sentido contrario las sustancias solubles que en ella se depositan (Lallana et al., 2006). La cutícula es una membrana permeable tanto a compuestos polares como no polares, donde las ceras cumplen un papel clave en la reducción de la permeabilidad al agua, especialmente las ceras epicuticulares que regulan la capacidad de la superficie para la evapotranspiración.
Las funciones de la cutícula no están correlacionadas con su grosor sino con su estructura cuticular, con su composición química y con las proporciones en que se encuentren sus componentes (Kerstiens, 2006; Leide et al., 2011; Yeats et al., 2012). El grosor de la cutícula varía entre 0.5 y 15 um, lo que depende de la especie vegetal, la zona de la planta y su edad o estado de desarrollo, ya que aumenta durante el crecimiento y disminuye durante el proceso de maduración y senescencia (Jetter et al., 2000; Jetter et al., 2006; Stark y Tian, 2006). La composición química y la estructura cuticular son generadas por una red metabólica compleja, regulada por factores bióticos y abióticos, para proporcionar un mecanismo de adaptación durante la interacción planta-ambiente (Bernard y Joubés, 2012)
BIOSÍNTESIS DE LA CUTÍCULA
La mayoría de estudios sobre la composición y ultraestructura de la cutícula han sido descriptivos, comparativos, pero es relativamente poco lo que se conoce acerca de la biosíntesis, transporte y ensamblaje extracelular de los compuestos cuticulares para formar el biopolímero de la cutícula (Isaacson et al., 2009; DeBono et al., 2009; Yeats et al., 2010). Uno de los principales puntos de discusión sobre la biosíntesis de la cutina es el transporte de sus monómeros desde el lugar de síntesis hasta el sitio donde son incorporados a la cutina en crecimiento (Pighin et al., 2004; DeBono et al., 2009).
En las plantas, las células epidérmicas emplean gran cantidad de energía para producir cutícula. Por ejemplo, más de la mitad de los ácidos grasos sintetizados por las células epidérmicas durante la expansión del tallo en Arabidopsis son utilizados en la formación de lípidos cuticulares (Reina-Pinto y Yephremov, 2009). La síntesis de cera requiere la coordinación de actividades de numerosas enzimas organizadas en complejos multienzimáticos en varios organelos celulares (cloroplastos, citoplasma y retículo endoplasmático), donde se lleva a cabo la síntesis y elongación de los ácidos grasos, precursores de las ceras, y la formación de una multitud de compuestos alifáticos (Kunst y Samuels, 2003; Kunst et al., 2006).
Si bien se han propuesto diversas hipótesis sobre la biosíntesis de los compuestos cuticulares, los mecanismos de transporte siguen siendo poco conocidos. Durante la década de los 70 quedó demostrado que la biosíntesis de cutina está mediada por enzimas localizadas en las células epidérmicas o en la cara externa de la pared celular, y que tales enzimas requerían ATP y CoA (Samuels et al., 2008). La biosíntesis de ceras abarca tres distintas etapas: síntesis de novo de ácidos grasos, elongación de los ácidos grasos y transporte de monómeros hacia el exterior de la pared celular.
Síntesis de novo de ácidos grasos
Los ácidos grasos de 16 y 18 carbonos son sintetizados de novo en los cloroplastos (Kunst et al., 2006; Byers y Gong, 2007). En su biosíntesis, la cadena de grupos acilos de crecimiento es unida covalentemente a la proteína transportadora de grupos acilo (ACP) mediante un enlace tioéster vinculado a un grupo prostético de fosfopanteteína, lo que resulta en la activación del carbono carboxilo del grupo acilo (Shepherd y Griffiths, 2006). La ACP es un componente de la enzima ácido graso sintasa (FAS), que participa como cofactor en por lo menos ocho reacciones de la síntesis de ácidos grasos y también puede funcionar como un donador de acilos para la biosíntesis de lípidos complejos (Kunst y Samuels, 2003; Byers y Gong, 2007). En este proceso se ensamblan largas cadenas de carbonos, ensamblaje que inicia con la condensación de acetil-CoA con una molécula de dos carbonos del malonil-ACP, los cuales se originan de acetil-CoA.
Después se produce el paso de la condensación, donde una secuencia de reacciones que incluyen la reducción de (β-hidroxiacil-ACP, la deshidratación de (β-hidroxiacil-ACP, y reducción de trans-Δ2 -enoil-ACP, en la que se genera un acil-ACP con dos carbonos más que la molécula con la cual se inició el ciclo. Ciclos similares de elongación, que ahora empiezan con la condensación de malonil-ACP con una acil-ACP y terminan con la eliminación reductiva del grupo (β-ceto, se repiten de seis a siete veces (Harwood, 2005; Shepherd y Griffiths, 2006).
Dos o tres tipos de complejos de FAS son necesarios para la formación de un ácido graso de 16 ó 18 carbonos, respectivamente. Los complejos FAS difieren en sus enzimas condensadoras, las cuales tienen una estricta longitud específica de la cadena acilo: cetoacil ACP sintasa III (KAS III) (C2 a C4), KAS I (C4 a C16), y KAS II (C16 a C18) (Kunst et al, 2006). Una vez sintetizados en los cloroplastos, los ácidos grasos son transportados al retículo endoplasmático para su elongación, proceso para el que se han propuesto dos vías (Figura 4): 1) En muchas especies de plantas y tipos de células, el retículo endoplasmático se ha encontrado cerca de los cloroplastos, sin aparente fusión o mezcla de bicapas, proximidad que puede facilitar la transferencia de ácidos grasos al retículo endoplasmático mediante mecanismos no-vesiculares como la desorción espontánea, la difusión y la absorción. 2) El transporte de lípidos de los cloroplastos al retículo endoplasmático podría verse facilitado por las proteínas acil-CoA "binding protein" (ACBPs), una clase de proteínas que ha sido descrita en una amplia variedad de células eucariotas (Schulz y Frommer, 2004; Kunst et al., 2006; Panikashvili y Aharoni, 2008).
Elongación de los ácidos grasos
La elongación de los ácidos grasos de 16 y 18 carbonos en el retículo endoplasmático (ER) genera ácidos grasos de cadenas muy largas (VLCFAs) de 20 a 34 carbonos. Esta extensión se lleva a cabo por complejos multienzimáticos que residen en la membrana del retículo endoplasmático, conocidas como elongasas de ácidos grasos (FAEs) (Kunst y Samuels, 2003; Shepherd y Griffiths, 2006). Análogo a la síntesis de ácidos grasos en los cloroplastos, la formación de VLCFAs implica cuatro reacciones enzimáticas consecutivas que resultan en una extensión de dos carbonos en la cadena de acilo por cada ciclo de elongación.
Sin embargo, a diferencia de la FAS que utiliza malonil-ACP como donante de dos carbonos, la FAE utiliza unidades de dos carbonos de malonil-CoA (Post-Beittenmiller, 1996; Kunst y Samuels, 2003; Shepherd y Griffiths, 2006; Samuels et al., 2008). Múltiples ciclos de elongación son necesarios para generar cadenas con longitudes de 24 a 34 carbonos para la producción de componentes alifáticos de ceras (Kunst et al., 2006). En la etapa final de la producción de cera en el retículo endoplasmático, las VLCFAs son transformadas en alcoholes, ésteres, aldehídos, alcanos y cetonas, mediante reducción y descarboxilación (Samuels et al., 2008; Lee et al., 2009), como se ilustra en la Figura 3.

Síntesis de alcoholes primarios y ésteres de ceras
Una parte de la biosíntesis de cera, generalmente la llamada vía de la reducción de acil-CoA, es la responsable de la formación de componentes con predominante número par de carbonos (Figura 3) (Kunst et al., 2006; Shepherd y Griffiths, 2006). En diversas plantas y órganos, los compuestos más importantes son los alcoholes primarios con cadena de 26 a 28 carbonos, aunque en algunos sistemas son de 30 a 32 carbonos. Los alcoholes se encuentran frecuentemente en forma libre o esterificada a diversos grupos acilos, e incluye los alcoholes aromáticos con número par de carbonos de cadena corta y cadena larga o ácidos alifáticos de cadenas muy largas.
Los alcoholes son generados por reducción de precursores de VLCFAs y se producen mediante aldehídos intermediarios. La biosíntesis de ésteres en plantas superiores es catalizada por enzimas, como la cera sintasa (WS), algunas de las cuales son capaces de usar una amplia gama de grasas saturadas e insaturadas en forma de acil-CoA, que oscilan entre 14 y 24 carbonos, mientras que los alcoholes insaturados con 18 carbonos son el segundo sustrato más utilizado (Post-Beittenmiller, 1996; Kunst et al., 2006; Samuels et al., 2008).
Síntesis de alcanos, alcoholes secundarios y cetonas
La segunda parte de la ruta de la biosíntesis de cera es responsable de la formación de compuestos predominantemente con número impar de carbonos. Entre éstos, los alcanos se han encontrado en las mezclas de ceras de varias plantas y órganos, donde frecuentemente se acumulan en altas concentraciones (Kunst et al., 2006). Los alcoholes secundarios y las cetonas con similar distribución de longitud de cadena, regularmente se encuentran con los alcanos, lo que sugiere una relación directa biosintética entre las tres clases de componentes. La reacción central de la vía de formación de alcanos (el paso que hace la transición de par a impar en las cadenas de carbono), implica la pérdida de un átomo de carbono de los precursores de grupos acilo, en lugar de la adición de un carbono. Los alcanos son luego convertidos en alcoholes secundarios y cetonas por dos reacciones consecutivas de oxidación (Kunst et al., 2006; Shepherd y Griffiths, 2006; Samuels et al., 2008). Está establecido que la elongación procede a la descarboxilación y que, por tanto, ambas rutas de los alcoholes primarios y la de alcanos compiten por los precursores Acil-CoA de varias longitudes de cadena.
Transporte de monómeros a la cutícula
La tercera etapa de la biosíntesis de la cutícula requiere el transporte de los lípidos de las células epidérmicas al exterior de la pared celular (Pighin et al., 2004). Los monómeros son transportados a través de ambientes hidrofílicos y membranas, es decir, de los cloroplastos, retículo endoplasmático, citosol, membrana plasmática y finalmente la pared celular, por lo que el transporte de los componentes cuticulares es un proceso complejo y poco conocido (Post-Beittenmiller, 1996; Panikashvili y Aharoni, 2008; DeBono et al., 2009; Yeats et al., 2010; Beisson et al., 2012).
Un primer avance hacia la comprensión de la exportación de cera recientemente se realizó mediante el descubrimiento de los transportadores tipo ABC (ATP binding cassette) ABCG12/CER5 y ABCG11/WBC11, cuya participación en el transporte de la cera fue reportada por Pighin et al. (2004). Estos autores fueron los primeros en demostrar mediante pruebas moleculares el transporte activo de los componentes de la cera a través de la membrana plasmática de las células de la epidermis (Kunst et al., 2006; Panikashvili et al., 2007; Panikashvili y Aharoni, 2008). Ambos transportadores fueron localizados en la membrana plasmática de células epidérmicas de tallos, mediante fusiones fluorescentes con las proteínas de transporte y utilización de microscopía confocal.
Sin embargo, el mecanismo de exportación a partir de la membrana plasmática a través del medio hidrofílico de la pared celular a la cutina sigue siendo poco conocido y por ello constituye un fenómeno interesante a elucidar. Esto es debido a que una molécula de cera hidrofóbica exportada fuera de una célula epidérmica debe atravesar un medio extracelular hidrofílico para llegar a la cutícula, además de que los polisacáridos de la pared celular, como pectinas, hemicelulosas y celulosas, pueden representar un obstáculo físico al transporte de la cera cuticular (Jeffree, 2006; Samuels et al., 2008; Yeats y Rose, 2008), como se ilustra en la Figura 4.
Las proteínas de transferencia de lípidos (LTPs) se han propuesto como candidatas para llevar a cabo la deposición de los componentes de la cera durante el ensamblaje de la cutícula (Kunst et al., 2006; Lee et al., 2009; DeBono et al., 2009; Yeats et al., 2010). Se ha reportado también que las LTPs participan en la defensa de las plantas contra patógenos (Arondel et al., 2000). Las LTPs poseen características apropiadas para el transporte de cera hacia la cutícula: poseen una cavidad hidrofóbica, son capaces de unirse a los ácidos grasos in vitro, contienen un péptido señal, y son proteínas extracelulares situadas en la pared celular (Kader, 1996; Li et al., 2008; Yeats y Rose, 2008). Han sido identificadas en hojas de tabaco (Nicotiana tabaccum L.) (Cameron et al., 2006), hojas de brócoli (Brassica oleracea var. italica) (Pyee et al., 1994), en hojas de espinaca (Spinacia oleracea L.), en plántulas de maíz, en semillas de cebada (Hordeum vulgare) y arroz (Oryza sativa L.) (Post-Beittenmiller, 1996; Ahn et al., 2009), en tallos, hojas y flores de Arabidopsis (Beisson et al., 2003; Suh et al., 2005; Lee et al., 2009; DeBono et al., 2009), y recientemente en tomate (Yeats et al., 2010).
Con base en la información revisada se diseñó la Figura 4 en la que se ilustran las diferentes vías propuestas para el transporte de los compuestos cuticulares. Las VLCFAs o sus derivados podrían ser transportados del retículo endoplasmático a la membrana plasmática por dos posibles rutas: directamente del retículo endoplasmático a la membrana plasmática (Figura 4, 2a), transportados mediante proteínas de unión a ácidos grasos (FABPs) y liberación de los lípidos directamente a un transportador ABC o en la bicapa de la membrana plasmática; los lípidos cuticulares podrían moverse a lo largo del sistema de endomembranas del retículo endoplasmático al aparato de Golgi y a la membrana plasmática, ya sea libres en la bicapa lipídica o a través de balsas lipídicas (Figura 4, 2b).
Una vez en la superficie celular, los componentes de cera podrían ser transferidos de la bicapa por transportadores ABC, o bien por dos mecanismos propuestos (Figura 4, 3a), transferidos directamente a través de la pared celular, o acarreados por proteínas de transferencia de lípidos (LTPs) a la cutícula (Figura 4, 3b) (Schulz y Frommer, 2004; Kunst et al., 2006; Shepherd y Griffiths, 2006; Panikashvili y Aharoni, 2008).
CONCLUSIÓN
La cutícula es una estructura heterogénea, cuya síntesis es controlada por factores genéticos, fisiológicos, climatológicos y de manejo, tanto en campo como en postcosecha. Estos factores influyen en su composición y ultraestructura, por lo que no se debe generalizar sobre su morfología y composición química.
Además de ser una barrera física, la cutícula es una estructura que cumple funciones importantes en la fisiología de la planta, como: mantener limpia y seca la superficie de la planta o del fruto, y así evitar la acumulación de agua, partículas de polvo y esporas; influye en las interacciones planta-plaga, mediante el reconocimiento de señales de patógenos e insectos; termorreguladora importante en las interacciones de las plantas con el ambiente y sirve de protección contra los rayos UV; soporte mecánico; y participación indirecta en la correcta formación de los órganos en las primeras fases de desarrollo de la planta, ya que impide la adhesión incontrolada de las células epidérmicas de los órganos en formación.
La biosíntesis de la cera cuticular ha sido estudiada durante los últimos años, con enfoques bioquímicos y fisiológicos. A pesar de estos esfuerzos, todavía se conoce poco sobre los factores que regulan la localización de los precursores de los ácidos grasos y la regulación que existe entre la síntesis de ceras con la síntesis de cutina, así como los mecanismos de transporte y deposición de sus componentes. Los estudios recientes enfocados en el aislamiento y estudio de los genes que codifican proteínas de transferencia de lípidos, implicadas en el transporte de los monómeros, han contribuido a elucidar el fenómeno de la transferencia de los componentes cuticulares a través de la pared celular durante la biosíntesis de la cutícula
Estos conocimientos permiten comprender mejor la biosíntesis y fisiología de la cutícula, y proporcionan las bases para llevar a cabo una modificación racional de las cutículas mediante ingeniería genética con el fin de mejorar la resistencia de productos agrícolas a diferentes tipos de estrés, tanto biótico como abiótico, y aumentar la vida postcosecha de productos hortofrutícolas.
BIBLIOGRAFÍA
Arondel V, C Vergnolle, C Cantrel, J C Kader (2000) Lipid transfer proteins are encoded by a small multigene family in Arabidopsis thaliana. Plant Sci. 157:1-12. [ Links ]
Ahn S B, J Kim, J Pyee, J H Park (2009) Biochemical characterization of the lipid-binding properties of a broccoli cuticular wax-associated protein, WAX9D, and its application. BMB Rep. 42:367-372. [ Links ]
Báez R, F Tadeo, E Primo-Millo, L Zacarías (1993) Physiological and ultrastructural changes during the ripening and senescence of clementine mandarin. Acta Hort. 343:18-24. [ Links ]
Bargel H, K Koch, Z Cerman, C Neinhuis (2006) Structure-function relationships of the plant cuticle and cuticular waxes—a smart material? Funct. Plant Biol. 33:893-910. [ Links ]
Barthlott W, C Neinhuis, D Cutler, F Ditsch, I Meusel, I Theisen, H Wil-helmi (1998) Classification and terminology of plant epicuticular waxes. Bot. J. Linn. Soc. 126:237-260. [ Links ]
Beisson F, Y Li-Beisson, M Pollard (2012) Solving the puzzles of cutin and suberin polymer biosynthesis. Curr. Opin. Plant Biol. 15:329-337. [ Links ]
Beisson F, A J K Koo, S Ruuska, J Schwender, M Pollard, J J Thelen, T Paddock, J J Salas, L Savage, A Milcamps, V B Mhaske, Y Cho, J B Ohlrogge (2003) Arabidopsis genes involved in acyl lipid metabolism. A 2003 census of the candidates, a study of the distribution of expressed sequence tags in organs, and a web-based database. Plant Physiol. 132:681-697. [ Links ]
Bessire M, C Chassot, A C Jacquat, M Humphry, S Borel, J MacDonald-Comber, J Pierre, C Nawrath (2007) A permeable cuticle in Arabidopsis leads to a strong resistance to Botrytis cinerea. EMBO J. 26:2158-2168. [ Links ]
Bernard A, J Joubés (2012) Arabidopsis cuticular waxes: Advances in synthesis, export and regulation. Prog. Lipid Res. 52:110-129. [ Links ]
Burghardt M, M Riederer (2006) Cuticular transpiration: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:292-311. [ Links ]
Byers D M, H Gong (2007) Acyl carrier protein: structure-function relationships in a conserved multifunctional protein family. Review/Synthese. Biochem. Cell Biol. 85:649-662. [ Links ]
Cameron K D, M A Teece, L B Smart (2006) Increased accumulation of cuticular wax and expression of lipid transfer protein in response to periodic drying events in leaves of tree tobacco. Plant Physiol. 140:176-183. [ Links ]
Carver T L W, S J Gurr (2006) Filamentous fungi on plant surfaces: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:368-392. [ Links ]
Chassot C, C Nawrath, J P Métraux (2008) The cuticle: Not only a barrier for plant defence. A novel defence syndrome in plants with cuticular defects. Plant Signal. Behav. 3:142-144. [ Links ]
DeBono A, T H Yeats, J K C Rose, D Bird, R Jetter, L Kunst, L Samuels (2009) Arabidopsis LTPG is a glycosylphosphatidylinositolanchored lipid transfer protein required for export of lipids to the plant surface. Plant Cell 21:1230-1238. [ Links ]
Domínguez E, J A Heredia-Guerrero, A Heredia (2011) The biophysical design of plant cuticles: an overview. New Phytol. 189:938-949. [ Links ]
Domínguez E, L España, G López-Casado, J Cuartero, A Heredia (2009) Biomechanics of isolated tomato (Solanum lycopersicum) fruit cuticles during ripening: the role of flavonoids. Funct. Plant Biol. 36:613-620. [ Links ]
Franke R, I Briesen, T Wojciechowski, A Faust, A Yephremov, C Nawrath, L Schreiber (2005) Apoplastic polyesters in Arabidopsis surface tissues-a typical suberin and a particular cutin. Phytochemistry 66:2643-2658. [ Links ]
Harwood J L (2005) Fatty acid biosynthesis: In: Plant Lipids: Biology, Utilization and Manipulation. DJ Murphy (ed). Blackwell Publishing, Oxford. pp:27-66. [ Links ]
Heredia A (2003) Biophysical and biochemical characteristics of cutin, a plant barrier biopolymer. Biochim. Biophys. Acta 1620:1-7. [ Links ]
Isaacson T, D K Kosma, A J Matas, G J Buda, Y He, B Yu, A Pravita-sari, J D Batteas, R E Stark, M A Jenks, J K C Rose (2009) Cutin deficiency in the tomato fruit cuticle consistently affects resistance to microbial infection and biomechanical properties, but not transpirational water loss. Plant J. 60:363-377. [ Links ]
Jeffree C E (2006) The fine structure of the plant cuticle. In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:11-110. [ Links ]
Jenks M A, S D Eigenbrode, B Lemieux (2002) Cuticular Waxes of Arabidopsis. In: The Arabidopsis Book. C R Somerville, E M Meyerowitz (eds.) American Society of Plant Biologists). Rockville, Maryland, USA. 22 p. [ Links ]
Jetter R, L Kunst, L Samuels (2006) Composition of plant cuticular waxes. In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:145-175. [ Links ]
Jetter R, S Schaffer, M Riederer (2000) Leaf cuticular waxes are arranged in chemically and mechanically distinct layers: evidence from Prunus laurocerasus L. Plant Cell Environ. 23:619-28. [ Links ]
Kader J C (1996) Lipid transfer proteins in plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 47:627-54. [ Links ]
Kerstiens G (2006) Water transport in plant cuticles: an update. J. Exp. Bot. 57:2493-2499. [ Links ]
Kosma D K, E P Parsons, T Isaacson, S Lu , J K C Rose, Matthew A Jenks (2010) Fruit cuticle lipid composition during development in tomato ripening mutants. Physiol. Plant. 139:107-117. [ Links ]
Kunst L, A L Samuels (2003) Biosynthesis and secretion of plant cuticular wax. Prog. Lipid Res. 42:51-80. [ Links ]
Kunst L, L Samuels (2009) Plant cuticles shine: advances in wax biosynthesis and export. Curr. Opin. Plant Biol. 12:721-727. [ Links ]
Kunst L, R Jetter, L Samuels (2006) Biosynthesis and transport of plants cuticular waxes: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:182-207. [ Links ]
Lallana M, C E Billard, J H Elizalde, V H Lallana (2006) Breve revisión sobre características de la cutícula vegetal y penetración de herbicidas. Cien. Doc. Tecnol. XVII:229-241. [ Links ]
Lee S B, Y S Go, H J Bae, J H Park, S H Cho, H J Cho, D S Lee, O K Park, I Hwang, M C Suh (2009) Disruption of glycosylphosphati-dylinositol-anchored lipid transfer protein gene altered cuticular lipid composition, increased plastoglobules, and enhanced susceptibility to infection by the fungal pathogen Alternaria brassicicola. Plant Physiol. 150:42-54. [ Links ]
Leide J, U Hildebrandt, G Vogg, M Riederer (2011) The positional sterile (ps) mutation affects cuticular transpiration and wax biosynthesis of tomato fruits. J. Plant Physiol. 168:871-877. [ Links ]
Leide J, U Hildebrandt, K Reussing, M Riederer, G Vogg (2007) The developmental pattern of tomato fruit wax accumulation and its impact on cuticular transpiration barrier properties: effects of a deficiency in a β-ketoacyl-coenzyme A synthase (LeCER6). Plant Physiol. 144:1667-1679. [ Links ]
Li C, W Xie, W Bai, Z Li, Y Zhao, H Liu (2008) Calmodulin binds to maize lipid transfer protein and modulates its lipids binding ability. FEBS J. 275:5298-5308. [ Links ]
Millar A A, S Clemens, S Zachgo, E M Giblin, D C Taylor, L Kunst (1999) CUT1, an Arabidopsis gene required for cuticular wax biosynthesis and pollen fertility, encodes a very-long-chain fatty acid condensing enzyme. Plant Cell 11:825-838. [ Links ]
Müller C (2006) Plant-insect interactions on cuticular surfaces: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:398-417. [ Links ]
Panikashvili D, A Aharoni (2008) ABC-type transporters and cuticle assembly linking function to polarity in epidermis cells. Plant Signal. Behav. 3:806-809. [ Links ]
Panikashvili D, S Savaldi-Goldstein, T Mandel, T Yifhar, R B Franke, R Hofer, L Schreiber, J Chory, A Aharoni (2007) The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion. Plant Physiol. 145:1345-1360. [ Links ]
Parsons E P, S Popopvsky , G T Lohrey , S Lu, S Alkalai-Tuvia , Y Per-zelan , I Paran, E Fallik, M A Jenks (2012) Fruit cuticle lipid composition and fruit post-harvest water loss in an advanced backcross generation of pepper (Capsicum sp.). Physiol. Plant. 146:15-25. [ Links ]
Petit-Jiménez D, A González-León, G González-Aguilar, R Sotelo-Mundo, R Báez-Sañudo (2007) Cambios de la cutícula durante la ontogenia del fruto de Mangifera indica l. Rev. Fitotec. Mex. 30:51-60. [ Links ]
Petit-Jiménez D, E Bringas-Taddei, A González-León, J M García-Robles, R Báez-Sañudo (2009) Efecto del tratamiento hidrotérmico sobre la ultraestructura de la cutícula del fruto de mango. Rev. UDO Agríc. 9:96-102. [ Links ]
Pfündel E E, G Agati, Z G Cerovic (2006) Optical properties of plant surfaces: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:216-239. [ Links ]
Pighin J A, H Zheng, L J Balakshin, I P Goodman, T L Western, R Jetter, L Kunst, L Samuels (2004) Plant cuticular lipid export requires an ABC transporter. Science 306:702-704. [ Links ]
Post-Beittenmiller D (1996) Biochemistry and molecular biology of wax production in plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 47:405-430. [ Links ]
Pollard M, F Beisson, Y H Li, J B Ohlrogge (2008) Building lipid barriers: biosynthesis of cutin and suberin. Trends Plant Sci. 13:236-246. [ Links ]
Pyee J, H Yu, P E Kolattukudy (1994) Identification of a lipid transfer protein as the major protein in the surface wax of broccoli (Brassica oleracea) leaves. Arch. Biochem. Biophys. 311:460-468. [ Links ]
Reina-Pinto J J, A Yephremov (2009) Surface lipids and plant defenses. Plant Physiol. Biochem. 47:540-549. [ Links ]
Riederer M (2006) Introduction: biology of the plant cuticle: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:1-8. [ Links ]
Riederer M, L Schreiber (2001) Protecting against water loss: analysis of the barrier properties of plant cuticles. J. Exp. Bot. 52:2023-2032. [ Links ]
Samuels L, L Kunst, R Jetter (2008) Sealing plant surfaces: cuticular wax formation by epidermal cells. Annu. Rev. Plant Biol. 59:683-707. [ Links ]
Schulz B, W B Frommer (2004) A plant ABC transporter takes the Lotus Seat. Science 306:622-625. [ Links ]
Shepherd T, D W Griffiths (2006) The effects of stress on plant cuticular waxes. New Phytol. 171:469-499. [ Links ]
Stark R, S Tian (2006) The cutin biopolymer matrix: In: Biology of the Plant Cuticle. M Riederer, C Müller (eds). Julius-von-Sachs-Institut, für Biowissenschaften Universitát Würzburg, Germany. pp:126-141. [ Links ]
Suh M C, A L Samuels, R Jetter, L Kunst, M Pollard, J Ohlrogge, F Besis-son (2005) Cuticular lipid composition, surface structure, and gene expression in Arabidopsis stem epidermis. Plant Physiol. 139:1649-1665. [ Links ]
Van Maarseveen C, H Han, R Jetter (2009) Development of the cuticular wax during growth of Kalanchoe daigremontiana (Hamet et Perr. de la Bathie) leaves. Plant Cell Environ. 32:73-81. [ Links ]
Yeats T H, K J Howe, A J Matas, G J Buda, T W Thannhauser, J K C Rose (2010) Mining the surface proteome of tomato (Solanum lycopersicum) fruit for proteins associated with cuticle biogenesis. J. Exp. Bot. 61:3759-3771. [ Links ]
Yeats TH, G J Buda, Z Wang, N Chehanovsky, L C Moyle, R Jetter, A A Schaffer, J K C Rose (2012) The fruit cuticles of wild tomato species exhibit architectural and chemical diversity, providing a new model for studying the evolution of cuticle function. Plant J. 69:655-666. [ Links ]
Yeats TH, J K C Rose (2008) The biochemistry and biology of extracellular plant lipid-transfer proteins (LTPs). Prot. Sci. 17:191-198. [ Links ]














