Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista fitotecnia mexicana
Print version ISSN 0187-7380
Rev. fitotec. mex vol.34 n.3 Chapingo Jul./Sep. 2011
Artículos científicos
Anatomía, contenidos de ácido abscísico y nutrimentos y germinación de semillas de heliconia
Anatomy, abscisic acid and nutrient content and germination of heliconia seeds
Lizeth Benítez–Domínguez1, Fernando C. Gómez–Merino2*, Libia I. Trejo–Téllez1 y Alejandrina Robledo–Paz1
1 Colegio de Postgraduados–Campus Montecillo. km 36.5, Carretera México–Texcoco. 56230, Montecillo, Texcoco, Estado de México.
2 Colegio de Postgraduados–Campus Córdoba. Carretera Córdoba–Veracruz km 348. Amatlán de los Reyes, Veracruz. Tel.: 01 (55) 58 04 59 11; Fax: 01 (55) 58 04 59 12. * Autor para Correspondencia (fernandg@colpos.mx)
Recibido: 16 de Marzo del 2010.
Aceptado: 13 de Junio del 2011.
Resumen
Las heliconias se propagan asexualmente a través de rizomas y en consecuencia hay pocos estudios sobre la biología de sus semillas, las cuales son necesarias para generar variabilidad genética. En esta investigación se estudió la constitución interna de las semillas, los contenidos de ácido abscísico y de nutrimentos, y la germinación en cuatro especies de heliconias: Heliconia bourgaeana, H. collinsiana, H. latispatha y H. psittacorum. En semillas de H. collinsiana y H. latispatha analizadas al microscopio, los embriones aparecen sin daños después de un año de almacenamiento, mientras que en H. bourgaeana y H. psittacorum se observaron alteraciones del tejido embrionario. En las cuatro especies se detectaron taninos y almidón en endospermo, con mayor presencia de taninos en H. bourgaeana y H. psittacorum. El contenido de ABA fue mayor en H. collinsiana (7.8 µg g–1 MS) que en las demás especies que presentaron 0.26 µg g–1 MS o menos. El mayor contenido de B, Ca, Mg, Mn, Fe y Zn también se registró en H. collinsiana, y las menores concentraciones de B, Ca, Cu, Fe, Mg, Mn, P y Zn las presentó H. psittacorum. A 85 d después de la siembra la germinación in vitro fue de 18, 30, 3 y 32 % para H. bourgaeana, H. collinsiana, H. latispatha y H. psittacorum, respectivamente. Se concluye que las semillas de las cuatro especies de heliconias analizadas difieren en niveles de consumo de sustancias de reserva del endospermo, en presencia de taninos y de almidón, en contenido de ABA y nutrimentos, y en porcentaje de germinación.
Palabras clave: Heliconia spp., embrión, endospermo, ácido abscísico, nutrimentos.
Abstract
Heliconias are asexually propagated through rhizomes and thus only few studies on their seed biology have been carried out so far. In this research we studied the anatomy of seeds and determined their abscisic acid and nutrient content, as well as their in vitro germination in four heliconia species: Heliconia bourgaeana, H. collinsiana, H. latispatha and H. psittacorum. The microscopical analyses of H. collinsiana and H. latispatha showed that, the seeds embryos appear without damages after a year of storage; conversely, the embryonic tissues of H. bourgaeana and H. psittacorum presented alterations. In these species we detected the presence of tannins and starch in endosperm, with tannins being more abundant in H. bourgaeana and H. psittacorum. ABA content was much higher in H. collinsiana (7.8 µg g–1 DM) than in the other species which had 0.26 µg g–1 DM or less. Contents of B, Ca, Fe, Mg, Mn and Zn were also higher in H. collinsiana, whereas the lowest contents of B, Ca, Cu, Fe, Mg, Mn, P and Zn were found in H. psittacorum. At 85 d after sowing the in vitro germination was 18, 30, 3 y 32 % in H. bourgaeana, H. collinsiana, H. latispatha and H. psittacorum, respectively. We conclude that the four species vary in the level of reserve consumption from endosperm, in the presence of tannins and starch, in ABA, and macro and micronutrients contents and in the percentage of in vitro germination.
Key words: Heliconia spp., embryo, endosperm, abscisic acid, nutrients.
INTRODUCCIÓN
Las heliconias pertenecen a la familia Heliconiaceae, del orden Zingiberales. El único género de esta familia, Heliconia, está representado por cerca de 200 especies (Marouelli et al., 2010). La gran mayoría de estas especies (98 %) se distribuyen en Centro, Sudamérica y el Caribe, y México es el centro de origen y diversidad genética de 16 de ellas (Jerez, 2007). Estas especies desempeñan un papel importante en los ecosistemas como pioneras en procesos de regeneración natural de la vegetación y de restauración de suelos degradados, y mantienen relaciones benéficas con animales, plantas y microorganismos (Bruna, 2002; Bruna y Ribeiro, 2005).
Más allá de su valor ecológico, las heliconias tienen también un valor comercial importante como flores de corte, plantas para maceta, y uso de hojas para preparar alimentos; sus inflorescencias poseen un alto precio unitario por su larga vida en florero, su tamaño y sus exóticas formas y colores, además de proyectar una imagen innovadora en los sitios donde se colocan (Rodrigues, 2005).
Las heliconias se reproducen principalmente de forma asexual por medio de rizomas, y su alto valor en el mercado ha provocado saqueo de estas especies en sus hábitats naturales, lo que está deteriorando estos ecosistemas, desprotegiendo al suelo y erosionando la biodiversidad, por lo que es necesario ofrecer alternativas de propagación, como el uso de semillas. Sin embargo, las semillas de las heliconias generalmente presentan problemas para germinar (Gutiérrez–Báez, 2000), pues el embrión no se encuentra bien diferenciado cuando madura la semilla, y ésta contiene una testa muy dura que impide la absorción de agua (Kress et al., 2004). La germinación es lenta pues puede tardar desde tres meses hasta tres años (Berry y Kress, 1991; Kress et al., 2004), por lo que para programas de propagación mediante semillas se recomienda utilizar frutos bien maduros y evitar los que se hayan secado dentro de las brácteas.
Si bien se han reportado algunas caracterizaciones básicas de las semillas de algunas especies de heliconia (Simão y Scatena, 2003), no se han hecho estudios detallados sobre la estructura de sus tejidos, su contenido de fitohormonas y nutrimentos, ni se han establecido relaciones entre éstos y la germinación in vitro, conocimientos que son necesarios para los programas de reproducción sexual de estas especies y que permitan lograr una mayor variabilidad genética en los progenies. Por ello, esta investigación tuvo como objetivo analizar la anatomía de semillas maduras y los embriones de cuatro especies de heliconias (Heliconia bourgaeana Petersen, H. collinsiana Griggs, H. latispatha Bentham y H. psittacorum L. f.), determinar sus contenidos de ácido abscísico y nutrimentos, y evaluar sus porcentajes de germinación in vitro. Las tres primeras especies tienen su centro de origen y diversidad genética en el sureste de México, en tanto que la última es de origen sudamericano (Gutiérrez–Báez, 2000; Marouelli et al., 2010).
MATERIALES Y MÉTODOS
Material biológico
Se utilizaron semillas almacenadas en oscuridad durante un año previo a su análisis, en frascos ámbar de vidrio de 1 L de capacidad, cerrados herméticamente a temperatura ambiente (25 °C). Las semillas provenían de frutos maduros de huertos de heliconias establecidos y en producción de la zona Córdoba–Orizaba en el Estado de Veracruz, localizados a 646 m de altitud, 96° 51' de LN y 18° 51' de LO. Las semillas se extrajeron manualmente, y se lavaron con agua corriente y jabón por 20 min con la ayuda de un agitador magnético. Posteriormente se trataron con el fungicida Daconyl® (i. a. Clortalonil) aplicado a 3 g L–1.
Estudios microscópicos
Los análisis microscópicos de semillas y embriones se hicieron en 15 semillas de cada especie, las cuales se incubaron por una semana en tubos de ensayo que contenían 30 mL de agua destilada, a temperatura ambiente (25 °C). Se hicieron cortes transversales y longitudinales con la técnica del corte fino (Montuenga–Badía et al., 2009), y las preparaciones se observaron con microscopios de disección y óptico para detectar la presencia de taninos y almidón.
Determinación del contenido de ácido abscísico
Para la extracción del ácido abscísico (ABA) se pesaron 90 g de semillas de cada especie y se trituraron con la ayuda de nitrógeno líquido. Las muestras pulverizadas fueron sumergidas en 4 mL de acetona 90 % y puestas en agitación por 12 min a 10 °C. Los extractos fueron separados por cromatografía de capa fina (thin layer chromatography, TLC) y luego analizados por cromatografía líquida de alta resolución (high performance liquid chromatography, HPLC) conforme al protocolo descrito por Olivella et al. (2001).
Análisis del contenido de nutrimentos
En las semillas de las cuatro especies se determinaron las concentraciones de N por el método micro–Kjeldahl (Chapman y Pratt, 1973). Los nutrimentos B, Ca, Cu, Fe, K, Mg, Mn, P y Zn se determinaron por el procedimiento descrito por Alcántar y Sandoval (1999), en muestras que fueron sometidas a digestión húmeda del material seco con una mezcla biácida; los extractos obtenidos se leyeron en un equipo de espectrometría de emisión atómica de inducción por plasma (ICP–AES, Varian® modelo Liberty II).
Germinación in vitro
En frascos de vidrio de 500 mL de capacidad que contenían 40 mL de medio de cultivo MS (Murashige y Skoog, 1962) 50 %, adicionado con 30 g de sacarosa como fuente de carbono, se colocaron cinco semillas desinfectadas y mantenidas en condiciones controladas (temperatura de 25 + 2 °C, densidad de flujo fotosintético de fotones de 25 (imol m–2 s–1 y fotoperiodo de 16 h de luz d–1). En total se establecieron 100 semillas de cada especie. Una semilla se consideró germinada cuando se observó la aparición del protófilo y de la raíz primaria. El porcentaje de germinación se evaluó por 85 d.
Diseño experimental y análisis estadístico de datos
Las especies evaluadas se aleatorizaron en un diseño experimental completamente al azar. En el ensayo de germinación se tuvieron 20 unidades experimentales consistentes en un frasco con cinco semillas. En los análisis de contenidos de ABA y nutrimentos se tuvieron tres repeticiones. Con los resultados obtenidos se hicieron análisis de varianza y prueba de comparación de medias por Tukey (P ≤ 0.05) con el paquete estadístico SAS (SAS Institute, 2010).
RESULTADOS Y DISCUSIÓN
Características microscópicas
Heliconia bourgaeana. Su embrión es alargado con forma de torpedo (Figuras 1A y 1B), y presenta daños atribuibles al almacenamiento de un año en el que se mantuvieron las semillas (Figura 1A). La semilla ya había consumido parte de sus reservas porque había un espacio entre el embrión y el endospermo (Figura 1B). Un estrato de células teñidas en rojo es indicador de la presencia de taninos en endospermo y embrión, en tanto que los puntos obscuros indican la presencia de almidón en endospermo (Figuras 1A y 1B).

Heliconia collinsiana. Su semilla muestra un embrión bien desarrollado, alargado, sin estructuras dañadas (Figuras 1C y 1D). Los compuestos de reserva habían sido consumidos por el embrión, y hay presencia de taninos en la región epidérmica del endospermo, aunque en menor frecuencia que en H. bourgaeana; también se observa almidón.
Heliconia latispatha. La semilla de esta especie presenta un embrión alargado, bien desarrollado, sin daños en sus estructuras (Figuras 1E y 1F). Se compone de un estrato con células aplanadas y bordes poco definidos. Un estrato de células teñidas en rojo es indicativo de la presencia de abundantes taninos; también se observa gran cantidad de almidón y un ligero consumo de reservas del endospermo.
Heliconia psittacorum. Entre el embrión y el endospermo de las semillas de esta especie hay un espacio que indica consumo de compuestos de reserva (Figuras 1G y 1H), lo cual podría tener repercusiones en el porcentaje de germinación de semillas si dicho consumo ocurrió antes de la germinación, ya que los embriones contarían con menor cantidad de reserva para que el proceso se dé adecuadamente. Su contenido de taninos y almidón es menor que en las otras tres especies analizadas.
En el Cuadro 1 se presenta un resumen de los contenidos de taninos y almidón observados en las semillas analizadas al microscopio. La presencia de taninos indica la existencia de mecanismos de protección ante el ataque por organismos, pero estos compuestos también actúan como inhibidores de la germinación al impedir el crecimiento inducido por giberelinas y paralelamente provocan una reducción en la síntesis de enzimas hidrolíticas en el endospermo, tales como amilasa y fosfatasa ácida (Laynez–Garsaball y Méndez–Natera, 2007). Sin embargo, Wang y Chen (2008) indican que la función de los taninos en semillas en controversial, tal vez porque estos compuestos son muy variables en su estructura química y sus efectos difieren con las condiciones del ambiente (Skopec et al., 2004; Bergvall y Leiman, 2005; Bergvall et al., 2006). En este sentido, mientras Shimada et al. (2010) reportan que el contenido de taninos no afecta ni la dispersión ni la sobrevivencia de semillas, An (2005) considera que los taninos pueden actuar como inhibidores o como estimuladores de la germinación, en función de sus contenidos en el tejido vegetal.

Los resultados encontrados en esta investigación permiten inferir que la presencia de taninos difiere de una especie a otra, ya que se encuentran en mayor cantidad en H. bourgaeana y H. latispatha que en H. collinsiana y H. psittacorum. También se observó que sus embriones difieren en tamaño y en consumo de sustancias de reserva; el mayor consumo se observó en H. collinsiana y H. psittacorum, en tanto que el menor se observó en H. latispatha, lo cual podría indicar que en esta última especie el embrión tuvo menor actividad fisiológica. Adicionalmente, se observó que los embriones presentan diferentes grados de deterioro, atribuibles a variación genética en sus respuestas a los procesos de estrés abiótico relacionados con su almacenamiento; el embrión más dañado se observó en H. bourgaeana, en tanto que los mejor conservados fueron los de H. collinsiana y H. latispatha.
Contenido de ácido abscísico
Las semillas de las cuatro especies de heliconias presentaron contenidos diferentes de ácido abscísico endógeno (P ≤ 0.05). La mayor concentración (7.8 µg g–1 MS) se observó en semillas de la especie H. collinsiana, seguidas de H. psittacorum (0.26 µg g–1 MS) y H. latispatha (0.25 µg g–1 MS). Los menores niveles de esta fitohormona los presentaron las semillas de H. bourgaeana (0.15 µg g–1 MS).
En Arabidopsis thaliana, Ali–Rachedi et al. (2004) encontraron que en comparación con las semillas que no presentaban latencia, las semillas latentes mostraban mayores contenidos de ABA. Al tratar las semillas para reducir su dormancia, los contenidos de ABA disminuyeron a niveles muy similares a los encontrados en las semillas no latentes. Finkelstein y Lynch (2000) comprobaron que la supresión del efecto inhibitorio del ABA inducida por la glucosa es dependiente de la luz y se limita únicamente al proceso de la emergencia de la radícula. Resultados similares fueron registrados por Price et al. (2003) y Barrero et al. (2009) y parecen relacionados con los encontrados en el presente estudio, pues en H. collinsiana el mayor contenido de ABA se asoció con un mayor porcentaje de germinación y con contenidos intermedios de almidón, el cual constituye una fuente de reservas para la germinación.
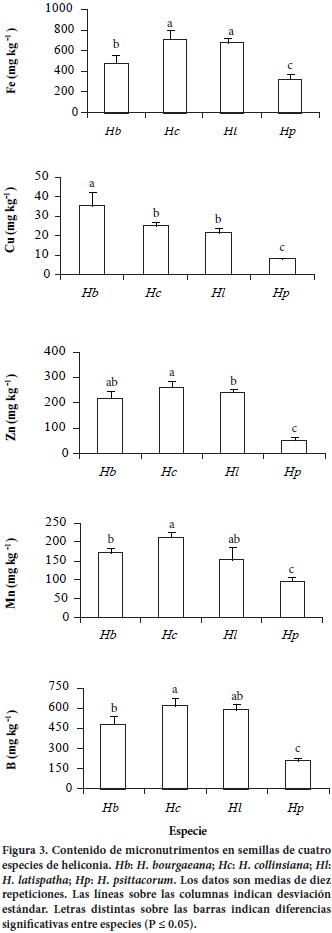
Concentración de nutrimentos
Las semillas de las especies estudiadas presentan contenidos diferentes de macro y micronutrimentos (Figuras 2 y 3). En estudios preliminares sobre nutrimentos en semillas, Ikeda et al. (1984) determinaron que el contenido de proteína soluble total decrece a medida que avanza la germinación, pero el contenido de N permanece estable; en tanto, Hall et al. (1982) encontraron que la deficiencia de N provoca una disminución significativa en la germinación de semillas de Amaranthus retroflexus, debido a que el N juega un papel determinante en el inicio del desarrollo de las plántulas y en la germinación en sí, cuya presencia es garantizada por las proteínas de reserva que constituyen almacenes de N para la germinación (Youle y Huang, 1981). Entre los escasos reportes sobre contenidos nutrimentales en semillas de heliconias, Auerbach y Strong (1981) encontraron 1.76 % de N en follaje de H. imbricata y 3.01 % en H. latispatha.

Especies del género Musa (también del orden Zingiberales) logran acumular más de 3 % de N en su follaje, niveles superiores a los encontrados en las semillas de heliconia. En especies no emparentadas con las heliconias, pero que pueden aportar datos comparativos, Kala y Mohan (2010) determinaron que semillas de tres accesiones de Mucuna pruriens var. pruriens son ricas en nutrimentos como Ca, Fe, K, Mn y P. En estudios similares, Kalidas y Mohan (2011) reportaron que cinco accesiones más de esta leguminosa mostraron niveles elevados de Ca, K, Mg, Na y P. Sin embargo, no se encuentran reportes sobre el contenido de P en semillas de heliconias; solamente se ha reportado que la deficiencia de N, P o K durante el desarrollo del cultivo de la var. 'Golden Torch' (H. psittacorum x H. spathocircinata), ocasiona reducciones significativas del diámetro y longitud del tallo, así como del tamaño de la inflorescencia (Castro et al., 2007), lo que hace suponer que también afectaría las concentraciones de estos nutrimentos en las semillas.
En general, los mayores contenidos de los cinco micro–nutrimentos evaluados (B, Cu, Fe, Mn y Zn) se observaron en semillas de H. collinsiana, en tanto que los menores niveles se registraron en H. psittacorum. Las otras especies ( H. bourgaeana y H. latispatha) presentaron valores intermedios de estos micronutrimentos (Figura 3).
Las menores concentraciones de B, Ca, Cu, Fe, Mg, Mn y Zn se registraron en H. psittacorum, especie que tuvo el mayor porcentaje de germinación in vitro y la mayor concentración de K.
Porcentaje de germinación
En la Figura 4 se muestra el porcentaje de germinación de semillas de las especies de heliconias a los 85 d después de la siembra. Al término de la evaluación, el mayor porcentaje de germinación se observó en H. psittacorum (32 %), y el más bajo en H. latispatha (3 %). Según Kress et al. (2004), la germinación de semillas de heliconias ocurre de manera espontánea en periodos de tres meses a tres años, lo cual depende de características inherentes a las semillas y del ambiente en donde se siembren (Berry y Kress, 1991). A este respecto, Criley y Broschat (1992) sostienen que el efecto del almacenamiento de las semillas previo a su siembra no se conoce a fondo.
Los embriones pueden presentar periodos de maduración más lentos que los frutos, por lo que un periodo de almacenamiento en condiciones óptimas después de su cosecha podría permitir que los embriones alcanzaran su desarrollo pleno. El almacenamiento en frascos de semillas de H. stricta por dos semanas previas a su siembra estimuló la velocidad y el porcentaje de germinación, en comparación con semillas cosechadas y sembradas en fresco. Sin embargo, en un experimento similar con H. aurantiaca no se encontraron diferencias en la germinación entre semillas conservadas por dos semanas o sembradas inmediatamente después de su cosecha (Kress et al., 2004).
En esta investigación, el almacenaje aumentó el porcentaje de germinación en tres de las cuatro especies estudiadas, en comparación con otro estudio similar (Gómez–Merino et al., 2010), en el cual la siembra de semillas fue hecha directamente después de su cosecha en fresco. Dado que las semillas de estas especies germinan lentamente, es posible postular que con periodos más largos de evaluación de la germinación se pudieran haber obtenido porcentajes más altos que los aquí observados, pues la evaluación duró menos de tres meses y en tres de las cuatro especies se observó una tendencia a incrementar este porcentaje en la última fecha de registro.
CONCLUSIONES
Los estudios microscópicos revelaron que en H. collinsiana y H. latispatha los embriones se encuentran bien desarrollados, y que se observa en H. psittacorum el mayor consumo de sustancias de reserva. Todas las semillas contienen taninos y almidón; los primeros fueron más abundantes en H. bourgaeana y H. latispatha. El ABA presente en las semillas fue mucho mayor en H. collinsiana que en las otras tres especies estudiadas, lo cual demuestra que esta fitohormona no está directamente relacionada con los problemas de germinación aquí encontrados, pues H. collinsiana fue una de las especies que tuvo mayores porcentajes de germinación.
Los contenidos de N encontrados en las semillas fueron bajos en comparación con otras especies, en tanto que los demás nutrimentos analizados muestran valores normales o altos. En general, H. psittacorum fue la especie que tuvo el mayor porcentaje de germinación in vitro y también los valores más bajos tanto de macro como de micronutrimentos, con excepción del N y K. Dado que las determinaciones fueron hechas con semillas almacenadas por un año, es necesario también hacer ensayos con semillas frescas y almacenadas por periodos e intervalos más cortos de tiempo, para verificar el consumo de sustancias de reserva, el desarrollo del embrión y los contenidos de fitohormonas como ácido abscísico, y de aleloquímicos como los taninos.
BIBLIOGRAFÍA
Alcántar G G, M Sandoval V (1999) Manual de Análisis Químico de Tejido Vegetal. Sociedad Mexicana de la Ciencia del Suelo A.C. Publicación especial No. 10. Chapingo, México. 156 p. [ Links ]
Ali–Rachedi S, D Bouinot, M H Wagner, M Bonnet, B Sotta, P Grappin, M Jullien (2004) Changes in endogenous abscisic acid levels during dormancy release and maintenance of mature seeds: studies with the Cape Verde Islands ecotype, the dormant model of Arabidopsis thaliana. Planta 219:479–488. [ Links ]
An M (2005) Mathematical modelling of dose–response relationship (Hormesis) in allelopathy and its application. Nonlinearity Biol. Toxicol. Med. 3:153–172. [ Links ]
Auerbach M J, D R Strong (1981) Nutritional ecology of heliconia herbivores: experiments with plant fertilization and alternative hosts. Ecol. Monogr. 51:63–84. [ Links ]
Barrero J M, A A Millar, J Griffiths, T Czechowski, W R Scheible, M Udvardi, J B Reid, J J Ross, J V Jacobsen, F Gubler (2009) Gene expression profiling identifies two regulatory genes controlling dormancy and ABA sensitivity in Arabidopsis seeds. Plant J. 61:611–622. [ Links ]
Bergvall U A, O Leimar (2005) Plant secondary compounds and the frequency of food types affect food choice by mammalian herbivores. Ecology 86:2450–2460. [ Links ]
Bergvall U A, P Rautio, K Kesti, J Tuomi, O Leimar (2006) Associational effects of plant defences in relation to within and between–patch food choice by a mammalian herbivore: neighbour contrast susceptibility and defence. Oecologia. 147:253–260. [ Links ]
Berry F, W Kress (1991) Heliconia: an Identification Guide. Smithsonian Institute. Washington, USA. 337 p. [ Links ]
Bruna E M (2002) Effects of forest fragmentation on Heliconia acuminata seedling recruitment in central Amazonia. Oecologia 132:235–243. [ Links ]
Bruna E M, M B N Ribeiro (2005) Regeneration and population structure of Heliconia acuminata in Amazonian secondary forests with contrasting land–use histories. J. Trop. Ecol. 21:127–131. [ Links ]
Castro R A C, V Loges, A S Costa, M F A Castro, F A S Aragao, L G Villadino (2007) Hastes florais de heliconia sob deficencia de macronutrimentes. Pesq. Agrop. Bras. 42:1299–1306. [ Links ]
Chapman H D, P F Pratt (1973) Métodos de Análisis para Suelos, Plantas y Aguas. Ed. Trillas, México, D. F. 195 p. [ Links ]
Criley R A, T K Broschat (1992) Heliconia: botany and horticulture of a new floral crop. Hort. Rev. 14:1–55. [ Links ]
Finkelstein R R, T J Lynch (2000) Abscisic acid inhibition of radicle emergence but not seedling growth is suppressed by sugars. Plant Physiol. 122:1179–1186. [ Links ]
Gómez–Merino F C, B Vidal–Morales, L I Trejo–Téllez, C Molinos da Silva (2010) Escarificación y germinación in vitro de semillas de heliconias. Univ. Ciencia 26:293–297. [ Links ]
Gutiérrez–Báez C (2000) Flora de Veracruz. Fascículo 118. Familia Heliconiaceae. Instituto de Ecología A. C. y Universidad de California–Riverside. Xalapa, México. 32 p. [ Links ]
Hall B A, U Blum, R C Fites (1982) Stress modification of allelopathy of Helianthus annuus L. debris on seed germination. Am. J. Bot. 69:776–783. [ Links ]
Ikeda K, K Arioka, S Fujii, T Kusano (1984) Effect on buckwheat protein quality of seed germination and changes in trypsin inhibitor content. Cereal Chem. 61:236–238. [ Links ]
Jerez E (2007) El cultivo de las heliconias. Cult. Trop. 28:29–35. [ Links ]
Kala B K, V R Mohan (2010) Nutritional and anti–nutritional potential of three accessions of itching bean (Mucuna pruriens (L.) DC var. pruriens): an under–utilized tribal pulse. Int. J. Food Sci. Nutr. 61:497–511. [ Links ]
Kalidas C, V R Mohan VR (2011) Nutritional and antinutritional composition of itching bean (Mucuna pruriens (l.) dc var. pruriens): an underutilized tribal pulse in western Ghats, Tamil Nadu, India. Trop. Subtrop. Agroec. 14:279–293. [ Links ]
Kress W J, J Betancur J, B Echeverry (2004) Heliconias. Llamaradas de la Selva Colombiana. Ed. Cristina Uribe. Bogotá. Colombia. 200 p. [ Links ]
Laynez–Garsaball J A, J R Méndez–Natera (2007) Efectos de extractos acuosos de la maleza Cyperus rotundus L. (Cyperaceae) sobre la germinación de semillas y crecimiento de plántulas de maíz (Zea mays L.) cv. Pioneer 3031. Rev. Peru. Biol. 14:55–60. [ Links ]
Marouelli L P, P W Inglis, M A Ferreira, G S C Buso (2010) Genetic relationships among Heliconia (Heliconiaceae) species based on RAPD markers. Genet. Mol. Res. 9:1377–1387. [ Links ]
Montuenga–Badía L, F J Esteban–Ruíz, A Calvo–González (2009) Técnicas en Histología y Biología Celular. Ed. Elsevier–Masson. Barcelona, España. 390 p. [ Links ]
Murashige T, F Skoog (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473–497. [ Links ]
Olivella C, M Vendrell, R Savé (2001) Determinación de ácido abscísico, ácido indolacético, zeatina y ribósido de zeatina en hojas desarrolladas de Gerbera jamesonii cv Bolus y su variación con la edad. Invest. Agr. Prod. Prot. Veg. 16:333–342. [ Links ]
Price J, T–Ch Li, S G Kang, J K Na, J–Ch Jang (2003) Mechanisms of glucose signaling during germination of Arabidopsis. Plant Physiol. 132:1424–1438. [ Links ]
Rodrigues V P H (2005) In vitro establishment of Heliconia rauliana (Heliconiaceae). Sci. Agric. 62:69–71. [ Links ]
SAS Institute (2010) SAS/STAT User's guide. Ver. 9.22. SAS Institute, Inc. Caray, NC. 1765 p. [ Links ]
Shimada T, A Takahashi, M Shibata (2010) Effects of seed size and chemical variation on seed fates in a deciduous oak species Quercus serrata. J. Int. For. Soc. 7:15–18. [ Links ]
Simão D G, V L Scatena (2003) Morphological aspects of the propagation in Heliconia velloziana L. Emygd. (Zingiberales: Heliconiaceae). Braz. Arch. Biol. Technol. 46:65–72. [ Links ]
Skopec M M, A E Hagerman, W H Karasov (2004) Do salivary prolinerich proteins counteract dietary hydrolyzable tannin in laboratory rats? J. Chem. Ecol. 30:1679–1692. [ Links ]
Wang B, J Chen (2008) Tannin concentration enhances seed caching by scatter–hoarding rodents: An experiment using artificial 'seeds'. Acta Oecol. 34:379–385. [ Links ]
Youle R J, A H C Huang (1981) Occurrence of low molecular weight and high cysteine containing albumin storage proteins in oilseeds for diverse species. Am. J. Bot. 68:44–48. [ Links ]














