Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista fitotecnia mexicana
versión impresa ISSN 0187-7380
Rev. fitotec. mex vol.32 no.4 Chapingo oct./dic. 2009
Artículo científico
Evaluación morfo-fisiológica de brotes de maíz sometidos a selección in vitro bajo estrés osmótico
Morpho-physiological characterization of maize shoots subjected to in vitro selection under osmotic stress
Ivonné Castro-Montes1, Ma. Cristina López-Peralta1* y Víctor A. González-Hernández1
1 Postgrado en Recursos Genéticos y Productividad-Fisiología Vegetal, Colegio de Postgraduados, Campus Montecillo. km 36.5 Carretera México-Texcoco. 56230, Montecillo, Texcoco, Estado de México. * Autor para correspondencia (cristy@colpos.mx)
Recibido: 07 de Diciembre del 2007.
Aceptado: 25 de Septiembre del 2009.
Resumen
Se examinaron las respuestas morfo-fisiológicas de brote órganogénico de maíz (Zea mayz L.) sometidas a estrés osmótico, simulado con la adición de 10, 15 y 20 g L-1 de polietilenglicol (PEG-8000) al medio de cultivo in vitro, durante tres ciclos de selección recurrente. Las semillas de las líneas endogámicas L-13, L-14, L-16 y L-46 se germinaron in vitro, y a los 12 d se cortaron 1 a 5 secciones del coleóptilo que se usaron como explantes y se cultivaron en medio de Murashige y Skoog con 0.6 % (p/v) de agar, para inducir organogénesis. Después, en la etapa de multiplicación los brotes se sometieron a estrés osmótico en medio líquido con PEG (0, 10, 15 y 20 %) durante tres ciclos de selección de 15 d cada uno. En el primer experimento se cuantificaron características morfo-fisiológicas de los brotes de los ciclos de selección 1 y 3, y se observó efecto significativo de la interacción genotipo x PEG sobre la altura y número de hojas por brote, de genotipo x ciclo sobre número de hojas y biomasa fresca, y de PEG x ciclo sobre el peso fresco. En el segundo experimento se midieron características de los brotes del tercer ciclo de selección, y se encontró efecto significativo del genotipo sobre el peso fresco y seco por brote, así como efecto de PEG sobre el peso fresco y el contenido de agua. La interacción genotipo x PEG fue significativa sobre el potencial hídrico, potencial osmótico y ajuste osmótico total. Las mejores líneas fueron L-14 y L-16 porque tuvieron mayor ajuste osmótico y mejores características morfo-fisiológicas, lo cual muestra que la selección in vitro es viable para elegir genotipos tolerantes.
Palabras clave: Zea mays, estrés osmótico, multiplicación de brotes, selección in vitro.
Abstract
In this study we examined the morpho-physiological responses of organogenic maize (Zea mays L.) shoots submitted to osmotic stress, simulated by the addition of polyethylene glycol (PEG-8000) to the culture media, across three recurrent selection cycles. The seeds of the lines L-13, L-14, L-16 and L-46, were germinated in vitro, and after 12 d the seedlings were dissected in 1 to 5 sections which were used as explants for the in vitro culture on a Murashige and Skoog solid medium added with agar 0.6 % (w/v), in order to induce organogenesis. Thereafter, shoots at the multiplication stage were exposed to osmotic stress in liquid medium added with PEG (10, 15 and 20 g L-1) during three cycles of selection (15 d each one). In the first experiment the morpho-physiological traits were determined on the first and third cycles of selection. In this essay significant effects of the interaction genotype x PEG were observed on height and number of leaves of shoots, as well as of genotype x cycle on leaf number and fresh weight, and of PEG x cycle on fresh weight. In the second experiment the shoot characteristics of the third cycle of selection were measured, finding a significant effect of genotype on shoot fresh and dry weight, and of PEG concentration on shoot fresh weight and water content. The interaction genotype x PEG had significant effects on the water potential, osmotic potential and osmotic adjustment of shoots. The best lines under stress were L-14 and L-16 because they displayed a greater osmotic adjustment and better morpho-physiological characteristics, thus indicating the viability of the in vitro selection for choosing better genotypes.
Key words: Zea mays, osmotic stress, multiplication of shoots, in vitro selection.
INTRODUCCIÓN
El cultivo de maíz (Zea mays L.) con frecuencia está expuesto al estrés por sequía. La incidencia de factores adversos se ha incrementado debido en parte al cambio climático, al desplazamiento del maíz hacia ambientes desfavorables con bajo potencial productivo, a la introducción de otros cultivos más rentables y a la disminución de la fertilidad del suelo, entre otras causas (Banziger et al., 2000). El mejoramiento genético convencional, algunas veces asistido por marcadores moleculares, ha sido importante en la generación de variedades más capaces para abastecer las necesidades humanas (Jauhar, 2006). Una parte importante de la ganancia genética en el rendimiento se atribuye a una mayor tolerancia al estrés (Campos et al., 2004); sin embargo, llevar a cabo este mejoramiento presenta como mayor inconveniente la larga duración de los numerosos ciclos de selección (Jauhar, 2006). Además, cuando es necesario examinar los cultivares por su tolerancia a sequía, en campo se presentan dificultades como condiciones climáticas incontroladas, insuficiente homogeneidad del suelo, requerimiento de mayores cantidades de material vegetal, tiempo y dinero.
Los métodos de evaluación in vitro podrían resultar más rápidos y de fácil manejo para estudiar la respuesta de genotipos a los factores implicados en la sequía (Turhan y Baser, 2004). Esto implica usar algún agente selectivo (patógeno, tratamiento químico o físico) aplicado directamente al explante cultivado y luego, mediante regeneración, derivar las variantes resistentes (Gunn y Day, 1986). Es factible aplicar dicha selección sin establecer la etapa de regeneración, bajo la hipótesis de que las plantas donadoras de los explantes tienen un comportamiento similar in vivo e in vitro en presencia del agente selectivo, lo cual sería conveniente porque en algunos casos la regeneración es difícil, y en otros casos la resistencia del explante no se expresa en las plantas regeneradas (Cubero, 2003).
La multiplicación in vitro del maíz se ha logrado con explantes como: embriones maduros e inmaduros, fragmentos de espiga, anteras, microsporas, secciones de mesocótilo, nudos coleoptilares, glumas de la espiguilla, partes basales de las hojas (Li et al., 2002 ), jilotes (elotes tiernos), el meristemo apical del vástago y las yemas axilares (Walden et al., 1989). El-Aref (2002) hizo selección in vitro de callos obtenidos a partir de embriones inmaduros de maíz, y encontró que la tolerancia al estrés osmótico estaba relacionada con cambios genéticos durante el cultivo en presencia de PEG-6000; además, que la tolerancia se conservó en las plantas regeneradas. Esto también ha ocurrido en alfalfa (Medicago sativa L.) (Dragiiska et al., 1996). En girasol (Helianthus annus L.), Turhan y Baser (2004) encontraron correlación entre el comportamiento in vitro de brotes en estrés osmótico con su comportamiento in vivo bajo estrés hídrico.
La finalidad de esta investigación fue examinar las respuestas morfo-fisiológicas de brotes obtenidos in vitro vía organogénesis directa de líneas de maíz, al estrés osmótico simulado por la adición del polímero polietilenglicol (PEG, PM-8000) en el medio de cultivo in vitro durante tres ciclos de selección. Con estos estudios se espera contar con un mayor entendimiento de los procesos fisiológicos que ocurren bajo condiciones in vitro en líneas de maíz, derivadas de un programa de mejoramiento genético por su tolerancia al estrés por déficit hídrico a nivel de campo, y así determinar criterios de selección convenientes.
MATERIALES Y MÉTODOS
Material vegetal y cultivo de plántulas in vitro
Se utilizaron semillas de cuatro líneas experimentales de maíz, identificadas como: L-13, L-16, L-14 y L-46, generadas en un programa de formación de arquetipos del Colegio de Postgraduados. De cada línea, se seleccionaron 100 semillas sanas, uniformes en tamaño y sin daño mecánico; se lavaron con 30 mL de una solución de detergente comercial en polvo (Roma®) durante 5 min. Se desinfectaron con una solución fungicida de Benlate (4 g L-1) y Captan (4 g L-1) y se sembraron bajo condiciones asépticas (campana de flujo laminar VECO®) en tubos de ensaye de 27 cm de largo por 2 cm de diámetro, que contenían 10 mL de medio de cultivo básico de Murashige y Skoog (1962) (MS) complementado con sacarosa (30 g L') y modificado de acuerdo con los tratamientos usados; el pH del medio se ajustó a 5.8 ± 0.1. Posteriormente, se adicionó agar 0.6 % (p/v) (Sigma®) y se esterilizó en una autoclave a 121 °C y 1.5 kg cm-2, durante 20 min. Los cultivos se mantuvieron a 26 ± 2 °C en un fotoperiodo de 16 h luz y 8 h de oscuridad, proporcionada por lámparas de luz blanca fría fluorescente de 75 W, cuya radiación fotosintéticamente activa fue de 45 µmol fotones m-2 s-1, y a una humedad relativa de 30 %.
Explantes y multiplicación de brotes
De 80 a 95 plántulas sanas por línea, de 12 d de edad, se cortaron las dos primeras secciones del tallo a partir del nudo del coleóptilo, las cuales se sembraron para la inducción de organogénesis en frascos de 250 mL con 40 mL del medio MS adicionado con 6-bencilaminopurina, BAP (1.5 mg L-1), ácido indolacético, AIA (1.0 mg L-1), sacarosa (30 g L-1), y agar 0.6 % (p/v) (Sigma®). Los explantes con brotes se transfirieron para su multiplicación en el mismo medio durante tres subcultivos hechos a intervalos de 15 d. Cada brote se subcultivó en un frasco, y en el tercer subcultivo se agregó ácido giberélico al medio, AG3 (1.0 mg L-1). Posteriormente, de manera individual, de 53 a 85 brotes (primer experimento) y de 48 a 120 (segundo experimento), en función del material disponible en cada línea, se sometieron a estrés osmótico en el mismo medio de cultivo pero líquido, mediante la adición de PEG-8000 (Sigma®) en concentraciones de 0, 10, 15 y 20 % (p/v), lo que dio lugar a 16 tratamientos.
Selección recurrente de brotes
Un ciclo de selección consistió en un periodo de exposición de brotes al agente osmótico (PEG), con su respectiva selección de los brotes con mejor desempeño.
Para definir el periodo, se evaluaron tres duraciones en el primer ciclo de selección: 10, 15 y 20 d. Con los resultados obtenidos (datos no presentados), se decidió utilizar el periodo de 15 d para los otros dos ciclos de selección recurrente. La selección de brotes fue visual, de acuerdo con Reddy y Vaidyanath (1986), y los criterios de tolerancia al estrés osmótico fueron: crecimiento normal del brote (alargamiento del brote), vigor (con brotes diferenciados), color verde y tamaño uniforme en los diferentes ciclos de selección. Los brotes que no reunían tales características se descartaron del proceso.
Evaluación morfo-fisiológica
En el primer experimento se midieron características morfológicas de los brotes en los ciclos de selección 1 y 3: a) Altura de brotes (cm); b) Número de hojas presentes (liguladas y no liguladas); y c) Peso fresco (g). El número de brotes por variable cuantificada osciló entre 10 y 21 brotes. No se reportaron datos del segundo ciclo porque fue necesario conservar el mayor número posible de brotes vivos para completar el tercer ciclo de selección.
En el segundo experimento se midieron características fisiológicas en 8 a 10 brotes por tratamiento del tercer ciclo de selección: d) Contenido de agua, calculado de acuerdo con Ogawa y Yamauchi (2006a): (Peso fresco -Peso seco)/Peso fresco. Puesto que los brotes se encontraban en alta humedad relativa y en medio líquido, el tejido no se sometió a hidratación; así el contenido relativo de agua se obtuvo en forma convencional; e) Estado hídrico: potencial hídrico (ψw) y potencial osmótico (ψπ), mediante psicrómetros de termopar (C-52, Wescor®; Logan, Utah) y un micro voltímetro de punto de rocío (HR-33T, Wescor®, Logan), en discos de tejido obtenido de las brácteas de los brotes, de 0.5 cm de diámetro y 1 mm de grosor.
Al cabo de 3 h se leyó la conductividad eléctrica para derivar el valor del ψw. El mismo tejido se congeló con nitrógeno líquido (N2) por 15 s y se introdujo nuevamente a la misma cámara para obtener el valor del ψπ; el potencial de presión de turgencia (ψP) se calculó por la diferencia ψw - ψπ, con base en la ecuación: ψw = ψπ+ ψp. Con los valores de ψπ peso fresco (PF) y peso seco (PS), se calculó el ajuste osmótico total (AOT, expresado en bares) y sus componentes: efecto de los solutos (AOS, en bares) y efecto de los polímeros de la pared celular (AOP, en bares), previa adaptación de las fórmulas usadas por Martínez et al. (2004): AOT = ψπ testigo sin PEG - ψπ tratamiento con PEG; AOP = [(PF/PS) testigo sin PEG - (PF/PS) tratamiento con PEG ]/[(PF/PS) testigo sin PEG x AOT]; y AOS = AOT-AOP.
Análisis estadístico
Se hicieron los análisis de varianza en un diseño completamente al azar bajo un arreglo factorial de los genotipos, niveles de PEG y ciclos de selección. Para la comparación de medias de tratamientos se usó la prueba de Tukey con un nivel de probabilidad de error de 5 %, y en unos casos se usó regresión lineal. Estos análisis se hicieron con el programa SAS versión 9 para Windows (SAS® Institute, 2003).
RESULTADOS Y DISCUSIÓN
Características morfológicas
En el primer experimento, el factor genotipo (G) tuvo efecto significativo en las características morfológicas del brote, mientras que el estrés osmótico causado por PEG sólo tuvo influencia en el peso fresco (Cuadro 1). Los ciclos de selección produjeron diferencias en altura y peso fresco por brote. La interacción G x PEG influyó en la altura y número de hojas, la interacción G x ciclo en el número de hojas y peso fresco, mientras que la interacción PEG x ciclo sólo tuvo impacto en el peso fresco por brote. Similarmente, otros investigadores reportaron un efecto significativo de la interacción G x PEG; por ejemplo, El-Aref (2002) observó diferencias significativas en la altura de brotes de maíz, y Turhan y Baser (2004) en la longitud de brote, número de hojas y peso fresco de brotes de girasol.
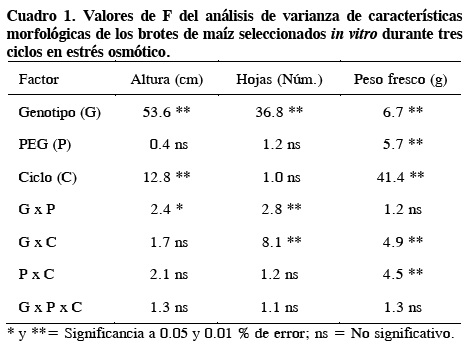
Interacción genotipo x PEG
Las cuatro líneas de maíz presentaron el siguiente gradiente significativo (P ≤ 0.05) en altura de brote y número de hojas: L-13 = L-14 ≥ L-46 ≥ L-16 (Cuadro 2). En la línea L-46 la altura y el número de hojas del brote aumentaron en 10 % con el tratamiento de PEG 20 %, en comparación con el testigo sin PEG. Lo contrario ocurrió en la línea L-16 en la que la altura se redujo con 20 % de PEG en comparación con el testigo, pero aumentó en número de hojas. Sin embargo, en las líneas L-13 y L-14 la altura y número de hojas no fueron diferentes al testigo sin estrés osmótico.

Fue evidente así que las líneas L-13 y L-14 fueron las más sobresalientes en características morfológicas bajo condiciones de estrés osmótico in vitro. En condiciones de campo y con base en el rendimiento por hectárea y su índice de tolerancia a la sequía, Zarco et al. (2005) determinaron que las mejores líneas fueron L-14 y L-16, mientras que L-13 fue la inferior. Esto indica que las líneas de maíz evaluadas pueden tener diferentes respuestas morfológicas al estrés in vitro e in vivo, como ha ocurrido en girasol (Turhan y Baser, 2004).
Interacción genotipo x ciclo y PEG x ciclo
Las líneas L-13 y L-14 mantuvieron constante su número de hojas después de tres ciclos de selección in vitro, pero en L-14 el peso fresco aumentó significativamente (Cuadro 3). L-16 tuvo menos hojas que los otros tres genotipos y no cambió su peso fresco con la selección, mientras que L-46 aumentó su peso fresco sin cambiar su número de hojas por brote. Por sus características morfológicas sobresalieron los genotipos L-13 y L-14 después de la selección in vitro.

El peso fresco se redujo solamente hasta el tercer ciclo en PEG 20 % (Cuadro 3). Es decir, con los niveles de 10 % y 15 % de PEG el estrés osmótico inducido no fue suficiente para afectar el peso fresco de los brotes de maíz, en promedio de los cuatro genotipos. El-Aref (2002) reportó una reducción de peso seco y tamaño de plántulas de maíz por efecto del estrés osmótico con PEG. Sin embargo, al establecer in vitro en varios niveles de PEG (0, 5 y 7.5 %), las plántulas seleccionadas por tolerancia mostraron un aumento en el peso seco que no se detectó en el testigo, lo que indica que la selección por tolerancia al estrés osmótico mediante técnicas de cultivo de tejidos vegetales, puede ser eficiente.
Características fisiológicas
Contenido de agua en brotes del tercer ciclo de selección
En el segundo experimento efectuado con brotes del tercer ciclo de selección, el peso fresco y el contenido de agua en los brotes, no se afectaron significativamente por la acción de la interacción genotipo x PEG (Cuadro 4). El peso fresco varió significativamente entre genotipos y entre niveles de estrés osmótico, pero el peso seco sólo cambió por efecto del genotipo. El contenido de agua dependió únicamente del nivel de estrés osmótico. Entre genotipos no hubo diferencias (P ≤ 0.05) en los pesos fresco y seco por brote, ni en su contenido de agua, aunque las líneas L-16 y L-14 tendieron a ser de mayor peso (Cuadro 5). Al analizar el efecto del estrés osmótico inducido por PEG, se encontró que el peso seco no cambió significativamente al aumentar el estrés osmótico, pero el peso fresco se redujo (Peso fresco = - 0.117 PEG + 4.84; R2 = 0.99) así como el contenido de agua del brote (Contenido de agua = -0.54 PEG + 91.5; R2 = 0.94), como lo demuestran las respectivas ecuaciones de regresión.


El cultivo in vitro de callos de arroz (Oryza sativa L.) en medio líquido que contenía PEG-8000 (de 0 hasta 30 g L-1), provocó disminución tanto del peso fresco como de la tasa relativa de crecimiento y el contenido relativo de agua en los callos (Al-Bahrany, 2002). Anteriormente, Lutts et al. (1996) reportaron datos similares en callos de arroz en cuanto a la tasa relativa de crecimiento, al evaluar varios tipos de sales y manitol como agentes osmóticos; estos autores también encontraron efectos significativos del genotipo, agente estresante y de la duración e intensidad del estrés, sobre el contenido de prolina y potencial osmótico del callo. Errabii et al. (2006) observaron disminución progresiva de la tasa relativa de crecimiento, del contenido de agua, y de las concentraciones de potasio y calcio, así como un aumento en la concentración de prolina, en callos de caña de azúcar (Saccharum officinarum L.) cultivados durante un mes bajo estrés osmótico (hasta -10.8 bar) inducido con manitol. En contraste, al cultivar células de Populus euphratica bajo estrés osmótico, Gu et al. (2004) detectaron una mayor tasa de crecimiento en 15 % de PEG-6000 que en 0 % y 25 %.
Al cultivar callos de sorgo (Sorghum bicolor L. Moench) bajo estrés osmótico con PEG-8000 disuelto en medio líquido en concentraciones de 0 % hasta 25 %, Bhaskaran et al. (1985) determinaron un aumento del contenido de prolina y la reducción drástica del peso fresco del callo, mientras que el peso seco resultó menos afectado.
Potencial hídrico y sus componentes
Después de tres ciclos de selección bajo estrés osmótico, se encontró que tanto la concentración de PEG como la interacción genotipo x PEG tuvieron efecto significativo sobre el potencial osmótico, el potencial hídrico del tejido foliar y sobre el ajuste osmótico total de los brotes, pero no tuvieron efecto sobre el potencial de turgencia (Cuadro 6). El genotipo sólo tuvo influencia significativa en el ajuste osmótico total.

Los promedios de la interacción genotipo x PEG para potencial hídrico y sus componentes se muestran en el Cuadro 7. La turgencia del tejido osciló entre 3.5 y 11.1 bar, pero sin diferencias (P ≤ 0.05) entre tratamientos. Los potenciales hídrico y osmótico variaron (P ≤ 0.05) entre genotipos dentro de cada nivel de PEG.

El potencial osmótico de los brotes de la línea L-13 descendió progresivamente hasta -31.0 bar conforme se incrementó el nivel de PEG. El genotipo L-14 presentó valores iguales estadísticamente (-12.8 a -17.3 bar) entre 0 y 10 % de PEG, pero descendió hasta -29.5 bar con 20 % del agente osmótico. El genotipo L-16 mostró valores estadísticamente iguales entre 10 y 15 % de PEG, en el intervalo de -20.4 a -20.2 bar, para descender a -30.0 bar al incrementarse el estrés. De todos los genotipos, L-46 fue el que mostró menor disminución en el potencial osmótico con 20 % de PEG (-22 bar).
En general, el potencial hídrico del tejido foliar de los genotipos L-13, L-14 y L-16 descendió progresivamente conforme aumentó la concentración de PEG, mientras que el genotipo L-46 mostró una dinámica desigual, ya que el potencial hídrico disminuyó a -15.2 bar con 10 % de PEG y se mantuvo entre -14.1 y -14.0 bar con mayor concentración del polímero, de manera que la diferencia entre el testigo y el nivel de 20 % fue la menor (-7.8 bar). Estos resultados evidencian que existe variación genotípica en la respuesta al estrés osmótico in vitro.
Ming et al. (2003) cultivaron células de Glycyrrhiza uralensis en medio de cultivo líquido con PEG-8000, y encontraron que el potencial osmótico disminuyó a través del tiempo y que alcanzó su mayor decremento a los 7 d (-1.9 bar) y luego se recuperó ligeramente (-1.6 bar) a los 10 d. En forma semejante, Santos-Díaz y Ochoa-Alejo (1994) determinaron en clones celulares de chile (Capsicum annuum L.) cultivados con 20 y 25 % de PEG, que el potencial osmótico disminuyó entre -12 y -22 bar, según el clon; a los 18 d las células tolerantes al estrés osmótico acumularon más sodio, potasio, prolina y glicina betaína, que las células no seleccionadas. Ben (1987), en clones celulares de dos especies de cítricos sometidos a estrés inducido con PEG (6000-8000 da), encontró que el peso fresco disminuyó progresivamente conforme el potencial osmótico del medio de cultivo disminuyó (de -4 a -10 bar), con efectos más severos en las células susceptibles (no seleccionadas), pero con magnitudes diferentes entre las dos especies.
En condiciones in vivo los órganos de la planta de maíz varían en su grado de tolerancia al estrés; así, raíz, hoja, jilote y tallo detienen su crecimiento cuando su potencial hídrico alcanza valores de -14, -10, -7.5 y -5.0 bar, respectivamente (Westgate y Boyer, 1985); la tasa de alargamiento del vástago se reduce en mayor magnitud al disminuir el potencial hídrico del sustrato de -0.3 a -7.5 bar, en comparación con el sistema radical que mantiene su crecimiento aún cuando el potencial disminuya hasta -16 bar (Sharp et al., 2004). En el presente trabajo los valores más bajos del potencial hídrico en el tejido foliar se presentaron principalmente con 20 % de PEG (-13 a -23 bar), lo que explica porqué el crecimiento de los brotes se alteró en tales condiciones.
Ajuste osmótico y sus componentes
Los genotipos L-13 y L-16 presentaron el mayor ajuste osmótico, con 22.3 y 21.1 bar, respectivamente, al ser cultivados con 20 % de PEG (Cuadro 8). Sin embargo, la naturaleza de su ajuste osmótico difirió en la contribución proporcional de polímeros insolubles (hemicelulosa y celulosa) y de solutos. En los genotipos L-13 y L-46 el ajuste osmótico se debió en más de 60 % a la acumulación de solutos, mientras que en L-16 y L-14 el efecto de los polímeros contribuyó con más de 50 % al ajuste osmótico total, principalmente en los niveles más altos de estrés (15 y 20 % de PEG).

El sistema radical del maíz desarrollado bajo estrés hídrico presenta ajuste osmótico, proceso que puede resultar de dos mecanismos: el primero es un incremento en la tasa neta de acumulación de moléculas osmóticas (que incluyen efectos en síntesis, absorción, catabolismo, importación y utilización de solutos); el segundo implica un aumento de concentración simple o pasiva de solutos. Sin embargo, este último tipo de ajuste osmótico es insuficiente para mantener la presión de turgencia en raíces sometidas a estrés hídrico severo (-16 bar) y se recurre a la síntesis de proteínas, como expansinas y otras enzimas necesarias para el ablandamiento de la pared celular que permitan el crecimiento (Sharp et al., 2004). Esta respuesta también se ha encontrado en hojas de plántulas de maíz sometidas a estrés osmótico con PEG-6000 (Sabirzhanova et al., 2005). Ogawa y Yamauchi (2006a) observaron que en raíces de plántulas de maíz sometidas a estrés por 20 min, la reducción del potencial osmótico se debió en 46 % a la deshidratación celular y en 54 % a la biosíntesis o importación de solutos en las células; a las 12 h de estrés, la disminución del potencial osmótico se debió en 7 % a la deshidratación y en 93 % a la acumulación de solutos compatibles. En general, con 30 % de PEG la raíz acumuló mayor cantidad de solutos principalmente aminoácidos, en comparación con las hojas en donde la mayoría fueron azúcares reductores (Ogawa y Yamauchi, 2006b).
En plantas de sorgo sometidas a estrés hídrico, la concentración pasiva de solutos por deshidratación contribuyó con 47 al 50% al potencial osmótico del tejido. La reducción del volumen celular por la acumulación de polímeros insolubles contribuyó con menos de 8 % y la acumulación activa de solutos participó con 42 a 45 % (Girma y Krieg, 1992). En Atriplex halimus la variedad tolerante presentó una participación equitativa de la acumulación activa de solutos y la de polímeros insolubles como hemicelulosa y celulosa (de la pared celular), mientras que en la variedad sensible el ajuste osmótico se debió en su mayoría a la acumulación activa de solutos (Martínez et al., 2004).
En el presente trabajo las líneas L-14 y L-16 fueron las que presentaron mayor influencia de los polímeros insolubles en el ajuste osmótico y también son consideradas tolerantes a la sequía a nivel de campo, mientras que L-13 mostró mayor participación de la acumulación activa de solutos y se considera una línea intolerante a la sequía en campo (Zarco et al., 2005). Esto significa que es posible determinar el nivel de tolerancia a la sequía mediante ensayos conducidos in vitro, donde se examine el ajuste osmótico debido a la acumulación de polímeros derivados de la pared celular, tal vez por su capacidad para retener agua.
CONCLUSIONES
Los genotipos, niveles de estrés osmótico simulado con PEG y la selección recurrente bajo estrés tuvieron influencia sobre la altura, número de hojas y peso fresco de los brotes. Con base en el número de hojas, el peso fresco y seco, las mejores líneas después de tres ciclos de selección in vitro fueron L-14 y L-46. Después de esos tres ciclos de selección, el estrés osmótico redujo el contenido de agua en los brotes de cada genotipo conforme incrementó el contenido de PEG en el medio de cultivo. Los cambios en el potencial hídrico, la presión de turgencia, el potencial osmótico y el ajuste osmótico, del tejido foliar de los brotes, dependieron de la interacción genotipo x PEG. Las mejores líneas fueron L-14 y L-16 por presentar mayor ajuste osmótico en el tejido del brote, lo que además evidencia la viabilidad de aplicar la selección in vitro para discriminar genotipos en base a su tolerancia al estrés osmótico.
AGRADECIMIENTOS
Los autores agradecen al CONACYT el apoyo económico para el proyecto 31968-B del cual deriva este artículo.
BIBLIOGRAFIA
Al-Bahrany A M (2002) Callus growth and proline accumulation in response to polyethylene glycol induced osmotic stress in rice (Oriza sativa L.). Pakistan J. Biol. Sci. 5:1294-1296. [ Links ]
Banziger M, Edmeades G O, Beck D, Bellon M (2000) Breeding for Drought and Nitrogen Stress Tolerance in Maize: From Theory to Practice. CIMMYT, Mexico, DF. 68 p. [ Links ]
Ben H G (1987) Relationship between salt tolerance and resistance to polyethylene glycol induced water stress in cultured citrus cells. Plant Physiol. 85:430-433. [ Links ]
Bhaskaran S, R H Smith, R J Newton (1985) Physiological changes in cultured sorghum cells in response to induced water stress. Plant Physiol. 79:266-269. [ Links ]
Campos H, M Cooper, J E Habben, G O Edmeades, J R Schussler (2004) Improving drought tolerance in maize: a view from industry. Field Crops Res. 90:19-34. [ Links ]
Cubero J I (2003) Introducción a la Mejora Genética Vegetal. Ediciones Mundi Prensa. Madrid, España. 567 p. [ Links ]
Dragiiska R, D Djilianov, P Denchev, A Atanassov (1996) In vitro selection for osmotic tolerance in alfalfa (Medicago sativa L.). Bulgarian J. Plant Physiol. 22:30-39. [ Links ]
El-Aref H M (2002) Employment of maize immature embryo culture for improving drought tolerance. 3rd Scientific Conference of Agriculture Sciences. Faculty of Agriculture, Assiut University, Assiut Egypt. 20-22 October. pp:463-477. [ Links ]
Errabii T, C B Gandonou, H Essalmani, J Abrini, N Idaomar, N S Senhaji (2006) Growth, proline and ion accumulation in sugarcane callus cultures under drought-induced osmotic stress and its subsequent relief. African J. Biotechnol. 5:1488-1493. [ Links ]
Girma F S, D R Krieg (1992) Osmotic adjustment in sorghum. Plant Physiol. 99:577-582. [ Links ]
Gu R, Q Liu, D Pei, X Jiang (2004) Understanding saline and osmotic tolerance of Populus euphratica suspended cells. Plant Cell Tiss. Org. Cult. 68:261-264. [ Links ]
Gunn R E, P R Day (1986) In vitro culture in plant breeding. In: L A Withers, P G Alderson (eds). Plant Tissue Culture and its Agricultural Applications. Butterworths, UK. pp:313-327. [ Links ]
Jauhar P P (2006) Modern biotechnology as an integral supplement to conventional plant breeding: the prospects and challenges. Crop Sci. 46:1841-1859. [ Links ]
Li W, P Masilamany, K J Kasha, K P Pauls (2002) Developmental, tissue culture, and genotypic factors affecting plant regeneration from shoot apical meristems of germinated Zea mays L. seedlings. In Vitro Cell Dev. Biol. Plant. 38:285-292. [ Links ]
Lutts S, J M Kinet, J Bouharmont (1996) Effects of various salts and mannitol on ion and proline accumulation in relation to osmotic adjustment in rice (Oryza sativa L.) callus cultures. J. Plant Physiol. 149:186-195. [ Links ]
Martínez J P, S Lutts, A Schanck, M Bajji, J M Kinet (2004) Is osmotic adjustment for water stress resistance in the mediterranean shrub Atriplex halimus L. J. Plant Physiol. 161:1041-1051. [ Links ]
Ming L, G Xuan W, and J Sheng L (2003) Application of external calcium in improving the PEG induced water stress tolerance in liquorice cells. Bot. Bull. Acad. Sinica 44:275-284. [ Links ]
Murashige T, F Skoog (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473479. [ Links ]
Ogawa A, A Yamauchi (2006a) Root osmotic adjustment under osmotic stress in maize seedlings 1. Transient change of growth and water relations in roots in response to osmotic stress. Plant Prod. Sci. 9:27-38. [ Links ]
Ogawa A, A Yamauchi (2006b) Root osmotic adjustment under osmotic stress in maize seedlings 2. Mode of accumulation of several solutes for osmotic adjustment in the root. Plant Prod. Sci. 9:39-46. [ Links ]
Reddy P J, K Vaidyanath (1986) In vitro characterization of salt stress effects and the selection of salt tolerant plants in rice (Oryza sativa L). Theor. Appl. Genet. 71:757-760. [ Links ]
Sabirzhanova I B, B E Sabirzhanov, A V Chemeris, D A Veselov, G R Kudoyarova (2005) Fast changes in expression of expansin gene and leaf extensibility in osmotically stressed maize plants. Plant Physiol. Biochem. 43:419-422. [ Links ]
Santos-Díaz M S, N Ochoa-Alejo (1994) PEG-tolerant cell clones of chilli pepper: growth, osmotic potentials and solute accumulation. Plant Cell Tiss. Org. Cult. 37:1-8. [ Links ]
Sharp R E, V Poroyko, L G Hejlek, W G Spollen, G K Springer, H J Bonhert, H T Nguyen (2004) Root growth maintenance during water deficits: physiology to functional genomics. J. Exp. Bot. 409:2343-2351. [ Links ]
SAS Institute Inc. (2003) The Analyst Application, Second Edition. Cary, NC, USA. 500 p. [ Links ]
Turhan H, I Baser (2004) In vitro and in vivo water stress in sunflower (Helianthus annus L.). Helia 27:227-236. [ Links ]
Walden D B, R I Greyson, V R Bommineni, D R Pareddy, J P Sanchez, E Banasikowska, D T Kudirka (1989) Maize meristem culture and recovery of mature plants. Maydica 34:263-275. [ Links ]
Westgate M E, J S Boyer (1985) Osmotic adjustment and the inhibition of leaf, root, stem, and silk growth at low water potentials in maize. Planta 164:540-549. [ Links ]
Zarco P E, V A González H, Ma C López P, Y Salinas M (2005) Marcadores fisiológicos de la tolerancia a sequía en maíz (Zea mays L.). Agrociencia 39:517-528. [ Links ]














