Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista fitotecnia mexicana
Print version ISSN 0187-7380
Rev. fitotec. mex vol.32 n.2 Chapingo Apr./Jun. 2009
Artículos científicos
Cinética de enraizamiento in vitro de portainjertos de vid en respuesta a la fuente y concentración de azúcar
In vitro rooting kinetics of grapevine rootstocks in response to sugar source and concentration
Yurixhi A. Raya Montaño1,2, Ángel Villegas Monter1* y Gregorio Arellano Ostoa1
1 Programa de Recursos Genéticos y Productividad - Fruticultura, Campus Montecillo, Colegio de Posgraduados. 56230, Montecillo, Texcoco, Edo. de México. *Autor para correspondencia (avillega@colpos.mx)
2 Dirección actual: Facultad de Agrobiología Presidente Juárez, Universidad Michoacana de San Nicolás de Hidalgo. Paseo Lázaro Cárdenas, esquina con Berlín, Col. Revolución. 60090, Uruapan, Mich.
Recibido: 02 de Julio del 2007.
Aceptado: 01 de Abril del 2009.
RESUMEN
En la micropropagación tiene particular importancia la fuente y concentración de azúcar debido a que afecta los procesos de organogénesis. En este estudio se compararon los portainjertos de vid (Vitis sp.) 'Saltcreek' y 'Freedom' cultivados en un medio reducido en sales, con tres fuentes de azúcar (sacarosa, glucosa y manitol), y tres concentraciones (43.82, 87.64 y 175.28 mM), más un testigo sin azúcar. La respuesta se determinó mediante la cinética de enraizamiento, número y longitud de raíces y potencial osmótico del medio. El mayor enraizamiento se registró en el portainjerto 'Freedom', en el que inició al quinto día de establecido el cultivo, mientras que en 'Saltcreek' inicio hasta el décimo día. El máximo enraizamiento (100 % para 'Freedom y 75 % para 'Saltcreek') se obtuvo al usar como fuente de carbono a glucosa, aunque el mayor número de raíces en 'Freedom' se obtuvo con sacarosa y en 'Saltcreek' con glucosa, ambos a 175.28 mM. La longitud de raíz fue superior en el tratamiento con glucosa 175.28 mM en 'Freedom', y con sacarosa a 87.64 mM en 'Saltcreek'. Se observó que al aumentar la concentración de azúcares el potencial osmótico disminuyó de -0.26 MPa en 43.82 mM de manitol hasta -0.69 MPa en 175.28 mM de sacarosa. En 'Freedom' se puede obtener hasta 97 % de enraizamiento en medio con potencial osmótico -0.69 MPa.
Palabras clave: Vitis sp., manitol, glucosa, sacarosa, micropropagación, enraizamiento in vitro.
ABSTRACT
The source and concentration of sugars are important in micropropagation because they affect the organogenesis processes. In this study explants of the 'Saltcreek' and 'Freedom' grapevine (Vitis sp.) rootstocks, were compared when grown in a low-salt culture medium, combined with three sugar sources (sucrose, glucose and mannitol) at three concentrations (43.82, 87.64 and 175.28 mM), plus a control without sugars. The rooting kinetics, root number and length and medium osmotic potential were determined. The highest rooting occurred in the 'Freedom' rootstock, in which it started on the fifth day of culture, while in 'Saltcreek' it started until the tenth day. The maximum rooting rates (100 % for 'Freedom' and 75 % for 'Saltcreek') were obtained -0.26 MPa in mannitol at 43.82 mM to -0.69 MPa in sucrose at 175.28 mM. In rootstock 'Freedom' rooting can be as high as 97 % when cultivated at -0.69 MPa of osmotic potential.
Key words: Vitis sp., mannitol, glucose, sucrose, micropropagation, in vitro rooting.
INTRODUCCIÓN
La viticultura tanto para vino como para mesa, se ha desarrollado desde hace más de un siglo con base en el uso de portainjertos tolerantes a filoxera (Daktilosphaera vitifolii Planchon). La propagación de portainjertos de vid (Vitis sp.) a escala comercial se hace por medio del enraizamiento de estacas o por cultivo in vitro. En la propagación in vitro las condiciones ambientales en las que se desarrollan las plántulas hace que tengan características anatómicas y fisiológicas diferentes a las propagadas in vivo y por ello presentan estrés al ser trasplantadas en invernadero (Preece, 2003). Lo anterior se debe principalmente a la adición de azúcar al medio de cultivo, que estimula el desarrollo heterótrofo de las plántulas (Calvete et al., 2002), así como al crecimiento en recipientes cerrados con reducido intercambio gaseoso. En la micropropagación las etapas de enraizamiento y aclimatización in vivo, son las más importantes para la aplicación comercial de la técnica, cuyo éxito depende del número de plantas que sobreviven ex vitro.
En general, para el enraizamiento in vitro se recomienda reducir a 50 % la concentración de las sales del medio de cultivo empleado para proliferación, así como excluir la citocinina, aumentar la concentración de auxina y reducir la de sacarosa de 30 a 10 - 15 g L-1. Otros autores sugieren modificar la concentración y fuente de azúcar, usar contenedores que permitan el intercambio complementario de O2, entre otros (Paz-Silva et al., 2004). El potencial osmótico del medio de cultivo también es determinante para la morfogénesis in vitro, pero no se considera en la mayoría de las investigaciones (Lankes y Zimmerman, 1987; Molinos et al., 2004). Además, se recomienda hacer el trasplante a suelo a los 28 d, sin tomar en cuenta la especie y longitud de las raíces, que lo puede ocasionar daños mecánicos durante el trasplante e incrementar los problemas para la aplicación de la técnica (Thomas y Schiefelbein, 2001). El objetivo de esta investigación fue estudiar el efecto de la fuente y concentración de azúcar del medio de cultivo, en el enraizamiento in vitro de dos portainjertos de vid, con base en la cinética de enraizamiento de los explantes.
MATERIALES Y MÉTODOS
Medio de cultivo y tratamientos
Se utilizaron brotes apicales multiplicados in vitro de explantes de tallo con yema axilar de dos portainjertos de vid 'Saltcreek' y 'Freedom', provenientes de estacas enraizadas desarrolladas en invernadero. Ambos portainjertos tienen como progenitor a Vitis champini, cuarta especie de vid americana considerado resistente a nematodos y filoxera.
Los explantes empleados en esta investigación, que medían aproximadamente 1.5 cm, tenían tres hojas expandidas y habían sido subcultivados cuatro veces, se sembraron en frascos de vidrio con capacidad de 100 mL que contenían 25 mL de medio de cultivo compuesto por: NH4NO3 2.5 mM, KNO3 1.25 mM, MgSO4-7H2O 1.50 mM, Ca(NO3)2-4H2O 6.0 mM, EDTA 0.10 mM, Fe 0.09 mM, MnSO4-H2O 5.00 μM, H3BO3 100 μM, ZnSO4-5H2O 30 μM, Na2M0O4-2H2O 1.0 μM, CoCl2-6H2O 0.1 μM; complementado con 2.96 μM de tiamina, 5.55 μM de mioinositol, 0.1 μM de ácido indol butirico (AIB) y 6 g L-1 de agar agar (Merck®); el pH se ajustó a 5.7 antes de agregar la fuente de azúcar. Los explantes de cada portainjerto se distribuyeron en 10 tratamientos conformados por tres fuentes de carbono (sacarosa, glucosa y manitol), cada una en tres concentraciones (43.82, 87.64 y 175.28 mM), más un testigo sin azúcar; cada tratamiento tuvo tres repeticiones, y la unidad experimental fue un frasco con cuatro explantes, para un total de 12 explantes por tratamiento. El experimento se repitió en tres ocasiones.
El tiempo que permanecieron los explantes en el medio de enraizamiento se definió con base en el tamaño de raíces. La evaluación se efectuó cuando los explantes tuvieron al menos una raíz de 1 cm de longitud, criterio definido con base en estudios previos con vid de Paz-Silva et al. (2004). Los explantes se mantuvieron en cuarto de incubación a 25 ± 2°C, 16hde fotoperiodo con intensidad lumínica de 76 μmol m-2 s-1 producida por lámparas fluorescentes blancas frías.
Cinética y porcentaje de enraizamiento
Con el registro diario del número de explantes con raíz en cada tratamiento, se construyó la cinética del porcentaje de enraizamiento, desde el momento en que aparecieron las raíces hasta que las plántulas estuvieron listas para el trasplante, a los 10 y 15 d para 'Freedom' y ' Saltcreek', respectivamente.
Número de raíces emergidas por día
El número de raíces en cada explante se contó a partir del día cinco y hasta el día diez para 'Freedom', y de los 10 hasta los 15 d para 'Saltcreek'. Los tratamientos se distribuyeron conforme a un diseño experimental completamente al azar.
Potencial osmótico
Esta variable se midió en un frasco de cultivo de cada tratamiento con cuatro lecturas por frasco. Para ello se colocaron discos de papel filtro Whatman® No. 2 de 0.5 cm de diámetro, sobre el medio de cultivo, y tan pronto como se humedecieron se introdujeron en la cámara de muestras del osmómetro de presión de vapor (Wescor® 5100C). La lectura se registró en mmol kg-1. Los valores obtenidos fueron transformados a MPa con la ecuación propuesta por Van't Hoff: ψs = -CRT; donde: ψs = Potencial osmótico, R = Constante universal de los gases (0.00831 kg MPa mol-1 K-1), T = Temperatura absoluta en grados Kelvin (K = Grados Celsius + 273).Todos los datos de las variables se sometieron a análisis de varianza y pruebas de comparación de medias por el método de Tukey (P ≤ 0.05), para cada portainjerto, con el paquete estadístico SAS Institute (1997) versión 9.0.
RESULTADOS Y DISCUSIÓN
Cinética de enraizamiento
El tiempo que requirió para enraizar cada portainjerto fue diferente; en 'Freedom' las raíces emergieron a partir de los 5 d, mientras que en 'Saltcreek' se desarrollaron hasta a los 10 d; en ambos portainjertos el proceso de enraizamiento duró 5 d. Aún cuando el número de brotes enraizados se incrementó con el tiempo en ambos portainjertos, la cantidad fue mayor en 'Freedom' que en 'Saltcreek', lo que muestra la influencia del genotipo en este proceso (Cuadros 1 y 2). El efecto del portainjerto en el enraizamiento de vid fue reportado Paz-Silva et al (2004), quienes observaron que el portainjerto 'R110' fue superior al 'SO4'; así mismo, Coupier et al. (2000) señalaron que la mayoría de genotipos de vid enraizan a los 10 d. Como la emergencia de raíces fue a los 5 y 10 d, se infiere que el proceso de iniciación y diferenciación fue primero en 'Freedom' y posteriormente en 'Saltcreek'; esto evidencia que las condiciones para inducir enraizamiento se deben definir para cada portainjerto y no se deben generalizar.
En la velocidad de enraizamiento in vitro, la respuesta obtenida es semejante a la observada en especies como Gerbera jamesonii cuya emergencia de raíces in vitro se presentó a los 4 y 5 d (Olivera et al., 2000). En manzano (Malus pumila) las raíces emergieron entre los 7 y 9 d en medio liquido (Modgil et al., 1998), mientras que en Prunus domestica la regeneración de raíces ocurrió a la segunda semana de cultivo (Gonzalez et al., 2003). Estos resultados indican que el trasplante no tiene que realizarse hasta los 28 ó 30 d, como señalan Thomas y Schiefelbein (2001) para todas las especies. Esta recomendación se ha mantenido como norma, sin considerar el efecto que el factor tiempo tiene en el establecimiento en suelo, ya que las raíces de mayor longitud dificultan el trasplante y reducen la supervivencia; además, la velocidad de enraizamiento no es igual en todas las especies.
En adición, al disminuir el tiempo de permanencia en el cuarto de incubación se logra un ahorro de energía y costos.
En experimentos previos, Paz-Silva et al. (2004) encontraron que los portainjertos 'R110' y 'SO4' enraizaron a partir del séptimo día. En Vitis vinifera cv. 'Zelen' el enraizamiento inició a partir de la segunda y tercera semanas y transcurrió hasta la octava semana (Blazina et al., 1991). Según Singh et al. (1992), las raíces de vid cv. 'Perlette' emergieron entre los 8 y 12 d y permanecieron tres semanas en el medio de enraizamiento. En diez genotipos de Vitis evaluados por Coupiere et al. (2000), la mayoría de éstos enraizaron a partir del décimo día de cultivo. También se ha demostrado que el tipo de explante afecta la respuesta en Vitis vinifera cv. 'Arka Neelamani', ya que al eliminar el ápice Thomas (2000) encontró que en explantes procedentes de los nudos 1 y 2 de la parte superior, el enraizamiento se demoró más que en los nudos 3 y 4 de la parte basal en los que inició desde las dos semanas.
Las diferencias en vid observadas en este experimento y por otros autores, muestran que los factores fundamentales del enraizamiento son: cultivar o portainjerto utilizado, medio de cultivo, tipo y concentración de auxina, por lo que no se deben generalizar los resultados obtenidos porque son específicos para cada genotipo. Por otra parte, trasplantar plántulas de vid hasta los 28 d no es correcto por lo antes mencionado.
La velocidad de enraizamiento fue diferente en cada portainjerto. En 'Freedom' a los 5 d habían enraizado 2.2 brotes en glucosa y 4.4 en sacarosa, mientras que en manitol y testigo no había enraizamiento (Cuadro 3). El número de brotes con raíces se incrementó en forma gradual de los 5 a los 10 d, sobre todo con sacarosa y glucosa en donde enraizaron 11.4 brotes de 12 y superaron (P ≤ 0.05) a manitol y al testigo. El hecho de que el número de brotes enraizados en el testigo haya sido bajo (5.6) se puede deber a la falta de azúcar como fuente de energía de los explantes, lo que demuestra que las condiciones fisiológicas de los brotes difiere entre medios, aún cuando tengan el mismo tamaño. El efecto retardante del manitol se puede deber a la menor capacidad de los explantes para metabolizar este carbohidrato, como mencionan Welander et al. (1989).
Para los brotes del portainjerto 'Saltcreek' la tendencia fue similar a la observada en 'Freedom', aunque el enraizamiento inició hasta los 10 d. En este caso, el mayor número de explantes con raíces también se registró en el medio de cultivo con sacarosa y glucosa (4.6 y 4.3, respectivamente) y se elevó hasta 11.4 a los 15 d, y superaron (P ≤ 0.05) a los tratamientos con manitol y testigo, donde solo enraizaron 4.3 y 5.6 brotes (Cuadro 4).
Esta respuesta se puede deber, de acuerdo con lo indicado por Welander et al. (1989), a las diferencias genéticas de los explantes para metabolizar carbohidratos. Así, en manzano la fuente de azúcar que indujo la mejor brotación fue sorbitol, mientras que para Syringa y Alnus fueron loas azúcares manitol y glucosa, respectivamente.
Porcentaje de enraizamiento
El genotipo influyó aún más en el porcentaje de enraizamiento in vitro, ya que mientras 72.7 % de los explantes de 'Freedom' formaron raíces sólo 47.4 % lo hicieron en 'Saltcreek'. En este sentido, Paz-Silva et al. (2004) encontraron que plántulas de vid del portainjerto 'R110' presentaron 82.8 % de enraizamiento, en contraste con 50 % del portainjerto 'SO4'. Mathre et al. (2000) obtuvieron 83.3, 82 y 77 % de enraizamiento en los materiales de V. vinifera 'Tas-e-Ganesh', 'Sonaka' y 'Thompson seedless', respectivamente, al utilizar 0.1 mg L-1 de AIA en el medio de cultivo.
Además de estar influenciado por el genotipo, el porcentaje de enraizamiento de los explantes, también es afectado por las condiciones en que son cultivados. Al comparar 10 genotipos de Vitis Couprie et al. (2000) obtuvieron de 63.6 a 100 % de enraizamiento con 7.3 y 2.46 μM de AIB respectivamente, en el portainjerto 'R110' y de 0 a 18 % en el portainjerto 'SO4'. Estos resultados son acordes con los reportados por Chée y Pool (1983), quienes observaron respuestas diferentes entre genotipos y cultivares de Vitis.
La interacción entre la fuente de azúcar y el portainjerto tuvo efecto significativo en el porcentaje de enraizamiento. La mayor respuesta se registró en brotes cultivados con sacarosa y glucosa en ambos portainjertos, aunque 'Freedom' superó a 'Saltcreek', al lograr 95.3 % de rizogénesis con adición de sacarosa y glucosa, en contraste con 35.1 % y 47.2 % que se obtuvieron con manitol y testigo (Figura 1A). En el portainjerto 'Saltcreek' sólo 69.4 % de los brotes cultivados en medio con glucosa enraizaron y un porcentaje similar (62.9 %) se obtuvo con sacarosa. Los tratamientos de manitol y testigo fueron superados (P ≤ 0.05) por glucosa (Figura 1B). Estos resultados demuestran el efecto del genotipo en el enraizamiento in vitro de vid. Las auxinas (concentración y tipo) también son importantes en el proceso de enraizamiento, además del efecto de: genotipo, medio de cultivo (relación NO3/NH4, concentración de sales, entre otros), condiciones de incubación, etc. Por ello es difícil elegir al factor más importante, debido a que la respuesta obtenida puede ser resultado de la interacción de todos los factores involucrados.
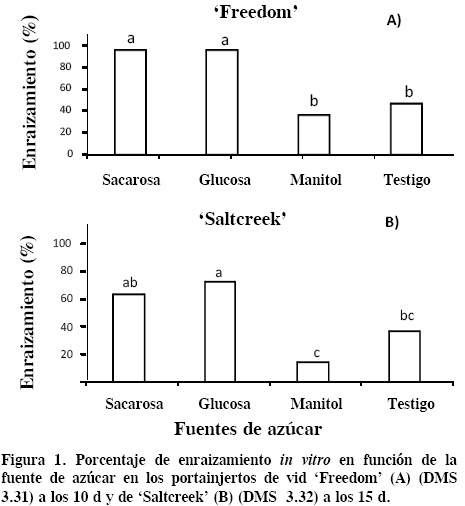
Al considerar conjuntamente los tres factores aquí estudiados, portainjerto, fuente y concentración de azúcar, en 'Freedom' el mayor porcentaje de enraizamiento (100 %) se obtuvo con 87.64 mM de glucosa, que generó -0.39 MPa de potencial osmótico, pero sin superar (P ≤ 0.05) a sacarosa a 175.28 mM y con un potencial osmótico de -0.67 MPa (Cuadro 5). El menor porcentaje de enraizamiento (8.3 %) se obtuvo con 175.28 mM de manitol y un potencial osmótico de -0.67 MPa. Las respuestas aquí obtenidas a los niveles de potencial osmótico no coinciden con los de Pierik (1990) y Morad y Henry (1998), quienes señalaron que con potenciales osmóticos por debajo de -0.3 MPa se inhibe el crecimiento y organogénesis, debido a la imposibilidad de absorber agua. Ello indica que el potencial osmótico también se debe definir para cada especie, y que no es correcto establecer parámetros generales porque sólo sirven como referencia. Para el portainjerto 'Saltcreek' el porcentaje más alto (75 %) se logró en el tratamiento de 43.82 mM con glucosa, y el menor (11.1 %) con manitol a 43.82 mM. De manera general, los tratamientos de sacarosa y glucosa superaron a los de manitol y testigo, en ambos portainjertos.
Se ha reportado que los potenciales osmóticos de los medios de cultivo utilizados para la propagación in vitro varían desde -0.21 hasta -0.33 MPa, y que la mayor respuesta se logra en medios con -0.33 MPa (Molinos-Silva et al., 2004). Sin embargo, Paz-Silva et al. (2004) reportaron que la mayor respuesta en vid se obtuvo en medio de cultivo con potencial osmótico de -0.11 MPa y la menor en potenciales de -0.53 MPa. Estos resultados coinciden con Dami y Hughes (1995), quienes comprobaron el efecto negativo de un bajo potencial osmótico en la etapa de enraizamiento. Lankes Zimmerman (1987) encontraron diferencias en el tamaño de plántulas y en el enraizamiento de Malus al modificar el potencial osmótico. En especies como Malus el uso del sorbitol promueve el enraizamiento y la formación de brotes (Welander et al., 1989). Según Leva et al. (1994), en Olea europea L. el manitol en altas concentraciones (68 g L-1) promueve el crecimiento de brotes hasta por cuatro subcultivos, aunque en subcultivos posteriores ocurre descrecimiento en esa misma concentración; cuando los autores utilizaron sacarosa el crecimiento se inhibió completamente, pero no indicaron el potencial osmótico del medio. Por otra parte, Shibli et al. (1992) observaron que el manitol en concentraciones de 0.1 a 0.2 M inhibe completamente el enraizamiento in vitro de crisantemo (Chrysanthemum morfolium).
Al considerar el efecto combinado del portainjerto y de la fuente de azúcar, la sacarosa a 175.28 mM con potencial osmótico de -0.69 MPa, influyó positivamente el número de raíces formadas (3.6) por brote en 'Freedom' (Cuadro 5). En cambio, para 'Saltcreek' el mejor azúcar fue glucosa a la misma concentración (175.28 mM), con un potencial osmótico de -0.59 MPa, y solamente se formaron 1.2 raíces. En esta variable los resultados obtenidos difieren de los presentados por Paz-Silva et al. (2004), quienes encontraron que al aumentar la concentración de sacarosa disminuye el número de raíces en el portainjerto de vid 'R110'. El hecho de que los mejores resultados se obtengan con la mayor concentración de sacarosa y glucosa (175 mM) para ambos portainjertos, confirma que no conviene reducir la concentración de sacarosa para inducir enraizamiento, y que además se pueden utilizar otras fuentes de azúcar.
CONCLUSIONES
El enraizamiento in vitro de los portainjertos de vid 'Freedom' y 'Saltcreck' varió entre genotipos y también dependió de la fuente y concentración de azúcar así como del potencial osmótico en el medio. En las condiciones de este trabajo, el portainjerto 'Freedom' alcanzó el máximo porcentaje de enraizamiento a los 10 d, mientras que 'Saltcreek' requirió de 15 d. En 'Freedom' se puede tener hasta 97 % de enraizamiento en medio de cultivo con potencial osmótico de -0.69 y -0.59 MPa en sacarosa y glucosa, respectivamente.
BIBLIOGRAFÍA
Blanzina I Z, Korosec-Koruza, M Ravnikar, N Gogala (1991) Regeneration and micropropagation of the grapevine (Vitis vinifera L. 'Zelen') from shoot tip meristems. Acta Hort. 300:123-127. [ Links ]
Calvete E O, A N Kämpf, M Suzin (2002) Concentrapao de sacarose no enraizamento in vitro de morangueiro. Hort. Brasil. 20:186-191. [ Links ]
Couprie I, N Ollat, J P Tandonnet, C Poizat, J P Doazan (2000) In vitro rhizognesis aptitudes of the petiole of different grapevine genotypes-comparison with hardwood cuttings. Acta Hort. 528:415-421. [ Links ]
Chée R, R M Pool (1983) In vitro vegetative propagation of Vitis: Application of previously defined culture conditions to a selection of genotypes. Vitis 22: 363-374. [ Links ]
Dami I, H Hugghes (1995) Leaf anatomy and water loss of in vitro PEG-treated 'Valiant' grape. Plant Cell Tiss. Org. Cult. 42:170-184. [ Links ]
González P L, K Web, R Scorza (2003) Early antibiotic selection and efficient rooting and acclimatization improve the production of transgenic plum plants (Prunus domestica L.). Plant Cell 22:38-45. [ Links ]
Lankes C, R H Zimmerman (1987) Impact of osmotic potential on in vitro cultures of apple. Acta Hort. 280:417-424. [ Links ]
Leva A R, R Petruccelli, G Bartolini (1994) Manitol "in vitro" culture of Olea europea L. (cv. Maurino). Acta Hort. 356:43-45. [ Links ]
Mhatre M, C Salunke, K Rao (2000) Migropropagation de Vitis vinifera L.: towards an improved protocol. Sci. Hort. 84:357-363. [ Links ]
Modgil M, D R Sharma, S V Bhardwaj (1998) Micropropagation of apple cv. Tydeman's Early Worcetes. Sci. Hort. 81:179-188. [ Links ]
Molinos-Silva Ch, A Villegas-Monter, P Sánchez-García, G Alcántar-González, M N Rodríguez-Mendoza, L M Ruiz-Posadas (2004) Efecto del potencial osmótico y contenido de Ca en el medio de cultivo sobre la distribución de Ca2+ y K+, producción de biomasa y necrosis apical de vid 'R110'. Interciencia 29:384-388. [ Links ]
Morad P, M Henry (1998) Optimization of the mineral composition of in vitro cultura media. J. Plant Nutr. 21:1565-1576. [ Links ]
Olivera O V Z, E M A Gutiérrez, E J A Gutiérrez, M R Andrade (2000) Cultivo in vitro de gerbera (Gerbera jamesonii H. Bolus) y su aclimatación a invernadero. Bioagro 12:75-80. [ Links ]
Paz-Silva R, A Villegas-Monter, C Trejo-López, T Terrazas-Salgado, C Cervantes-Martínez (2004) Niveles de sacarosa y pérdida de agua del medio de cultivo durante el enraizamiento in vitro de dos portainjertos de vid. Rev. Chapingo S. Hort. 10:119-125. [ Links ]
Pierik R L M (1990) In vitro culture of higher plants. 3a ed. Marthinuis Nijhoff Publisher, Dordrecht. Netherlands. 325 p. [ Links ]
Preece J, E (2003) A century of progress with vegetative plant propagation. HortScience 28:1015-1025. [ Links ]
SAS Institute (1997) SAS/STAT User's Guide Release 6.0 3 ed. Cary, NC, USA. [ Links ]
Shibli R A, L A Spomer, M A L Smith (1992) Osmotic adjustment and growth responses of three Chrysanthemum morfolium Ramat. cultivars to osmotic stress induced in vitro. J. Plant Nutr. 15: 1373-1381. [ Links ]
Singh A K, B B Sharma, R M Pandey (1992) Rapid in vitro multiplication of Vitis vinifera L. through shoot tips and nodal segments. Acta Hort. 321:601-605. [ Links ]
Thomas P (2000) Microcutting leaf area, weigth and position on the stock shoot influence root vigour, shoot growth and incidence of shoot tip necrosis in grape plantles in vitro. Plant Cell Tiss. Org. Cult. 61:189-198. [ Links ]
Thomas P, J W Schiefelbein (2001) Combined in vitro and in vitro propagation for rapid multiplication of grapevine cv. Arka 0elamani. HortScience 36:1107-1110. [ Links ]
Welander M, N T Welander, A S Brackman (1989) Regulation of in vitro shoot multiplication in Syringa, Alnus and Malus by different carbon sources. J. Hort. Sci. 64:361-366. [ Links ]














