Introducción
Los hongos del género Morchella Dill. ex Pers. son altamente cotizados a nivel mundial. Debido a su alto valor culinario distintivo, así como a su aroma agradable y a sus múltiples propiedades nutricionales y medicinales, se encuentran entre los hongos gourmet preferidos internacionalmente, solo superados por las trufas (Agro Fungi, 2002; Lakhanpal et al., 2010; Moctezuma, 2014). En mercados internacionales como Estados Unidos de América, el precio de estos hongos en seco para 2007 fue de entre 104 y 160 dólares kg-1 (Pilz et al., 2007). Para 2017, el precio en fresco en Michigan, EUA, y China fue de una media de 80 dólares kg-1 (Ge y Pecchina, 2017; Malone et al., 2022). En México, en mercados regionales de la Sierra Nevada (Estado de México), este grupo de hongos se vendieron en fresco, en 2009, a precios que variaron entre $50 y $150 M.N. kg-1, según la especie (Estrada et al., 2009). En mercados del municipio Amanalco, Estado de México, México, Burrola et al. (2012) reportaron precios de hasta $250 M.N. kg-1 en fresco. Esto coloca a este grupo de hongos como los más caros de la región; condición definida por su baja disponibilidad y por la lejanía física y temporal en su recolección (Estrada et al., 2009; Burrola et al., 2012).
Algunas especies de Morchella presentan alto potencial biotecnológico debido a que se pueden cultivar (Ower, 1982; Masaphy, 2010; Liu et al., 2017). Además, se pueden aprovechar bajo sistemas de micosilvicultura (Miller, 2005; Chung Guin-Po, 2010; Alvarado-Castillo et al., 2015). El cultivo artificial exitoso de Morchella spp. en interiores (cámaras de ambiente controlado) fue reportado y patentado por primera vez en Estados Unidos de América (Ower, 1982; Ower et al., 1986, 1987, 1988, 1989). Lo anterior permitió que se iniciara el cultivo artificial a gran escala en naves industriales y que a partir de 2005 se comercializaran las fructificaciones o ascocarpos en fresco; por ejemplo, la comercialización que realiza la empresa “Gourmet mushrooms” (Mason, Michigan, EUA) (Xu et al., 2022). Sin embargo, con el tiempo se presentaron dificultades técnico-operativas debido a la complejidad del método de cultivo, así como a las consecuentes fluctuaciones en la producción, por lo que dejaron de cultivarse en 2008 (Tan, 2016; Liu y Dong, 2020). Aunado a eso, las patentes no eran claras y eso dificultaba la reproducibilidad del método de cultivo (Tan, 2016; Liu et al., 2018; Xu et al., 2022). En la actualidad, investigadores de Israel y China han evidenciado el gran potencial biotecnológico que representa su resurgente cultivo a gran escala, tanto en interiores (cámaras de ambiente controlado y naves industriales) (Masaphy, 2005, 2010; CEMBN, 2016), como en exteriores (sistemas agrícolas con o sin rotación de cultivos y bajo malla sombra o bajo cubierta forestal/sistema agroforestal), pese a las dificultades técnicas (Ge y Pecchina, 2017; Liu et al., 2017; Liu y Dong, 2020).
La búsqueda de especies cultivables de Morchella es una actividad inicial necesaria de abordar para su posterior cultivo artificial (Masaphy, 2010). Hasta donde se conoce, en México no existen reportes en los que se logre el cultivo artificial de especies de dicho género. El objetivo del presente trabajo fue identificar las especies de Morchella recolectadas en un bosque de Abies religiosa (Kunth) Schltdl. & Cham., así como su cultivo y propagación en trigo.
Materiales y Métodos
Área de recolección
El área de recolección se ubica en la localidad Santo Tomás Apipilhuasco, Tepetlaoxtoc, Estado de México, México, a una altitud media de 3145 m, donde el clima corresponde a semifrío subhúmedo, en particular a C(E)(w2)(w) según INEGI (2008) con base en García (2004). La estación meteorológica más cercana es “San Juan Totolapa” (19.5297° latitud norte, 98.7267° longitud oeste; 2750 m s.n.m.; clima templado subhúmedo), ubicada a 6.5 km al noreste del sitio, donde para el periodo 1981-2010 la temperatura media normal fue de 13.7 °C, la mínima normal 7.1 °C y la máxima normal 20.3 °C, con precipitación normal anual de 549.2 mm (SMN, 2010).
La provincia fisiográfica correspondiente al área de estudio es el Eje Neovolcánico, la subprovincia Lagos y Volcanes Del Anáhuac, así como la topoforma sierra volcánica con estratovolcanes o estratovolcanes aislados (INEGI, 2001). Con respecto a la edafología, a nivel regional dominan los suelos cambisoles eútricos y andosoles mólicos; en menor medida se presentan litosoles (SEMARNAP, 1998).
El área de recolecta abarcó un radio de 150 m del punto ubicado a 19.49362° latitud norte, 98.67641° longitud oeste en dos sitios dentro de un bosque de oyamel (Abies religiosa). El sitio 1 (19.49327° latitud norte, 98.6778° longitud oeste) registró la presencia de árboles maduros de oyamel, de 25 a 35 m de altura. Estos, localizados entre 30 y 50 m de distancia a un cuerpo de agua artificial (“Jagüey”) y de una vereda. El sitio 2 (19.4937º latitud norte, 98.6760º longitud oeste) presentó acolchado (capa gruesa de humus y hojarasca) y troncos en pudrición. El sitio se ubicó en una ladera, al margen de un río intermitente y sin agua, en el que se observaron árboles de renuevo de oyamel (1 a 3 m), pero no sobre el margen.
Los especímenes se recolectaron en octubre de 2017, mes en el que se han reportado abundantes especies de Morchella en México (Durán, 1999; Arteaga y Moreno, 2006; Naturalista, 2022). Para la identificación se utilizó la guía de hongos de Pacioni (1982). Cada uno de los ascocarpos recolectados se colocaron individualmente en bolsas de papel estraza, mismas que fueron etiquetadas con plumón permanente y transportadas, en una canasta con la finalidad de evitar daños físicos, hasta el Laboratorio de Semillas de la División de Ciencias Forestales (DICIFO) que pertenece a la Universidad Autónoma de Chapingo, Chapingo, México.
Caracterización macromorfológica y micromorfológica de los ascocarpos
El color de los ascocarpos fue codificado de acuerdo con el Sistema de Color Natural (NCS por sus siglas en inglés) desarrollado por el Instituto Escandinavo del Color (IEC, 2022). Las medidas de las diferentes partes de las fructificaciones fueron tomadas con vernier digital caliper (Uline, model H-7352, Pleasant Prairie, Wisconsin, E.U.) de acuerdo con la metodología descrita por Hernández (2012), considerando lo siguiente:
a) Himenóforo: color, largo y ancho (diámetro inferior, medio y superior). La forma se definió en función de la conicidad (C) usada en la clasificación varietal del maíz (Ordas y Ron, 1988), expresada como índice (1/1) con la ecuación:
Donde: 𝐷𝑖 es el diámetro inferior, D𝑠 el diámetro superior, y 𝐿 la longitud total del himenóforo. A partir de C la forma del himenóforo se definió como cilíndrica cuando es <15%, subcónica con valor de C=15-20%, o cónica con C≥20%.
b) Costillas: número total, distancia entre crestas (DPEC, promedio de cinco pares de crestas y desviación estándar) y profundidad del valle promedio (PVP).
c) Estípite: largo, ancho (base, parte media y superior), color y textura (lisa L, granulosa G o aterciopelada A). La textura se definió de acuerdo con la Society for General Microbiology (SGM, 2022).
Por medio de esporadas obtenidas (12 h) de una porción del himenóforo sobre un portaobjetos, se estudiaron las ascosporas en preparaciones montadas con azul de metileno bajo un microscopio compuesto marca Leica, Modelo ICC50 (Wetzlar, Germany). Las ascosporas, ascas y paráfisis fueron fotografiadas con el software Leica aplication suite LAS EZ, v. 3.2.0 (LAS EZ, 2023). Las fotografías fueron exportadas al programa AutoCAD (2016), v. M.49.0, donde se midió el largo (L) y ancho (A) de 50 ascosporas de cada ejemplar. Se utilizó el coeficiente Q (L/A) de las esporas como indicador de su forma (Hughes et al., 2007; Hernández, 2012). También se calculó la superficie de las ascosporas, tal como lo ha sugerido Loizides (2017). Para ello, se utilizó la fórmula del área dentro de una elipse expresada en µm:
En donde: L es el largo de la espora y A el ancho de la espora.
Finalmente, se calculó la media aritmética de cada característica medida. La información de la caracterización macro y micromorfológica fue contrastada con la de literatura especializada (por ejemplo, Loizides et al., 2015; Loizides, 2017).
Extracción de ADN, amplificación y secuenciación
Los especímenes del género Morchella presentan una morfología compleja (Masaphy, 2010); sus ascocarpos suelen ser morfológicamente diferentes en su etapa madura e inmadura, aun si pertenecen a la misma especie (Loizides, 2017). Por lo anterior, fue necesario obtener ADN para su posterior secuenciación como soporte de su identificación taxonómica. Para ello, fueron seleccionados tres de los especímenes recolectados, en buen estado, y que presentaron un fenotipo diferente para ser identificados mediante técnicas taxonómicas y moleculares. Una porción de tejido del estípite se tomó para el análisis molecular, mientras que para los aislamientos in vitro del micelio se tomó parte del himenóforo. Los ejemplares identificados molecularmente fueron Santos 101 (recolectado en el sitio 1), y Santos 201 y 202 (recolectados en el sitio 2).
La extracción de ADN de las muestras se realizó de acuerdo con el método CTAB (Martínez-González et al., 2017). El ADN se cuantificó con el espectrofotómetro Nanodrop 200c (Thermo Scientific TM, Wilmington, D.C., USA). La región del espaciador transcripto internor DNA-ITS1 5.8S se amplificó con los primers ITS5-ITS4 (White et al., 1990). La mezcla de reacción para PCRs se llevó a cabo en un volumen final de 15 µl que contenían 1× buffer, 0.8 mMdNTPs mezcla, 20 pmol para cada primer, 2 unidades de GoTaq DNA (Promega, USA) y 100 ng de ADN molde. Los productos del PCR fueron verificados en un gel de agarosa para electroforesis. El gel se corrió durante 1 h a 95 V cm⁻³ en 1.5% agarosa y 1× TAE buffer (Tris Acetate-EDTA). El gel fue teñido con GelRed (Biotium, USA) y las bandas se visualizaron en un Infinity 3000 trans illuminator (Vilber Lourmat, Eberhardzell, Alemania).
Los productos fueron purificados con el paquete de purificación ExoSAP (Affymetrix, EUA), siguiendo las instrucciones del fabricante; las cuales fueron cuantificadas y preparadas para la reacción de secuenciación mediante un BigDye Terminator v. 3.1 (Applied Biosystems, Foster City, EUA). Los productos fueron secuenciados en ambas direcciones con un secuenciador modelo 3730XL (Applied Biosystems, Foster City, EUA) en el Instituto de Biología de la Universidad Nacional Autónoma de México (UNAM). Las secuencias obtenidas fueron comparadas con el cromatograma original para detectar y corregir posibles errores de lectura. Las secuencias para cada uno de los genes fueron analizadas, editadas y ensambladas utilizando BioEdit v. 7.0.5 (Hall, 1999). Con el objetivo de generar una secuencia consenso, las secuencias se compararon con las depositadas en NCBI (2020) utilizando la herramienta BLASTN v. 2.2.9 (Zhang et al., 2000).
Cultivo in vitro
De cada uno de los tres ejemplares seleccionados para secuenciación, se tomaron trozos de tejido del himenóforo para el aislamiento de micelio in vitro en cajas Petri con medio PDA (preparado a un pH de 5.6±0.2 y sin antibiótico). Las cajas Petri se depositaron en una incubadora de luz controlada durante 21 días, Prendo® INCL-11 (Prendo, SEVMÉXICO, Puebla, México) a 20±5 °C y en obscuridad. Se realizaron 14 réplicas por cada ejemplar.
Se registraron el tiempo medio en que la cepa colonizó al medio de cultivo y las siguientes características (Hernández, 2012; SGM, 2022): forma de la cepa (circular, irregular, filamentosa o rizoide), forma del borde (entero, ondulado, filiforme, rizado o lobulado), elevación de la cepa (gruesa, convexa, delgada, umbonada o crateriforme), textura de la cepa (acanalada, lanosa, granulosa, aterciopelada, lisa o algodonosa), densidad de la cepa (baja, media o alta) e hifas aéreas (ausente, poco, regular o abundante). La asignación del color se efectuó con base en la carta NCS (IEC, 2022).
Las cepas se conservaron durante un mes en tubos entomológicos de 35 ml con medio PDA. Se les inoculó con fragmento de micelio de 8 mm diámetro y se incubaron durante una semana para el crecimiento de micelio a 20±5 °C. Posteriormente, y en condiciones asépticas, al tubo con el micelio se le agregó aceite previamente esterilizado a 16 lb/in2 durante 15 minutos hasta que tomó una coloración transparente (lo cual se logró hasta la tercera esterilización). Los tubos se conservaron bajo refrigeración a 4 °C en el Laboratorio DICIFO de la Universidad Autónoma de Chapingo.
Propagación de micelio en granos de trigo y obtención de esclerocios
Utilizando diferentes semillas (arroz, trigo y maíz) se experimentó en pruebas preliminares la propagación de micelio de una especie no identificada de Morchella. Los granos de trigo resultaron ser un buen sustrato debido a que presentaron un óptimo crecimiento del micelio. Derivado de lo anterior, se remojó 1 kg de grano de trigo por cada 1.3 l de agua durante 12 h, dejándose escurrir durante 1 h en harneros de malla sombra con orificios de aproximadamente 1 × 1 mm. Posteriormente el trigo se colocó en frascos de vidrio de 413 ml (8 cm de diámetro y 23 cm de altura aproximadamente) hasta 3/4 partes del recipiente (unos 160 g de trigo por frasco), realizándose diez repeticiones. A cada uno de los frascos se le colocó una tapa hecha de algodón, la cual se cubrió con un pedazo de aluminio. Los frascos con trigo se esterilizaron durante 50 min a 16 lb in-2 (110.316 KPa) en autoclave vertical de 24 l, Evar (Jalisco, México), y se dejaron enfriar para su posterior inoculación.
La inoculación consistió en colocar a cada frasco cuatro discos de 8 mm de diámetro de los cultivos stock de micelio de cada cepa aislada. Los frascos se incubaron a 20±5 °C y en obscuridad en una incubadora de luz controlada, modelo INCL-11, marca Prendo® (Puebla, México). Se realizaron diez repeticiones de cada ejemplar. Durante tres semanas se registró el porcentaje de colonización del hongo en el trigo y se consideró 100% cuando todo el trigo fue cubierto por el micelio del hongo. Así mismo, con el objetivo de producir ascocarpos, se inoculó el trigo con micelio de los especímenes estudiados en 800 g de suelo de monte. El suelo se colocó en charolas de plástico de 24 × 28 cm y 11 cm de profundidad. En la charola se colocó el suelo de monte y después una capa de trigo esparcida en toda el área de la charola. Posteriormente se cubrió con una capa de suelo de aproximadamente 1 cm, y de lo anterior se realizaron tres repeticiones. Las charolas se cubrieron con aluminio y se colocaron en una cámara de ambiente controlado Barnstead (Lab-Line, San Diego, EUA) a 20±5 °C y en obscuridad durante 40 días, con riegos de agua purificada y estéril cada tercer día con el fin de mantener la humedad a 80%.
Resultados
En el área de estudio se recolectaron 15 fructificaciones de Morchella. Estas se identificaron taxonómicamente como M. tridentina Bres. con base en sus características macro y micromorfológicas. La identificación de tres de esos especímenes se apoyó con técnicas moleculares y fueron registradas y depositadas en el Herbario CHAP como Santos 101, 201 y 202. Un análisis de las secuencias de dichas muestras, con la herramienta BLAST, dio como resultado 100% de similitud con secuencias de Morchella frustrata M. Kuo (Cuadro 1), especie recientemente reagrupada como sinónimo de M. tridentina (Loizides et al., 2015; Richard et al., 2015). Lo anterior fue la base para tratar los especímenes estudiados en el presente trabajo como M. tridentina.
Cuadro 1: Especímenes de M. tridentina Bres. número voucher, número de acceso en NCBI (2020) de las secuencias generadas aquí (en negritas), % similitud BLAST y secuencias con mayor similitud en NCBI (2020).
| Especie | Voucher | No. Acceso GenBank | BLAST % | ˃similitud No. Acceso GenBank |
| Morchella tridentina Bres. | Santos 101 | ITS - MG893856 | 100% Morchella frustrata M. Kuo | MF954682.1, MH718201.1 |
| Morchella tridentina Bres. | Santos 201 | ITS - MG893857 | 100% Morchella frustrata M. Kuo | KT875083.1 |
| Morchella tridentina Bres. | Santos 202 | ITS - MG893858 | 100% Morchella frustrata M. Kuo | KM204684.1 |
Taxonomía
Morchella tridentina Bres., Fung. trident. 2(11-13): 65. 1898. Figs. 1, 2.

Figura 1: Ascocarpos de Morchella tridentina Bres. en el área de estudio, municipio Tepetlaoxtoc, Estado de México, México. A. Santos 101; B. Santos 201; C. Santos 202.
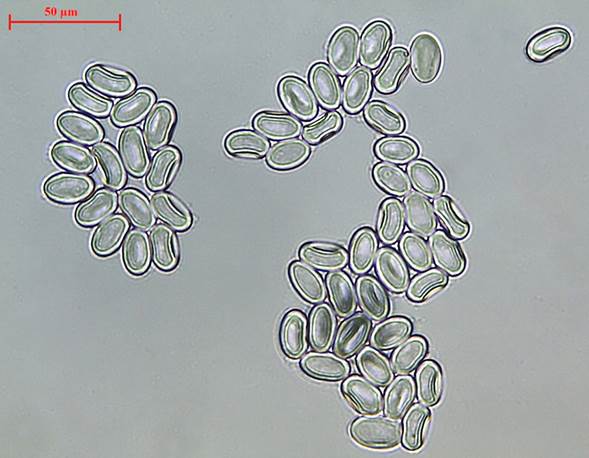
Figura 2: Ascosporas de Morchella tridentina Bres. vistas con el microscopio compuesto a 80 × (Santos 202).
TIPO: ITALIA. 10.V.1882, G. Bresadola S-F9101 (lectotipo: S).
Ascocarpo de hasta 161 mm; himenóforo 66-98 mm de largo, con diámetro inferior 35-50 mm, medio 30-55 mm y superior 27-66 mm, cilíndrico a subcónico o cónico (coeficiente C=4.6-19.7), de color marrón a crema; costillas variables en número, 21-25, con una distancia promedio entre crestas (n=10 costillas), 6.3-7.5 mm y una profundidad del valle promedio 4.6-5 mm; estípite 52-62 × 23-25 mm de diámetro:parte superior 25-31 mm, parte media e inferior 26-32 mm; estípite con forma obclavada, superficie granulosa a aterciopelada, color crema (S 0505-Y20R) (Fig. 1); ascosporas 22.2-24.3 × 13.3-13.9 µm (media=23.1 × 13.6 µm), Q=1.67-1.72 µm (media=1.7 µm), elipsoides, con pared lisa, hialinas, superficie de 241.4-276.2 µm (media=261.5 µm) (Fig. 2); ascas elípticas de 171-230 × 21-22 µm, con ocho ascosporas, protunicadas y no amiloides; paráfisis en promedio de 130 × 10 µm, con terminación cilíndrica (Fig. 3A, B).
Hábito y hábitat: solitario a gregario, en suelo, entre hojarasca, en bosque de Abies religiosa a una altitud media de 3145 m. Fructifica en octubre.
Distribución: ampliamente distribuida de apariencia cosmopolita (ver discusión abajo). Se cita por primera vez para el municipio Tepetlaoxtoc, Estado de México.
Material examinado: MÉXICO. Estado de México, municipio Tepetlaoxtoc, Santo Tomás Apipilhuasco, X.2017, Santos 101 (CHAP), 201 (CHAP), 202 (CHAP).
Cultivo in vitro
El tiempo que las cepas tardaron en colonizar el medio de cultivo (cajas Petri de 90 mm de diámetro × 14 mm de alto) fue de 5 a 8 días; esto es, una tasa de 9 a 5.6 mmd-1 (Fig. 4 A-C) para la mayoría de los reaislamientos. En algunos casos se observó una menor velocidad de crecimiento.
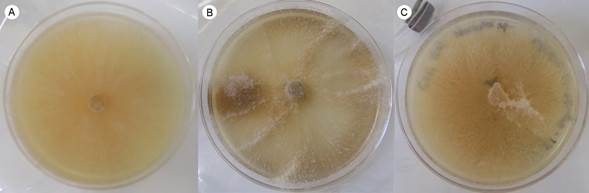
Figura 4: Cultivo in vitro de Morchella tridentina Bres. A. cepa de Santos 101; B. cepa de Santos 201; C. cepa de Santos 202.
Las características de la cepa en cultivo in vitro variaron a pesar de que se trata de la misma especie, lo que sugiere una variación por individuo. Las cepas de los tres ejemplares presentaron un color de amarillo a marrón claro (Santos 101: S 0505-G80Y, Santos 201: S 1010-Y20R; Santos 202: S 0502-Y); con forma irregular (Santos 101) a circular (Santos 201 y 202); textura de aterciopelada (Santos 101) a aterciopelada-lanosa con borde lanoso (Santos 201 y 202); la densidad fue de media (Santos 201) a alta (Santos 201 y 202); con borde ondulado (Santos 101) a entero (Santos 201 y 202); hifas aéreas de regulares (Santos 101) a abundantes (Santos 201 y 202).
Propagación y formación de esclerocios en granos de trigo
Durante la manipulación de las cepas se perdió Santos 101, por lo que solo se propagaron en trigo las cepas de Santos 201 y 202. En la primera y segunda semana el porcentaje de colonización del trigo por el hongo en los frascos fue de alrededor de 30%, mientras que en la tercera semana para ambos ejemplares fue de 60%. Cabe señalar que no se notaron diferencias en las repeticiones de cada ejemplar.
Se observó la presencia de esclerocios (Figs. 5C, 6) en las paredes de todos los frascos a partir del día 21 después de la inoculación, los cuales aumentaron su presencia conforme transcurrió el tiempo. Tales estructuras se identificaron como esclerocios debido a la presencia de almidones (Fig. 5C), lo cual es una particularidad de dichas estructuras de resistencia rígida (Volk y Leonard, 1989a, 1990; Alvarado, 2008, 2011; Masaphy, 2010). Así mismo, la observación coincide con la de trabajos previos en otras especies de Morchella (Liu et al., 2017; Liu y Dong, 2020). Estas estructuras varían en características conforme a la especie y pueden resultar claves en su cultivo artificial, pues son las estructuras de donde se forman los primordios, que a su vez originan el ascocarpo (Liu et al., 2017; Liu y Dong, 2020).

Figura 5: Colonización del trigo por el micelio de Morchella tridentina Bres. A. frascos con trigo recién inoculados con el hongo; B. cepa de Santos 201 a 15 días de la inoculación; C. cepa de Santos 202 a 21 días de la inoculación.

Figura 6: Esclerocios de Morchella tridentina Bres., cepa Santos 201. A, B. vista macroscópica de los esclerocios, la flecha azul señala un esclerocio de forma circular; C. vista microscópica del tejido del esclerocio.
En la Figura 7 se muestra una capa blanca de conidios que se produjo tras 30 días de la inoculación del trigo infectado por el hongo en el suelo de monte. Desafortunadamente no fue posible reproducir carpogénicamente al hongo, posiblemente debido a la falta de condiciones agronómicas (ambientales y edáficas) y de inducción óptimas.
Discusión
Morchella tridentina previamente fue reportada por Hernández (2012) (bajo su sinónimo M. frustrata) en el Parque Nacional Iztaccíhuatl-Popocatépetl lo que hace notar que le favorecen las condiciones bióticas y abióticas de los bosques de Abies religiosa ubicados en la provincia del Eje Neovolcánico o Sierra Volcánica Transversal. Se ha concluido que dicha especie probablemente es biotrófica o endofítica (Bresadola, 1898; Loizides et al., 2015; Loizides, 2017). Se trata de una especie cosmopolita que puede encontrarse en al menos diez países (Argentina, Armenia, Chile, Chipre, Francia, India, Italia, España, Turquía y los Estados Unidos de América) de cuatro continentes; se vincula a Abies Mill., Arbutus L., Castanea Mill., Fraxinus Tourn. ex L., Olea L., Pinus L., Pseudotsuga Carrière, Quercus L., y al menos otras siete especies arbóreas; así mismo, ha sido clasificada como una de las siete especies transcontinentales (Du et al., 2015; Loizides et al., 2015; Richard et al., 2015; Loizides, 2017).
La macromorfología de M. tridentina se asemeja en tamaño y forma a la de algunas especies anteriormente descritas para el Centro de México como M. esculenta var. crassipes (Vent.) Kreisel, M. conica Pers. y M. conica var. angusticeps Clowez (Rodríguez y Herrera, 1962). Sin embargo, existe la posibilidad de que las especies definidas bajo la taxonomía moderna no correspondan con las especies descritas en el pasado ni con la totalidad existente en el territorio mexicano; es decir, que exista mayor diversidad de la actualmente registrada. Los especímenes recolectados se encontraban en un área con un radio reducido y mostraban diferencias macroscópicas considerables, lo que sugiere diferencias genéticas significativas y una alta plasticidad morfológica, que son características afirmadas previamente a nivel género (Pilz et al., 2007; Loizides et al., 2015; Loizides, 2017). Este patrón podría repetirse en muestras de especies posiblemente cercanas. Esta afirmación se basa en que las características de su fructificación se ven afectadas por las dinámicas de desarrollo y las condiciones ambientales (Masaphy, 2010; Loizides, 2017).
En los tres ejemplares estudiados, el tamaño de las ascosporas varió (22.2-24.3 × 13.3-13.9 µm). Hernández (2012) reportó valores similares para su sinonimia M. frustrata (20-26 × 13-16 µm). En especies como M. deliciosa Fr. se ha registrado un tamaño de 21-23 × 12-15 µm y en M. esculenta (L.) Pers. de 16-22 × 10-12 µm (Baran y Borón, 2017). Es decir, M. tridentina tiene un tamaño de ascosporas más parecido al de M. deliciosa, debido quizás al hecho de que se encuentran evolutivamente más cercanas entre sí con respecto a M. esculenta (Kuo et al., 2012; Richard et al., 2015). Para Morchella tridentina se han reportado ascas hasta de 350 × 25 µm, con ocho ascosporas (octosporadas), uniseriadas y no amiloides; paráfisis hasta 150 × 20 µm de ancho, con terminaciones anchas, cilindráceos, abultados o en forma de huso e hialinos (Muñoz, 2019).
Las cepas que más rápido colonizaron el medio PDA fueron las provenientes de Santos 202, las cuales registraron el menor tiempo de colonización y el cambio más rápido en la coloración del medio de cultivo (seis a ocho días). Ese cambio de color es característico del género, tal como lo observó Stamets (2000). En los casos de M. deliciosa y M. esculenta, se ha reportado que alcanzan un crecimiento de 90 mm de diámetro en cinco días en medios de cultivo suplementados o basados en extracto de malta más Tetracyclinum o sacarosa (Winder, 2006; Baran y Borón, 2017), lo que superó al tiempo de crecimiento aquí reportado, quizás debido a la mayor disponibilidad de nutrimentos. Esto coincide, en general, con el tiempo de colonización cuando el medio de cultivo se suplementa con extractos ricos en materia orgánica como el compost (Volk y Leonard, 1989a, 1990; Alvarado, 2008, 2011). Tales argumentos afirman que la colonización del medio de cultivo está relacionada con el material vegetativo y con el medio de cultivo (Hernández, 2012).
Se ha reportado que el color de la cepa varía con respecto a su maduración (Stamets, 2000). De hecho, se notaron diferencias entre cepas de un mismo ejemplar y entre cepas de ejemplares diferentes, suceso determinado posiblemente por una mayor capacidad de crecimiento (y maduración) en ciertas “secciones” de las cepas o variabilidad genética en el mismo material de un ejemplar (entre ascosporas).
En la etapa inicial la mayoría de las cepas presentaron una elevación crateriforme, posiblemente por el rápido crecimiento que se observa en las cepas recientemente aisladas (“cepas jóvenes”) en especies del género en estudio (Stamets, 2000). Se observó que con cada reaislamiento la cepa pierde vigor paulatinamente, tal como lo ha afirmado Stamets (2000) en M. esculenta (una de las especies más cultivadas y conocidas hasta entonces y que posteriormente se determinó que se trataba de M. rufobrunnea Guzmán y F. Tapia (Tan, 2016)). Es posible que la pérdida de vigor se deba a que esta especie necesite pasar por una fase sexual para recuperar y mantener esta vigorosidad; es decir, ello sugiere un carácter heterotálico (fructificación con la necesidad de apareamiento micelial y ascosporas) en su reproducción.
Contrario al mencionado carácter heterotálico, también se ha presentado homotalismo (fructificación sin necesidad de apareamiento ni esporas) facultativo en las especies más comúnmente cultivadas en China, tales como M. importuna M. Kuo, O’Donnell & T.J. Volk, M. sextelata M. Kuo y M. eximia Boud, que son especies de tipo pirofílico obligado o facultativo, del subclado Distantes en el Clado Elata (Larson et al., 2016; Du et al., 2017; Liu y Dong, 2020).
De acuerdo con la morfología externa y crecimiento micelial, el material vegetativo más adecuado para obtener una propagación más rápida y densa corresponde a Santos 202, ya que en el presente estudio mostraron un mayor crecimiento y facilidad de aislamiento. Liu y Dong (2020) recomiendan usar medio PDA sin adiciones de materia orgánica o maltosa para lograr un mejor control sobre los aislamientos y evitar contaminación por bacterias.
La propagación de micelio de Morchella se ha realizado en diferentes semillas, como es el caso reportado para M. esculenta por Alvarado-Castillo et al. (2008), quienes observaron mejores tasas de crecimiento en semillas de centeno (Secale cereale (L.) M. Bieb.) como medio de propagación con respecto al grano de trigo, por lo que deberá ser considerado como una alternativa en trabajos posteriores.
Los esclerocios han sido reportados en varios trabajos en medios de cultivo sólidos o líquidos, adicionados o no con sustancias ricas en materia orgánica o en sustratos compuestos por una capa inferior rica en nutrientes y una capa superior pobre en nutrientes (Volk y Leonard,1989a; 1990; Durán, 1999; Alvarado, 2008; 2011; Alvarado-Castillo et al., 2008; 2012; Baran y Borón, 2017; Liu et al., 2017; Liu y Dong, 2020), pero también se les ha reportado creciendo en la naturaleza (Volk y Leonard, 1990; Miller et al., 1994). Sin embargo, no son esclerocios en el sentido estricto (estructuras rígidas de reserva de nutrientes y de resistencia a condiciones adversas), como en Sclerotinia sclerotiorum (Lib.) de Bary), sino más bien pseudoesclerocios (Volk y Leonard, 1989b), formados por ramificaciones e hinchamientos repetidos de hifas; ese término se ha aceptado en la literatura del género, pero debe tenerse en cuenta la diferencia. En China, la calidad del inóculo durante su cultivo artificial (en exteriores y a gran escala) se relaciona con los esclerocios (y con otros factores, aún desconocidos), así como con la pureza de la cepa (Liu et al., 2018; Liu y Dong, 2020). Los esclerocios a su vez intervienen en la formación de los primordios (estructuras iniciales de la carpogénesis). La forma en que operan estos elementos no está completamente esclarecida; en cierta medida se ha observado que dependen de varios factores como la nutrición y la estimulación oxidativa por ciertas bacterias (Liu et al., 2017; 2018; Liu y Dong, 2020).
Se ha documentado la aparición de una densa capa blanca y asexual de conidios (“powdery mildew” en inglés) sobre la superficie de sustratos en cultivo artificial después de la etapa de esclerocios y previo a la fructificación (Rodríguez y Herrera, 1962; Ower et al., 1986, 1987, 1988, 1989; Pilz et al., 2007; Masaphy, 2010; Liu et al., 2017; Xu et al., 2022), que se ha observado, tiene una relación directa con la fructificación; sin embargo, el mecanismo que lo explica aún es desconocido (Liu et al., 2017). Dicha capa nunca ha sido reportada en la naturaleza (Masaphy, 2010), pero sí denota con gran certeza las fases posteriores de formación carpogénica y es un criterio usado en la elección de cepas comerciales (Liu et al., 2017; Liu y Dong, 2020). Esta capa de conidios se presentó con las cepas de este estudio, lo cual resulta en un indicio de la posibilidad de su cultivo.
En este trabajo se sientan las bases para la posible germinación carpogénica de M. tridentina. Para llegar a la obtención de ascocarpos con la especie estudiada es necesario determinar las condiciones óptimas en las cuales germinaría, como lo son las ambientales (temperatura y ventilación), riego, nutrición, tipo de sustrato y mecanismos de inducción-estrés. Así mismo, se deberán tener en cuenta la variación entre cepas y considerar diferentes especies a la par (de preferencia) en un mismo ensayo.
Dado que M. tridentina forma esclerocios y produce una capa blanca de conidios podría tener potencial biotecnológico para su cultivo artificial, al igual que otras especies que se han ensayado en México, principalmente M. esculenta y M. conica (Alvarado, 2008, 2011; Alvarado-Castillo et al., 2008, 2012) y otras más que se cultivan en China (M. sextelata, M. eximia, M. exuberans Clowez, Hugh Sm. & S. Sm., M. importuna, M. owneri X.H. Du & D.M. Wu, M. rufobrunnea, M. tomentosa M. Kuo, Mel-13 y Mel-2 (Du et al., 2017; Liu y Dong, 2020; Zhao et al., 2021; Xu et al., 2022)) e Israel (M. rufobrunnea (Masaphy, 2005; 2010)). En nuestro país existen especies pirofílicas del subclado Distantes, mismas que en China han sido cultivadas en exteriores y a gran escala (Liu et al., 2017; Zhao et al., 2021; Xu et al., 2022), incluidas M. sextelata y M. importuna (Naturalista, 2022). En bosques de coníferas del Estado de México y Tlaxcala, en México, se ha observado que el fuego induce la presencia de hongos del género Morchella, lo que indica cierto grado de adecuación a estas condiciones (Montoya et al., 2002; Burrola et al., 2012). Una de las especies ampliamente cultivada en China es M. importuna, que ha sido referida en algunos estudios como M. conica (Loizides, 2017). Esta es una especie que se encuentra en México (Naturalista, 2022), por lo que con esta evidencia y con bases de desarrollo biotecnológico internacionales resulta prometedor para el cultivo de especies de Morchella en el país. Morchella rufobrunnea también tiene presencia en México (Guzmán y Tapia, 1998; Naturalista, 2022) y se ha cultivado en interiores en capas de sustrato-trigo-sustrato (Masaphy, 2010; Tan, 2016). Así mismo, es importante destacar la importancia biotecnológica de las especies del género debido a su uso en micosilvicultura, porque es posible inocular con material vegetativo o ascosporas en solución acuosa las raíces de plantas o árboles ya establecidos en campo (probada en México por Alvarado-Castillo et al., 2015) o en vivero (mediante micorrización, en caso de ser especies simbiontes; o bien mediante inducción si se tratara de especies endófitas). En Chile algunas evidencias de la inoculación en Nothofagus alpina (Porpp. & Endl.) Oerst, desde vivero hasta campo, son aportadas por Chung Guin Po (2010). Lo anteriormente enunciado y el presente estudio pueden coadyuvar al conocimiento, conservación, protección y uso biotecnológico efectivo de especies del género Morchella, por lo que resulta imprescindible seguir realizando trabajos en torno al estudio de este género.











 nueva página del texto (beta)
nueva página del texto (beta)





