Introducción
La presencia de la vegetación determina la sostenibilidad ecológica del entorno urbano, y esta se ve influenciada por la composición y estructura de la comunidad vegetal local (Threlfall et al., 2016). Sin embargo, la creciente urbanización en los últimos años ha llevado a una disminución en la extensión y distribución de la vegetación nativa en las ciudades, debido a una serie de factores intrínsecos al crecimiento urbano, como los sociales, políticos, económicos, de infraestructura, físicos y biológicos (McKinney, 2006; Von Thaden et al., 2021). Como consecuencia, se ha generado una combinación de especies exóticas y nativas en los ecosistemas urbanos, que es fomentada por la influencia humana, lo cual ha resultado en la pérdida y degradación de la estructura y funcionalidad de la biodiversidad y de los servicios ecosistémicos (Von Thaden et al., 2021).
En el contexto de las áreas verdes urbanas se incluyen espacios cubiertos de vegetación que se encuentran dentro de la jurisdicción de la ciudad: parques, jardines públicos y privados, jardineras, camellones y remanentes de vegetación nativa. Dentro de estos últimos destacan las áreas de mayor extensión que conforman bosques en diferentes etapas de sucesión ecológica y que pueden encontrarse de forma fragmentada (McKinney et al., 2018; Maldonado et al., 2019; Chacón-Castillo, 2020). Estas áreas contribuyen a la regulación de la temperatura, así como de los flujos de agua, suelo y aire, reducción del ruido, y provisión de hábitat para la biodiversidad (Zefferman et al., 2018).
Es importante destacar que algunas áreas verdes urbanas albergan ecosistemas específicos de gran importancia biótica, como es el caso de las que se localizan en la zona conurbada de Xalapa-Banderilla, Veracruz, México. En esta región montañosa, se encuentran fragmentos de bosque mesófilo de montaña (BMM), caracterizados por su alta riqueza vegetal por unidad de superficie y su fuerte presión antropogénica (Rzedowski, 1996; Villaseñor y Ortiz, 2014). El BMM proporciona servicios ecosistémicos importantes, tales como hábitat para la vida silvestre, captación de agua y reducción del escurrimiento pluvial; en consecuencia, aumento de la recarga de los mantos acuíferos (Carter Berry et al., 2020). También participa en la disminución de inundaciones y sequías, y controla la erosión del suelo, entre otros servicios (Bruijnzeel, 2004). Sin embargo, la distribución del BMM en México se ha reducido drásticamente a menos de 1% del territorio nacional (Rzedowski, 2006; CONABIO, 2010). A pesar de su importancia, el BMM enfrenta desafíos significativos debido a la deforestación y al aumento de la urbanización, lo cual ha provocado cambios en los servicios ecosistémicos como en los regímenes de precipitación y en la presencia de niebla en estos ecosistemas (Hu y Riveros-Iregui, 2016).
Por lo tanto, resulta fundamental conservar el BMM y asegurar la preservación de espacios verdes urbanos, especialmente aquellos que albergan este tipo de vegetación de gran importancia biótica. Un ejemplo de ello lo representan los bosques urbanos de la zona conurbada Xalapa-Banderilla; la vegetación dominante es el BMM, que se distribuye en fragmentos de diferentes tamaños y grados de antropización (Williams-Linera et al., 2002) y en algunas ocasiones se encuentran bajo algún esquema de protección oficial (GOV, 2023).
La zona conurbada de Xalapa-Banderilla está influenciada por actividades humanas ligadas a la agricultura, ganadería y crecimiento urbano, dejando fragmentos como remanentes de bosque mesófilo y vegetación secundaria e incluso con áreas reforestadas y en regeneración (MacGregor-Fors et al., 2016). Esto afecta la composición y estructura vegetal de las áreas verdes urbanas ubicadas tanto en la periferia (bosque periurbano) como al interior de la ciudad (bosque urbano). Las principales causas de pérdida de vegetación en esta región son el cambio de uso de suelo, la extracción de especies, la urbanización y la apertura de caminos (Ellis et al., 2010), con una tasa anual de crecimiento urbano constante de 0.43% de 1997 a 2018 (Chacón-Castillo, 2020). Sin embargo, Xalapa-Banderilla mantiene vegetación remanente en distintos espacios de la zona conurbada, alberga siete áreas naturales protegidas (casi 300 ha de vegetación), que equivalen a más de 20% de su territorio (MacGregor-Fors et al., 2015; SEDEMA, 2023), distribuidas en camellones, calles y avenidas, así como otros parques, paseos, glorietas y demás áreas con vegetación, por lo cual es considerada una “ciudad verde”.
Por lo anterior, el objetivo del presente estudio fue evaluar la diversidad alfa y beta, además de la estructura y composición de la vegetación del BMM presente en cuatro bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, basado en las siguientes preguntas: 1) ¿La estructura y composición de la vegetación es igual en estos cuatro bosques urbanos?, 2) ¿Los bosques urbanos de la zona conurbada mantienen especies típicas del BMM o son una mezcla de especies nativas y exóticas?
Materiales y Métodos
Área de estudio
El estudio se realizó en la zona conurbada de los municipios Xalapa y Banderilla, la cual se localiza en la región central del estado de Veracruz, México, entre las coordenadas 19º29' y 19º36' de latitud N y los meridianos 96º48' y 96º58' de longitud O, con una altitud de entre 1120 y 1700 m (Fig. 1; INEGI, 2009).
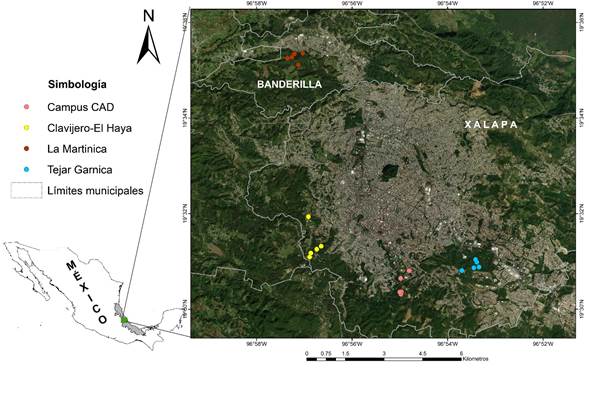
Figura 1: Ubicación geográfica de los cuatro bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México.
La zona presenta remanentes de bosque mesófilo de montaña en fragmentos de diferentes tamaños e historias de transformación distintas. En este trabajo se evaluaron cuatro bosques urbanos con este tipo de vegetación; dos de ellos se ubican dentro de la ciudad de Xalapa: “El Tejar Garnica” en la sección correspondiente al Parque Natura (TEJ) y “Campus para la Cultura las Artes y el Deporte” (Campus CAD, específicamente en el Agrobosque Universitario Kaná al interior del Campus y otros espacios con regeneración natural), y dos en la periferia de la zona conurbada de Xalapa-Banderilla: “Reserva Ecológica Francisco Javier Clavijero” y “Parque El Haya” en Xalapa (considerados en su conjunto como un solo sitio, debido a que son colindantes pero administradas por el gobierno estatal y municipal respectivamente) (CLA), y “La Martinica” (MAR) en Banderilla. A excepción del Campus CAD, que está resguardado por la Universidad Veracruzana, el resto de las áreas se encuentran oficialmente protegidas por el gobierno estatal y municipal (en el caso de El Haya) (Jara-Toto, 2023) (Fig. 1, Cuadro 1).
Cuadro 1: Descripción de los bosques urbanos considerados como sitio de muestreo en el presente estudio en la zona conurbada Xalapa-Banderilla, Veracruz, México (Fuente: GOV, 2023). BMM=Bosque mesófilo de montaña.
| Área de estudio | Extensión (ha)/Altitud (m s.n.m.) | Tipo de protección | Tipo de vegetación | Historia de transformación |
|---|---|---|---|---|
| Tejar Garnica (TEJ) (Mpio. Xalapa) | 133.00/1310 | Área natural protegida de competencia estatal (decretada en 1986) | Vegetación secundaria derivada de bosque mesófilo de montaña | Cafetal y potrero para el ganado. En algunas zonas se han realizado reforestaciones en diferentes etapas desde su decreto como área natural protegida. |
| Campus para la Cultura las Artes y el Deporte (Campus CAD) (Mpio. Xalapa) | 28.00/1366 | Bajo protección de la Universidad Veracruzana | Vegetación secundaria derivada de bosque mesófilo de montaña | En 1998, el predio convertido en un pastizal destinado al pastoreo de ganado fue cedido a la Universidad Veracruzana. Posteriormente se realizaron actividades de reforestación y transformación en jardines con elementos vegetales introducidos. En algunos espacios la vegetación se regeneró naturalmente, como el caso del Agrobosque Universitario Kaná, el cual alberga un remanente de BMM y vegetación en regeneración. |
| Reserva Ecológica Francisco Javier Clavijero-El Haya (CLA) (Mpio. Xalapa) | 59.85/1362 | Área natural protegida de competencia estatal (decretada en 2012) | Bosque mesófilo de montaña | En este sitio se conserva el bosque mesófilo de montaña en mejores condiciones de conservación de la zona de influencia de la ciudad de Xalapa. Tiene diferentes polígonos internos; en este estudio se realizó el muestreo en el administrado por la Secretaría de Medio Ambiente del Estado de Veracruz que está representado por 22.06 ha. En algunas zonas se observa la presencia de especies introducidas. Además, se incluyó parte del parque ecológico El Haya, sitio vecino a Clavijero y bajo resguardo del municipio de Xalapa. |
| Área Natural Protegida La Martinica (MAR) (Mpio. Banderilla) | 52.30/1599 | Área natural protegida de competencia estatal (decretada en 2010) | Bosque mesófilo de montaña en diferentes grados de conservación | El sitio en la década de 1990 tenía extensiones de potreros que ocupaban casi la mitad de lo que hoy es el polígono actual, mientras que el resto mantenía vegetación de bosque mesófilo de montaña. Se han realizado reforestaciones y algunos espacios han tenido regeneración natural. |
Trabajo de campo
Para caracterizar la estructura y composición vegetal, se establecieron cinco parcelas de 20×20 m (400 m2) en cada uno de los cuatro sitios de estudio (Fig. 1); es decir, 0.2 ha por sitio, con un total de 0.8 ha muestreadas en las cuatro áreas. Las parcelas se instalaron en espacios que presentaran una estructura típica de bosque, con una cobertura de dosel superior a 70% y evitando los bordes de los fragmentos y senderos al interior del bosque, así como las áreas reforestadas. Dentro de cada parcela se registraron y contabilizaron las plantas leñosas que tuvieran como mínimo 1.5 m de altura y un diámetro a la altura del pecho (DAP) mayor y/o igual a 5 cm. El DAP se midió con ayuda de una cinta diamétrica y la altura se estimó a través de un clinómetro digital (ECII-D Haglöff, Suecia).
Los individuos de las especies observadas se colectaron y herborizaron siguiendo lo propuesto por Lot y Chiang (1986). Los especímenes fueron identificados con ayuda de las siguientes claves taxonómicas: fascículos de Flora de Veracruz (Nee, 1981, 1983; Sánchez-Vindas, 1990), Flora Mesoamericana (Davidse et al., 2009), y Árboles de Los Tuxtlas (Vázquez-Torres et al., 2010). Además, se realizaron comparaciones con ejemplares disponibles en los herbarios virtuales Plants of the World Online (POWO, 2023), Red de Herbarios del Noreste de México (RHNM, 2023) y Tropicos.org (TROPICOS, 2023). También se consultó al especialista Dr. Miguel Cházaro Basáñez (Facultad de Biología-Xalapa, Universidad Veracruzana).
Las muestras fueron depositadas en los herbarios de la Facultad de Biología de la Universidad Veracruzana (XALU) y el Herbario Nacional de la Universidad Nacional Autónoma de México (MEXU) (acrónimos de acuerdo con Index Herbariorum, Thiers, 2022). El listado florístico resultante fue ordenado de acuerdo con APG IV (2016) y los nombres científicos y autores fueron corroborados de acuerdo con la base de datos de Plants of the World Online (POWO, 2023), así como del International Plant Names Index (IPNI, 2003). Se señalaron las especies que se encuentran en alguna categoría de riesgo en la NOM-059-SEMARNAT-2010 (SEMARNAT, 2010), así como en la UICN (IUCN, 2023) Además, se incluyó el origen de las especies registradas (nativas, endémicas y exóticas) según Villaseñor (2016).
Análisis de datos
Para evaluar la diversidad alfa, se realizaron curvas de rarefacción y la evaluación del comportamiento de la riqueza y la diversidad mediante los números de Hill, con el software iNEXT versión online (agosto 2022) (Chao et al., 2014; 2016). La comparación de la riqueza de cada sitio se calculó con la prueba de Kruskal-Wallis mediante el software Past v. 4.10 (Hammer et al., 2001). Además, se realizaron curvas de rango-abundancia utilizando el software GraphPad by Dotmatics v. 9.4.1 (GraphPadSoftware, 2022).
La diversidad beta fue evaluada con el Índice de recambio de especies de Whittaker (Moreno, 2001; Tuomisto, 2010) y se expresa mediante la siguiente fórmula:
donde S=número de especies de un conjunto de muestras y α=número promedio de especies en las muestras (alfa promedio) (Moreno, 2001). Los valores del Índice van de 0 (nulo recambio de especies) a 1 (recambio total). Adicionalmente, se realizó un análisis del escalamiento multidimensional no paramétrico (NMDS) para observar gráficamente la composición de especies de cada sitio. También se llevó a cabo una prueba Permanova con el Índice de similitud de Bray Curtis para determinar si existen diferencias estadísticas en la composición florística de las comunidades vegetales presentes en los diferentes sitios. Esta prueba se realizó para la totalidad de la muestra, así como para las comparaciones pareadas entre sitios. Todos estos análisis se ejecutaron con el software Past v. 4.10 (Hammer et al., 2001).
Adicionalmente, se aplicó el Índice de Valor de Importancia (IVI) que es la suma de los valores de la dominancia, densidad y frecuencias relativas de cada especie (Curtis y McIntosh, 1951). Además, se hicieron histogramas para observar gráficamente la distribución de los datos del DAP y alturas de cada uno de los sitios de estudio, con la finalidad de analizar la estructura de cada área muestreada.
Resultados
Riqueza y diversidad de especies
En un total de 0.8 ha muestreadas en cuatro bosques urbanos remanentes de bosque mesófilo de montaña, se registraron 1049 individuos de especies leñosas que presentaron un DAP ≥5 cm. Los individuos registrados se clasificaron en 38 familias, 55 géneros y 71 especies (ver Apéndice). De estas, 62 son nativas de México (12 son endémicas al país) y ocho exóticas. Las familias con mayor riqueza fueron: Fagaceae (8), Asteraceae (5), Melastomataceae (5). Los géneros con mayor riqueza fueron Quercus L. (8) y Miconia Ruiz & Pav. (4).
La riqueza de especies fue similar en las cuatro áreas estudiadas, y así se corroboró mediante la prueba de Kruskal-Wallis (p=0.75). El Campus CAD presentó la mayor riqueza (34 especies), aunque no significativamente mayor en comparación con el resto de las áreas estudiadas (Cuadro 2). La riqueza estimada por la cobertura del muestreo, obtenida a través del software iNext versión Online (Chao et al., 2014; 2016), indicó un muestreo satisfactorio en todos los sitios de estudio, sobrepasando 90% en todos los casos (Cuadro 2, Fig. 2).
Cuadro 2: Riqueza de especies arbóreas que obtuvieron un DAP ≥5 cm, en los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México.
| Sitio | Número de familias | Número de géneros | Número de especies | Abundancia (Número de individuos) | Riqueza estimada (%) |
|---|---|---|---|---|---|
| El Tejar Garnica | 21 | 26 | 33 | 294 | 94 |
| Campus CAD | 23 | 31 | 34 | 251 | 97 |
| Clavijero-El Haya | 20 | 24 | 31 | 198 | 94 |
| La Martinica | 20 | 23 | 31 | 306 | 96 |
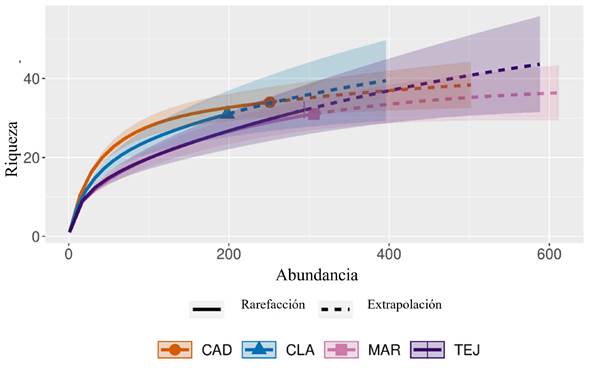
Figura 2: Curva de rarefacción y extrapolación de la riqueza estimada de especies leñosas de los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México. CAD=Campus CAD; CLA=Clavijero-El Haya; MAR=Martinica; TEJ=Tejar Garnica.
Por otro lado, la diversidad alfa de los cuatro sitios señaló que el Campus CAD fue el sitio más diverso, seguido de Clavijero-El Haya y la menor diversidad se presentó en La Martinica y El Tejar Garnica (Fig. 3). En complemento, las curvas de rango-abundancia muestran que el Campus CAD fue el sitio que presentó una distribución más homogénea de sus abundancias, lo cual no sucedió con los otros sitios, ya que La Martinica y El Tejar Garnica tuvieron varias especies con abundancias superiores a 50 individuos, contrastando con otras especies con abundancias de uno o dos individuos (Fig. 4).
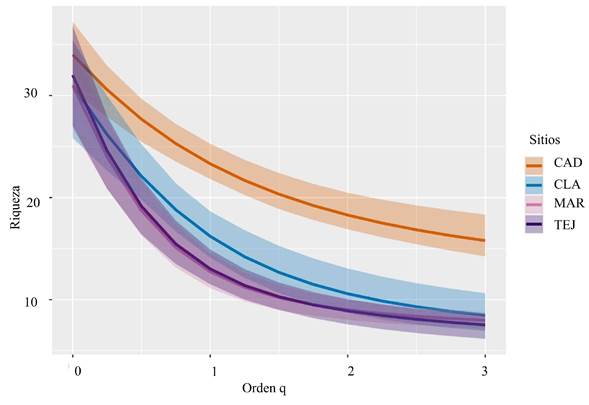
Figura 3: Riqueza de especies de vegetación leñosa encontrada en los bosques urbanos de la zona conurbada de Xalapa-Banderilla, Veracruz, México, donde q0= riqueza de especies, q1= diversidad de Shannon, q2=diversidad de Simpson. CAD=Campus CAD; CLA=Clavijero-El Haya; MAR=Martinica; TEJ=Tejar Garnica.
Recambio de especies
De acuerdo con el Índice de Whittaker, El Tejar Garnica presenta un mayor recambio de especies comparado con La Martinica y es más afín con el Campus CAD, en cambio Clavijero-El Haya tiene un menor recambio con La Martinica (Cuadro 3). Por otro lado, el NMDS mostró una mayor distancia entre los grupos de La Martinica y Clavijero-El Haya, mientras que el Campus CAD y El Tejar Garnica se encuentran más cercanos (Stress: 0.1687) (Fig. 5). Esa distribución mostrada por el NMDS es coherente con el análisis de Permanova realizado con el Índice de similitud de Bray Curtis, el cual indica que existen diferencias entre el total de sitios (F=2.967; p<0.05). Al hacer la comparación pareada, se observa que la composición de especies de La Martinica y Clavijero-El Haya es diferente al resto de sitios (P<0.05, para ambos casos), mientras que el Campus CAD y El Tejar Garnica no presentaron diferencias en su composición florística (P=0.658).
Cuadro 3: Índice de diversidad beta de Whittaker en los sitios muestreados de la zona conurbada Xalapa-Banderilla, Veracruz, México.
| El Tejar Garnica | Campus CAD | Clavijero-El Haya | La Martinica | |
|---|---|---|---|---|
| El Tejar Garnica | 0 | 0.48 | 0.58 | 0.74 |
| Campus CAD | 0 | 0.53 | 0.69 | |
| Clavijero-El Haya | 0 | 0.48 | ||
| La Martinica | 0 |

Figura 5: Escalamiento multidimensional no paramétrico (NMDS) de la composición de especies leñosas registradas en los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México, con distancia de Bray Curtis. Grupo 1: El Tejar Garnica; 2: Campus CAD; 3: Clavijero-El Haya; 4: La Martinica.
Estructura de la vegetación
En El Tejar Garnica, el grupo de especies más importantes de acuerdo con el IVI está compuesto por aquellas relacionadas con la vegetación secundaria, como Dendropanax arboreus (L.) Decne. & Planch., Piper amalago L., Lonchocharpus guatemalensis Benth. y Heliocarpus appendiculatus Turcz. Por su parte, el Campus CAD presentó una mezcla de especies típicas de bosques maduros como Quercus xalapensis Bonpl. y otras de vegetación secundaria derivada de BMM como Liquidambar styraciflua L. y Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. En Clavijero-El Haya hubo dominancia de especies típicas del BMM en mayor estado de madurez, como las especies del género Quercus; además, también se registró la especie exótica Casuarina equisetifolia J.R. Forst. & G. Forst. Por último, en La Martinica igualmente hubo dominancia tanto de especies secundarias (Carpinus tropicalis (Donn. Sm.) Lundell), como de primarias (diferentes especies del género Quercus) (Fig. 6).
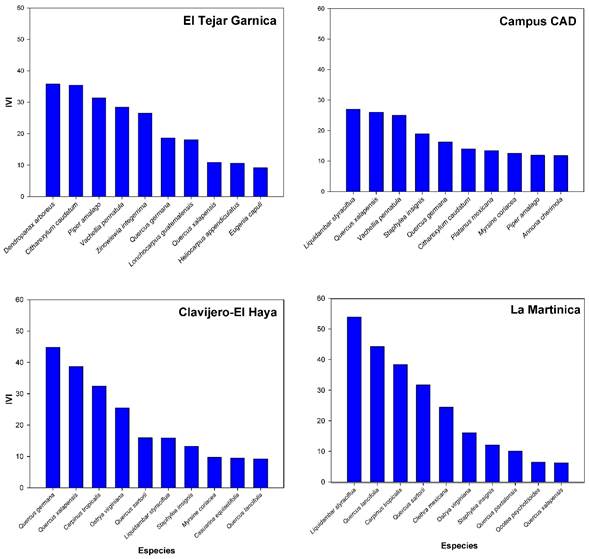
Figura 6: Especies leñosas registradas en los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México, con los primeros diez valores más altos del Índice de valor de importancia (IVI).
Las clases diamétricas mostraron que en todos los sitios la mayoría de los individuos son juveniles (diámetros entre 5 y 15 cm), y en menor medida se observan árboles con diámetros de más de 40 cm. Se destaca que en Clavijero-El Haya existe una mayor distribución de los diámetros, ya que se registraron individuos arbóreos con DAP superiores a 100 cm. Por otro lado, El Tejar Garnica y La Martinica fueron los sitios que presentaron mayor abundancia de árboles con diámetros pequeños (Fig. 7).

Figura 7: Histogramas del diámetro a la altura del pecho (DAP) (cm) de las especies leñosas registradas en los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México.
Los histogramas de las alturas mostraron que en Clavijero-El Haya y La Martinica existe una distribución más equitativa de árboles de diferentes alturas, a diferencia del Campus CAD y El Tejar Garnica, donde se registró una mayor abundancia de individuos de porte bajo (Fig. 8). Cabe mencionar que estos dos últimos bosques urbanos son los que presentan mayor densidad de individuos por hectárea, debido a que son bosques urbanos en desarrollo con arbolado en estado juvenil. No obstante, Clavijero-El Haya es el sitio que presenta un valor mayor en el área basal de los árboles que lo componen, debido a que se tratan de árboles maduros y con diámetros mayores (Cuadro 4).

Figura 8: Histogramas de alturas de las especies leñosas (m) registradas en los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México.
Cuadro 4: Promedio y desviación estándar de las variables analizadas de estructura de los bosques urbanos de la zona conurbada Xalapa-Banderilla, Veracruz, México. DAP=Diámetro a la altura del pecho; arb=árboles.
| Bosque Urbano | Altitud | Área basal (m2/ha) | DAP (cm) | Altura (m) | Densidad (arb/ha) |
|---|---|---|---|---|---|
| El Tejar Garnica | 1310 | 0.16±0.40 | 14.92±13.38 | 11.20±5.50 | 46±75 |
| Campus CAD | 1366 | 0.19±0.56 | 14.86±16.27 | 9.88±5.73 | 37±35 |
| Clavijero-El Haya | 1362 | 0.33±1.14 | 19.08±21.89 | 13.48±7.19 | 32±46 |
| La Martinica | 1599 | 0.16±0.72 | 13.57±14.66 | 14.20±6.80 | 49±78 |
En promedio, La Martinica y El Tejar Garnica son las áreas que tienen mayor densidad de plantas por hectárea, con un total de 1530 y 1475 plantas por hectárea respectivamente, indicando que existe una mayor cantidad de individuos. Quercus sartorii Liebm. y Citharexylum caudatum L., respectivamente, son las especies con mayor densidad; mientras que Staphylea insignis (Tul.) Byng & Christenh. en Campus CAD, y Quercus germana Schltdl. & Cham. en Clavijero-El Haya son las más abundantes.
Discusión
Riqueza y diversidad de especies
La riqueza registrada en este estudio en los bosques urbanos de la zona conurbada Xalapa-Banderilla representa menos de 1% del inventario florístico del estado de Veracruz (Villaseñor, 2016). Esta baja proporción se debe en parte al muestreo en una superficie menor a una hectárea y, por otro lado, a que el listado de Villaseñor (2016) se refiere a todas las especies de la flora vascular. Sin embargo, en este estudio solo se consideraron las especies leñosas. Esta riqueza varía de acuerdo con lo registrado en otras áreas de la ciudad de Xalapa y su periferia, ya que los números reportados en otros estudios difieren según el método, la ubicación y la superficie de muestreo (Aquino-Zapata, 2007; Chávez-Alaffita, 2014; Ruíz-Montiel et al., 2014; Falfán y MacGregor-Fors, 2016; Lorea-Hernández et al., 2020). La riqueza de especies leñosas registradas en zonas fuera del área urbana generalmente es mayor comparada con la del presente estudio, lo cual puede deberse al impacto humano, lo que repercute en la diversidad vegetal (Ramírez-Marcial et al., 2001). En ese sentido, un estudio realizado en un bosque mesófilo de montaña del centro de Veracruz corrobora que la riqueza de árboles presente en fragmentos de bosque maduro decrece significativamente cuando existe una perturbación antrópica que propicia la creación de fragmentos de vegetación secundaria (Monge-González et al., 2019).
Cuando se comparan la riqueza registrada en este estudio con la de otros realizados en diferentes áreas de la ciudad de Xalapa, se observa que en algunos casos esta es similar. Por ejemplo, Aquino-Zapata (2007) registró 80 especies leñosas en un área natural protegida denominada Molino de San Roque, localizada al interior de la ciudad de Xalapa. Cabe destacar que en dicho estudio se realizó un inventario exhaustivo, mientras que en el presente trabajo fue a través de parcelas, lo que limitó la superficie muestreada. En particular, en un estudio realizado en El Tejar Garnica, utilizando un método de recolección intensiva, se registraron 22 especies de árboles, que es una cifra inferior a la encontrada en esta investigación en la misma área (Hernández-Cázares, 2022). Para La Martinica recientemente se reportaron 37 especies leñosas en 1.25 has de muestreo (López-Álvarez et al., 2021), lo que indica que en una superficie mayor a la que se realizó en la presente investigación, se registró una riqueza similar, aunque en el trabajo citado solo fueron incluidos los árboles mayores a 10 cm de DAP. De igual forma, Falfán y MacGregor-Fors (2016), en un conteo de los árboles distribuidos en toda la ciudad de Xalapa (incluyendo camellones o jardines), registraron 140 especies leñosas, incluyendo nativas y exóticas, aunque estas últimas representaron más de la mitad de las especies totales.
Estas diferencias en el número de especies indican que los métodos empleados son distintos porque obedecen a objetivos diferentes, y por lo tanto los resultados son diversos, en este caso, reflejados en el número de especies registradas. También la riqueza de especies se modifica por los diferentes impactos antrópicos constantes e historias de transformación de los espacios verdes en la ciudad (Cuadro 1), ya que estos sitios muestreados han tenido procesos de degradación, y lo que se observa actualmente son fragmentos de vegetación secundaria en su mayoría. No obstante, a pesar de las presiones antropogénicas a los bosques urbanos que en proporción pueden contener menos especies que las registradas en los camellones y jardines de la ciudad (Falfán y MacGregor-Fors, 2016), es interesante destacar que siguen manteniendo comunidades vegetales ricas, con representantes de la flora nativa del bosque mesófilo de montaña y conservan especies en alguna categoría de riesgo o endémicas al país.
Al clasificar todas las especies según su origen geográfico, se registraron 59 especies nativas al país y siete especies exóticas. De acuerdo con Falfán y MacGregor-Fors (2016), los árboles y arbustos nativos se ubican principalmente en áreas periféricas de Xalapa, mientras que los exóticos se distribuyen al interior de la ciudad. Esta observación fue confirmada por el presente estudio, ya que las especies exóticas se registraron principalmente en los sitios con mayor influencia de la urbanización como El Tejar Garnica y Campus CAD. Si bien estos espacios mantienen conectividad con algunos fragmentos de vegetación de los alrededores de la ciudad, un gran porcentaje de su perímetro está rodeado de la mancha urbana y han tenido procesos de transformación que involucraron la propagación de especies exóticas, como el café en El Tejar Garnica o de árboles ornamentales en el Campus CAD. Es necesario aclarar que, en el Campus CAD, el muestreo se realizó en los fragmentos de vegetación secundaria sin considerar los senderos donde fueron introducidas especies exóticas.
Las especies exóticas encontradas en este estudio ya han sido reportadas antes para el BMM en la región de Xalapa, Veracruz (López-Gómez, 2004; Ruíz-Montiel et al., 2014; Falfán y MacGregor-Fors, 2016). La presencia de especies exóticas en los bosques urbanos no demerita la importancia de estas áreas, ya que no son del tipo invasoras, y no significan un problema con relación a que estén cambiando la dinámica de los ecosistemas de forma radical. En ocasiones pueden convertirse en un recurso más para la fauna, como es el caso de Rhaphiolepis bibas (Lour.) Galasso & Banfi o Citrus spp., las cuales se han observado siendo consumidas por aves (obs. pers.). Sin embargo, se sugiere la realización de estudios que profundicen en estos aspectos.
Recambio de especies
De acuerdo con los análisis de diversidad beta, el Campus CAD y El Tejar Garnica fueron los que presentaron menor recambio de especies. Esto puede deberse a la cercanía geográfica, ya que entre estos dos sitios hay una distancia de apenas 2.4 km. Además, ambos sitios tuvieron un mayor impacto previo, ya que los fragmentos de vegetación que se observan en la actualidad se establecieron de forma natural después del abandono de potreros y cultivos de café. Asimismo, son áreas ubicadas al interior de la ciudad y probablemente estén sujetas a una homogeneización de la diversidad debido al filtro ambiental (aumento de temperatura, cambios edáficos, sequía, etc.), que la antropización propicia y que no todas las especies toleran (Dolan et al., 2017). Lo anterior se ha demostrado en zonas con alto impacto antrópico como es el caso de las áreas verdes urbanas (McKinney, 2008; Tobías-Baeza et al., 2019). Sin embargo, son necesarios estudios para corroborar dicha situación (p. ej., análisis de rasgos funcionales como respuesta a ambientes antropizados en esos sitios de estudio). Este mismo patrón, de menor recambio de especies en sitios con menor distancia geográfica, se observó también en estas mismas áreas con el grupo de las plantas epífitas (Hernández-Zamora, 2022).
Si bien la distancia geográfica es un factor que puede determinar el recambio en la composición de las comunidades, no es la única explicación (Soininen et al., 2007). Como ejemplo de ello, entre el Clavijero-El Haya con respecto a El Tejar Garnica y Campus CAD la distancia es de 4.5 y 2.4 km, respectivamente. A pesar de las distancias cortas de Clavijero-El Haya con respecto a los otros sitios, este difiere en su composición. Se puede explicar por la historia de cada sitio, ya que las diferencias estructurales de estos bosques son el reflejo de los procesos de transformación de cada uno de ellos (Cuadro 1). Por ejemplo, El Tejar Garnica y Campus CAD antes presentaban potreros, áreas desnudas o el establecimiento de cafetales. Sumado a lo anterior, en El Tejar Garnica, al ser un sitio que se encuentra inmerso dentro de la ciudad, se dificulta la posible dispersión de especies. Esto se relaciona con el hecho de que la dinámica en las ciudades promueve la homogenización de la biodiversidad al favorecer la presencia de especies adaptadas a condiciones que pueden ser estresantes, dejando en desventaja a otras especies que no logran establecerse en las zonas urbanas (McKinney, 2006). Considerando esto, se corrobora que la perturbación antropogénica es un factor que determina la composición del ensamble de la flora, reduciendo la riqueza y favoreciendo el recambio de especies entre las áreas con mayor impacto, con respecto a las que han tenido impactos antropogénicos menores. Lo anterior se ha documentado con diferentes grupos de plantas en la región montañosa del centro de Veracruz (Carvajal-Hernández et al., 2017; Gómez-Díaz et al., 2017; Monge-González et al., 2019; Bautista-Bello et al., 2019; Guzmán-Jacob, et al., 2020).
El bosque mesófilo es muy variable en composición, pues se encuentra en sitios montañosos que por la condición orográfica presentan mayor heterogeneidad ambiental, y esto a su vez modifica las condiciones microclimáticas y/o edáficas, limitando o favoreciendo la presencia de algunas especies (Rzedowski, 2006; Carvajal-Hernández et al., 2014). Por lo tanto, la altitud y la heterogeneidad topográfica son otros factores que explican el recambio de especies en los bosques mesófilos (Williams-Linera et al., 1996; Monge-González et al., 2019). Esta situación puede darse en La Martinica, ya que tiene una diferencia altitudinal de 250 m respecto al resto de los sitios, y es la que presenta mayor recambio de especies respecto al resto de bosques evaluados.
Estructura de la vegetación
De acuerdo con los resultados obtenidos, La Martinica se caracteriza por tener los árboles más altos y los menores diámetros. Lo anterior es un reflejo de los procesos de recuperación que están sucediendo en el área, ya que los diámetros delgados son indicativos de un bosque en sucesión (Lahoti et al., 2020). Además, si se consideran los datos de la composición del sitio, se observa que Carpinus tropicalis y Liquidambar styraciflua son las especies dominantes que habitan en estadios intermedios de la sucesión ecológica en los bosques mesófilos de montaña (Rzedowski, 2006; Niembro-Rocas et al., 2010), y L. styraciflua es pionera de este tipo de vegetación (Mohan et al., 2007).
Dicha situación se refuerza también con el análisis de grupos vegetales considerados indicadores, como lo son las epífitas, ya que en un estudio previo se registró que este fragmento de bosque tiene, en proporción, menos de 50% de especies epífitas en comparación con grupos afines, pero que se encuentran de forma terrestre; además, en su mayoría presenta especies generalistas que sobreviven en condiciones de perturbación (Hernández-Zamora, 2022). Lo anterior corrobora que La Martinica es un bosque en regeneración. Sin embargo, debido a su conectividad con otros fragmentos de bosque mesófilo de montaña, la sucesión está ocurriendo de forma natural, con la incorporación de especies típicas de BMM, como C. tropicalis y L. styraciflua (Jardel et al., 2001; Sánchez-Velásquez et al., 2008).
Las actividades humanas, como el establecimiento de un cafetal en el pasado, han impactado la estructura y composición de la vegetación en El Tejar Garnica, el cual presentó los mayores cambios en su estructura y composición con respecto a lo que representa el bosque mesófilo de montaña. En este lugar se registraron especies tropicales con mayor afinidad a altitudes menores que no son características del BMM de la zona de estudio (p. ej., Vachellia pennatula (Schltdl. & Cham.) Seigler & Ebinger). Además, aunque se observaron algunos árboles de grandes diámetros del género Quercus, que son remanentes del bosque mesófilo, las especies más dominantes fueron Dendropanax arboreus, Citharexylum caudatum y Piper amalago, las cuales están asociadas a sitios en sucesión. Por ejemplo, D. arboreus puede ser dominante en BMM después de una modificación antropogénica (Gallardo-Hernández et al., 2008). De igual forma, los individuos del género Lonchocarpus Kunth, también asociado a vegetación secundaria, fueron de los más dominantes en el sitio (Rzedowski, 2006; Niembro-Rocas et al., 2010). Por otro lado, el género Piper L. está presente en la primera etapa de sucesión en áreas post-disturbio en el Neotrópico (Hooper, 2008), lo que indica que la estructura de la vegetación de El Tejar Garnica se encuentra estructuralmente dominado por vegetación secundaria.
La presencia de las especies mencionadas, junto con la distribución de alturas y diámetros de los árboles, indican que El Tejar Garnica se encuentra en un estado sucesional intermedio lento, debido a la mezcla de especies típicas del bosque mesófilo, además de especies tropicales con afinidad a sobrevivir en ecosistemas de zonas de menor altitud con climas más cálidos (Jardel et al., 2014). Lo anterior probablemente es causado por el aislamiento que le ha conferido el crecimiento de la zona urbana, siendo escasos los puntos de conectividad con fragmentos de vegetación grandes, reduciendo aparentemente el intercambio de especies vegetales y modificando el microclima. Sin embargo, se requieren mayores estudios de conectividad, dispersión de especies o evaluación del microclima en las islas de calor generadas en la ciudad para corroborar esto.
En contraste, el Clavijero-El Haya presentó una estructura más similar a la de un bosque mesófilo de montaña, representado por bosques densos con algunos árboles que superan 180 cm de diámetro (Rzedowski, 2006). La dominancia de diferentes especies del género Quercus, así como de Liquidambar styraciflua, Carpinus tropicalis, Ostrya virginiana (Mill.) K. Koch o Clethra mexicana DC., indica que de los cuatro sitios evaluados el Clavijero-El Haya fue el que presentó mayor afinidad al ecosistema típico de bosque mesófilo de la región y que se encuentra en una etapa de mayor madurez (Gual y González, 2014). Además, en este sitio se registró previamente la mayor cantidad de especies epífitas de las mismas cuatro áreas evaluadas (Hernández-Zamora, 2022). Este grupo es considerado sensible a las perturbaciones antrópicas, ya que se ha demostrado que cuando la estructura del bosque mesófilo de montaña se modifica, también cambia el microclima y las epífitas son más sensibles a dichos cambios, como los helechos (p. ej., algunas especies de Hymenophyllaceae) (Krömer et al., 2014; Carvajal-Hernández et al., 2014, 2017). La presencia de un mayor número de plantas epífitas y el registro de especies de helechos indicadores de conservación dentro de este bosque (Dubuisson et al., 2003; Carvajal-Hernández et al., 2017), tal vez se deba a que este sitio genera condiciones microclimáticamente adecuadas para el establecimiento de estos grupos sensibles.
A pesar de que el Clavijero-El Haya presenta condiciones de bosque mesófilo en buen estado de madurez y que el sitio se encuentra protegido por el Gobierno del Estado de Veracruz y por el Municipal de Xalapa, respectivamente, no lo exime de procesos de transformación ocasionados por la cercanía con los habitantes de la ciudad de Xalapa y las modificaciones que se hacen en este sitio. Los bordes del fragmento de bosque se encuentran impactados antropogénicamente. Incluso en el interior de esta zona en su conjunto (incluyendo el Parque El Haya) existen plantaciones forestales de Pinus L., presencia de especies exóticas y extracción de elementos del bosque (suelo, plantas, leña, etc) (obs. pers.).
Por su parte, el Campus CAD presentó una estructura similar al bosque mesófilo de montaña, con árboles del género Quercus, con diámetros mayores a 100 cm. A pesar de la fuerte modificación en los espacios verdes del Campus CAD con la introducción de especies exóticas (Chávez-Alaffita, 2014), en este estudio la estructura del fragmento de bosque analizado se explica debido a que se realizó el trabajo en un remanente de bosque mesófilo denominado Agrobosque Universitario Kaná. Este contiene encinos, liquidámbar y otras especies típicas del bosque mesófilo. Sin embargo, la historia del sitio indica que en la década de 1990 este predio era un potrero destinado a la ganadería (Cuadro 1). Debido a esto, también se pueden observar con valores altos de IVI algunos taxa como Vachellia pennatula, Piper amalago (características de vegetación secundaria) o incluso el registro de una especie exótica como Annona cherimola Mill. Lo anterior indica que el sitio, a pesar de tener especies típicas del bosque, también presenta una mezcla de elementos vegetales que dominan la estructura de la vegetación y que son producto de diferentes procesos de antropización, como la introducción de ganado o la reforestación con especies exóticas o comestibles.
De acuerdo con Williams-Linera (2007), en Veracruz los árboles con diámetros mayores a 1 m de diámetro son escasos y se encuentran en bosques ubicados a mayor altitud y lejos de grandes asentamientos humanos. Esto tiene relación directa con el impacto antropogénico, ya que las diferentes actividades modifican la estructura de la vegetación; por lo cual, a mayor cercanía con áreas urbanas, la estructura de los bosques se ve modificada. Esta situación se observa claramente en los bosques urbanos considerados en este estudio, ya que por la cercanía con la ciudad, las historias y los procesos de transformación de cada área, los árboles con diámetros menores son más comunes.
Es necesario mencionar que el hecho de que existan perturbaciones de diferente intensidad en las áreas de estudio no significa necesariamente un efecto negativo, ya que los ecosistemas en la actualidad, y más aún dentro o en la periferia de las ciudades, tienen componentes de ambientes originales, pero también de espacios intervenidos por los humanos. A pesar de lo anterior, los espacios verdes remanentes mantienen riqueza de especies y la estructura de la vegetación puede ser refugio de especies dependientes, nativas e incluso endémicas, además de mantener y proporcionar servicios ecosistémicos (Karuppannan et al., 2014; Lepczyk et al., 2017).
Conclusiones
Los cuatro bosques urbanos estudiados en la ciudad de Xalapa son un ejemplo de que los ecosistemas de las ciudades se encuentran en condiciones diferentes a las originales. Los resultados del presente estudio demuestran que, si bien la riqueza reportada en las áreas verdes “en general” es baja, el número de especies reportado por sitio es destacable si se compara con bosques en mayor estado de madurez. Respecto a la pregunta planteada, se concluye que la estructura y composición de la vegetación es diferente entre los sitios de estudio y que están en función del impacto antropogénico al que está sometida el área. Sin embargo, a pesar de las presiones antropogénicas, se resguardan especies endémicas o en alguna categoría de riesgo. Además, se trata de especies que componen el ecosistema del bosque mesófilo de montaña, el cual se encuentra seriamente amenazado, por lo que estos remanentes tienen un gran valor para la conservación y más aún en ambientes urbanos. Por lo tanto, los bosques urbanos representan bastiones de biodiversidad en la ciudad que están contribuyendo a la conservación de especies y servicios ecosistémicos, tan necesarios para lograr la convivencia entre el crecimiento urbano y el patrimonio natural.











 nueva página del texto (beta)
nueva página del texto (beta)




