Introducción
El género Phylloporia Murrill, tipificado con P. parasitica Murrill, se ubica entre los géneros de Hymenochaetaceae que más atención han recibido en las últimas décadas desde el punto de vista taxonómico debido a la consecuente revalorización de sus caracteres morfológicos y a la incorporación de datos moleculares y ecológicos para su identificación (Ferreira-Lopes et al., 2016; Jerusalem et al., 2019). Phylloporia incluye especies que se desarrollan en áreas restringidas y se distribuyen predominantemente en regiones tropicales (Bittencourt et al., 2018). Es considerado un género monofilético, aunque es morfológicamente diverso debido en gran medida a la afinidad presente en muchos taxones de Phylloporia por parasitar especies de plantas específicas, lo cual conlleva al desarrollo de rasgos morfológicos particulares en correspondencia con su hábitat y hospedero (Wagner y Ryvarden, 2002; Zhou y Dai, 2012; Bittencourt et al., 2018).
Actualmente, el género Phylloporia se califica como heterogéneo, debido a la variabilidad de sus caracteres morfológicos (Valenzuela et al., 2011). Este incluye especies con basidiomas resupinados, pileados o estipitados, con sistema hifal que puede variar de monomítico a dimítico y con un contexto de homogéneo a dúplex (Wagner y Ryvarden, 2002; Zhou y Dai, 2012; Zhou et al., 2022). Su ciclo de vida puede ser anual o perenne y sus taxones se clasifican de acuerdo con su estrategia nutricional, como parásitos o saprófitos (Valenzuela et al., 2011). No presentan setas (con la excepción de Phylloporia mori Shen H. Wu), poseen basidiósporas de hialinas a amarillentas, no dextrinoides, generalmente menores a 6 µm de longitud, y en las especies pileadas o estipitadas se presenta habitualmente un comprimido y persistente tomento (Ryvarden, 1991; Wagner y Ryvarden, 2002; Wu et al., 2022; Zhou et al., 2022).
En las últimas décadas, numerosas especies de géneros filogenéticamente cercanos a Phylloporia (p. ej., Inonotus P. Karst. y Phellinus Quél. s.l.) se le han transferido, y otras se han propuesto como nuevas para la ciencia (Ferreira-Lopes et al., 2016), para un total de 75 taxones en el género (Chamorro-Martínez et al., 2022; Wu et al., 2022; Zhou et al., 2022). De ellos, solo cinco se han registrado para Cuba: Phylloporia chrysites (Berk.) Ryvarden, P. fruticum (Berk. & M.A. Curtis) Ryvarden, P. pectinata (Klotzsch) Ryvarden, P. spathulata (Hook.) Ryvarden (Minter et al., 2001) y, recientemente, con base en una secuencia de un espécimen cubano (Zhou et al., 2022) P. crystallina Y.C. Dai, F. Wu, Meng Zhou & Vlasák. No obstante, el conocimiento taxonómico del género y de la familia en general para el país aún es incompleto (Decock et al., 2006). Esto se debe a la diversidad y peculiaridades de Phylloporia y a que Cuba constituye el principal centro de especiación de las Antillas al poseer una alta heterogeneidad de ecosistemas y un gran número de especies vegetales endémicas (González-Torres et al., 2016), por lo que se estima que la cantidad de especies de hongos políporos himenoquetáceos presentes en la Isla es superior a la registrada por Mena et al. (2006). Por ello, el objetivo de la presente investigación fue la revisión taxonómica del género Phylloporia en Cuba, a partir del análisis morfológico de ejemplares depositados en las colecciones micológicas de herbarios cubanos.
Materiales y Métodos
Se estudiaron especímenes depositados en las colecciones micológicas de los herbarios HAJB, del Jardín Botánico Nacional de Cuba, y HAC, del Instituto de Ecología y Sistemática de Cuba, acrónimos según Thiers (2022). Se tomaron fotografías empleando un teléfono celular LG G4 (LG Electronics; Seúl, Corea del Sur), con cámara frontal de 16 megapíxeles de resolución. La determinación taxonómica se basó en el análisis de los caracteres macroscópicos y microscópicos de las diferentes partes del cuerpo fructífero. Se emplearon como material de referencia los trabajos de Berkeley y Curtis (1868); Murrill (1903, 1904, 1915, 1919); Ryvarden y Johansen (1980); Gilbertson y Ryvarden (1987); Ryvarden (1991, 2004); Wagner y Ryvarden (2002); Dai (2010)); Ferreira-Lopes et al. (2016); Bittencourt et al. (2018); Wu et al. (2019, 2022); Chamorro-Martínez et al. (2022) y Zhou et al. (2022), que abordan la taxonomía de Hymenochaetaceae, y en los que se incluyen descripciones, claves y comentarios taxonómicos de las especies de la familia.
Para la caracterización de los atributos macromorfológicos del basidioma (forma, dimensiones y coloración) se utilizó un microscopio estereoscópico Zeiss Stemi SV6 (Carl Zeiss, Jena, Alemania). Para el estudio de sus elementos microscópicos (poros por mm, sistema hifal y basidiósporas), se realizaron cortes manuales del basidioma que incluyeron: tomento, contexto, superficie de los poros y tubos del himenóforo. Estas secciones fueron montadas indistintamente en reactivo de Melzer, azul de algodón e hidróxido de potasio (KOH) al 5%. Se utilizó un microscopio óptico Zeiss Axioskop 2 Plus (Carl Zeiss, Jena, Alemania), con cámara acoplada (AxioCam MRc, Zeiss, Jena, Alemania) y el programa AxioVision v. 4.0 (Carl Zeiss Microscopy, 2020), para la observación y medición de las estructuras microscópicas. Todas las dimensiones se tomaron en reactivo de Melzer y se dan como intervalos, con los valores extremos entre paréntesis. Para las estructuras microscópicas (poros, hifas y basidiósporas) se tomó una muestra de 30 (n=30) mediciones. Adicionalmente, se presenta el largo (L) y ancho (A) promedio de las basidiósporas, así como su relación largo/ancho (L/A). Los colores en las descripciones se registraron usando la carta de colores de Kornerup y Wanscher (1978) y para la descripción del basidioma (p. ej., tipo de basidioma, poros, hifas, basidiósporas) se siguió a Ryvarden (2004) y Kirk et al. (2008).
Entre los materiales revisados se incluyó el isotipo de Pyropolyporus subpectinatus Murrill, perteneciente a la colección del HAC. Esto, con el objetivo de esclarecer su posición taxonómica, pues aunque tradicionalmente se ha tratado bajo la sinonimia de Phylloporia pectinata, autores como Zhou et al. (2022) indican que puede tratarse de una especie diferente. Con este mismo propósito, y como análisis adicional, se incluyó esta especie junto a Phylloporia pectinata en un escalado multidimensional no métrico, utilizando el programa Past v. 4.12 (Hammer et al., 2001) y distancias euclidianas. Se tuvo en cuenta para ello solamente el número menor, mayor y medio de poros en un milímetro; así como la longitud y anchura mayor, menor y media de las basidiósporas, debido a la similitud de otros caracteres entre ambos taxones.
A partir de los datos obtenidos de los especímenes revisados, se proporciona una clave dicotómica para la determinación de las especies del género en territorio cubano, que se basa en sus caracteres morfológicos, y se presentan las descripciones de los taxones determinados. En la clave se incluye a Phylloporia crystallina, con base en la descripción original aportada por Zhou et al. (2022). Además, en un mapa elaborado con ArcGis v. 10.2 (ESRI, 2013), se representan las localidades de presencia de las especies del género en el país. Para esto último se utilizó la información disponible en los ejemplares examinados, además de datos de la literatura y del GBIF (2022) correspondientes a material cubano de estas especies que se encuentran depositados en herbarios foráneos y de los cuales no existen duplicados en instituciones nacionales.
Resultados
Se determinaron 80 especímenes de Phylloporia correspondientes a ocho especies. Se adicionan nuevas localidades de presencia para cuatro de las especies del género previamente registradas para Cuba: P. chrysites, P. fruticum, P. pectinata y P. spathulata. Phylloporia verae-crucis (Berk. ex Sacc.) Ryvarden se registra por primera vez para el país. Se propone la nueva combinación P. subpectinata (Murrill) Castro, Camino & S. Herrera, y se describen como especies nuevas para la ciencia: P. pinarensis Castro, Camino & S. Herrera y P. rodriguezii Castro, Camino & S. Herrera.
Clave para la determinación de las especies del género Phylloporia en Cuba
1a. Basidioma estipitado ………………………………….…………………………… 2
1b. Basidioma sésil ………………………………………………..………………….. 4
2a. Basidioma menor de 2 cm de ancho, basidiósporas (2.04-)2.24-3.06(-3.26) µm en longitud ……………. P. rodriguezii Castro, Camino & S. Herrera
2b. Basidioma mayor de 2 cm de ancho, basidiósporas de mayor rango en longitud .… 3
3a. Basidiósporas de 3-3.73(-3.98) × (2-)2.2-2.7(-2.86) µm ………………………………………………………..… P. spathulata (Hook.) Ryvarden
3b. Basidiósporas de (3.7-)4-4.46 × (2.34-)2.5-3.3(-3.4) µm ……………………………………………..… P. verae-crucis (Berk. ex Sacc.) Ryvarden
4a. Sistema hifal pseudodimítico ……………………………………………………... 5
4b. Sistema hifal monomítico …………………………………………………………. 6
5a. Poros redondos a elipsoides, 7-9(-10) por mm, basidiósporas (3.25-)3.4-4.1(-4.21) µm en longitud ………………………………………….… P. pectinata (Klotzsch) Ryvarden
5b. Poros redondos a elipsoides, (8-)9-12(-13) por mm, basidiósporas (2.15-)2.4-2.9(-3.1) µm en longitud ………………….. P. subpectinata (Murrill) Castro, Camino & S. Herrera
6a. Contexto homogéneo, poros 1-2 por mm ……………………………………………… P. pinarensis Castro, Camino & S. Herrera
6b. Contexto dúplex, poros 2-10 por mm …………………………………………….… 7
7a. Basidioma perenne, cristales presentes en la trama (Zhou et al., 2022) … P. crystallina Y.C. Dai, F. Wu, Meng Zhou & Vlasák
7b. Basidioma anual, cristales ausentes en la trama …………………………..………. 8
8a. Poros angulares, (2-)3-5 por mm, basidiósporas (3.2-)3.4-4.2(-4.4) µm en longitud ……………………………………………. P. fruticum (Berk. & M.A. Curtis) Ryvarden
8b. Poros redondos a elipsoides, 6-8 (-9) por mm, basidiósporas (2.3-)2.4-3.6(-3.71) µm en longitud ……………………………………………..… P. chrysites (Berk.) Ryvarden
Taxonomía
Hymenochaetaceae
Phylloporia chrysites (Berk.) Ryvarden, Norweg. J. Bot. 19: 235. 1972. Fig. 1.
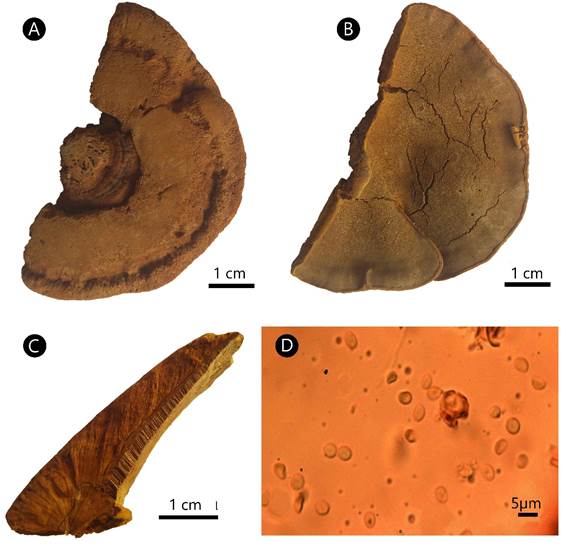
Figura 1: Phylloporia chrysites (Berk.) Ryvarden. A. superficie del píleo; B. superficie de los poros; C. corte transversal del basidioma; D. basidiósporas.
TIPO: BRASIL. San Carlos, VIII.1853 (holotipo: NY 730574).
≡ Polyporus chrysites Berk., Hooker's J. Bot. Kew Gard. Misc. 8: 233. 1856.
Basidioma anual, pileado, sésil, solitario o imbricado, dimidiado a semicircular, proyectado 1.5-7 cm, 1-9 cm de ancho, hasta 1.5 cm de grosor; píleo de pardo-amarillento (5C8) a pardo claro (6D7), azonado, surcado, cubierto por un espeso, aterciopelado, esponjoso y comprimido tomento, hasta 10 mm de grosor; margen entero, redondeado; superficie de los poros de amarillo dorado (5B7) a pardo-amarillento (5D5), frecuentemente con margen estéril; poros redondos a elipsoides, 75-120(-130) × (68-)72-100 µm, 6-8(-9) por mm; disepimentos delgados, 36-96 µm de grosor; tubos concoloros con la superficie de los poros, 1-4 mm de largo; contexto dúplex, 1-2 mm de grosor, pardo-amarillento (5C7), separado del tomento por una línea negra en la sección longitudinal; sistema hifal monomítico, hifas generativas con septos simples, ramificadas, de amarillas a pardo claras, 4.5-6.6(-7) µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas subglobosas, (2.3-)2.4-3.6(-3.71) × (1.9-)2-2.8(-3) µm, L=3, A=2.4, L/A=1.25, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: troncos y ramas vivas o muertas de varias especies de angiospermas.
Distribución: extendida desde Suramérica hasta la Florida en Estados Unidos de América (Ryvarden, 2004; Rajchenberg y Robledo, 2013; Wu et al., 2022). En Cuba presenta una amplia distribución con mayor número de registros en la región occidental del país (Fig. 2).
Material examinado: CUBA. Provincia Artemisa, municipio Bahía Honda, Los Hoyos, sobre tronco muerto, 4.II.1988, M. Camino y M. Benítez s.n. (HAJB 5703). Municipio Candelaria, Sierra del Rosario, a 1 km de la Estación Ecológica El Salón, sobre tronco de Matayba oppositifolia (A. Rich.) Britton, 7.X.1999, N. Blanco s.n. (HAC 7392); a 600 m de la Estación Ecológica El Salón, sobre tronco seco, 7.X.1999, N. Blanco s.n. (HAC 7409), s.n. (HAC 7426); Sierra del Rosario, Loma El Salón, alrededores de la torre de comunicaciones, en raíz viva de Bauhinia glabra Jacq., 4.V.1976, J. Ortíz s.n. (HAC 2535); Sierra del Rosario, sobre tronco vivo de Matayba oppositifolia, 26.II.1987, J. Ortíz s.n. (HAC 4624); Sierra del Rosario, campismo El Taburete, sobre tronco seco, XII.2000, J. Ortíz s.n. (HAC 7783); Sierra del Rosario, Loma El Salón, en tronco muerto, 15.X.1983, G. Recio s.n. (HAJB 4099); loc. cit., en tronco muerto, 15.X.1983, M. Rodríguez et al. s.n. (HAJB 4100), s.n. (HAJB 4101), s.n. (HAJB 4104); loc. cit., en tronco muerto, 12.XI.1983, M. Rodríguez et al. s.n. (HAJB 4145); loc. cit., 10.I.1984, M. Rodríguez y M. Benítez s.n. (HAJB 4171). Municipio San Cristóbal, cercanías del río Taco Taco, 5.IX.2003, L. Castillo et al. s.n. (HAC 8640). Provincia Camagüey, municipio Camagüey, Puerto Príncipe, sobre tronco seco, III.1905, F. S. Earle y W. A. Murrill 642 (HAC 7143). Provincia Granma, municipio Bartolomé Masó, Sierra Maestra, Loma al sureste de Montpié, entre 900-1200 m s.n.m., sobre tronco muerto, 28.IV.1978, M. Rodríguez s.n. (HAJB 3520). Provincia Guantánamo, municipio Baracoa, Yunque de Baracoa, IX.2003, L. Castillo et al. s.n. (HAC 8665). Municipio Yateras, cerca de Monte Cristo, en tronco de Citharexylum sp., 13.V.1983, M. Rodríguez s.n. (HAJB 4037). Provincia Holguín, municipio Mayarí, falda norte de Sierra del Cristal, al suroeste de El Culebro, subida a Alto del Mono, sobre tronco muerto, 8.IV.1987, M. Camino y M. Rodríguez s.n. (HAJB 5206); Sierra del Cristal, sobre tronco muerto, 20.II.1976, G. Recio s.n. (HAJB 2771). Municipio Moa, arroyo Punta Gorda, sobre tronco muerto, 27.IV.1986, M. Camino s.n. (HAJB 4953); arroyo el Palmar, La Melba, sobre bejuco vivo, 19.V.1989, J. Ortíz s.n. (HAC 5726). Provincia Matanzas, municipio Ciénaga de Zapata, Ciénaga de Zapata, sendero ecológico, 27.XI.2002, J. Ortíz et al. s.n. (HAC 8447), s.n. (HAC 8450). Provincia Mayabeque, municipio Jaruco, Área Protegida de Recursos Manejado Escaleras de Jaruco, sendero detrás de la estación biológica, valle del recreo, en bosque semideciduo mesófilo, sobre tronco vivo de Serjania diversifolia (Jacq.) Radlk., 16.IV.2022, J. Ortíz et al. s.n. (HAC 11709). Provincia Pinar del Río, municipio Consolación del Sur, San Diego de los Baños, La Catalina, 4.XII.1976, J. Bisse s.n. (HAJB 3085); San Diego de los Baños, 8-10.III.1905, F. S. Earle y W. A. Murrill 327 (HAC s.n.), 339 (HAC s.n.). Municipio Guanahacabibes, El Valle, a 10 km de la estación meteorológica La Bajada, sobre tronco de Calliandra sp., 29.IX.2005, L. Castillo y J. Ortíz s.n. (HAC 9722). Municipio La Palma, Mil Cumbres, sobre tronco seco, 7.I.2000, N. Blanco et al. s.n. (HAC 7444); San Marcos, 11.XI.2002, J. Ortíz s.n. (HAC 8064), s.n. (HAC 8074); San Andrés, mogote Pico Chico, 9-13.XII.2002, L. Castillo s.n. (HAC 9420). Municipio Sandino, Península de Guanahacabibes, Contrera, en bosque semicaducifolio, sobre ramas vivas de Gouania sp., 21.XI.1976, H. Kreisel s.n. (HAJB 3058). Municipio Viñales, en raíces de Broughtonia ortgiesiana (Rchb. f.) Dressler, XI.1968, J. Bisse y H. Lippold s.n. (HAJB 675); tronco seco, 20.IX.2002, L. Castillo s.n. (HAC 8003), s.n. (HAC 8011). Provincia Sancti Spíritus, municipio Fomento, Sierra del Escambray, Loma del Burro, sobre tronco vivo de Citharexylum spinosum L., 6.XI.1968, H. Kreisel s.n. (HAJB 582); Caballete de Casa, sobre tronco vivo de Meliosma oppositifolia Griseb., 8.XI.1979, M. Rodríguez s.n. (HAJB 3607). Municipio Sancti Spíritus, Trinidad, Sierra del Escambray, Topes de Collantes, 600-650 m s.n.m., 22.IX.1968, H. Kreisel s.n. (HAJB 251); Trinidad, Sierra del Escambray, Pico de Potrerillo, pluvisilva de montaña, 7.XI.1968, J. Bisse s.n. (HAJB 593); Trinidad, Topes de Collantes, Pico Potrerillo, sobre tronco de Allophylus cominia (L.) Sw., 18.VII.1984, J. Ortíz s.n. (HAC 7134); Lomas de Banao, pluvisilva, sobre tronco muerto, 31.V.1986, M. Camino y M. Rodríguez s.n. (HAJB 5146). Provincia Santiago de Cuba, municipio Guamá, Parque Nacional Turquino, 17.XI.2003, J. Ortíz s.n. (HAC 9211). Provincia Villa Clara, municipio Manicaragua, Sierra del Escambray, lomas al noreste de la presa Hanabanilla, sobre tronco vivo de Allophylus cominia (L.) Sw., 8.XI.1987, M. Rodríguez s.n. (HAJB 5576).
Notas taxonómicas: La especie es fácilmente reconocida por la combinación de un denso tomento, contexto dúplex, el número de poros por mm, tipo de sistema hifal y las dimensiones de las basidiósporas. Los materiales revisados concuerdan con las descripciones de Wagner y Ryvarden (2002) y Ryvarden (2004). Otras especies del género como P. flacourtiae L.W. Zhou, P. gutta L.W. Zhou & Y.C. Dai, P. oreophila L.W. Zhou & Y.C. Dai, P. peristrophidis (S. Ahmad) Y.C. Dai & F. Wu y P. yuchengii Gafforov, Tomšovský, Langer & L.W. Zhou, también poseen características similares a P. chrysites en cuanto al número de poros por mm, presencia de contexto dúplex y tipo de sistema hifal; sin embargo, las diferencias morfológicas con este taxón se encuentran fundamentalmente en que presentan basidiósporas de mayor longitud (3.7-4.4, 3-4, 3-3.7, 3-4.5 y 3.2-4 µm, respectivamente) (Wu et al., 2022).
Phylloporia fruticum (Berk. & M.A. Curtis) Ryvarden, Norweg. J. Bot. 19: 235. 1972. Fig. 3.

Figura 3: Phylloporia fruticum (Berk. & M.A. Curtis) Ryvarden. A. superficie del píleo; B. superficie de los poros; C. corte transversal del basidioma; D. basidiósporas.
TIPO: CUBA. En ramas vivas, C. Wright 442 (holotipo: NY 730689).
≡ Polyporus fruticus Berk. & M.A. Curtis, J. Linn. Soc., Bot. 10: 310. 1868.
Basidioma anual, pileado, sésil, solitario, circular, 1.5-4 cm de diámetro y hasta 1.3 cm de grosor; píleo de amarillo dorado (5B7) a amarillo parduzco (5C7), azonado, cubierto por un espeso, aterciopelado, esponjoso y comprimido tomento, hasta 3 mm de grosor; margen entero, redondeado; superficie de los poros de anaranjado claro (5A4) a anaranjado parduzco (5C5), frecuentemente con margen estéril; poros angulares, (97-)100-280(-300) × (86-)93-220(-300) µm, (2-)3-5 por mm; disepimentos delgados, 47-91(-106) µm de grosor; tubos concoloros con la superficie de los poros, 1-2 mm de largo; contexto dúplex, 0.5-1 mm de grosor, anaranjado claro (5A4), separado de tomento por una línea negra (no tan distintiva como en otras especies del género) en la sección longitudinal; sistema hifal monomítico, hifas generativas con septos simples, ramificadas, de amarillas a pardo claras, 4.5-5.5(-5.8) µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas subglobosas, (3.2-)3.4-4.2(-4.4) × (2.2-)2.4-3(-3.2) µm, L=3.8, A=2.7, L/A=1.4, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: ramas vivas de varias especies de angiospermas. En Cuba se reporta parasitando Citrus sp., Nerium oleander L. (Murrill, 1919) y Espadaea amoena A. Rich., aunque todos los materiales examinados parasitan la planta endémica E. amoena, lo que sugiere que puede existir una determinada afinidad por la misma.
Distribución: desde Centroamérica hasta el sureste de los Estados Unidos de América (Ryvarden, 2004; Wu et al., 2022). En Cuba se presenta en varias provincias, aunque sus áreas de ocupación no son muy extensas (Fig. 2).
Material examinado: CUBA. provincia Holguín, municipio Holguín, 25 km al oeste de la ciudad de Holguín, sobre ramas vivas de Espadaea amoena, 5.XI.1968, H. Kreisel s.n. (HAJB 574). Municipio Rafael Freire, al este de la Bahía del Naranjo, sobre ramas vivas de E. amoena, 17.X.1978, A. Álvarez s.n. (HAJB 3528). Provincia La Habana, municipio Boyeros, Instituto de Ecología y Sistemática, sobre ramas vivas de E. amoena, X.2018, I. Baró s.n. (HAC 11547); loc. cit., sobre ramas vivas de E. amoena, 3.XI.2018, I. Baró y L. Castro s.n. (HAC 11550); Jardín Botánico Nacional, en monte seco, sobre ramas vivas de E. amoena, IX.2018, L. Castro s.n. (HAC s.n.); Jardín Botánico Nacional, área de plantas medicinales, sobre ramas vivas de E. amoena, IX.2018, L. Castro s.n. (HAJB s.n.); loc. cit., sobre ramas vivas de E. amoena, VII.2019, L. Castro s.n. (HAC 11546). Provincia Pinar del Río, municipio Los Palacios, San Diego de los Baños, en pinares, sobre ramas vivas de E. amoena, 24.VII.1968, J. Bisse s.n. (HAJB 167). Provincia Sancti Spíritus, municipio Sancti Spíritus, Trinidad, Topes de Collantes, 7.X.1968, H. Kreisel s.n. (HAJB 458); Sierra del Escambray, Loma del Burro, bosque seco, sobre ramas vivas de E. amoena, 6.XI.1968, H. Kreisel s.n. (HAJB 583). Provincia Villa Clara, municipio Yaguajay, La Picadora, sobre ramas vivas de E. amoena, IV.2019, M. Camino y L. Castro s.n. (HAJB s.n).
Notas taxonómicas: entre los caracteres más importantes para la segregación de la especie dentro del género, se encuentran la presencia de grandes poros, contexto dúplex y las dimensiones de las basidiósporas. Otros taxones del género que también poseen poros grandes, contexto dúplex y sistema hifal monomítico constituyen P. amplectens (Murrill) Y.C. Dai & F. Wu, P. insolens Y.C. Dai & F. Wu, P. montana Oliveira-Filho & Gibertoni y P. rzedowskyi R. Valenz. & Decock; aunque la principal diferencia entre estas y P. fruticum radica en que poseen basidiósporas de mayor longitud (6, 3.7-4.7, 4-5 y 4.2-6 µm, respectivamente) (Wu et al., 2022).
Phylloporia pectinata (Klotzsch) Ryvarden, Synopsis Fung. 5: 196. 1991. Fig. 4.

Figura 4: Phylloporia pectinata (Klotzsch) Ryvarden. A. superficie del píleo; B. superficie de los poros; C. corte transversal del basidioma; D. basidiósporas.
TIPO: INDIA. India oriental, C. Wright s.n. (holotipo: NY 730877).
≡ Polyporus pectinatus Klotzsch, Linnaea 8: 485. 1833.
Basidioma bienal, de efuso-reflexo a sésil, solitario o imbricado, aplanado a semiungulado, proyectado 2-6 cm, 2-7 cm de ancho, hasta 1 cm de grosor; píleo de pardo (6E8) a pardo oscuro (6F4), de azonado a zonado en especímenes viejos, surcado, aterciopelado con tomento denso, hasta 3 mm de grosor; margen entero, redondeado a distintamente lobado; superficie de los poros de pardo amarillento (5D8) a amarillo (5D4), frecuentemente con margen estéril; poros redondos a elipsoides, (68-)74-87 × 60-69(-73) µm, 7-9(-10) por mm; disepimentos delgados, 35-68 µm de grosor; tubos anaranjado parduzcos (6C4-C66), distintamente estratificados en especímenes viejos, 1-3 mm de largo en cada región; contexto dúplex, hasta 2 mm de grosor, anaranjado parduzco (6C5), separado del tomento por una línea negra en la sección longitudinal; sistema hifal pseudodimítico, hifas generativas con septos simples, delgadas, amarillentas, 2.5-3.05 µm de diámetro, hifas esqueléticas arboriformes dominantes, gruesas, pardo-rojizas, 3.84-5.9 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas abundantes, subglobosas, (3.25-)3.4-4.1(-4.21) × (2.23)2.3-3.7(3.89) µm, L=3.75, A=3, L/A=1.25, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: troncos vivos o muertos de angiospermas.
Distribución: especie pantropical (Larsen y Cobb-Poulle, 1990; Núñez y Ryvarden, 2000; Ryvarden, 2004; Gomes-Silva et al., 2013). En Cuba se distribuye en cuatro provincias, que abarcan occidente, centro y oriente del país, aunque sus áreas de ocupación no son muy extensas (Fig. 2).
Material examinado: CUBA. Provincia Ciego de Ávila, municipio Florencia, Loma de Cacarrata, sobre tronco vivo, 13.III.1974, O. Oliva et al. s.n. (HAC 1663). Provincia Guantánamo, municipio Maisí, alrededores del río Maya, sobre tronco seco, 8.II.1973, J. Ortíz s.n. (HAC 1291). Provincia Pinar del Río, municipio Consolación del Sur, San Diego de Los Baños, sobre tronco seco, 8-10.III.1905, F. S. Earle y W. A. Murrill 344 (HAC 7149). Provincia Santiago de Cuba, municipio Santiago de Cuba, Loma de San Juan-Gato, sobre tronco muerto, VII.1925, B. Hioram s.n. (HAC 6952).
Notas taxonómicas: los especímenes examinados coinciden con las descripciones de Wagner y Ryvarden (2002) y Ryvarden (2004) para este taxón que se distingue de los restantes en el género por la combinación de caracteres como un contexto dúplex, tipo de sistema hifal, el número de poros por mm y las dimensiones de las basidiósporas. Características relevantes en la especie, aunque no discriminatorias, lo constituyen la presencia de un píleo concéntricamente surcado y de un sistema hifal pseudidimítico, los cuales son compartidos con taxones morfológicamente similares como P. fulva Yombiy. & Decock y P. pulla (Mont. & Berk.) Decock & Yombiy. Entre estas especies y P. pectinata las diferencias radican principalmente en la presencia de cistidiolos en P. fulva y de poros y basidiósporas más pequeñas en P. pulla (de 11-12 poros por mm y basidiósporas de 2.8-3.3 × 2.3-2.8 μm) (Yombiyeni et al., 2015; Wu et al., 2022).
Phylloporia pinarensis Castro, Camino & S. Herrera, sp. nov. Fig. 5. Index Fungorum no. IF 900481.

Figura 5: Phylloporia pinarensis Castro, Camino & S. Herrera. A. superficie del píleo y corte transversal del basidioma; B. superficie de los poros; C. basidiósporas.
TIPO: CUBA. Provincia Pinar del Río, municipio Mantua, Santa Lucía, en pinar, sobre el tronco vivo de Byrsonima sp., 9.X.2005, L. Castillo y J. Ortíz s.n. (holotipo: HAC 9792!).
Annual and pileate basidiomata, pores 1-2 per mm, homogeneous context, monomitic hyphal system; setae, cystidia and cystidioles absent; hyaline to yellowish basidiospores, 4.5-5.8(-6.29) × (2.48-)3-3.8(-4.12) µm.
Basidioma anual, pileado, sésil, solitario, semicircular, proyectado 4.5 cm, 2.8 cm de ancho, 1.2 cm de grosor; píleo de amarillo dorado (5B7) a amarillo parduzco (5C6), azonado, cubierto por un espeso, aterciopelado, esponjoso y comprimido tomento, hasta 6 mm de grosor; margen entero, redondeado a ligeramente lobado; superficie de los poros anaranjado parduzco (5C5), con margen estéril; poros angulares, grandes, 320-620(-734) × (196-)233-495 µm, 1-2 por mm; disepimentos delgados, 87-146 µm de grosor; tubos concoloros con la superficie de los poros, hasta 6 mm de largo; contexto homogéneo, compacto, hasta 4 mm de grosor, anaranjado parduzco (5C5); sistema hifal monomítico en todas las regiones del basidioma, hifas generativas dispuestas paralelamente, con septos simples, pared delgada, escasamente ramificadas, de hialinas a amarillentas, 5.52-7.6 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas elipsoides, 4.5-5.8(-6.29) × (2.48-)3-3.8(-4.12) µm, L=5.15, A=3.4, L/A=1.51, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: tronco vivo de Byrsonima sp.
Distribución: solo conocida de la localidad tipo en la provincia de Pinar del Río (Fig. 2).
Etimología: el epíteto pinarensis se refiere a la provincia de Pinar del Río y el tipo de vegetación en que fue recolectado el ejemplar.
Material examinado: CUBA. Provincia Pinar del Río, municipio Mantua, Santa Lucía, en pinar, sobre el tronco vivo de Byrsonima sp., 9.X.2005, L. Castillo y J. Ortíz s.n. (holotipo: HAC 9792).
Notas taxonómicas: para la distinción de la especie dentro del género, es necesario combinar varios atributos como la presencia de un abundante tomento en el píleo, contexto homogéneo, número de poros por mm, tipo de sistema hifal y las dimensiones de las basidiósporas; aunque para la separación con especies particulares bastarían menos caracteres. Características relevantes en el taxón lo constituyen la presencia de grandes poros (1-2 por mm) y largas basidiósporas (4.5-5.8(-6.29) µm). Los poros de esta especie son los mayores entre los taxones del género. Especies cercanas morfológicamente a P. pinarensis en cuanto al número de poros por mm y las dimensiones de las basidiósporas lo constituyen P. amplectens, P. inonotoides Yombiy. & Decock y P. rzedowskyi. Estos tres taxones presentan sistema hifal monomítico, de 2-4, 2-3 y 2-3 poros por mm y basidiósporas de 6 × 4 μm, 4.5-5.5 × 2.0-2.5 μm y 4.2-6 × 2.4-3.2 μm, respectivamente (Valenzuela et al., 2011; Yombiyeni et al., 2015; Zhou et al., 2022), caracteres similares a P. pinarensis. Sin embargo, la presencia de un píleo glabro en P. inonotoides, que a la vez distingue esta especie, el contexto dúplex en P. amplectens y P. rzedowskyi, así como los cistidiolos en P. inonotoides y P. rzedowskyi, son características que las separan de P. pinarensis. En cuanto a los hospederos que utilizan, Wu et al. (2022) indican que P. amplectens parasita ramas de Asimina sp. (Annonaceae), Yombiyeni et al. (2015) que P. inonotoides fructifica sobre ramas vivas de Crotonogyne manniana Müll. Arg. (Euphorbiaceae) y Garcinia cf. smeathmannii (Planch. & Triana) Oliv. (Clusiaceae), mientras que Valenzuela et al. (2011) reportan a P. rzedowskyi parasitando exclusivamente ramas de Hybanthus mexicanus Ging. ex DC. (Violaceae). Sin embargo, solo se tiene el registro de P. pinarensis parasitando Byrsonima sp. (Malpighiaceae).
Phylloporia rodriguezii Castro, Camino & S. Herrera, sp. nov. Fig. 6. Index Fungorum no. IF 900482.

Figura 6: Phylloporia rodriguezii Castro, Camino & S. Herrera. A. superficie del píleo; B. superficie de los poros; C. corte transversal del basidioma; D. basidiósporas.
TIPO: CUBA. Provincia Pinar del Río, municipio Viñales, Mural de la Prehistoria, en suelo, 6.VII.1991, M. Rodríguez s.n. (holotipo: HAJB 6840!).
Annual and stipitate basidiomata, pores 6-9 per mm, simple or branched stipe, duplex context, monomitic hyphal system; setae, cystidia and cystidioles absent; hyaline to yellowish basidiospores, (2.04-)2.24-3.06(-3.26) × (1.44-)1.7-2.2(-2.63) µm.
Basidioma anual, de central a lateralmente estipitado, circular a espatulado, proyectado 0.5-1.1 cm, 0.8-1.7 cm de ancho y hasta 3 mm de grosor; píleo anaranjado parduzco (6C5) a pardo (6D7), de azonado a ligeramente zonado, cubierto por un delgado tomento concentrado hacia la región central; margen entero, redondeado; superficie de los poros ligeramente decurrentes en el estípite, color pardo claro (6D4), con margen estéril; poros de redondos a elipsoides, (67-)74-110(-120) × (50-)56-74 µm, 6-9 por mm; disepimentos delgados, 47-97(-112) µm de grosor; tubos concoloros con la superficie de los poros hasta 1 mm de largo; estípite simple o ramificado dando varios píleos pequeños, concoloro con el píleo, hasta 3 cm de largo y hasta 0.4 cm de diámetro, engrosado hacia la base; contexto dúplex, fibroso, hasta 2 mm de grosor, color pardo claro (6D5), separado del tomento por una línea negra en la sección longitudinal; sistema hifal monomítico en todas las regiones del basidioma, hifas generativas dispuestas paralelamente, con septos simples, de pared delgada, escasamente ramificadas, de hialinas a amarillentas, 3.46-4.58 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios 4.01-4.3 × 2.14-2.22 µm, claviformes, hialinos, con cuatro esterigmas; basidiósporas elipsoides, (2.04-)2.24-3.06(-3.26) × (1.44-)1.7-2.2(-2.63) µm, L=2.65, A=1.95, L/A=1.36, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: suelo y troncos en descomposición.
Distribución: solo conocida de la provincia de Pinar del Río (Fig. 2).
Etimología: rodriguezii, epíteto honorífico al reconocido micólogo Dr. Miguel Rodríguez Hernández en reconocimiento por sus aportaciones micológicas de Cuba y recolector del material tipo.
Material adicional examinado: CUBA. Provincia Pinar del Río, municipio Soroa, en suelo, 17.XI.1989, J. Ortíz s.n. (HAC 6023, paratipo). Municipio Viñales, en tronco muerto, 20.IX.2002, L. Castillo s.n. (HAC 7961, paratipo).
Notas taxonómicas: se destaca en la especie la presencia de estípite como un carácter de elevado valor taxonómico, pues solo está presente en 14.7% de los taxones del género. Este atributo tradicionalmente ha sido asociado a especies de Phylloporia como P. spathulata y P. verae-crucis. Sin embargo, recientes revisiones del género (Yombiyeni et al., 2015; Ferreira-Lopes et al., 2016; Wu et al., 2019, 2022; Chamorro-Martínez et al., 2022) indican una mayor proporción de especies estipitadas a las conocidas anteriormente. Asimismo, el rango de variabilidad de otros caracteres para los taxones estipitados es muy estrecho, pero cercano entre ellos. En consecuencia, P. rodriguezii es morfológicamente similar a las restantes especies estipitadas de Phylloporia, siendo necesario para su segregación el combinar caracteres como la presencia de un contexto dúplex, el número de poros por mm, las dimensiones de las basidiósporas y la ausencia de cistidiolos. Si comparamos a P. rodriguezii con especies estipitadas de Phylloporia que presentan similar número de poros por mm (7-9), como P. minutispora Ipulet & Ryvarden, P. spathulata y P. verae-crucis, encontramos que poseen características comunes, como un sistema hifal monomítico y la ausencia de cistidios y cistidiolos. Sin embargo, P. spathulata y P. verae-crucis presentan basidiósporas con mayores dimensiones (3-3.73 × 2.2-2.7 y 4-4.46 × 2.5-3.3 µm, respectivamente), mientras que P. minutispora posee un contexto homogéneo (Ipulet y Ryvarden, 2005), lo que marca una segregación entre estos taxones y P. rodriguezii. Similares combinaciones de caracteres resaltan Wu et al. (2019) como necesarias para la separación de taxones estipitados en el género debido a la similitud morfológica en varios atributos.
Phylloporia spathulata (Hook.) Ryvarden, Synopsis Fung. 5: 196. 1991. Fig. 7.
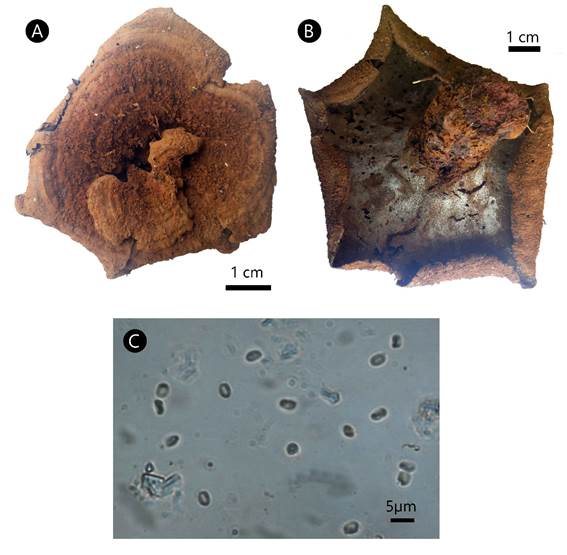
Figura 7: Phylloporia spathulata (Hook.) Ryvarden. A. superficie del píleo; B. superficie de los poros; C. basidiósporas.
TIPO: ECUADOR. Provincia de Loja, A. von Humboldt 246 (holotipo: K 19681, isotipo: NY 65221).
≡ Boletus spathulatus Hook. Synopsis Plantarum 1: 9. 1822.
Basidioma anual, central o lateralmente estipitado, circular a espatulado, proyectado 1-6 cm, 1-6 cm de ancho, hasta 4 mm de grosor; píleo color pardo (6D7), de azonado a parcialmente zonado, cubierto por un comprimido tomento de hasta 1 mm de grosor que suele perderse en ejemplares viejos; margen entero, redondeado a lobado; superficie de los poros color pardo claro (6D4), ligeramente decurrentes en el estípite, con margen frecuentemente estéril; poros de redondos a elipsoides, 97-120 × 50-75 µm, 7-9 por mm; disepimentos delgados, 40-85 µm de grosor; tubos concoloros con la superficie de los poros, hasta 2 mm de lago; estípite simple, pardo claro (6D5), 1-4 cm de largo, de hasta 1.7 cm de diámetro, más grueso hacia la base; contexto dúplex, hasta 2 mm de grosor, anaranjado parduzco (6C4), separado del tomento por una línea negra en la sección longitudinal; sistema hifal monomítico, hifas generativas con septos simples, de amarillas a pardo claras, 3.48-6.16 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas elipsoides, 3-3.73(-3.98) × (2-)2.2-2.7(-2.86) µm, L=3.36, A=2.45, L/A=1.37, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: suelo.
Distribución: probablemente extendida en el Neotrópico (Ferreira-Lopes et al., 2016) y además registrada del noreste de Norteamérica (Ryvarden, 2004; Wu et al., 2022). En Cuba se registra en las provincias de Sancti Spíritus (Murrill, 1919) y Granma (Minter et al., 2001) (Fig. 2).
Material examinado: CUBA. Provincia Granma, municipio Niquero, Monte Castillo, en suelo, 28.XI.1984, J. Ortíz s.n. (HAC 4664), s.n. (HAC 6629); Cabo Cruz, 29.XI.1984, J. Ortíz s.n. (HAC 4659); Belic, en suelo, 30.XI.1984, J. Ortíz s.n. (HAC 4728).
Notas taxonómicas: los especímenes revisados coinciden con las descripciones de Wagner y Ryvarden (2002), Ryvarden (2004) y Ferreira-Lopes et al. (2016) para este taxón, que se distingue de los restantes en el género por la combinación de atributos como la presencia de estípite, contexto dúplex, el tipo de sistema hifal, número de poros por mm y las dimensiones de las basidiósporas. Phylloporia verae-crucis representa una especie morfológicamente similar, aunque se distingue fácilmente de P. spathulata por sus basidiósporas de mayor longitud (4-4.46 µm).
Phylloporia subpectinata (Murrill) Castro, Camino & S. Herrera, comb. nov. Fig. 8. Index Fungorum no. IF 900483.

Figura 8: Phylloporia subpectinata (Murrill) Castro, Camino & S. Herrera. A. superficie del píleo; B. superficie de los poros; C. corte transversal del basidioma; D. basidiósporas.
TIPO: CUBA. Provincia Camagüey, municipio Puerto Príncipe, en madera muerta de un bosque denso, 21.III.1905, F. S. Earle y W. A. Murrill 629 (holotipo: NY 743055!, isotipo: HAC s.n.!)
≡ Pyropolyporus subpectinatus Murrill, N. Amer. Fl. 9: 109. 1908.
Basidioma bienal, de efuso-reflexo a sésil, solitario o imbricado, aplanado a semiungulado, proyectado 2-5 cm, 2.5-8 cm de ancho, hasta 1 cm de grosor; píleo de pardo (6E8) a pardo oscuro (6F4), de azonado a zonado en especímenes viejos, concéntricamente surcado, aterciopelado con tomento denso de hasta 3 mm de grosor; margen entero, redondeado a distintamente lobado; superficie de los poros de pardo amarillento (5D8) a amarillo oscuro (5D4), con margen estéril; poros de redondos a elipsoides, (65-)70-85 × 60-75 µm, (8-)9-12(-13) por mm; disepimentos delgados, 36-81 µm de grosor; tubos anaranjado parduzcos (6C4-C66), distintamente estratificados en especímenes viejos, 1-3 mm de largo en cada región; contexto dúplex, hasta 2 mm de grosor, anaranjado parduzco (6C3), separado del tomento por una línea negra en la sección longitudinal; sistema hifal pseudodimítico, hifas generativas dispuestas paralelamente, ramificadas, con septos simples, pared delgada, 2.4-3.83 µm de diámetro, hifas esqueléticas dominantes, con escasas ramificaciones, paralelas entre sí, pardo-rojizas, 4.01-5.08 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas abundantes, subglobosas, (2.15-)2.4-2.9(-3.1) × (1.7-)1.9-2.5(-2.74) µm, L=2.65, A=2.2, L/A=1.2, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: troncos muertos de angiospermas.
Distribución: se encuentra extendida en la Isla, aunque sus áreas de ocupación no son muy extensas (Fig. 2).
Material adicional examinado: CUBA. Provincia Camagüey, municipio Sierra de Cubitas, Paso de Lesca, sobre tronco seco, 7.V.1975, J. Ortíz s.n. (HAC 2190). Provincia Ciego de Ávila, municipio Florencia, Loma de Cacarrata, sobre tronco muerto de Cupania americana L., 28.I.1977, S. Herrera s.n. (HAC 2875). Provincia Guantánamo, municipio Baracoa, cercanías de la Bahía de Taco, 3-14.VI.2003, L. Castillo et al. s.n. (HAC 8944); loc. cit., 3-10.IX.2003, C. Decock s.n. (HAC 8900). Municipio Yateras, Cuchillas del Toa, sobre tronco muerto, 14-21.VI.2003, L. Castillo et al. s.n. (HAC 8577). Provincia Pinar del Río, municipio La Palma, Mil Cumbres, 24-28.III.2005, J. Ortíz y L. Castillo s.n. (HAC 9535). Provincia Sancti Spíritus, municipio Cumanayagua, Escambray, Finca Javira, sobre tronco muerto de Cupania glabra Sw., 30.X.1986, A. Labrada s.n. (HAC 4402), s.n. (HAC 4403). Municipio Sancti Spíritus, Reserva Ecológica Alturas de Banao, orillas del río Higuanojo, cerca del charco del Oro, sobre tronco seco, 21.II.2001, M. Camino et al. s.n. (HAJB 8776); Lomas de Banao, alrededores de la cañada El Regalo, en rama muerta, 29.I.2004, T. Cabrera s.n. (HAC 9319). Provincia Santiago de Cuba, municipio Mella, Alto Cedro, 19-20.III.1905, F. S. Earle y W. A. Murrill 432 (HAC 7142).
Notas taxonómicas: al comparar los atributos morfológicos de los materiales examinados con Phylloporia pectinata, se encontraron 11 ejemplares (algunos de ellos tratados por Herrera Figueroa (1979) como esta especie) que, aunque presentan similitud macromorfológica con este taxón, difieren en varios parámetros y forman en su conjunto un morfogrupo diferente a P. pectinata. Asimismo, al examinar el isotipo de Pyropolyporus subpectinatus Murrill, especie descrita de Cuba y sinonimizada con Phellinus pectinatus (Klotzsch) Quel. (= Phylloporia pectinata) (Larsen y Cobb-Poulle, 1990), se encontró que comparte las mismas características que los materiales antes mencionados y es diferente a P. pectinata. En consecuencia, se revalida Pyropolyporus subpectinatus y la especie se transfiere a Phylloporia como P. subpectinata. Ambos taxones presentan características morfológicas comunes: basidioma bienal, píleo concéntricamente surcado, contexto dúplex, sistema hifal pseudodimítico y poros de redondos a elipsoides. Estas semejanzas podrían ser resultado de vivir en simpatría como ocurre en las especies P. rzedowskyi y P. ulloai R. Valenz., T. Raymundo, Cifuentes & Decock, simpátricas en un bosque tropical semideciduo de México (Valenzuela et al., 2011), en las cuales las diferencias se destacan en el número de poros por mm y en las dimensiones de sus basidiósporas. De igual modo, para P. pectinata y P. subpectinata la combinación de estos caracteres determina una separación entre ambas, así los poros por mm van de 7-9(-10) vs. (8-)9-12(-13), mientras que las basidiósporas de (3.25-)3.4-4.1(-4.21) × (2.23-)2.3-3.7(-3.89) µm vs. (2.15-)2.4-2.9(-3.1) × (1.7-)1.9-2.5(-2.74) µm, respectivamente.
Una segregación entre Phylloporia pectinata y P. subpectinata se observa además de manera gráfica en el ordenamiento multidimensional no métrico realizado (Fig. 9). En este análisis se compara para las dos especies el número y dimensiones menores, medios y mayores de poros en un milímetro y basidiósporas, respectivamente; donde se evidencia una notable diferenciación entre ambas y a la vez se corrobora la combinación propuesta.

Figura 9: Representación del ordenamiento según el escalado multidimensional no métrico de las variables micromorfológicas para las especies P. pectinata (Klotzsch) Ryvarden y P. subpectinata (Murrill) Castro, Camino & S. Herrera.
La combinación de estos elementos (número de poros por mm y dimensiones de las basidiósporas) representa en ocasiones combinaciones suficientes y necesarias para la delimitación entre muchas de las especies del género y de políporos en general; sobre todo cuando otros caracteres son idénticos o presentan una amplia similitud. En este sentido Yombiyeni et al. (2015) y Wu et al. (2019) indican que la combinación de estos atributos constituye la clave para la delimitación entre especies del género Phylloporia como P. fulva, P. pectinata, P. pseudopectinata Yuan Y. Chen & B.K. Cui, P. pulla y P. subpulla F. Wu, G.J. Ren & Y.C. Dai, dado que poseen una macromorfología similar e idéntico sistema hifal. De igual manera ocurre entre P. pectinata y P. subpectinata.
Phylloporia verae-crucis (Berk. ex Sacc.) Ryvarden, Synopsis Fung. 5: 195. 1991. Fig. 10.

Figura 10: Phylloporia verae-crucis (Berk. ex Sacc.) Ryvarden. A. superficie del píleo; B. superficie de los poros; C. basidiósporas.
TIPO: MÉXICO. Veracruz, VIII.1854, Berkeley s.n. (holotipo: NY 731046, isotipo: K 174177).
≡ Polyporus verae-crucis Berk. ex Sacc., Syll. Fung. 6: 89. 1888.
Basidioma anual, central o lateralmente estipitado, dimidiado a espatulado, proyectado 1-5 cm, 1-6 cm de ancho, hasta 5 mm de grosor; píleo de pardo (6D8) a pardo claro (6D5), de azonado a parcialmente zonado, cubierto por un comprimido tomento, hasta 2 mm de grosor; margen entero, redondeado; superficie de los poros de anaranjado parduzco (6C6) a pardo (6D8), ligeramente decurrente en el estípite, con margen estéril; poros redondos a elipsoides, 84-125 × 60-90 µm, 7-9 por mm; disepimentos delgados, 38-87 µm de grosor; tubos concoloros con la superficie de los poros, 2 mm de largo; estípite simple, pardo claro (6D5), 1-4 cm de largo, 1-10 mm de diámetro, más grueso hacia la base; contexto dúplex, hasta 2 mm de grosor, pardo amarillento (5C7), separado del tomento por una línea negra en la sección longitudinal; sistema hifal monomítico, hifas generativas con septos simples, de amarillas a pardo claras, 3.76-5.1 µm de diámetro; setas, cistidios y cistidiolos ausentes; basidios no observados; basidiósporas elipsoides, (3.7-)4-4.46 × (2.34-)2.5-3.3(-3.4) µm, L=4.23, A=2.9, L/A=1.46, de hialinas a amarillentas, frecuentemente con regiones colapsadas, lisas, acianófilas, sin reacción al reactivo de Melzer.
Hábitat: suelo.
Distribución: especie conocida de México y Costa Rica (Ryvarden, 2004). Para Cuba este registro representa el primero de la especie (Fig. 2).
Material examinado: CUBA. Provincia Granma, municipio Niquero, Belic, Monte Gordo, en suelo, 8.II.1987, J. Ortíz s.n. (HAC 4512).
Notas taxonómicas: El material examinado coincide con las descripciones de Wagner y Ryvarden (2002) y Ryvarden (2004) para el taxón. Representa el primer hallazgo de la especie en Cuba. Se puede distinguir de otras especies estipitadas de Phylloporia por la combinación de atributos como un contexto dúplex, el tipo de sistema hifal, número de poros por mm y las dimensiones de las basidiósporas. Una especie morfológicamente similar lo constituye P. spathulata, aunque se diferencia fácilmente de P. verae-crucis por sus basidiósporas de menor longitud (3-3.73 µm).
Discusión
Los resultados del análisis morfológico de las especies determinadas brindan la primera información comparada que existe en la literatura sobre el género Phylloporia en Cuba. Al caracterizar la morfología de estas especies, se encontró variabilidad en algunos de sus caracteres morfológicos; coincidiendo con lo descrito para el género por Wagner y Ryvarden (2002) y Bittencourt et al. (2018), quienes plantean que es un género morfológicamente diverso y ampliamente heterogéneo. No obstante, algunas características son similares entre especies y los rangos de poros por milímetro y dimensiones de las basidiósporas pueden superponerse o coincidir (Wu et al., 2019; 2022). Por tanto, para lograr una correcta determinación de las especies del género es necesario combinar varios atributos morfológicos además de evaluar la presencia o no de afinidad por determinados hospederos.
Los caracteres morfológicos de las especies Phylloporia chrysites, P. fruticum, P. pectinata, P. spathulata y P. verae-crucis coincidieron con las descripciones utilizadas como material de referencia. Para los restantes taxones se encontraron diferencias en relación con dichas descripciones y con los descritos en el género hasta el momento. En consecuencia, para Cuba además de confirmarse cuatro de las especies anteriormente registradas y una nueva para el país, se proponen dos nuevas especies y una nueva combinación. Por otra parte, ninguno de los materiales examinados coincidió con las características morfológicas descritas para P. crystallina, lo que indica que pueda tratarse de un taxón poco frecuente en Cuba y que a la vez presente muy particulares requerimientos de hábitat.
Lo anterior sugiere la necesidad de continuar realizando muestreos micológicos en áreas donde existen vacíos de información o estén poco exploradas, así como en sitios con alto endemismo en plantas. Futuros estudios sobre las especies cubanas del género, además, podrían encaminarse hacia el análisis molecular de los especímenes con diferentes marcadores para corroborar lo obtenido, interpretar mejor la diversidad del género y discernir las relaciones entre estos y otros taxones de Phylloporia.
Por otra parte, se conoce que algunas de las especies del género poseen una amplia distribución y pueden utilizar una vasta gama de especies vegetales para su desarrollo (Ferreira-Lopes et al., 2016), mientras que otras parasitan plantas específicas y presentan una distribución restringida, generalmente menor a la de su hospedero (Bittencourt et al., 2018). En este sentido, la amplia distribución y área de ocupación observada en P. chrysites, pudiera ser resultado de utilizar, como hospedero, diferentes especies de plantas, tanto vivas como muertas. Estos resultados coinciden con Wagner y Ryvarden (2002) en cuanto a aspectos de su distribución, pues plantean que es una especie ampliamente distribuida en regiones tropicales. Sin embargo, contrastan en cuanto a los sustratos que utiliza, pues la citan solo en ramas y troncos vivos. Por otra parte, las menores áreas de ocupación de las restantes especies pudieran responder a determinadas exigencias como afinidad por especies hospederas. No obstante, P. rodriguezii, P. spathulata y P. verae-crucis, no poseen especificidad por sustratos y fructifican generalmente en suelo, lo que podría indicar a primera instancia una amplia distribución para las mismas, aunque se obtuvo lo contrario. Similar resultado obtuvo Ryvarden (2004) al analizar la distribución de P. spathulata y P. verae-crucis, e indica que son especies raras; la primera, probablemente extendida en el Neotrópico (Ferreira-Lopes et al., 2016) y con registros en el noreste de Norteamérica (Wu et al., 2022), mientras que la segunda conocida previamente de México y Costa Rica (Ryvarden, 2004). Por otra parte, según resalta Ryvarden (2004), estas especies fructifican sobre madera enterrada, contrastando con lo obtenido en el presente trabajo, debido quizás a errores al tomar los datos de campo cuando fueron recolectados los especímenes.
La información obtenida en el presente estudio, además de contribuir a la taxonomía del género Phylloporia y abordar su distribución en Cuba, brinda elementos que pudieran tenerse en cuenta para valorar el estado de conservación actual de sus taxones en el país, así como para la planificación, ejecución y evaluación de acciones enfocadas en su conservación. De igual modo, sirve de base para la evaluación de los posibles cambios que pueden sufrir las áreas de distribución de estas especies bajo condiciones de cambio climático en las próximas décadas.
Conclusiones
En el género Phylloporia es necesaria la combinación de varios atributos morfológicos para una correcta delimitación de taxones, constituyendo el tipo de basidioma, contexto y sistema hifal, número de poros por milímetro y las dimensiones de las basidiósporas los caracteres de mayor peso taxonómico. Con este estudio, la riqueza de este género en Cuba asciende a nueve especies, que incluye una especie nueva para el catálogo del país, una nueva combinación y dos nuevas especies para la ciencia.
El género se distribuye a lo largo de la isla de Cuba, constituyendo P. chrysites la especie con mayor representación. Las especies P. pinarensis, P. rodriguezii, P. spathulata y P. verae-crucis son las de menor extensión de presencia y área de ocupación en el territorio nacional. Los restantes taxones, aunque presentan una amplia extensión de presencia, no poseen áreas de ocupación extensas.











 nova página do texto(beta)
nova página do texto(beta)




