Introducción
Los bosques secos de República Dominicana ocupan aproximadamente 24.05% (5059.30 km) de la superficie boscosa total del país (MIMARENA, 2018). De este, la provincia San Juan alberga 18% de toda su cobertura vegetal (MIMARENA, 2012), incluida la Reserva Forestal Guanito (RFG) como parte de este ecosistema. Se ha reportado la pérdida de los bosques secos por deforestación a nivel global en los últimos 20 años (Pando Ocón et al., 2021). La República Dominicana no es la excepción; son uno de los bosques más amenazados en el país ya que son utilizados por el ser humano para el desarrollo de la agricultura y ganadería (Mejía, 1984; García y Pimentel, 1986). Por otro lado, el porcentaje del territorio nacional que ocupan los bosques semideciduos del país aún no ha sido documentado.
Existen reportes dispersos de especies de plantas registradas para la RFG, como Azolla caroliniana Willd. (Salviniaceae) (Howard, 1950), especies de orquídeas de los géneros Oncidium Sw. y Epidendrum L., cactus como Harrisia divaricata (Lam.) Lourteig. (Franck et al., 2013), bromelias del género Tillandsia L. (Ducoudray, 2006), Croton corylifolius Lam. (Euphorbiaceae), Vachellia macracantha (Humb. & Bonpl. ex Willd.) Seigler & Ebinger (Fabaceae), Phyllostylon rhamnoides (J. Poiss) Taub. (Ulmaceae), Trichilia hirta L. (Meliaceae), Bunchosia glandulosa DC. (Malpighiaceae), Guettarda abbottii Urb. (Rubiaceae), Bursera simaruba Sarg. (Burseraceae), entre otras (MIMARENA, 2018). Sin embargo, no se cuenta con un listado más completo sobre la flora de Cerros del Tabacal y Loma del Agua, dos de las montañas que componen esta reserva.
El objetivo general de este estudio fue inventariar la flora vascular del bosque seco de Cerros del Tabacal y del bosque semideciduo de Loma del Agua, y como objetivos específicos: 1) determinar la diversidad y riqueza de especies en la Reserva Forestal Guanito, 2) documentar la distribución de las especies, estado de conservación y formas de vida de las especies inventariadas, y 3) registrar la variación en la composición florística entre las vertientes norte y sur de cada bosque. Esta investigación constituye el primer inventario florístico de la RFG que aporta al conocimiento de los bosques secos y semideciduos de República Dominicana.
Materiales y Métodos
Área de estudio
La RFG es un área protegida de 68.91 km2 que se encuentra dentro de la Categoría V de manejo de ecosistemas: Reservas Naturales, subcategoría a: Reservas Forestales, destinada a la conservación de las especies presentes y al aprovechamiento sostenible de sus recursos naturales (MIMARENA, 2004). Loma del Agua se ubica al norte de la reserva y es su montaña con mayor elevación (939 m s.n.m.), mientras que la más baja (390 m s.n.m.) es cercana a Cerros del Tabacal y se encuentra hacia el oeste de la reserva (MIMARENA, 2010). La RFG tiene en sus proximidades al río Mijo en su lado occidental y al río Yaque del Sur, en el oriental. Para este estudio, se inventarió la flora de dos montañas de la RFG: Loma del Agua (LA) y Cerros del Tabacal (CT) (Figs. 1, 2).
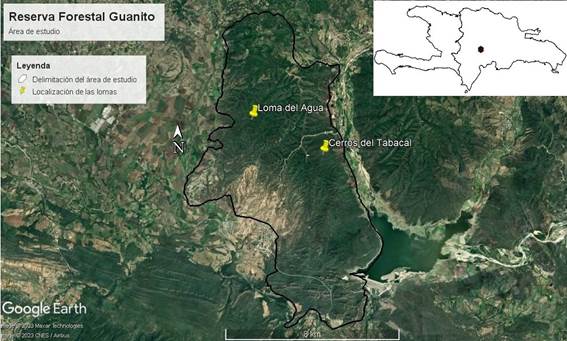
Figura 1: Área de estudio en la Reserva Forestal Guanito, provincia San Juan, República Dominicana. Bosque seco de Cerros del Tabacal hacia el sur del mapa, y el bosque semideciduo de Loma del Agua, hacia el norte del mapa.

Figura 2: A. bosque semideciduo de Loma del Agua; B. bosque seco de Cerros del Tabacal, Reserva Forestal Guanito, provincia San Juan, República Dominicana.
La RFG tiene un clima caracterizado por largas épocas de sequía (Hager y Zanoni, 1993). De acuerdo con la estación meteorológica más cercana, la provincia San Juan tiene 24.5 °C de temperatura promedio anual y 78.3 mm3 de pluviometría promedio anual (ONAMET, 2019). La geología de la RFG comprende desde molasa continental o conglomerado de areniscas de origen terrestre y marino, hasta caliza de varios espesores con tonos grisáceos, blancuzcos y crema, que datan del Cretácico Superior (SGN, 2020). Se desconoce la composición química del suelo de la RFG.
Flora y vegetación del bosque seco de Cerros del Tabacal
Bosque seco perturbado con especies herbáceas y epífitas, en el que predominan Randia aculeata L., varias especies del género Croton L., y de Tillandsia como T. usneoides (L.) L. y T. recurvata (L.) L.; las orquídeas Tolumnia variegata (Sw.) Braem., Psychilis sp. y Vanilla barbellata Rchb. f., y abundan las cactáceas Harrisia divaricata, Consolea moniliformis A. Berger, Pilosocereus polygonus (Lam.) Byles & G.D. Rowley, Stenocereus fimbriatus (Lam.) Lourteig., Cylindropuntia caribaea (Britton & Rose) F.M. Knuth e Hylocereus undatus (Haw.) Britton & Rose, entre otras especies. Hay presencia de especies arbóreas como Guaiacum officinale L., Annona urbaniana R.E. Fr., Trichilia hirta, Eugenia rhombea (O. Berg) Krug & Urb., Delonix regia (Bojer) Raf., y varios individuos de Coccothrinax argentea (Lodd. ex Roem. & Schult) Sarg. ex K. Schum (palma Guanito). Bosque con mucha hojarasca y alterado por la crianza de vacas y por cultivos de naranja y limón, que están cercanos al río Yaque del Suren, en su parte norte, y en la parte sur de la loma existe un bosque joven de Amyris diatrypa Spreng. cercano a la Presa de Sabana Yegua.
Flora y vegetación del bosque semideciduo de Loma del Agua
Bosque semideciduo mesófilo, relativamente joven, sobre roca calcárea y suelo arcilloso, cercano al río Mijo en el lado este de la reserva, con predominancia de las siguientes especies arbustivas y arbóreas: Swietenia mahagoni (L.) Jacq., Chrysophyllum cainito L., Chiococca alba Hitchc., Maytenus domingensis Krug & Urb., Nectandra coriacea Griseb., Wallenia lauriflora Sw., Theophrasta americana Sw. Algunos individuos de Coccoloba diversifolia Jacq., Prunus myrtifolia (L.) Urb., Erythroxylum urbanii O.E. Schulz, Savia sessiliflora Willd., Amyris elemifera L. y varias epífitas del género Tillandsia. Bosque alterado en algunas partes por cultivo de legumbres como habichuelas, guandules y de cítricos como naranja y limón.
Diseño de muestreo de flora
Se establecieron tres parcelas (P) de 10 × 10 m y dos transectos (T) de 60 × 2 m (Fig. 3) en las zonas norte y sur, con cobertura vegetal densa, de cada montaña. Un transecto en cada vertiente, con el fin de registrar la variación en su composición florística. También se hicieron recorridos fuera de las áreas de muestreo para documentar la mayor diversidad posible. Las parcelas y transectos fueron delimitados siguiendo los lineamientos de área mínima modificada y se estableció un margen de distancia entre 3 y 5 m por efecto borde (Matteucci y Colma, 1982). Se contaron los individuos de las especies dentro de las parcelas con el fin de calcular la diversidad. Se destaca que el transecto número dos (T2) realizado en el bosque semideciduo de Loma del Agua no se muestreó en el lugar que se tenía pensado al inicio (fue necesario mover el punto de muestreo de manera forzosa), debido a la pendiente de la loma.
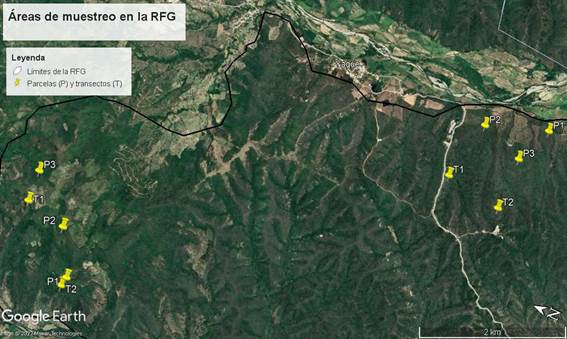
Figura 3: Localización de las parcelas y transectos en el bosque seco de Cerros del Tabacal (en la esquina superior derecha) y del bosque semideciduo de Loma del Agua (en la esquina inferior izquierda), Reserva Forestal Guanito, provincia San Juan, República Dominicana.
Los muestreos para la composición florística de la RFG fueron realizados en marzo, septiembre y diciembre de 2020, y marzo de 2021. Los muestreos en estos meses no son suficientes para registrar toda la composición florística de los bosques estudiados. Sin embargo, el trabajo de campo se vio afectado por la llegada del COVID-19 a República Dominicana y el consiguiente vencimiento del permiso de colecta, de manera que hubo que esperar que el Ministerio de Medio Ambiente y Recursos Naturales (MIMARENA) hiciera la renovación pertinente del permiso y volver al campo a colectar cuando había financiamiento disponible para este tipo de viajes.
Manejo de muestras
Parte de las muestras (hojas, tallos, flores y frutos) fueron identificadas in situ de acuerdo con el conocimiento de las autoras, mientras que el resto se identificó siguiendo los métodos de comparación de especímenes y utilizando La Flora de La Española (Liogier, 1982, 1983, 1985, 1986, 1989, 1995, 1996). Las muestras y duplicados fueron depositados en los herbarios JBSD del Jardín Botánico Nacional “Dr. Rafael Ma. Moscoso” (JBN) y el herbario USD del Instituto de Investigaciones Botánicas y Zoológicas “Prof. Rafael Ma. Moscoso” (IIBZ) de la Universidad Autónoma de Santo Domingo (UASD), ambos herbarios en la República Dominicana.
Revisión de literatura
Los datos de composición florística fueron procesados y analizados en una matriz de datos de Excel®. Para la verificación de los nombres científicos se consultaron las bases de datos de Taxonomic Name Resolution Sources (TNRS) alojada en iPlant Collaborative (Boyle et al., 2013) y Tropicos (Tropicos, 2022), y para los nombres de los autores se siguieron los lineamientos del International Plant Names Index (IPNI, 2022). Para la distribución de las especies se revisó el Catalogue of Seeds Plants of the West Indies (Acevedo-Rodríguez y Strong, 2012) y el Listado de Especies Exóticas Invasoras del MIMARENA (2016). Para el estado de conservación se consultó la Lista Roja Nacional (García et al., 2016). Para los nombres comunes se consideró el Diccionario Botánico de Nombres Vulgares de La Española (Liogier, 2000). También se revisó el listado de especies que se encuentran dentro de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, 2022).
Análisis estadístico de diversidad
Para determinar la diversidad del área de estudio se utilizó el índice de Shannon. La comparación entre unidades muestrales y entre montañas se realizó con el coeficiente de similitud de Jaccard. Para conocer la equidad y dominancia se empleó el índice de Berger-Parker (Moreno, 2001). Estos análisis fueron realizados con el software PAST v. 4 (Hammer et al., 2001). Para la extrapolación de los datos en la curva área - especie se usó el software EstimateSWin v. 9.1.0 (Colwell, 2013), utilizando el índice no paramétrico de Chao 1 (Escalante-Espinosa, 2003).
Resultados
Diversidad y composición florística
Para ambas montañas de la Reserva Forestal Guanito (Loma del Agua (LA) y Cerros del Tabacal (CT)) se registraron 168 especies de flora vascular distribuidas en 141 géneros, 55 familias y 1419 individuos en las parcelas, transectos y recorridos (Apéndice). Las familias con mayor cantidad de especies fueron Fabaceae con 17, Malvaceae con nueve, seguida de Bromeliaceae, Euphorbiaceae, Apocynaceae y Asteraceae con ocho cada una. Los géneros con mayor riqueza de especies fueron Tillandsia con seis y Eugenia L. con cinco. De las especies reportadas amenazadas para ambas lomas, seis se encuentran en CITES: Guaiacum officinale, Consolea moniliformis, Harrisia divaricata, Swietenia mahagoni, Rhipsalis baccifera (Sol.) Stearn y Cylindropuntia caribaea.
En el bosque seco de CT se registraron 81 especies distribuidas en 72 géneros, 31 familias y 816 individuos. Entre las familias con mayor diversidad de géneros se encuentran Fabaceae con ocho y Cactaceae y Euphorbiaceae con cinco cada una (Cuadro 1). Los géneros con mayor riqueza de especies fueron Tillandsia con seis y Croton y Senna Mill., con tres cada una. Las especies con mayor abundancia fueron Tillandsia recurvata (173 individuos), T. fasciculata Sw. (131) y Randia aculeata (78). En el bosque seco de CT predominaron las plantas herbáceas con 26 especies representando 32% de las inventariadas para este bosque, seguido por las especies arbustivas (20, representando 25%). De las 81 especies registradas para el bosque seco, 63 son nativas, ocho son endémicas, una es invasora y una es introducida, de acuerdo con el Catalogue of Seeds Plant of the West Indies (Acevedo-Rodríguez y Strong, 2012). También se registraron 16 especies en categoría de Preocupación Menor, 6 en categoría de Vulnerable y dos en Peligro Crítico de acuerdo con la Lista Roja Nacional (García et al., 2016). Las familias con mayor cantidad de especies amenazadas en el bosque seco fueron Cactaceae (6 spp.), Orchidaceae (3 spp.) y Fabaceae (2 spp.).
Cuadro 1: Familias con mayor diversidad de géneros y especies en los bosques estudiados en la Reserva Forestal Guanito, provincia San Juan, República Dominicana.
| Familias | Géneros | Especies |
|---|---|---|
| Bosque seco de Cerros del Tabacal | ||
| Fabaceae | 8 | 10 |
| Cactaceae | 5 | 5 |
| Euphorbiaceae | 5 | 7 |
| Apocynaceae | 4 | 5 |
| Asteraceae | 3 | 3 |
| Orchidaceae | 3 | 4 |
| Bosque semideciduo de Loma del Agua | ||
| Fabaceae | 9 | 11 |
| Malvaceae | 5 | 5 |
| Asteraceae | 5 | 5 |
| Polypodiaceae | 4 | 4 |
| Sapindaceae | 4 | 5 |
| Rubiaceae | 3 | 4 |
En el bosque semideciduo de LA se registraron 110 especies distribuidas en 96 géneros, 50 familias y 603 individuos. Entre las familias más representativas están Fabaceae con nueve géneros, y Malvaceae y Asteraceae con cinco cada una (Cuadro 1). Los géneros con mayor riqueza fueron Tillandsia con cinco especies, Eugenia con tres, y Adiantum L., Poitea Vent., Senna, Allophylus L., Trichilia P. Browne y Echites P. Browne, con dos especies cada uno. Las especies más dominantes fueron Savia sessiliflora con 39 individuos, Chiococca alba con 36 y Bromelia pinguin L. con 30. La forma de vida mejor representada en el bosque semideciduo de LA fue la arbustiva con 29.4% (33 especies), seguido de la herbácea con 27.6% (31 especies). Se registraron 73 especies nativas, 14 endémicas, seis introducidas y dos invasoras. Se reportan 23 especies en Preocupación Menor, cinco en estado Vulnerable y una En Peligro, de acuerdo con la Lista Roja Nacional (García et al., 2016). Las familias con mayor número de especies amenazadas fueron Rubiaceae con tres, y Sapotaceae, Orchidaceae, Myrtaceae y Malvaceae con dos especies cada una.
Análisis estadístico de diversidad
Para el bosque seco de CT el índice de diversidad alfa de Shannon arrojó un valor de 2.94, lo que indica una diversidad media. De acuerdo con el coeficiente de similitud de Jaccard, P3 y P1 tuvieron el menor porcentaje de similitud (11%), y los transectos el mayor porcentaje (31%) (Cuadro 2). El índice de Berger-Parker dio un valor de 0.20, lo que indica dominancia de una o de varias especies, en este caso Randia aculeata, Tillandsia recurvata y T. fasciculata, y bajo nivel de equidad. Para el bosque semideciduo de LA, el resultado del índice de diversidad de Shannon fue de 3.99, lo que indica una alta diversidad, mientras que en el coeficiente de similitud de Jaccard, P1 y P2 obtuvieron el valor más alto de similitud (27%), y P3 y T2 la similitud más baja (4%) (Cuadro 3). El valor del índice de Berger-Parker fue de 0.06, lo que refleja la baja dominancia y alta equidad de especies. La similitud florística entre ambos bosques fue de 13%, lo que significa que florísticamente son muy distintos.
Cuadro 2: Coeficiente de similitud de Jaccard para las áreas muestreadas en el bosque seco de Cerros del Tabacal, Reserva Forestal Guanito, provincia San Juan, República Dominicana. P1=parcela 1, P2=parcela 2, P3=parcela 3, T1=transecto 1, T2=transecto 2.
| P1 | P2 | P3 | T1 | T2 | |
|---|---|---|---|---|---|
| P1 | 1 | 0.24 | 0.11538 | 0.18182 | 0.26923 |
| P2 | 0.24 | 1 | 0.18182 | 0.24138 | 0.30435 |
| P3 | 0.11538 | 0.18182 | 1 | 0.13333 | 0.21739 |
| T1 | 0.18182 | 0.24138 | 0.13333 | 1 | 0.31034 |
| T2 | 0.26923 | 0.30435 | 0.21739 | 0.31034 | 1 |
Cuadro 3: Coeficiente de similitud de Jaccard para las áreas muestreadas en el bosque semideciduo de Loma del Agua, Reserva Forestal Guanito, provincia San Juan, República Dominicana. P1=parcela 1, P2=parcela 2, P3=parcela 3, T1=transecto 1, T2=transecto 2.
| P1 | P2 | P3 | T1 | T2 | |
|---|---|---|---|---|---|
| P1 | 1 | 0.02703 | 0.05 | 0.05 | 0.05 |
| P2 | 0.02703 | 1 | 0.10526 | 0.13514 | 0.07692 |
| P3 | 0.05 | 0.10526 | 1 | 0.04545 | 0.04545 |
| T1 | 0.05 | 0.13514 | 0.04545 | 1 | 0.15 |
| T2 | 0.05 | 0.07692 | 0.04545 | 0.15 | 1 |
Curva área-especie y área mínima
En el bosque seco de CT, la P1 y el T1 fueron las unidades de muestreo que presentaron mayor riqueza de especies (17 y 22, respectivamente), por lo que la diferencia de cantidad de especies entre las unidades de muestreo es más marcada entre las primeras cinco unidades muestrales mientras que en el resto de las unidades, solo aumenta aproximadamente dos especies (Fig. 4). En el bosque semideciduo la mayor riqueza estuvo representada en la P3 con 28 especies, y ambos transectos con 23 especies cada uno. En la curva de LA se observa un constante aumento hasta la unidad de muestreo número diez. Es decir, a medida que aumentan la cantidad de áreas muestrales, disminuye la cantidad de nuevas especies que se registran en ambos bosques.
Discusión
Diversidad y composición florística
La diferencia en riqueza específica que existe entre este estudio y otros realizados en bosques secos (García y Alba, 1989; Herra-Custodio, 2011; De Los Santos, 2016; MIMARENA, 2018; Franklin et al., 2019) se debe principalmente a que las zonas muestreadas en este estudio fueron elegidas con base en el mayor porcentaje de cobertura vegetal observado en imágenes satelitales, a diferencia de las demás investigaciones que también muestrearon en zonas abiertas; es decir, en lugares en donde la cobertura vegetal es muy baja o casi nula. Al comparar la composición florística entre Cerros del Tabacal (aquí presentado) y Loma del Yaque, montaña perteneciente a la Reserva Forestal Guanito (MIMARENA, 2018), es notable que esta última loma ha sido más afectada por actividad antropogénica por tumba y quema de árboles con fines de cultivo. La presencia de especies invasoras como Leucaena leucocephala (Lam.) de Wit (lino criollo), Oeceoclades maculata (Lindl.) Lindl. y Kalanchoe daigremontiana Raym.-Hamet & H. Perrier son claros indicadores de bosques perturbados (Hager y Zanoni, 1993).
Se confirma la presencia de especies típicas de bosques secos como Vachellia macracantha, Neltuma juliflora (Sw.) Raf., así como Zanthoxylum fagara Sarg. y Trichilia hirta (Banda-Rodríguez 2016), Randia aculeata, Coccothrinax argentea, Oxandra lanceolata Baill. y otras (Franklin et al., 2019). También se registran en el bosque semideciduo Senna atomaria (L.) H.S. Irwin & Barneby, Guaiacum officinale, Amyris elemifera, Celtis philippensis Blanco, Eugenia foetida Pers., Chiococca alba, Macfadyena unguis-cati (L.) A.H. Gentry, y bromelias epífitas como Tillandsia recurvata y T. schiedeana Steud., entre otras (Hager y Zanoni, 1993; Santana-Ferreras, 1993).
Entre las especies con mayor ocurrencia en las unidades muestrales del bosque seco se encuentran Guaiacum officinale, Eugenia rhombea y Randia aculeata, que también se registraron para el bosque seco de Sierra Martín García (Franklin et al., 2019). Poitea campanilla DC., Chrysophyllum oliviforme Lam., Wallenia laurifolia Sw. y Chiococca alba son las de mayor ocurrencia para el bosque semideciduo, lo que no concuerda en su totalidad con lo descrito por Santana-Ferreras (1993), debido a que LA es un bosque relativamente joven que se encuentra aún en regeneración con relictos de la vegetación original como Swietenia mahagoni y Coccoloba diversifolia.
La mayor cantidad de especies en el bosque semideciduo de LA fue reportada en el área de muestreo que se encontró a mayor elevación (900 m s.n.m.), lo que coincide con los resultados de Berdugo-Lattke y Rangel-Ch. (2015) en Colombia: a mayor elevación aumenta la probabilidad de que haya mayor diversidad. La cantidad de especies registradas para el bosque semideciduo (111) se encuentra dentro del rango que presenta de manera típica este bosque (López-Almirall, 1998).
La presencia de Amyris diatrypa (Guaconejo) está limitada al bosque seco, mientras que Amyris elemifera se restringe al bosque semideciduo. Al igual que Trichilia hirta está presente en ambos bosques, pero Trichilia pallida Sw. solo se encuentra en el bosque semideciduo. Debido a que la variación altitudinal en la que fueron encontrados esos taxones es poca, consideramos que su presencia restringida a una montaña en específico se debe al tipo de sustrato y a la diferencia del clima.
Aunque esta última no fue una variable tomada en cuenta, se resalta (por observaciones de las autoras) que el bosque de Amyris diatrypa es un poco húmedo debido a la cercanía con la Presa de Sabana Yegua y el viento que proviene de esta. Por otro lado, la vegetación del bosque semideciduo se encuentra creciendo sobre roca caliza, mientras que la del bosque seco, sobre suelo serpentino. Resultados similares se obtuvieron para Sierra Martín García (Franklin et al., 2019), en donde se menciona que la diferencia florística en el área de estudio puede deberse más al microclima que presenta la Sierra que a la variación altitudinal.
También fueron registradas otras especies de diferencia entre ambas lomas, como algunos helechos (Anemia adiantifolia (L.) Sw., Adiantum peruvianum Klotzsch, Myriopteris microphylla (Sw.) Grusz & Windham, entre otros, que solo estuvieron en el bosque semideciduo por la humedad presente debido a la cercanía con el río Mijo. Las montañas estudiadas de la RFG coinciden con otros estudios (López-Almirall, 1998; Mendoza y Jiménez, 2011; Herra-Custodio, 2011; De Los Santos, 2016) en bajo porcentaje de especies endémicas (11.5% en total), en comparación con la flora nativa (82.9%).
Se esperaba que en el bosque seco dominaran las especies arbustivas (Fernández-Choque, 2008; Herra-Custodio, 2011; De Los Santos, 2016;). Sin embargo, en CT la forma de vida predominante fue la herbácea con 27 especies, seguido de los arbustos con 20. Lo mismo ocurrió en el bosque semideciduo: se esperaba que excediera las 25 especies arbóreas (Santana-Ferreras, 1993), pero en este estudio la forma de vida predominante fue la arbustiva con 36 especies, seguido del arbóreo con 22. Esto se debe a las perturbaciones antropogénicas cíclicas (pastoreo, tala y quema de árboles con fines de cultivo de habichuela, guandules, naranjas, limones y otros) que sufren estos bosques en la actualidad (observaciones de las autoras).
Análisis de similitud de Jaccard
Treinta y un por ciento de similitud entre las vertientes norte y sur del bosque seco se debe principalmente a que ambos transectos se encuentran en el mismo rango altitudinal de 450 m s.n.m. El restante 69% de disimilitud es producto de que el T1 es un bosque joven de Amyris diatrypa, lo que dificulta que otras especies arbustivas y arbóreas estén presentes debido a la regeneración natural del área. Las P1 y P3 fueron las parcelas más similares porque ambas se encuentran en zonas donde la incidencia antropogénica es mayor que en las otras unidades muestrales. En cambio, la P2 fue la unidad de muestreo mejor conservada ya que se encuentra aproximadamente en el medio de Cerros del Tabacal y está alejada de la carretera y de zonas antropizadas (Fig. 5).
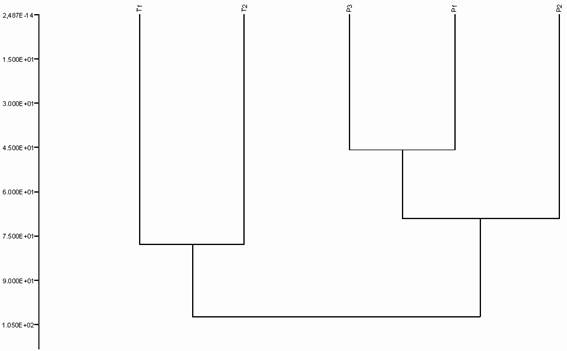
Figura 5: Dendrograma de similitud (Jaccard) entre las áreas de muestreo del bosque seco, Cerros del Tabacal Reserva Forestal Guanito, provincia San Juan, República Dominicana.
Aunque en ambos transectos del bosque semideciduo hubo abundancia de individuos de Maytenus domingensis y Nectandra coriacea (especies comunes en ambos transectos), el rango altitudinal varió de 714 a 551 m, haciendo posible que otras especies estuvieran presentes. Esto explica el bajo porcentaje de similitud entre ambos transectos (15%). Cabe destacar que el T2 se reubicó de manera forzosa debido a la pendiente de la montaña, lo que influye en la variación de elevación y, por consiguiente, en la composición florística entre ambos transectos (Fig. 6).

Figura 6: Dendrograma de similitud (Jaccard) entre las áreas de muestreo del bosque semideciduo, Loma del Agua Reserva Forestal Guanito, provincia San Juan, República Dominicana.
La vertiente norte de ambas montañas presentó exactamente la misma cantidad de especies (23), pero solo tenían cuatro en común: Acacia skleroxyla Tussac, Neltuma juliflora, Trichilia hirta y Harrisia divaricata. Sin embargo, en la vertiente sur de ambas se registraron 17 especies en el bosque seco y 23 en el bosque semideciduo con ninguna especie en común. La vertiente sur del bosque seco está compuesta por un bosque bien conservado de Amyris diatrypa con algunas epífitas como Tillandsia usneoides y especies del género Psychilis Raf. Esto reduce la posibilidad de que en la vertiente sur del bosque seco haya presencia de alguna de las especies que se encuentran en la vertiente sur del bosque semideciduo, porque aparte de estar a mayor altitud está compuesta en su mayoría por árboles como Coccoloba diversifolia, Guettarda preneloupii Urb., Nectandra coriacea, Oxandra lanceolata, Guazuma ulmifolia Lam., entre otros, y lo hace un bosque más diverso.
Curva área-especie
Se esperaba que en la gráfica obtenida (Fig. 4) se pudiera visualizar el punto de inflexión o el punto máximo para la acumulación de especies, con la finalidad de relacionar la cantidad de especies mínima que se puede encontrar en los bosques estudiados. Sin embargo, no fue posible observarlo con los datos obtenidos. Este tipo de curvas son los mismos resultados que se obtienen típicamente para bosques con alta diversidad de especies (Marcelo-Peña et al., 2007), como es el caso del bosque semideciduo de LA, o con algún grado de perturbación (Cano y Stevenson, 2009), como el bosque seco de CT.
Aunque en ambas montañas el número de especies aumenta en las últimas áreas muestrales de la Figura 4, hay una marcada diferencia entre los bosques. De acuerdo con el resultado del índice de Chao 1 para el bosque seco (62), en las dos últimas unidades de muestreo (nueve y diez), el aumento es tan solo de dos especies, lo que nos indica que estamos muy cerca de la saturación de la curva. Esto significa que es probable que en la unidad de muestreo número 12 se visualice la homogeneidad.
Por otro lado, para el bosque semideciduo el índice de Chao 1 dio un resultado de 93, lo que se visualiza en la curva como un aumento constante de especies; es decir, heterogeneidad del bosque, por lo que queda claro que estamos lejanos de la saturación de especies en LA. Esto complementa los resultados de composición florística y del índice de diversidad de Shannon, y nos indica que estamos frente a bosques heterogéneos con gran diversidad que, como parte de los cambios en cobertura vegetal a través de los años, ya sea por factores climáticos o antrópicos, aún se encuentran en regeneración con especies que ocupan nuevos nichos.
Conclusiones
Se concluye que los bosques estudiados, aunque presentan un grado de perturbación por actividades antropogénicas, siguen siendo bosques con alta riqueza, con presencia de muchas especies nativas y endémicas, y variación en la composición florística de las vertientes norte y sur, lo que representa un punto a favor de la conservación del área de estudio y de las especies presentes. Es recomendable realizar trabajos florísticos y fenológicos en los bosques de la RFG no contemplados en este estudio que puedan complementar la información. También es importante contar con un registro de la fauna asociada, ya que es parte fundamental de la dinámica de los bosques, y con ello hacer un llamado a las autoridades competentes a aumentar la protección en la reserva con construcción de casetas y asignación de guardaparques.











 nueva página del texto (beta)
nueva página del texto (beta)




