Introducción
El Atlántico mexicano, conformado por el litoral del Golfo de México y el Caribe mexicano, cuenta con aproximadamente 3294 km de línea de costa (Pedroche y Sentíes, 2003), la cual presenta una alta variedad de ambientes entre los que destacan las lagunas costeras. La condición de esas lagunas es típicamente estuarina originada por la conexión permanente o temporal con el mar y los aportes de agua dulce, lo que les confiere propiedades fisicoquímicas únicas y una alta variabilidad ambiental (Álvarez-Arellano y Gaitán-Morán, 1994; Contreras y Castañeda, 2004; Herrera-Silveira y Morales-Ojeda, 2010). Asimismo, su conformación estructural, resultado de la interrelación de diversos ecosistemas, constituye uno de los ambientes acuáticos más productivos y biodiversos (Herrera-Silveira y Morales-Ojeda, 2010). Por tanto, las lagunas costeras son considerados sistemas de gran utilidad ecológica e importancia económica, ya que además son sitios de reproducción, desarrollo y refugio de diversas especies, muchas con valor comercial, como es el caso de las macroalgas (Dreckmann et al., 2006; Lara-Domínguez et al., 2011; Sanay-González y Perales-Valdivia, 2022).
La riqueza florística de las lagunas costeras está integrada, principalmente, por manglares y vegetación acuática sumergida; esta última está constituida por comunidades de pastos marinos y macroalgas, ya sea asociadas de forma directa a las raíces de los árboles de mangle o al ecosistema bentónico del estuario en cuestión (Contreras y Castañeda, 2004; Dreckmann et al., 2006; Lara-Domínguez et al., 2011). Las macroalgas son un componente importante de los ecosistemas, por constituir una fuente de productividad primaria para el nivel heterótrofo acuático, por lo que realizar estudios ficológicos junto con un monitoreo permanente de la biodiversidad y la historia ecológica de los sistemas estuarinos nacionales permitiría salvaguardar el capital natural de estos ambientes (Vilchis et al., 2018; Núñez Resendiz et al., 2019; Hernández et al., 2021).
Los estudios con enfoques florísticos han tenido el propósito de catalogar e inventariar las especies presentes (riqueza algal) en la región del Atlántico mexicano, lo que resulta indispensable para su correcto uso y manejo (Ramírez-Rodríguez y Blanco-Pérez, 2011). Además, debido a la complejidad que presentan las comunidades de macroalgas, resultado de la heterogeneidad espacial y la interdependencia coevolutiva a lo largo del tiempo, dichos inventarios son una base fundamental para realizar análisis integrativos de tipo taxonómico, ecológico, biogeográfico y de conservación. Estos permiten desarrollar trabajos florísticos más representativos y ayudan a comprender la dinámica y estructura de las comunidades de macroalgas (Núñez Resendiz et al., 2019; Hernández et al., 2021).
En el litoral de Veracruz los cuerpos lagunares abarcan 1166 km2 correspondientes a 14 lagunas costeras, las cuales han sido objeto de numerosos estudios hidrológicos, ictiológicos y malacológicos, entre otros (Lara-Domínguez et al., 2011). Sin embargo, los estudios sobre macroalgas han sido pocos, ya que la mayoría de los ficólogos se han concentrado en el litoral marino (Ramírez-Rodríguez y Blanco-Pérez, 2011). Como resultado de esto se han realizado aproximadamente 36 trabajos enfocados en el litoral, que han contribuido al aumento de los registros ficológicos y dan como resultado una flora algal constituida por 450 especies de macroalgas para el litoral de Veracruz (Ramírez-Rodríguez y Blanco-Pérez, 2011; Landa-Cansigno et al., 2019).
En contraste con la abundante literatura ficológica marina de Veracruz (Mateo-Cid et al., 2013), resalta lo escaso de las publicaciones acerca de las macroalgas estuarinas para ese estado (Dreckmann y Pérez-Hernández, 1994; Orozco-Vega y Dreckmann, 1995; Dreckmann et al., 2006; Ramírez-Rodríguez y Blanco-Pérez, 2011). Esto se debe a que, del total de lagunas costeras veracruzanas, solo en siete se ha realizado algún estudio ficológico (Garduño-Solórzano et al., 2005; Ramírez-Rodríguez y Blanco-Pérez, 2011; García-López et al., 2017).
Los trabajos ficoflorísticos, tanto del litoral marino de Veracruz como de sus lagunas costeras, publicados hasta 1998 fueron incluidos en dos importantes catálogos: el de Dreckmann (1998) y el de Ortega et al. (2001). Posteriormente, ambos fueron integrados junto con la literatura publicada de 2001 hasta 2020 (para algas rojas) y 2021 (para algas pardas) en los listados de García-García et al. (2020, 2021), los cuales se enfocan en la actualización taxonómica de algas rojas y pardas, respectivamente. Sin embargo, desde la publicación de Orozco-Vega y Dreckmann (1995) no se han realizado otros trabajos compilatorios que se enfoquen en las especies estuarinas de Veracruz y que además incluyan las tres divisiones de macroalgas. La carencia de estudios ficofloristicos en los ambientes estuarinos, que son áreas de importancia biológica para el estado de Veracruz, compromete la integridad de los recursos ficológicos de la región. Por lo anterior, el objetivo de este trabajo fue elaborar un listado sistemático actualizado de las macroalgas estuarinas de Veracruz, que contribuya al conocimiento del grupo y que pueda servir como referencia para posteriores investigaciones biogeográficas, ecológicas o de conservación.
Materiales y Métodos
Se revisó la mayor cantidad de literatura publicada con registros de macroalgas estuarinas en Veracruz (Apéndice) desde 1965 a la fecha (septiembre 2022), con la finalidad de obtener un listado de macroalgas estuarinas para el estado. Simultáneamente se revisaron los ejemplares de herbario depositados en el herbario Metropolitano UAMIZ de la Universidad Autónoma Metropolitana (acrónimo de acuerdo con Thiers, 2022), para documentar la información de aquellas especies recolectadas y no publicadas previamente en la región y sus datos de distribución, con el objetivo de complementar y actualizar los registros. A partir del listado obtenido, se realizó un análisis gráfico utilizando hojas de cálculo, con la finalidad de observar gráficamente la distribución de las especies entre las lagunas costeras registradas.
Para la determinación taxonómica de los ejemplares de herbario se recurrió al estudio de la morfología externa. Para obtener los datos de la morfología externa (características celulares y medidas), se empleó un microscopio Leica DM LB (Leica Microsystems, Wetzlar, Alemania) donde se realizaron cortes microscópicos del talo en las porciones apical y media, a mano alzada usando una navaja. Los cortes se montaron en una solución de agua destilada al 80% con miel Karo®. A partir de la observación de los caracteres morfológicos, los taxones se identificaron utilizando claves especializadas (Taylor, 1960; Littler y Littler, 2000). En la base de datos AlgaeBase (Guiry y Guiry, 2021) se revisaron las sinonimias y estatus nomenclatural de cada especie, principalmente de aquellas pertenecientes a Chlorophyta.
Resultados
Se presenta una lista actualizada con un total de 113 especies de macroalgas estuarinas, 25 Chlorophyta, 26 Phaeophyceae, Ochrophyta y 62 Rhodophyta, distribuidas en 24 órdenes, 38 familias y 68 géneros (Apéndice), registradas en siete lagunas costeras de Veracruz (Fig. 1). Las familias, géneros y especies se ordenaron alfabéticamente y se presentan de acuerdo con el sistema de clasificación usado en AlgaeBase (Guiry y Guiry, 2021).
Figura 1: Mapa de la localización geográfica de las lagunas estudiadas en el estado de Veracruz. México.
El análisis gráfico de la distribución de especies mostró un máximo de 57 taxones para Laguna Verde, seguida de Laguna Tamiahua con 45, hasta un mínimo de un taxon para Laguna Mandinga (Fig. 2). Del total de registros, Rhodophyta (algas rojas) representa 55% de este listado, seguido de Phaeophyceae, Ochrophyta (algas pardas) con 23% y Chlorophyta (algas verdes) con 22% (Fig. 3).
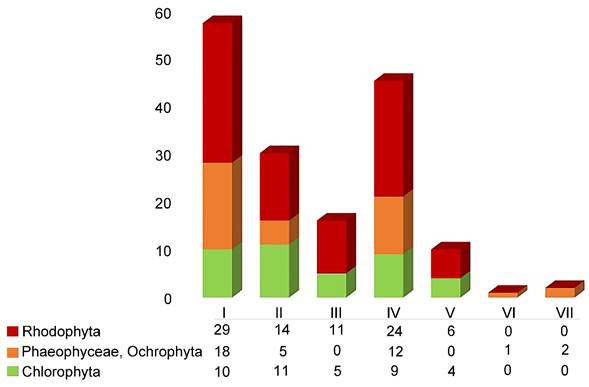
Figura 2: Comparación de la composición florística y su proporción por división, de las especies de macroalgas presentes en cada laguna costera en Veracruz, México. El número romano corresponde con cada laguna estudiada. I. Laguna Verde, II. Laguna de Tampamachoco, III. Laguna de Sontecomapan, IV. Laguna de Tamiahua, V. Laguna de Pueblo Viejo, VI. Laguna Mandinga, VII. Laguna de Alvarado.
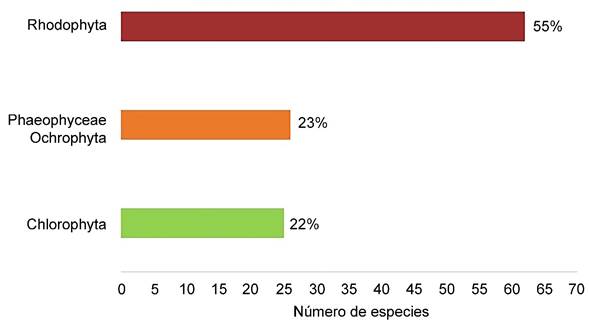
Figura 3: Proporción de especies totales por división en cada laguna estudiada (Laguna Verde, Laguna de Tampamachoco, Laguna de Sontecomapan, Laguna de Tamiahua, Laguna de Pueblo Viejo, Laguna Mandinga, Laguna de Alvarado) en Veracruz, México.
De las 62 especies listadas para algas rojas, distribuidas en 13 órdenes (Fig. 4), 30 pertenecen al orden Ceramiales, mismas que se encuentran distribuidas en cinco familias, lo que representa 48% del total de los registros para algas rojas. En el caso de las algas verdes, de las 25 especies distribuidas en cinco ordenes (Fig. 5) diez pertenecen al orden Cladophorales, en dos familias, representando 40% de los registros de algas verdes. Para algas pardas, las 26 especies se distribuyen en cinco órdenes (Fig. 6), siendo Dictyotales y Ectocarpales las que reportaron mayor número de especies, con nueve cada uno, distribuidas en una familia para el primer orden y tres para el segundo, lo que representa 69% del total de los registros para algas pardas.
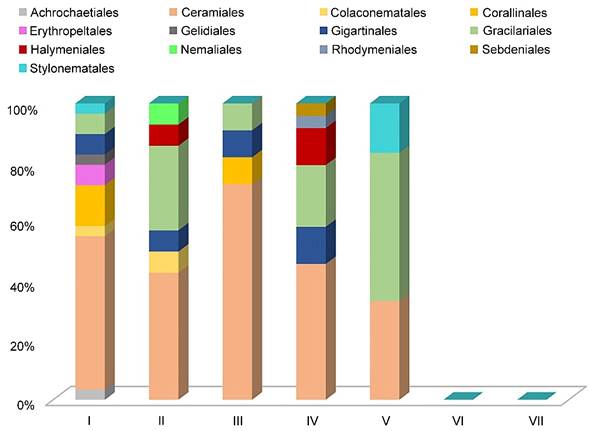
Figura 4: Proporción comparativa del porcentaje de especies en cada orden de Rhodophyta presentes en las lagunas costeras de Veracruz, México. En colores se indica a cada orden representado, indicado en la parte superior del gráfico. El número romano corresponde con cada laguna estudiada. I. Laguna Verde, II. Laguna de Tampamachoco, III. Laguna de Sontecomapan, IV. Laguna de Tamiahua, V. Laguna de Pueblo Viejo, VI. Laguna Mandinga, VII. Laguna de Alvarado.
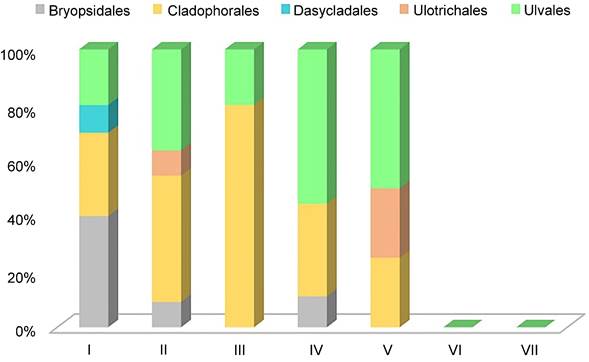
Figura 5: Proporción comparativa del porcentaje de especies en cada orden de Chlorophyta presentes en las lagunas costeras de Veracruz, México. En colores se indica a cada orden representado, indicado en la parte superior del gráfico. El número romano corresponde con cada laguna estudiada. I. Laguna Verde, II. Laguna de Tampamachoco, III. Laguna de Sontecomapan, IV. Laguna de Tamiahua, V. Laguna de Pueblo Viejo, VI. Laguna Mandinga, VII. Laguna de Alvarado.
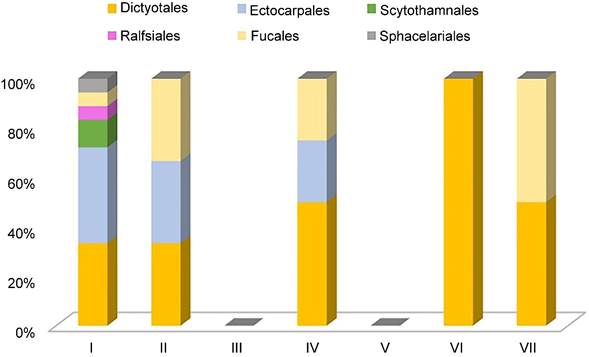
Figura 6: Proporción comparativa del porcentaje de especies en cada orden de Phaeophyceae, Ochrophyta presentes en las lagunas costeras de Veracruz, México. En colores se indica a cada orden representado, indicado en la parte superior del gráfico. El número romano corresponde con cada laguna estudiada. I. Laguna Verde, II. Laguna de Tampamachoco, III. Laguna de Sontecomapan, IV. Laguna de Tamiahua, V. Laguna de Pueblo Viejo, VI. Laguna Mandinga, VII. Laguna de Alvarado.
Discusión
A partir de la flora algal descrita para los ambientes estuarinos de Veracruz se muestra una evidente dominancia de algas rojas, que es un panorama similar al que se presenta en otros estudios de diversidad realizados en sistemas estuarios del Atlántico mexicano. Collado-Vides y González-González (1993) reportan para el Sistema Lagunar Nichupté en Quintana Roo, que las especies de algas rojas tuvieron una mayor representación que las algas verdes y pardas. De igual manera, Pérez-Jiménez et al. (2020) encuentran que para la laguna “El Carmen” en Tabasco, la mayor riqueza de especies pertenece a las algas rojas.
De acuerdo con Mendoza-González et al. (2011), parte del éxito del desarrollo de las algas rojas se da a partir de sus estrategias adaptativas, pues son especies epizoicas, epífitas o epilíticas, lo que les permite una mayor cobertura y diversidad. En este sentido, de los taxa aquí listados se reportan especies como Bostrychya calliptera (Montagne) Montagne, B. moritzina (Sonder ex Kützing) J. Agardh, B. radicans (Montagne) Montagne, Caloglossa leprieurii (Montagne) G. Martens, Spyridia filamentosa (Wulfen) Harvey, Herposiphonia secunda (C. Agardh) Ambronn y Melanothamnus sphaerocarpus (Børgesen) Díaz-Tapia & Maggs, que fueron reconocidas como miembros de tres asociaciones macroalgales por Orozco-Vega y Dreckmann (1995) en la laguna de Tampamachoco.
La primera asociación es la denominada como Bostrychietum, típica de ambientes estuarinos, la cual se encuentra compuesta principalmente por los géneros Bostrychia Montagne, Caloglossa (Hervey) G. Martens, Catenella Greville, Murrayella F. Schmitz y Stictosiphonia Hooker f. & Harvey. Se trate de una asociación algal perenne dominante que se desarrolla sobre el sistema radicular del manglar. Las especies del género Bostrychia son las más representativas de esta asociación. Sin embargo, presentan un problema en cuanto al estatus taxonómico, ya que la asignación de taxa a este género ha demostrado ser compleja debido a la plasticidad fenotípica que presenta. Por lo tanto, ha surgido la necesidad de integrar datos moleculares y morfológicos que complementen la filogenia del género (Zuccarello y West, 2003, 2011; Muangmai et al., 2014). En relación con esto, en los sistemas estuarinos de Veracruz no se han realizado estudios enfocados a resolver este problema de especiación criptica del Bostrychietum, por lo que se plantea una nueva línea de investigación, tanto para la costa veracruzana como para el Atlántico mexicano en general.
Otra de las asociaciones denominadas por Orozco-Vega y Dreckmann (1995), de la comunidad bentónica sumergida, es la del Spyridioetum compuesta por Spyridia filamentosa y Herposiphonia secunda. La última asociación es la del Gracilarioetum, conformada por especies del género Gracilaria Greville y Melanothamnus sphaerocarpus. Ambas asociaciones también fueron descritas para siete estuarios costeros del Golfo de México (Callejas-Jiménez et al., 2005) y en este estudio se registraron especies pertenecientes a ambas.
La mayoría de las especies que constituyen las tres asociaciones mencionadas pertenecen al orden Ceramiales, el cual se caracteriza por comprender una gran variedad de especies de algas rojas con una amplia distribución (Peña-Salamanca, 2017). De hecho, en cinco de las siete lagunas reportadas resalta la dominancia de taxa pertenecientes a este orden, el cual tuvo registros que se distribuyen en cinco familias de las diez que actualmente constituyen a Ceramiales (Peña-Salamanca, 2017). De estas, Rhodomelaceae y Gracilariaceae son las que presentaron un mayor número de especies, lo que refleja una amplia distribución y dominancia de dichas familias en estos ambientes. El estudio de Quiroz-González et al. (2018), realizado en Tabasco, muestra un panorama similar: el orden Ceramiales fue uno de los dos órdenes con mayor riqueza específica y dentro de este, de igual forma, las familias Rhodomelaceae y Gracilariaceae fueron las más representativas con un mayor número de especies. Según lo reportado, existe cierta afinidad entre las especies de algas rojas que se han registrado para Tabasco, Campeche y Veracruz. Esto se ha atribuido a la presencia de corrientes costeras tropicales de la plataforma de Tamaulipas que circulan sobre Veracruz hasta Tabasco/Campeche, particularmente en otoño e invierno (Ramírez, 1996; Ortega et al., 2001; Zavala et al., 2005; Quiroz-González et al., 2017, 2018).
Para el caso de algas verdes, después de Cladophorales, el orden Ulvales presenta un alto porcentaje de dominancia, destacando el género Ulva L., misma situación que fue reportada para la laguna “El Carmen” en Tabasco (Pérez-Jiménez et al., 2020). De acuerdo con Rast y Holland (1988) y Cano-Mallo (2008), dicho género se caracteriza por su capacidad de crecer en hábitats heterogéneos, con diferencias de salinidad, temperatura, turbidez y composición química, como son los ambientes enriquecidos de nutrientes procedentes de los ríos. En este sentido, dicha propiedad les permite a las especies de Ulva prosperar en ambientes estuarinos, como en este caso las lagunas costeras de Veracruz. Quiroz-González et al. (2017) mencionan que este género muestra afinidad con especies registradas para Campeche y Tabasco, particularmente Ulva lactuca L. y U. flexuosa Wulfen, que presentan una distribución continua entre los estados del Golfo de México (Garduño-Solórzano et al., 2005).
En cuanto a las algas pardas, de las especies listadas, Canistrocarpus cervicornis (Kützing) De Paula & De Clerck, Padina gymnospora (Kützing) Sonder y Sargassum fluitans (Børgesen) Børgesen también han sido reportadas en otras localidades estuarinas de Tabasco y Yucatán, afinidad que puede atribuirse a las corrientes tropicales (Pérez-Jiménez et al., 2020; Ortegón-Aznar et al., 2001). Particularmente la presencia de especies del género Sargassum C. Agardh, las cuales son estrictamente marinas (Guiry y Guiry, 2021), se atribuye a las arribazones algales provenientes del Mar de los Sargazos (Atlántico noroeste, frente a la costa de la península de Florida) que llegan al litoral del Atlántico mexicano por medio de las corrientes y se introducen en los ambientes estuarinos a través de la conexión que estos mantienen con el mar (Castillo-Arenas y Dreckmann, 1995; Dreckmann y Sentíes, 2013; Núñez Resendiz et al., 2019).
La diversidad específica en las siete lagunas reportadas en este trabajo presenta una diferencia significativa, ya que se presentaron valores que oscilaron entre un máximo de 57 especies para Laguna Verde, hasta un mínimo de una especie registrada para Laguna Mandinga y dos en Laguna de Alvarado. Los únicos registros que se obtuvieron para esas lagunas pertenecen a Phaeophyceae, Ochrophyta: Dictyota menstrualis (Hoyt) Schnetter, Hörning & Weber-Peuket, en Laguna Mandinga (Ortega et al., 2001), y Padina gymnospora (Kützing) y Sargassum buxifolium (Chauvin) M.J. Wynne Sonder, en laguna Alvarado (De la Campa-De Guzmán, 1963), caso contrario al presentado en la Laguna de Sontecomapan y Laguna de Pueblo Viejo en las cuales no se tienen registros de algas pardas. Sin embargo, esto no implica que haya una baja riqueza específica en las localidades. Al parecer es resultado de una falta de exploraciones ficológicas, como las que se han llevado a cabo en las lagunas que presentaron mayor número de especies: Laguna de Pueblo Viejo, Laguna de Tamiahua, Laguna de Alvarado, Laguna de Tampamachoco y Laguna de Sontecomapan con los reportes de De la Campa-De Guzmán (1963), Dreckmann y Pérez-Hernández (1994) y Orozco-Vega y Dreckmann (1995), y para Laguna Verde el estudio de Sánchez (1980). También están los trabajos realizados en otras lagunas costeras del Atlántico mexicano: el Sistema Lagunar de Nichupté, en Quintana Roo, con 95 especies (Collado-Vides y González-González, 1993); la Laguna de Ria Lagartos, en Yucatán, con una ficoflora de 72 taxa (Ortegón-Aznar et al., 2001), y Laguna El Carmen en Tabasco, con 147 especímenes reportados (Pérez-Jiménez et al., 2020).
Particularmente la Laguna de Tamiahua, que es la segunda con alta diversidad (45 especies), se caracteriza por ser una zona de convergencia entre dos provincias oceanográficas: la Carolineana al norte (caracterizada por especies de clima templado-cálido) y la Caribeña al sur (expuesta a corrientes cálidas y caracterizada por la presencia de especies tropicales) (Briggs, 1995). Es una zona influenciada por la corriente de Lazo, la cual se origina a partir de la corriente del Caribe (proveniente del sur) que pasa a través de Canal de Yucatán e impacta en el noreste de la Península de Yucatán, dando lugar a la corriente de Lazo. De esta corriente se desprenden giros anticiclónicos que migran al interior del Golfo de México generando una trayectoria hacia el oeste que impacta en el noroeste de la Laguna de Tamiahua, dividiéndola en dos nuevos flujos: uno hacia el norte (a lo largo de Texas, Louisiana, Mississippi, Alabama y Florida) y otro hacia el sur de Veracruz (Athié et al., 2011; Ocaña-Luna y Sánchez-Ramírez, 2016; Vilchis et al., 2018). Dicho fenómeno podría estar contribuyendo a la dispersión y establecimiento (en este caso, en la Laguna de Tamiahua) de las especies que viajan con las corrientes e influyendo en el incremento de la diversidad específica.
Finalmente, de acuerdo con lo observado, es necesario incrementar los estudios ficológicos en ambientes estuarinos, ya que las lagunas han permanecido con escasas o nulas investigaciones. De las 14 lagunas costeras de Veracruz solo siete cuentan con trabajos florísticos, y de estas, para Laguna de Alvarado únicamente se tiene reportado el trabajo de De la Campa-De Guzmán (1963) y para la Laguna Mandinga, el de Ortega et al. (2001), lo que deja un vacío en el contexto de la diversidad real de macroalgas en ambientes estuarinos.
Este trabajo, además de ser una contribución actualizada al conocimiento ficológico estuarino, es base fundamental para emprender futuros análisis de diversidad (alfa, beta y gamma), ecológicos y biogeográficos. Es necesario llevar a cabo dichos análisis, debido a que la información que proporcionan contribuye a implementar políticas de conservación para los ecosistemas estuarinos. Esto promueve el establecimiento de reservas naturales en estos ambientes con el fin de maximizar la diversidad y salvaguardar los recursos biológicos, aspectos estrechamente relacionados con la biología de la conservación (Pinilla-Agudelo y Guillot-Monroy, 1996; Primack, 2000; Pozo y Llorente-Bousquets, 2003). Por tanto, promover áreas de conservación en los ecosistemas estuarinos es indispensable debido a la riqueza biológica que presentan y a su importancia económica, ya que además de ser ambientes críticos para algunas especies que dependen del hábitat, también lo son para las actividades humanas tales como agricultura, ganadería y extracción de madera para construcción y carbón (Travieso-Bello, 2006).











 nueva página del texto (beta)
nueva página del texto (beta)



