Introducción
Desde la antigüedad, las plantas silvestres con potencial alimenticio han sido fundamentales en la dieta de los habitantes de las comunidades rurales en diversas partes del mundo (Islary et al., 2019). En este contexto, México se caracteriza por la amplia diversidad de sus especies vegetales. En particular las especies nativas que producen frutos comestibles son consideradas un componente importante de esa diversidad, ya que representan una fuente de alimentos saludables e ingresos económicos para muchas familias campesinas (Lema et al., 2017).
Estudios florísticos y exploraciones etnobotánicas en diferentes estados de México reportan la presencia de numerosas especies nativas cuyo valor potencial radica en sus frutos comestibles. Por ejemplo, en el estado de Veracruz se ha descrito la presencia de 106 frutos silvestres comestibles (Lascurain et al., 2010); en el de Michoacán, 134 especies (Segura et al., 2009); en los cafetales de la Sierra Norte de Puebla, 356 especies nativas y 63 introducidas útiles agrupadas en 13 categorías antropocéntricas (Martínez et al., 2007), de las cuales, las comestibles (algunas por sus frutos) son las más numerosas; y en el Estado de México se reportan 138 especies con frutos y semillas comestibles (101 nativas y 37 introducidas) (Martínez de la Cruz, et al., 2015).
Lo anterior muestra que existe una gran cantidad de recursos alimenticios, como los frutos, que pueden ser utilizados como una alternativa en la lucha contra la inseguridad alimentaria (Bvenura y Sivakumar, 2017). A este respecto, se ha señalado que cualquier evidencia científica sobre el valor nutricional de los frutos silvestres, así como de sus beneficios sobre la salud, les da un valor agregado a estas especies (Sharma et al., 2015).
Tanto en México como en otros países, la información sobre las características físicas, nutricionales y fitoquímicas de algunos frutos silvestres con potencial como alimento es insuficiente, y en algunos casos es nula. A pesar de que en años recientes se han incrementado las investigaciones en los frutos comestibles silvestres con el propósito de identificar y evaluar el efecto de algunos de sus metabolitos secundarios en la salud, hasta el momento no se cuenta con información al respecto en los frutos del género Jarilla Rusby (Caricaceae). Estos frutos comestibles son de forma ovoide o globosa, tipo baya, conocidos principalmente en México como “jarillas” (Díaz-Luna y Lomelí-Sención, 1992), Este género está integrado por tres especies de plantas herbáceas que pueden ser diferenciadas por la morfología de su fruto (Díaz-Luna y Lomelí-Sención, 1992; Carvalho y Renner, 2013). Dos de ellas, J. caudata Standl. y J. heterophylla Rusby, son endémicas al territorio mexicano, mientras que J. chocola Standl. extiende su distribución hasta Guatemala.
La importancia de estos frutos del género Jarilla como alimento en estado inmaduro y crudos (sin cocción) se reportó por primera vez en 1921 (Rusby, 1921), particularmente para las comunidades campesinas de Guanajuato, México. Posteriormente, se documentó la presencia, como alimento y medicina, de raíces y frutos de J. heterophylla y J. caudata en algunos mercados locales de Jalisco (Tookey y Gentry, 1969; Calderón de Rzedowski y Lomelí Sención, 1993). Recientemente, se ha confirmado la importancia de estos frutos como alimento para los habitantes de diferentes zonas rurales de Baja California Sur, Sonora, Guanajuato, Michoacán, Estado de México y Jalisco (Díaz-Luna y Lomelí-Sención, 1992; Calderón de Rzedowski y Lomelí Sención, 1993; Martínez-De la Cruz, et al., 2015). Los pobladores también recolectan frutos en estado maduro para obtener el líquido que se almacena en su interior, y aprovecharlo como bebida refrescante (Calderón de Rzedowski y Lomelí Sención, 1993).
Por lo anterior y considerando que no hay información nutricional y/o fitoquímica de estos frutos, el objetivo de la presente investigación consistió en analizar la composición nutricional de los frutos silvestres de J. caudata en términos de su composición químico proximal, contenido de minerales y aminoácidos. Además, se determinó, mediante un análisis fitoquímico preliminar, la presencia de algunos metabolitos secundarios, así como el contenido total de compuestos fenólicos y flavonoides.
Materiales y Métodos
Colecta de frutos inmaduros de Jarilla caudata
En julio de 2018 y 2019, aproximadamente 2 km al sur de la localidad conocida como Agua Honda, municipio Teocuitatlán de Corona, Jalisco, México (20°04'40.0''N, 103°20'08.1''W), se colectaron aproximadamente 25 frutos verdes e inmaduros de J. caudata, tal y como son consumidos y comercializados en esa región (Fig. 1). Así mismo, se recolectaron algunas plantas de donde provenían los frutos para preparar ejemplares de herbario. El material vegetal recolectado fue identificado con claves taxonómicas especializadas (Díaz-Luna y Lomelí-Sención, 1992; McVaugh y Anderson, 2001; Carvalho y Renner et al., 2013). El espécimen de referencia M. F. González González 3 fue depositado en el herbario Luz María Villareal de Puga (IBUG) de la Universidad de Guadalajara, México.

Figura 1: Jarilla caudata Standl. A. ejemplar depositado en el herbario IBUG de la Universidad de Guadalajara, México; B. comercialización de frutos en un mercado local de Teocuitatlán de Corona, Jalisco, México; C. frutos en su hábitat, Teocuitatlán de Corona, Jalisco, México.
Los frutos aparentemente sanos (sin daño mecánico o causado por insectos) se guardaron en recipientes de plástico y se trasladaron al Laboratorio de Biotecnología del Departamento de Botánica y Zoología de la Universidad de Guadalajara, donde fueron almacenados a 4 oC. Los muestreos y el procesamiento de los frutos fueron hechos de la misma manera para cada uno de los dos años de colecta.
Preparación de los frutos de J. caudata
De los frutos recolectados se seleccionaron los más sanos y libres de imperfecciones, que fueron agrupados en tres lotes en forma sistemática y aleatoria para formar una muestra compuesta con tres repeticiones. Posteriormente fueron lavados con agua de grifo y después con agua destilada. Utilizando un cuchillo de acero inoxidable (Ekco, modelo 24314, China), el epicarpio de los frutos fue removido manualmente, de la misma manera como lo hacen en esta región antes de consumirlo. Se realizaron cortes transversales haciendo rodajas pequeñas que fueron secadas en un horno de aire (Thermo Fisher, modelo PR305225M, Waltham, Massachusetts, EUA) a 50 oC hasta completa sequedad. Posteriormente, las muestras secas fueron molidas en una licuadora convencional (Oster clásica, modelo BLST4655, Estado de México, México) y se conservaron a 4 oC hasta la realización de los análisis.
Análisis químico proximal
Se llevó a cabo el análisis proximal de las muestras secas y molidas para estimar el contenido de humedad, cenizas, fibra y lípidos acorde a los protocolos de la Association of Official Analytical Chemists (AOAC), métodos 925.09, 923.03, 985.29 y 932.06, respectivamente (AOAC, 1990). Se utilizó un factor de 6.25 para convertir el nitrógeno total por el método Kjeldahl, en proteína cruda (James, 1995). El valor total de carbohidratos se determinó por espectrofotometría (Dubois et al., 1951), utilizando una curva de calibración de glucosa como estándar (Merck KGaA). El contenido de energía se calculó por diferencia, de acuerdo con James (1995) y se utilizaron los factores de conversión descritos por la FAO (2003).
Determinación de minerales
El análisis de minerales se llevó a cabo después de que 2 g de las muestras se incineraran en seco en una mufla (Felisa, modelo FE-363, Jalisco, México) a 550 oC. Las cenizas de cada muestra se hirvieron con 10 ml de HCl al 20% en un vaso de precipitado hasta obtener una solución transparente. Luego se filtró en un matraz estándar de 100 ml para después aforar con agua desionizada. Los minerales se determinaron a partir de la solución resultante usando un espectrofotómetro de absorción atómica (Agilent Technologies, modelo AA Agilent 240FS, Santa Clara, EUA) y fueron expresados en mg/100 g de materia en base seca (AOAC, 2005).
Determinación de aminoácidos
El análisis de aminoácidos de los frutos colectados en 2018 y 2019 se llevó a cabo por el método fenilisotiocianato (PITC) (Salazar-Cavazos, 1993), con algunas modificaciones. Para la extracción de aminoácidos, 30 mg de tejido pulverizado en mortero con presencia de N2 líquido, se suspendieron en 600 µl de etanol absoluto frío (se enfrió antes de su uso a -20 oC) y las mezclas fueron homogenizadas por 30 minutos. Se agregaron 600 µl de GABA (Ácido Gama Aminobutírico) y se agitaron en vortex (DAIGGER Vortex-Genie 2, Bohemia, NY, EUA) por 30 segundos. Luego, estas fueron incubadas en un thermoblock (Heat Block, VWR Scientific Company, Atlanta, EUA) herméticamente a 70 oC por 5 min y posteriormente a 4 oC por 60 min, para finalmente centrifugarlas (Centrifuga Eppendorf Mod-5424, Hamburg, Alemania) a 14,000 g durante 30 min. El sobrenadante recuperado se filtró y se “alicuotó” en muestras de 200 µl en tubos de 1.5 ml. Las muestras se llevaron a sequedad total a 45 oC en un concentrador con vacío (Concentrator plus/Vacufuge plus, Eppendorf, Hamburg, Alemania). Ya seco, se le añadieron 20 µl de metanol, agua y trietílamina (2:2:1) y posteriormente fueron concentrados en el mismo concentrador a 45 oC para eliminar el exceso de reactivo. A las muestras secas provenientes de la extracción de aminoácidos se les agregaron 20 µl de metanol:agua:trietilamina (2:2:1). Se llevaron a agitación y secado al vacío durante 30 min a 45 oC para eliminar el exceso de reactivo. Finalmente la muestra se derivatizó agregando 20 µl de metanol:agua:trietilamina: isocianato de fenilo (7:1:1:1). Nuevamente se agitó en vortex, seguido de una incubación por 30 min a temperatura ambientes y un secado al vacío. Los concentrados fueron reconstituidos en un buffer adecuado (acetato de sodio 0.1 M, pH 6.5) para su análisis posterior.
El análisis de aminoácidos se realizó por Cromatografía de Líquidos de Alta Resolución (HPLC), en un cromatógrafo (Shimadzu High Performance Liquid Chromatograph CBM-20A/20Alite, Shimadzu Scientific Instruments, Columbia, EUA) con detector SPD-20 de arreglo de fotodiodos, bajo las siguientes condiciones: columna Shimadzu-Premier C18, 4.6 × 150 mm (DXL) y tamaño de partícula de 5 µm, flujo de 0.9 ml/min y un volumen de inyección de 20 µl. Los componentes de la fase móvil fueron: A=acetato de sodio (0.1 M, pH 6.5) y B=acetonitrilo:H2O (4:1).
Extracción de metabolitos secundarios
Los metabolitos secundarios de los frutos fueron extraídos colocando en un tubo falcón 1 g de material vegetal y 10 ml de metanol:agua (80:20, v/v). Posteriormente los tubos fueron agitados y llevados a un baño de sonicación (Brason Ultrasonics Corporation, Serie CPXH, Danbury, EUA) por 20 minutos en dos ocasiones dejando reposar 5 minutos en cada intervalo de tiempo. En seguida los tubos fueron centrifugados a 5000 rpm por 10 minutos y se recuperó el sobrenadante para las pruebas fitoquímicas. Los sobrenadantes fueron almacenados en un refrigerador a 4 oC hasta su análisis.
Análisis de metabolitos secundarios
Se llevó a cabo un análisis fitoquímico preliminar de los extractos metanólicos obtenidos de los frutos. Se determinó la presencia de los principales grupos de metabolitos secundarios mediante los siguientes procedimientos.
La presencia de alcaloides se determinó con el reactivo de Dragendorff (Shukla et al., 2013). Para la detección de taninos se utilizó FeCl3 3% (Oikeh et al., 2013). La presencia de compuestos fenólicos se evaluó utilizando el Método del Folin-Ciocalteu (Singleton et al., 1999). El ensayo de Shinoda fue utilizado para determinar la presencia de flavonoides en el extracto vegetal (Yadav y Agarwala, 2011). La presencia de saponinas fue analizada por el método de espuma en solución acuosa (Oikeh et al., 2013). Para determinar terpenoides se utilizó el ensayo de Lieberman-Burchard (Oikeh et al., 2013). Para la prueba de glucósidos cianogénicos se utilizó la reacción de Grignard (Piura et al., 2015). Los datos se registraron como abundante (+++), moderado (++), escaso/dudoso (+) y ausencia (-).
Determinación de compuestos fenólicos totales
En matraces volumétricos de 25 ml, se agregó 1 ml de los extractos metanólicos o ácido gálico (Sigma-Aldrich, St. Louis, EUA) como solución estándar (20, 40, 60, 80 y 100 mg/l). Posteriormente, a cada matraz se le adicionaron 9 ml de agua destilada y 1 ml del reactivo de Folin Ciocalteu. Después de 5 min la reacción fue neutralizada añadiendo 10 ml de Na2CO3 al 7% y diluida con agua destilada hasta completar 25 ml. Las muestras y la curva de calibración fueron medidas a 750 nm en un espectrofotómetro UV - Vis (modelo JENWAY 7305, Stone, Staffordshire, UK). El contenido de compuestos fenólicos totales fue expresado como mg equivalentes de ácido gálico (mg EAG)/100 g de muestra en base seca (bs). Las determinaciones se realizaron por triplicado (Marinova et al., 2005).
Determinación de flavonoides totales
En matraces volumétricos de 10 ml, se agregó 1 ml de los extractos metanólicos o catequina (99%, Sigma-Aldrich) como solución estándar (20, 40, 60, 80 y 100 mg/l). Los extractos se mezclaron con 4 ml de agua destilada y 0.3 ml de Na2NO2 al 5% (p/v) y se dejó reposar por 5 minutos. Posteriormente fueron adicionados 0.3 ml de AlCl3 al 10% (p/v), 2 ml de NaOH 1M y se aforó con agua destilada. Después de 30 min de reposo la absorbancia fue determinada a 510 nm. El contenido de flavonoides fue expresado como mg equivalentes de catequina (mg EC)/100 g. Las determinaciones se realizaron por triplicado (Marinova et al., 2005).
Resultados
Composición químico proximal, minerales y aminoácidos
En el Cuadro 1 se muestra el análisis químico proximal de los frutos inmaduros deshidratados y molidos de J. caudata. Solo el contenido de proteína cruda y cenizas (que representa el contenido de minerales totales) mostraron diferencias significativas (P<0.05) respecto al año de colecta. Los carbohidratos totales y el contenido de proteína cruda fueron los nutrientes más abundantes, con valores de 36.84 y 17.04 g/100 g, respectivamente (promedio de dos años). Le siguen el contenido de cenizas y de fibra cruda con valores promedio muy similares (11.51 y 11.35 g/100 g respectivamente). El nutriente con menor presencia en estos frutos fue la grasa o extracto etéreo con un contenido promedio de 3.86 g/100 g, mientras que el contenido promedio de humedad fue de 9.77%. Los valores energéticos fueron similares estadísticamente, independientemente del año de colecta.
Cuadro 1: Composición química proximal de frutos de Jarilla caudata Standl., colectados en 2018 y 2019. Superíndices con la misma letra dentro de cada columna indican diferencias significativas (P<0.05).
| Años de colecta | Humedad | Proteína cruda | Cenizas | Fibra cruda | Grasa | Carbohidratos | Valor energético |
| g/100 g (base seca) | Kcal/100 g | ||||||
| 2018 | 9.55a | 18.01a | 10.53a | 9.23a | 3.67a | 35.29a | 233.9a |
| 2019 | 10.03a | 16.08b | 12.49a | 13.47b | 4.06a | 37.18a | 221.2a |
| Promedio | 9.77 | 17.04 | 11.51 | 11.35 | 3.86 | 36.84 | 227.56 |
En el Cuadro 2 se muestra el contenido de macro y micro-minerales en los frutos inmaduros de J. caudata en mg/100 g de materia seca. Los frutos colectados en 2018 en comparación con los colectados en 2019 mostraron mayor contenido de macro-minerales con excepción del calcio. El potasio fue el macro-mineral con mayor presencia en ambos años con valores de 4277 y 3822 mg/100 g respectivamente, seguido de fósforo con 446 y 370 mg/100 g, mientras que calcio y magnesio registraron las menores cantidades con valores promedio de 280.5 y 287.5 mg/100 g, respectivamente. No se observaron diferencias significativas en el contenido de micro-minerales entre los dos años de colecta. El hierro fue el que se registró en mayor cantidad con 3.55 mg/100 g (promedio de dos años), seguido del zinc y manganeso con valores promedio de 2.11 y 0.95 mg/100 g respectivamente, mientras que el molibdeno fue el micronutriente en menor concentración (<0.01 mg/100 g). Otros micro-minerales como cobre y sodio no fueron detectados en estos frutos.
Cuadro 2: Contenido de macro- y micro-minerales en frutos de Jarilla caudata Standl., colectados en 2018 y 2019. Superíndices con la misma letra dentro de cada columna indica diferencias significativas (P<0.05).
| Colecta de frutos (años) | Macro-minerales (mg/100 g de muestra) | Micro-minerales (mg/100g de muestra) | ||||||
| P | K | Ca | Mg | Mn | Fe | Zn | Mo | |
| 2018 | 446a | 4277a | 275a | 302a | 1.02a | 3.27a | 2.26a | 0.01a |
| 2019 | 370b | 3822b | 296a | 273b | 0.81a | 3.84a | 1.96a | 0.01a |
| Promedio | 383 | 4049 | 280.5 | 287.5 | 0.95 | 3.55 | 2.11 | 0.01 |
Con las técnicas analíticas utilizadas en este estudio se identificaron y cuantificaron en ambos años de colecta siete aminoácidos libres en los frutos verdes e inmaduros de J. caudata (Cuadro 3). Aunque el contenido de estos aminoácidos fue variable en función del año de colecta, solamente tres de estos, lisina, fenilalanina y treonina, son considerados esenciales. Entre los pocos aminoácidos esenciales, treonina presentó mayor concentración que lisina y fenilalanina. Inclusive en el año de colecta 2018, estos se encontraron en cantidades que apenas fueron detectados en el análisis (Cuadro 3).
Cuadro 3: Perfil y contenido de aminoácidos libres en frutos de Jarilla caudata Standl., colectados en 2018 y 2019. *Valores menores a 0.05 mg/g de muestra seca.
| Aminoácidos | Frutos de 2018 | Frutos de 2019 | Promedio |
| mg/g de muestra (peso seco) | |||
| Ácido aspártico | 2.91±0.017 | 2.273±0.026 | 2.596 |
| Asparagina | 2.265±0.015 | 1.864±0.012 | 2.062 |
| Treonina | 1.472±0.003 | 1.316±0.048 | 1.394 |
| Arginina | 0.868±0.029 | 0.0723±0.039 | 0.4701 |
| Prolina | 0.930±0.048 | 0.859±0.019 | 0.894 |
| Fenilalanina | Trazas* | 0.176±0.0241 | 0.088 |
| Lisina | Trazas* | 0.327±0.0199 | 0.163 |
Análisis fitoquímico
En el Cuadro 4 se presentan los primeros resultados de un tamizaje fitoquímico en extractos obtenidos de los frutos de J. caudata en dos años de colecta. El análisis permitió detectar la presencia de los principales grupos de metabolitos secundarios, variando en algunos casos el contenido de estos en función del año de colecta. Los compuestos fenólicos y los terpenos fueron ligeramente más abundantes en el año 2019 que en 2018, mientras que la abundancia de los flavonoides y saponinas fue similar en ambos años. Alcaloides y glucósidos cianogénicos no estuvieron presentes en los frutos.
Cuadro 4: Contenido de algunos metabolitos secundarios en frutos de Jarilla caudata Standl., colectados en 2018 y 2019. Los contenidos se representan como abundantes (+++), moderados (++), escasos (+) o ausentes (-). n=3.
| Metabolitos secundarios | Ensayo | 2018 | 2019 |
| Alcaloides | Dragendorff | - | - |
| Compuestos fenólicos | Folin-Ciocalteu | ++ | +++ |
| Flavonoides | Shinoda | + | + |
| Saponinas | Fehling | ++ | ++ |
| Terpenos | Lieberman | ++ | +++ |
| Glucósidos cianogénicos | Grignard | - | - |
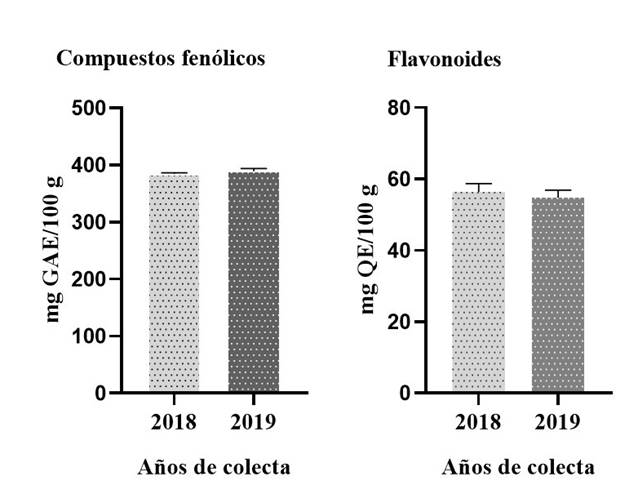
En la Figura 2 se muestra el contenido total de compuestos fenólicos y flavonoides en frutos inmaduros de J. caudata colectados en 2018 y 2019. El contenido de compuestos fenólicos totales es ligeramente mayor en el año 2019 que en 2018 (389 vs. 383 mg GAE/100 g), sin registrarse diferencias significativas. El contenido total de flavonoides no mostró diferencias significativas entre los dos años de colecta con valores de 59 en 2018 y 58 mg QE/100 g en 2019.
Discusión
Composición químico proximal, contenido de minerales y aminoácidos
La composición químico proximal considera el análisis de los alimentos dividiéndolos en cinco constituyentes: humedad, proteínas, cenizas, grasas y carbohidratos. Aunque no da una información completa sobre el valor nutricional, es considerado un procedimiento rápido y de bajo costo para monitorear variaciones en la calidad de los alimentos (Sibiya et al., 2021). Los primeros estudios sobre la importancia de los frutos de las especies del género Jarilla como alimento se registraron en 1921 (Rusby, 1921). Aunque en años posteriores se siguió analizando la utilidad de estos frutos como alimento, en la actualidad no se tenía información sobre su valor nutricional y composición fitoquímica (Tookey y Gentry, 1969; Díaz-Luna y Lomelí Sención, 1992; Calderón de Rzedowski y Lomelí Sención, 1993; Martínez-De la Cruz et al., 2015; Sandoval-Ortega y Siqueiros-Delgado, 2020).
En México también se ha reportado la importancia de otros frutos comestibles obtenidos de diferentes especies de la familia Caricaceae como Vasconcellea cauliflora A. DC. y Jacaratia mexicana A. DC. (Díaz-Luna y Lomelí Sención, 1992; Lascurain et al., 2010; Martínez-De la Cruz et al., 2015). Sin embargo, hasta el momento no se tenía información sobre el valor nutricional y composición fitoquímica del fruto de J. caudata. En otros países los frutos de algunas especies silvestres de la familia Caricaceae tienen importancia como alimento y existen estudios recientes sobre su valor nutricional y composición fitoquímica. Así, por ejemplo, en frutos maduros de Jacaratia spinosa (Aubl.) A.DC., colectados en tres regiones de Brasil, se reportaron valores promedio de cenizas, proteínas y carbohidratos totales de 1.47, 1.24 y 13.62 g/100 g, respectivamente, inferiores a los valores observados en este estudio con J. caudata (Prospero et al., 2016). En otra investigación más reciente también se reportó en pulpa madura de Jacaratia spinosa valores de nutrientes en base húmeda inferiores a los observados en este estudio (Berni et al., 2019).
Así mismo, en Chile con frutos maduros de Vasconcellea pubescens A.DC., bajo diferentes condiciones de secado, el contenido de proteínas varió de 7.92 a 10.70 g/100 g, cenizas de 9.09 a 12.40 g/100 g, fibra de 11.64 a 15.55 g/100 g y grasas de 1.65 a 2.95 g/100 g (Vega-Gálvez et al., 2019). De estos valores solamente el contenido de fibra en frutos secados al sol superó significativamente al contenido de fibra encontrado en los frutos de J. caudata secados en estufa de aire forzado (15.55 vs. 11.35 g/100 g). Otro estudio en Brasil con frutos inmaduros y maduros de Vasconcellea quercifolia A. St.-Hil., reportó un mayor contenido promedio de proteínas en frutos maduros que en frutos inmaduros (2.04 vs. 1.74 g/100 g) (Folharini et al., 2019). Sin embargo, se observó lo contrario con el contenido promedio de carbohidratos, cuyos valores fueron más altos en los frutos inmaduros que en los maduros (12.28 vs. 7.6 g/100 g) (Folharini et al., 2019). Además, los contenidos de cenizas y fibra son muy similares entre ambos tipos de frutos (inmaduro y maduros). De lo anterior se puede señalar que independientemente del estado de maduración de los frutos de Vasconcellea quercifolia, el contenido de los diferentes nutrientes analizados también fue inferior a los que se registraron en los frutos inmaduros de J. caudata.
Con respecto a la papaya (Carica papaya L.), la única especie domesticada y cultivada de la familia Caricaceae, son numerosas las investigaciones y variables los resultados generados respecto a su composición nutricional. Sin embargo, cuando estos frutos han sido analizados en estado inmaduro suelen presentar valores muy similares a los que se determinaron en este estudio con frutos inmaduros de J. caudata. Así, por ejemplo, en frutos inmaduros de C. papaya utilizados como ingredientes en sopas en algunas regiones de África, se registró un contenido de proteína de 16.50 y 15.73 g/100 g en pulpa cruda secada al sol y pulpa cocida, respectivamente (Okon et al., 2017). Sin embargo, el contenido de carbohidratos fue superior al observado en los frutos de este estudio (63.00 y 60.67 g/100 g, respectivamente). En otra investigación con C. papaya, cultivada en Nigeria y con frutos cosechados en tres diferentes estados de maduración, se observó que el contenido de carbohidratos totales y proteínas en los frutos inmaduros (27.1 y 8.80 g/100 g) fueron menores a los valores que se registraron en este estudio. Los demás nutrientes, con excepción del contenido de fibra, también mostraron valores inferiores a los registrados en este estudio (Chukwuka et al., 2013). En frutos inmaduros de C. papaya de Pakistán solamente el contenido de cenizas mostró valores superiores a los encontrados en los frutos inmaduros de J. caudata (14.2 vs. 11.51 g/100 g) (Oloyede, 2005).
Otros frutos no silvestres de especies de otras familias, como el pepino Cucumis sativus L. (Cucurbitaceae), que también se consumen crudos, frescos e inmaduros, generalmente presentan menor contenido de nutrientes que los determinados en este estudio en frutos de J. caudata (Agatemor et al., 2018; Shariff et al., 2020). Aunque es escasa la información sobre el contenido de minerales en frutos silvestres de la familia Caricaceae, encontrar potasio y fósforo como los macrominerales más abundantes en los frutos de J. caudata es congruente con lo reportado en otras investigaciones con frutos de especies silvestres y domesticadas de diferentes familias de plantas. De acuerdo con Martínez-Ballesta et al. (2010), el potasio y el fósforo junto con el calcio están estrechamente relacionados con las funciones metabólicas del organismo, incluyendo el crecimiento celular y la contracción de los músculos. En un estudio donde se analizó la composición de minerales en aproximadamente 22 frutos, la mayoría nativos de la región del Amazonas, se observó una tendencia muy similar a la registrada en este estudio, ya que el contenido de potasio fue el más abundante (varió de 711 a 9479 mg/100 g), y debido a que no se analizó el fósforo, le siguieron el calcio y el magnesio con una fluctuación de 402 a 8750 mg/100 g y de 359 a 2199 mg/100 g, respectivamente (Alves et al., 2019).
Se reportó el potasio como el macro-mineral mayoritario. Sin embargo, se encontraron fósforo y en menor cantidad calcio y magnesio, contrario a lo que se observó en este estudio (Montero et al., 2020). En frutos de Jacaratia spinosa, colectados en tres localidades de Brasil, también se registró una tendencia similar a la observada en este estudio. Sin embargo, los contenidos de macro-minerales fueron menores. Por ejemplo, el potasio varió de 355 a 515 mg/100 g mientras que el contenido de fósforo, calcio y magnesio fluctuó de 24 a 37 mg/100 g (Prospero et al., 2016). Lo anterior indica que la mayoría de los frutos mencionados anteriormente presentan menor contenido en macro-minerales en comparación con los frutos de J. caudata, inclusive algunos estudios con frutos verdes y maduros de C. papaya reportan un contenido de potasio, fósforo, calcio y magnesio inferior a los que se han registrado en frutos verdes e inmaduros de J. caudata (Oloyede, 2005; Chukwuka et al., 2013). En frutos silvestres de la familia Caricaceae, analizados por su composición de micro-nutrientes, solamente se tiene información al respecto en Jacaratia spinosa de Brasil (Prospero et al., 2016). Estos autores reportaron un contenido promedio de hierro, zinc y manganeso de 0.59, 0.13 y 0.17 mg/100 g respectivamente, valores inferiores a los observados en los frutos de J. caudata (Cuadro 2).
Además de las proteínas, los frutos poseen aminoácidos en forma libre, que pueden influir en las propiedades sensoriales de los frutos. Al comparar el contenido de aminoácidos encontrados en los frutos inmaduros de J. caudata con lo que se ha reportado en la literatura en otros frutos silvestres, estos frutos presentaron bajo contenido de aminoácidos. En relación con los frutos silvestres y comestibles de la familia Caricaceae, solamente en frutos inmaduros y maduros de Vasconcelleae quercifolia se tiene un análisis completo sobre el perfil y composición de aminoácidos, en donde se reportó al ácido aspártico como el segundo aminoácido mayoritario, independientemente del estado de maduración (Folharini et al., 2019). Esto difiere de lo registrado en este estudio, ya que en los frutos de J. caudata el ácido aspártico es el aminoácido mayoritario (Cuadro 3). Los frutos de J. caudata mostraron un perfil pobre de aminoácidos en comparación con lo reportado en otros frutos silvestres con potencial alimenticio de la familia Caricaceae. Es posible que esto esté relacionado con la etapa de madurez en la que se analizaron los frutos, ya que de acuerdo con Choi et al. (2012), durante la maduración de los frutos puede ocurrir una síntesis o una degradación de diferentes compuestos químicos. Las diferencias observadas en la composición nutricional, contenido de minerales y aminoácidos en los frutos de J. caudata, en comparación con otros frutos de la familia Caricaceae, pueden deberse a la especie en estudio, diferencias en el estado de maduración del fruto, diferencias en las técnicas analíticas utilizadas, a la localidad de colecta, partes del fruto analizadas (frutos completos o pulpa), o a tratamientos previos a los frutos antes del análisis (base seca vs. base húmeda), entre otros (Chukwuka et al., 2013; Prospero et al., 2016; Berni et al., 2019; Folharini et al., 2019; Vega-Gálvez, et al., 2019).
Análisis fitoquímico
En el análisis fitoquímico de los frutos de J. caudata no se detectó la presencia de metabolitos secundarios tóxicos o anti-nutricionales como alcaloides y glucósidos cianogénicos, aunque si hubo presencia de saponinas. Estos compuestos, al igual que taninos, fitatos y oxalatos, disminuyen la disponibilidad de algunos nutrientes requeridos por el organismo (Umaru, 2007). Por otro lado, es importante señalar que en estos frutos se detectó la presencia de compuestos fenólicos y flavonoides, los cuales fueron posteriormente cuantificados por espectrofotometría (Fig. 2). Se ha reportado que específicamente los compuestos fenólicos tienen relación con la calidad sensorial de los alimentos de origen vegetal, tanto frescos como procesados (Tekaya et al., 2014). Además, en los últimos años el interés en estos compuestos ha aumentado debido a sus efectos favorables para la salud, protegiendo frente al estrés oxidativo (actividad antioxidante) y reduciendo el riesgo de enfermedades cardiovasculares y diferentes tipos de cáncer (Martínez-Valverde et al., 2000; Gayosso-García Sancho et al., 2011). Solamente en algunas especies silvestres de la familia Caricaceae se han realizado análisis fitoquímicos para conocer los metabolitos secundarios presentes en los frutos comestibles. En Chile, por ejemplo, después de analizar el contenido de polifenoles y flavonoides totales en frutos maduros de Vasconcellea pubescens sometidos a diferentes técnicas de secado, se determinó una variación de 676 a 889 mg GAE/100 g y de 125 a 333 mg QE/100 g en compuestos fenólicos y flavonoides, respectivamente (Vega-Gálvez et al., 2019). Cabe señalar que estos valores son superiores a los que se encontraron en los frutos de J. caudata en ambos años de colecta (Fig. 2). En otros estudios fitoquímicos en frutos maduros de Jacaratia spinosa (Caricaceae) solo se reportaron el perfil y contenido de carotenoides, así como su actividad antioxidante (Prospero et al., 2016; Berni et al., 2019). El perfil y contenido de compuestos fenólicos y flavonoides, así como su actividad antioxidante ha sido ampliamente estudiada en extractos obtenidos de frutos, hojas y semillas de C. papaya, única especie domesticada y cultivada de la familia Caricaceae (Rivera-Pastrana, 2010; Gayosso-García Sancho et al., 2011; Addai et al., 2013; Zunjar et al., 2015; Pinnamaneni, 2017). En estos estudios se han reportado valores de compuestos fenólicos y flavonoides, tanto superiores como inferiores a los observados en los frutos de J. caudata. Aunque en este estudio no fue posible analizar frutos durante la maduración, se demostró en C. papaya que el contenido de compuestos fenólicos tiende a disminuir con la maduración de los frutos (Gayoso-García Sancho et al., 2011).
Conclusiones
En comparación con frutos silvestres comestibles de otras especies de la familia Caricaceae, los frutos de J. caudata presentaron altos valores de proteínas, carbohidratos y minerales, principalmente potasio, fósforo, calcio, así como hierro y zinc. Sin embargo, el contenido de aminoácidos registrado fue bajo. No se detectó la presencia de metabolitos secundarios tóxicos o anti-nutricionales como alcaloides y glucósidos cianogénicos. El contenido de compuestos fenólicos y flavonoides encontrados en estos frutos es similar y en algunos casos superior al que se han reportado en otros frutos silvestres.











 nueva página del texto (beta)
nueva página del texto (beta)