Introducción
La familia Orchidaceae, con más de 880 géneros y 25,000 especies, constituye uno de los grupos de plantas más diversos dentro de las angiospermas (Givnish et al., 2015; Hetherington-Rauth y Ramírez, 2015). En la familia se incluyen especies que exhiben diseños florales y de recompensa altamente especializados, que responden a los procesos evolutivos de adaptación entre las orquídeas y sus polinizadores (Darwin, 1876; Givnish et al., 2015). Un ejemplo de estas orquídeas lo constituyen las especies polinizadas por abejas euglosinas (Hymenoptera: Apidae), las cuales han promovido y acelerado los procesos de especiación y diversificación en la familia (Dressler, 1968a; Givnish et al., 2015). En estos sistemas de polinización especializado, la especie de orquídea emite un aroma específico (perfume floral) que atrae a los individuos macho de abejas pertenecientes a la tribu Euglossini (Hinojosa-Díaz et al., 2011; Engel, 2021). Los insectos no producen su propia feromona, por lo que la colectan de las flores y de otras fuentes/sustratos para procesarla y utilizarla en reconocimiento con sus conespecíficos (Dressler, 1968a; Hetherington-Rauth y Ramírez, 2015). La polinización altamente especializada parece haber surgido en al menos dos ocasiones en Orchidaceae, en las subtribus Catasetinae y Zygnophyllinae-Stanhopeinae-Coeliopsidinae hace 16-22 millones de años (Givnish et al., 2015; Hetherington-Rauth y Ramírez, 2015). Dentro de la subtribu de Stanhopeinae se encuentra el género Gongora Ruiz & Pav., de interés en este estudio.
Gongora es un género neotropical de orquídeas epífitas que exhibe el mecanismo de polinización altamente especializado asociado a la producción de químicos volátiles que atraen a individuos macho de abejas euglosinas (Dressler, 1968, b, 1993; Martini et al., 2003; Adachi et al., 2015). Las flores de este género tienen una longevidad no mayor a seis días, como en las especies Gongora bufonia Lindl. (de 2 días, Adachi et al., 2015) y Gongora quinquenervis Ruiz & Pav. (de 4 días, Martini et al., 2003). Para el caso de esta última y de Gongora galeata (Lindl.) Rchb. f. se ha documentado, además, la presencia de flores protándricas (Flores et al., 1995; Martini et al., 2003).
Dressler (1968a, b; 1993) sugiere que el género presenta, dentro de las orquídeas u otras especies de plantas con flores polinizadas por insectos, uno de los mecanismos más seguros para evitar la autopolinización y geitonogamia. Lo anterior se basa en el argumento de que la transición de la función sexual masculina a la función femenina se desencadena cuando el polinario es removido de la flor en este género de orquídeas (Dressler, 1968a, b, 1993; Flores et al., 1995). Esta afirmación se apoya en los modelos tradicionales que mencionan que la función primordial de las flores es promover el entrecruzamiento (Darwin, 1876; Lloyd y Webb, 1986; Givnish et al., 2015; Hetherington-Rauth y Ramírez, 2015). Aunado a lo anterior, los estudios empíricos y teóricos basados en la biología de la polinización enfatizan el papel preponderante que juega la disminución del desperdicio de polen (“pollen discounting”) para explicar la evolución de los sistemas reproductivos en plantas (Holsinger, 1991; Johnston, 1998). Específicamente, el desperdicio de polen se entiende como la reducción del éxito reproductivo masculino por entrecruzamiento, el cual se produce cuando se evita que el polen sea exportado a otra planta/individuo diferente (p. ej., ‘pollen discounting’; Holsinger, 1991; Johnston, 1998).
De acuerdo con lo planteado por Dressler (1968a, b; 1993), para este estudio, se buscó trabajar con una especie de orquídea polinizada por abejas euglosinas, en la cual se pudiera poner a prueba el mecanismo floral que evita los efectos de la autopolinización y geitonogamia. En este sentido, Gongora galeata es interesante como modelo de estudio ya que comparte los rasgos de hermafrodismo y dicogamia con otras especies de plantas que no presentan sistemas de polinización especializados (Bertin y Newman, 1993; Charlesworth, 2006). A su vez, la especie presenta atributos florales que típicamente se asocian a sistemas de polinización especializados (p. ej., polinización por abejas euglosinas; Darwin, 1876; Flores et al., 1995). En este sentido, el estudio de la ecología reproductiva de Gongora galeata permite aportar información respecto al funcionamiento de caracteres que están presentes en un gran número de especies (hermafroditismo y dicogamia), pero en contextos altamente especializados (orquídea-abeja), lo que a su vez constituyen temas cruciales dentro de la biología de la conservación.
En lo que se refiere al sistema de polinización de la especie, Euglossa viridissima Friese, 1899 y Euglossa villosa Moure, 1968, han sido reportadas como los visitantes florales de Gongora galeata en Chiapas y Veracruz (Flores et al., 1995; Damon y Salas-Roblero, 2007). El estudio sobre la biología floral y polinización de (Orchidaceae) efectuado por Flores et al. (1995) fue pionero y a la fecha ha sido el único trabajo que ha documentado el mecanismo de polinización en la especie. Por ello, en la presente investigación se planeó continuar con el estudio de Gongora galeata en la misma localidad para aportar información adicional referente a la ecología reproductiva de la orquídea.
Con base en lo anterior, el objetivo principal de este estudio fue caracterizar la ecología reproductiva de Gongora galeata en el centro de Veracruz, México. Para ello, se determinó el despliegue floral, el tiempo de antesis y la longevidad floral, la identidad y comportamiento de los polinizadores, la producción de frutos, así como la transición de la función sexual masculina a la femenina en la flor. La hipótesis de este estudio fue que en Gongora galeata el comportamiento del polinizador determinaría el cambio de la función sexual a través de la remoción del polinario, constituyéndose como un mecanismo que evita la autopolinización y geitonogamia (Dressler, 1968a, b, 1993; Flores et al., 1995).
Materiales y Métodos
Especie de estudio
Gongora galeata es una orquídea epífita que se distribuye en México, y posiblemente en Guatemala, entre 600 y 1800 m de altitud en bosque mesófilo de montaña (Hágsater y Salazar, 1990; Flores et al., 1995; Fig. 1). Sus inflorescencias son basales péndulas que se producen en el pseudobulbo asociado al nuevo brote. Sus flores son hermafroditas con labelo articulado en el pie de la columna, por lo que es móvil como bisagra, mientras que la cavidad estigmática forma una ranura transversal angosta oculta por el rostelo (Hágsater y Salazar, 1990). Florece de mayo a agosto en Soconusco, Chiapas (Damon y Salas-Roblero, 2007) y de julio a septiembre en Coatepec, Veracruz (Flores et al., 1995). El porcentaje de frutos producidos oscila entre 0 y 16% para la zona de Chiapas (Damon y Salas-Roblero, 2007) y 8.5% para la de Veracruz (Flores et al., 1995).
Población de estudio y muestreo
Con base en la información aportada por Flores et al. (1995), se localizó la población de Gongora galeata reportada para el municipio Coatepec, Veracruz, México (19°29'N, 96°59'O, 1450 m s.n.m.; Fig. 2). El área de estudio incluye relictos de bosque mesófilo de montaña en unión con plantíos de café de sombra ubicado a 1188 m s.n.m. La temperatura promedio anual en la zona es de 20 °C, con una precipitación anual que varía entre 1500 y 1900 mm (CNA, 2010).
Figura 2: Localidad de este estudio de Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) en el centro de Veracruz, México. La población se ubicó con la información aportada por Flores et al. (1995).
Se hicieron recorridos al margen de varios ríos secundarios y terciarios en donde se encuentran relictos de vegetación original. El muestreo se inició en el mes de abril en 2017 y 2018, con la finalidad de ubicar los individuos de la especie antes de la floración, y se continuó hasta el mes de diciembre en 2017 y 2018 una vez que terminó la fructificación de la especie. Los árboles en donde se ubicaron las plantas se marcaron con etiquetas numeradas para darles seguimiento. Las orquídeas se encontraron de 5 a 10 metros de altura en las ramas de los árboles.
A través de los datos abiertos e históricos meteorológicos de la base de datos de 1961 a 2018 del Servicio Meteorológico Nacional (CNA, 2010), se estimaron las temperaturas promedio mínimas y máximas para los meses que corresponden al periodo de floración de G. galeata en los años de muestreo reportados por Flores et al. (1995) y los años muestreados en este estudio (Cuadro 1). La selección de las variables de temperatura se basó en estudios previos que han documentado que las orquídeas que habitan en zonas templadas han modificado sus periodos de floración en respuesta a los cambios en la temperatura ambiental (Rafferty e Ives, 2011; Molinár et al., 2012).
Cuadro 1: Valores de temperatura promedio mínima y máxima para el periodo de floración de Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) en el centro de Veracruz, México, con base en los años de muestreo reportados por Flores et al. (1995) y los años muestreados en este estudio. Fuente: Datos abiertos históricos meteorológicos de la base de datos de 1961 a 2018 del Servicio Meteorológico Nacional (CNA, 2010).
| Año | Temperatura (°C) Julio (promedio mínimo-promedio máximo) | Temperatura (°C) Agosto (promedio mínimo-promedio máximo) | Temperatura (°C) Septiembre (promedio mínimo-promedio máximo) |
| 1992 | 15.9-25.9 | 12.12-24.9 | 9.4-24.8 |
| 1993 | 12.7-26.4 | 12.5-26.0 | 11.5-24.7 |
| 2017 | 14.41-27.9 | 14.5-29.3 | 15.6-27.1 |
| 2018 | 13.8-29.9 | 14.1-29.6 | 15.2-29.1 |
Despliegue floral, tiempo de antesis y longevidad floral
Se estudió el despliegue floral (número de inflorescencias y número de flores por planta), el tiempo de desarrollo del botón floral hasta la apertura de la flor (días) y la longevidad floral (días) en 25 individuos de la especie ubicados en plantas diferentes durante dos estaciones reproductivas consecutivas. Por lo tanto, el tiempo de muestreo desde el marcaje de individuos, iniciando en la floración y culminando en la fructificación, fue de abril a diciembre en 2017 y 2018. Para conocer el periodo de floración y el tiempo de desarrollo del botón floral, se marcaron con anillos de plástico tres botones florales por planta a los cuales se les colocó una bolsa de tela tul. Se observó diariamente su desarrollo hasta la apertura de la flor. Una vez abierta, se contaron los días hasta que se marchitó (longevidad floral). Las flores se mantuvieron embolsadas con la finalidad de evitar cambios en la longevidad floral asociados a la visita por parte de los polinizadores.
Se utilizó un Análisis de Supervivencia no paramétrico de Kaplan-Meier para determinar el tiempo que tarda un botón floral en desarrollarse hasta la apertura de la flor (Muenchow, 1986). Dicho método estima la probabilidad de que una flor sobreviva después del inicio de la observación (Muenchow, 1986). Para ello, se registró el inicio de la observación como el tiempo cero (marcaje del botón floral) y el evento subsecuente (apertura de la flor) como días posteriores al inicio de la observación. Si el botón floral alcanzó a desarrollarse y abrir como flor, este evento se determinó como no-censurado, mientras que la aborción del botón floral se consideró como censurado. Con la finalidad de comparar las diferencias en el tiempo de desarrollo del botón floral a flor entre años, se realizó la prueba no-paramétrica de Mantel-Cox (Muenchow, 1986).
Para conocer las diferencias en el número de inflorescencias y en el de flores producidas por planta entre estaciones reproductivas, se utilizaron ANOVAS anidados de una vía (Zar, 1998). En este modelo, el año se consideró como el factor fijo y la planta se anidó al año. La cantidad de inflorescencias y flores producidas por planta, así como la longevidad floral (días) fueron las variables de respuesta. Estas fueron transformadas a raíz cuadrada +0.5 para alcanzar los supuestos paramétricos del análisis (Zar, 1998).
Visitantes florales y producción de frutos
En las 25 plantas marcadas, durante dos estaciones reproductivas consecutivas (2017 y 2018), se realizaron observaciones focales aleatorias de 6:00 a 18:00 horas, para hacer un total de 300 horas de observación por año (Flores et al., 1995). Se registró la hora de llegada del visitante floral y se identificó la especie a la que pertenece. Aunado a lo anterior, se observó el mecanismo de polinización en la orquídea, por medio de un submuestreo cronometrado sobre 30 eventos de visita floral. Específicamente, se registró el comportamiento del visitante floral desde que se aproximó a la orquídea, ingresó y salió de la misma. Al final de la estación reproductiva (diciembre) se cuantificó, por planta, la proporción de flores que produjeron frutos.
Para conocer las diferencias en la proporción de flores que produjeron frutos entre las estaciones reproductivas, se utilizó un ANOVA anidado de una vía (Zar, 1998), donde el año fue el factor fijo y el factor planta se anidó al año (Zar, 1998). La variable de respuesta se transformó a arco-seno raíz cuadrada de la proporción para alcanzar los supuestos paramétricos del análisis (Zar, 1998).
Se utilizó un Análisis de Supervivencia para analizar la probabilidad de que las flores de Gongora galeata fueran visitadas por las abejas euglosinas (Muenchow, 1986). Para ello, el registro del inicio de la observación fue el tiempo cero y los eventos subsecuentes de visita floral como minutos posteriores al mismo. Si la abeja ingresó a la flor se consideró como evento no-censurado, mientras que el acercamiento del visitante floral sin introducirse a la flor como censurado. Se utilizó la prueba no-paramétrica de Mantel-Cox con la finalidad de comparar las diferencias en la probabilidad de visita a las flores de la orquídea entre años (Muenchow, 1986).
La identificación del polinizador se realizó a través de su colecta con trampas hechas de botellas de plástico colgadas en los mismos árboles y adyacentes a las plantas observadas, por lo que se utilizaron como cebo las mismas flores de la orquídea en la botella. Una vez capturada la abeja se siguieron las claves de identificación, descripción y sexo, con base en Hinojosa-Díaz et al (2011) y Engel (2021). Posterior a su identificación, las abejas fueron liberadas sin daño.
Transición de la función sexual masculina a femenina
En una estación de floración y en 15 individuos diferentes se seleccionó al azar, por planta, una inflorescencia. Dentro de ella se eligieron aleatoriamente cuatro flores y se asignaron a los siguientes tratamientos: 1) flor a la que se le remueve el polinario en el primer día de antesis, 2) flor a la que se le remueve el polinario en el segundo día de antesis, 3) flor a la que se le remueve el polinario en el tercer día de antesis y 4) flor intacta como control. La inflorescencia se mantuvo cubierta con bolsas de tela tul con el fin de excluir el posible efecto de los visitantes florales. Las remociones del polinario se hicieron en entre las 7:00 y 8:00 horas y se revisaron/registraron los cambios en el estigma de la flor dos veces al día (tarde y mañana; incluida la revisión del mismo día de la remoción). En el análisis, se consideró la expansión del estigma en el día correspondiente a la vida de la flor (receptividad en la función femenina); también se registró la longevidad floral (días) hasta que la flor se marchitó.
Se utilizaron ANOVAS de una vía para conocer las diferencias en la longevidad floral y en el número de días que tardó el estigma en expandirse (días que tarda en alcanzar la receptividad), con base en el tratamiento empleado (Zar, 1998). La variable de respuesta (días) fue transformada a raíz cuadrada +0.5 para alcanzar los supuestos paramétricos del análisis (Zar, 1998).
Todos los análisis se llevaron a cabo en el paquete estadístico de StatView v. 5.0 y SuperAnova v. 1.11 (Abacous Concepts, 1996, 1989).
Resultados
Despliegue floral, tiempo de antesis y longevidad floral
El periodo de floración de G. galeata se presentó en el mes de septiembre para ambos años muestreados. Del total de botones florales estudiados, 13% fueron abortados por las plantas en 2017 y 8% en 2018. El Análisis de Supervivencia mostró que los botones florales difirieron en su tiempo de desarrollo entre años muestreados. Es decir, los producidos en 2017 se desarrollaron en menor tiempo que los producidos en 2018 (Cuadro 2A, Fig. 3). Una vez alcanzada la apertura de la flor, no hubo diferencias en la longevidad floral entre años muestreados (Cuadro 2A). El factor planta no fue significativo en el modelo (F=0.66, p=0.94).
Cuadro 2: Rasgos florales y ecológicos de Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) en el centro de Veracruz, México. N=tamaño de muestra, E.S.=Error Estándar, * p<0.01, ** p<0.001, *** p<0.0001.
| Rasgo | 2017 | 2018 | Prueba | ||
|---|---|---|---|---|---|
| N | Media±E.S. | N | Media±E.S. | ||
| A) Biología floral | |||||
| Desarrollo del botón floral hasta la flor (días) | 75 | 11.47±0.12 | 75 | 13.84±0.17 | Chi=62.63*** |
| Longevidad floral (días) | 75 | 3.66±0.05 | 75 | 3.72±0.05 | F=0.26 |
| B) Despliegue floral | |||||
| Número de inflorescencias | 25 | 2.2±0.14 | 25 | 2.16±0.13 | F=0.04 |
| Número de flores producidas | 25 | 17.72±0.41 | 25 | 16.80±0.52 | F=1.85 |
| C) Visitantes florales | |||||
| Tiempo de llegada del polinizador (minutos) | 174 | 100.29±3.55 | 188 | 151.89±8.66 | Chi=28.62*** |
| D) Producción de cápsulas | |||||
| Proporción de frutos producidos | 25 | 17.51±0.01 | 25 | 10.27±0.01 | F=25.43*** |
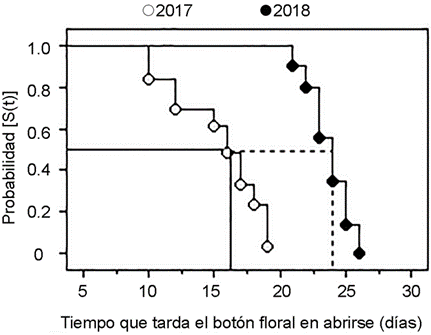
Figura 3: Comparación en el tiempo de desarrollo de los botones florales y su probabilidad de que se desarrollen hasta flor en Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) ubicada en el centro de Veracruz, México. La abreviación S(t) es la probabilidad de que los botones florales no alcancen a desarrollarse y abrir como flor. El tiempo hasta que el botón floral alcanza a abrirse se refiere al intervalo de tiempo desde el inicio de la observación hasta que el evento se presenta. Las líneas continuas indican el número de días promedio en los cuales los botones florales abrieron en 2017. Las líneas punteadas indican el número de días promedio en los cuales los botones florales abrieron en 2018.
Gongora galeata produjo un número similar de estructuras reproductivas entre años, por lo que no se observaron diferencias significativas entre el número de inflorescencias o flores producidas entre años muestreados (Cuadro 2B). El factor planta no fue significativo en el modelo (F=0.35, p=0.90 para número de inflorescencias y F=2.66, p=0.45 para número de flores).
Visitantes florales y producción de frutos
Las flores de Gongora galeata fueron visitadas exclusivamente por abejas euglosinas macho pertenecientes a la especie Euglossa villosa. En total se registraron 348 eventos de forrajeo por parte del insecto a las flores de la orquídea durante 300 horas de observación. La abeja se aproximó a las flores sin visitarla en 14% de las ocasiones (8% en 2017 y 6% en 2018). El Análisis de Supervivencia reveló que el polinizador visitó más temprano las flores en 2017 en comparación con 2018 (Cuadro 2C, Fig. 4).
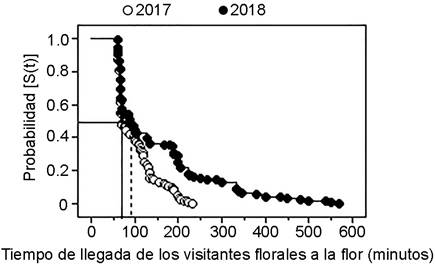
Figura 4: Comparación en el tiempo de llegada de los polinizadores y la probabilidad de que las flores de Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) sean visitadas en el centro de Veracruz, México. La abreviación S(t) es la probabilidad de que las flores no sean visitadas por los polinizadores durante el tiempo de observación. Las líneas continuas indican el tiempo promedio (minutos) que tardaron los polinizadores en visitar las flores de la orquídea en 2017. Las líneas punteadas indican el tiempo promedio (minutos) que tardaron los polinizadores en visitar las flores de Gongora galeata en 2018.
Los individuos macho de Euglossa villosa iniciaron su comportamiento de visita a Gongora galeata al posarse en su pedicelo para alcanzar el labelo de la flor. Por su morfología floral, las abejas hicieron un giro para ingresar, por lo que exponen la parte ventral de su cuerpo hacia arriba. Una vez que la abeja ingresó, y como consecuencia del peso de su cuerpo, el labelo se dobló hacia abajo y la abeja cayó en la columna de la flor (mecanismo de deslizamiento). En este lugar la abeja permaneció entre 20 y 55 segundos forrajeando la flor (N=30 registros de visita cronometrados). La abeja fue mantenida en la misma posición por la disposición de los pétalos de la flor a los lados de la columna (morfología floral). Posterior a su actividad de forrajeo, al salir, la abeja tocó primero el estigma de la flor y posteriormente la antera con el tórax, por lo que el polinario se le depositó sobre el escutelo. Si la abeja lleva un polinario adherido al cuerpo, lo deposita en el estigma de la flor cuando esta se encuentra en fase pistilada (con estigmas abiertos). No obstante, es posible que el polinario se adhiera al estigma cerrado de la flor durante la actividad de forrajeo de la abeja (2%). Las abejas portaron más de un polinario (24%) y el polinario también llegó a depositarse debajo de las alas de las abejas (15%).
Las abejas visitaron de tres a siete flores por planta de manera consecutiva (promedio ±Desviación Estándar; 4.4±1.35, N=25). Las visitas realizadas por parte de Euglossa villosa a la orquídea se tradujeron en una menor producción de frutos en 2018 en comparación con 2017 (Cuadro 2D). El factor planta no fue significativo en el modelo (F=1.56, p=0.57).
Transición de la función sexual masculina a femenina
La remoción del polinario durante el primero y segundo día aceleró la apertura del estigma (de 24 a 12 horas). La remoción del polinario en el tercer día propició la apertura del estigma durante las siguientes 12 horas (Fig. 3). Las flores que permanecieron intactas (control) expandieron su estigma en el tercer día aún con el polinario adherido a sus anteras (Fig. 5).

Figura 5: Longevidad floral y expansión del estigma (días) por tratamiento de remoción del polinario en flores de Gongora galeata (Lindl.) Rchb. f. (Orchidaceae) en el centro de Veracruz, México. Los tratamientos corresponden a: 1) flor a la que se le remueve el polinario en el primer día de antesis, 2) flor a la que se le remueve el polinario en el segundo día de antesis, 3) flor a la que se le remueve el polinario en el tercer día de antesis y 4) flor intacta, control.
Discusión
Biología reproductiva de Gongora galeata
La orquídea fue visitada exclusivamente por individuos macho de Euglossa villosa en la población de estudio y durante el periodo muestreado. Lo anterior denota un sistema de polinización altamente especializado en la orquídea.
Gongora galeata produjo un número similar de flores distribuidas en dos inflorescencias por planta, que no difirió entre estaciones reproductivas. No obstante, la floración se presentó de corta duración y sesgada al final del periodo de floración con respecto a lo reportado por Flores et al. (1995). Aunado al desplazamiento en el tiempo de floración, se observó una presentación diferencial de las flores en el tiempo y entre estaciones reproductivas, lo cual a su vez se relacionó con el tiempo de desarrollo de la flor. Es decir, el cambio en el tiempo de desarrollo del botón floral propició que las flores de Gongora galeata abrieran antes en 2017 con respecto a 2018.
En la orquídea Gongora quinquenervis las flores tardaron en desarrollarse 22 días (15 a 29 días) y abrieron de forma sincrónica según Martini et al. (2003). En contraste, las flores de Gongora galeata abrieron de forma asincrónica en ambos periodos de estudio y el tiempo de desarrollo de la flor fue ligeramente menor al reportado por Martini et al. (2003) para Gongora quinquenervis. Rodríguez-Robles et al. (1992) reportan que la orquídea epífita Comparettia falcata Poepp. & Endl. produjo despliegues florales pequeños, pero con una producción secuencial de flores a lo largo del tiempo y la asincronía en la producción de flores se tradujo en una producción de frutos de 17 a 19%. Para Gongora galeata, el tiempo de floración (septiembre) y la asincronía en la producción de las flores propició una proporción de frutos que osciló entre 10 y 17%. Aunque estos valores se encuentran dentro del rango de cápsulas producidas por la especie en Chiapas, superan los reportados previamente para la población en la localidad (0-16% producción de frutos en Chiapas (Damon y Salas-Roblero, 2007) y 8% producción en Veracruz (Flores et al., 1995)).
Los datos meteorológicos históricos de la base de datos de 1961 a 2018 del Servicio Meteorológico Nacional (CNA, 2010) mostraron que se han presentado variaciones de cuando menos 1 °C en los valores promedio mínimos y máximos de temperatura durante la estación de floración de la orquídea. Si bien no es posible establecer una relación de causalidad entre los cambios en la temperatura y los cambios en la fenología de la floración de Gongora galeata, es evidente que la orquídea aceleró y completó el desarrollo de sus flores de manera anticipada en 2017. Estos cambios en la fenología de la floración (tiempo de desarrollo del botón floral e inicio de la floración) parecen repercutir en el comportamiento de los polinizadores. Es decir, los polinizadores tardaron más tiempo en visitar (encontrar) las flores de la orquídea cuando esta floreció de manera tardía en 2018 con respecto a la estación reproductiva anterior.
Al respecto, Rafferty e Ives (2011) han observado que las especies de plantas que históricamente han modificado su periodo de floración son capaces de mantener las visitas de sus polinizadores. Estos autores consideran que las relaciones preexistentes entre las plantas y sus polinizadores promueven el seguimiento de los polinizadores a los cambios en la floración para algunos sistemas de polinización especializados (Rafferty e Ives, 2011). Para el caso de Gongora galeata, el desplazamiento en el tiempo de floración y apertura del botón floral ocurrió dentro del periodo reproductivo originalmente reportado para la especie y localidad (Flores et al., 1995). Por lo tanto, es de esperar que la relación preexistente entre la orquídea y su polinizador pudiera responder sin problemas a este desplazamiento en el periodo de floración. No obstante, un desplazamiento mayor de la floración de Gongora galeata pudiera propiciar el desajuste entre el encuentro de las flores y la presencia del polinizador en el sitio de estudio.
Con base en los resultados obtenidos, es de suponerse que las abejas potencialmente tardaron más tiempo en encontrar las flores de la orquídea cuando esta floreció de manera tardía. Molinár et al. (2012) observaron que 56% de las especies de orquídeas terrestres de Europa adelantaron su periodo de floración, 23% de las especies la retrasaron y 21% de las especies presentaron su periodo de floración sin cambio con respecto a las condiciones climáticas. En su análisis, las orquídeas autógamas y polinizadas por engaño son las que exhibieron cambios en su periodo de floración, mientras que orquídeas de vida corta y productoras de néctar, las que menos muestran cambios con respecto al clima (Molinár et al., 2012). Lo anterior se considera de importancia cuando se involucran relaciones de alta dependencia y que repercuten directamente en el éxito reproductivo de las plantas (Rafferty e Ives, 2011; Molinár et al., 2012).
Para el caso de Gongora galeata, estudios experimentales y a largo plazo sobre la floración de la orquídea y la dinámica poblacional de su abeja polinizadora permitirán conocer si el sistema Gongora galeata - Euglossa villosa es capaz de adaptarse a un cambio mayor en la fenología de la floración de la orquídea, lo que a su vez repercutiría en la conservación de este tipo de sistemas de polinización altamente especializados. Aunado a lo anterior, el presente estudio sugiere vías futuras de investigación relacionadas con las variaciones en las condiciones climáticas y la fenología de la floración de la orquídea.
Tradicionalmente la región tropical se ha considerado como un ambiente estacionalmente estable, por lo que ha favorecido procesos de adaptación, diversificación y evolución de interacciones del tipo de polinización especializada (Givnish et al., 2015; Hetherington-Rauth y Ramírez, 2015). Los resultados obtenidos en este estudio destacan la importancia de reconocer que las regiones tropicales no están exentas de experimentar variaciones en sus condiciones climáticas y cambios en la fenología floral de las plantas. Por ello, estos ambientes no deben excluirse de las agendas de investigación dirigidas a conocer los efectos del cambio climático global sobre la biodiversidad y su funcionamiento.
Mecanismo de polinización, fenología floral y sus implicaciones para el funcionamiento del sistema protándrico y especializado en la especie
La polinización de las flores de G. galeata se presenta a través del mecanismo conocido como “desplazamiento”, el cual se considera ancestral en el género Gongora y que favorece la deposición del polinario en el escueto de la abeja (Dressler, 1968a; Flores et al., 1995; Hetherington-Rauth y Ramírez, 2015). Si bien este mecanismo favorece la adhesión del polinario en el cuerpo de la abeja (y su acumulación), también es posible que se adhieran algunos polinarios debajo de las alas de las abejas. Al respecto, Martini et al. (2003) describen un fenómeno similar en la abeja Eulaema cordata Linnaeus, 1758, la cual comúnmente acumula polinarios de Gongora quinquenervis y exhibe comportamientos de acicalamiento para eliminar los polinarios que son adheridos a las patas del insecto. Lo anterior denota que para ambas especies de Gongora se presenta un sistema de polinización altamente especializado para atraer a sus polinizadores (p. ej., químicos volátiles; Dressler, 1968a, b, 1993; Martini et al., 2003; Adachi et al., 2015). No obstante, se presenta una discordancia entre la morfología floral y el cuerpo/comportamiento de la abeja, que repercute en la eficiencia del polinizador para colectar el polinario de las anteras en una parte óptima de su cuerpo.
En este estudio se realizaron observaciones a detalle del comportamiento de varios individuos de Euglossa villosa en la orquídea, por lo que fue posible documentar que en el sistema de interacción entre Gongora galeata con su abeja polinizadora se presentan riesgos de desperdicio de polen (p. ej., “pollen discounting”; Holsinger, 1991; Johnston, 1998). El desperdicio de polen se presenta en un primer momento cuando el polinario se adhiere en un lugar del cuerpo de la abeja que impide que el conjunto de gametos masculinos pueda ser depositado en el estigma de las flores. Este fenómeno parece no ser insignificante cuando se contabilizó en 15% del total de eventos de forrajeo observados.
Dressler (1968a, b; 1993) sugiere que el comportamiento de las abejas euglosinas en las flores de Gongora propicia la remoción del polinario, el cual a su vez desencadena la receptividad del estigma. Debido a esta secuencia de eventos, se ha reconocido que el género Gongora representa uno de los sistemas más seguros para evitar la autopolinización y geitonogamia dentro de las orquídeas (Dressler, 1968a, b, 1993; Flores et al., 1995). En este estudio se observó que las flores de Gongora galeata presentaron una longevidad floral de 3-4 días, iniciando en fase estaminada, para posteriormente desarrollar la fase pistilada (expansión de los lóbulos del estigma; sistema protándrico). Martini et al. (2003) documentan una longevidad floral y cambio de la función sexual similar para Gongora quinquenervis (cuatro días de longevidad floral, iniciando en fase estaminada para posteriormente cambiar a fase pistilada). Para Gongora galeata el cambio en la fase sexual de las flores ocurrió entre el segundo y/o tercer día de la vida de la flor, independientemente de la presencia de los polinarios. Es decir, la remoción de los polinarios aceleró el cambio en la fase sexual en las flores de la orquídea, pero este cambio no estuvo supeditado a la remoción de los polinarios. De manera similar, Martini et al. (2003) mencionan que las flores de Gongora quinquenervis inician en fase estaminada y la receptividad del estigma se desencadena un día después de la antesis de la flor independientemente de la remoción del polinario. Lo anterior denota que para ambas especies de Gongora el mecanismo de transición de la función sexual masculina a la femenina no está determinada por la remoción del polinario en la flor (Gongora quinquenervis (Martini et al., 2003) y Gongora galeata (este estudio)).
Desde el punto de vista de la orquídea el cambio inherente (proceso interno) en la función sexual de la flor le confiere cierta ventaja, ya que una sola visita por parte del polinizador podría asegurar el cumplimiento de ambas funciones sexuales en la flor. Es decir, la fase pistilada estaría activa para una flor de tres días de edad que, en el caso de no haber sido visitada, tendría a su vez el polinario adherido a la antera. Si esta flor es visitada por una abeja cargada con algún polinario, la abeja lo depositaría en el estigma abierto de la flor (función femenina receptiva) y al momento de salir lo colectaría de la misma flor (función masculina). De esta manera se lograría el cumplimiento de ambas funciones sexuales en la flor con una sola visita por parte del polinizador.
Este planteamiento es relevante cuando se toma en consideración la información que se tiene respecto a la historia natural de las orquídeas. Diversos autores han observado que las orquídeas tropicales y no-nectaríferas exhiben una baja producción de frutos debido a problemas de limitación de polen (baja frecuencia de visita de los polinizadores), en comparación con las orquídeas de climas templados y nectaríferas (revisado por Neiland y Wilcock, 1998). Para Gongora galeata, una potencial respuesta adaptativa a los problemas de limitación de polen pudiera estar asociada a esos cambios inherentes en la función sexual de la flor. Dada la importancia de este fenómeno, actualmente se encuentra en curso una investigación que aborda a detalle el tema de la limitación de polen para la producción de frutos en la especie.
Dressler (1968, b; 1993) y Flores et al. (1995) sugieren que el diseño de las flores, en unión con el comportamiento de los polinizadores, evitaría los riesgos de autopolinización y geitonogamia en las flores del género Gongora. A reserva de investigar el sistema de compatibilidad de Gongora galeata, que evitaría la autofertilización por mecanismos diferentes a los relacionados con el comportamiento del polinizador, en este estudio se observó un sistema efectivo que evita la autofertilización en la orquídea. Lo anterior está asociado a que las abejas tocan primero el estigma y posteriormente la antera de la flor. No obstante, este mecanismo solo funciona a nivel de flor, pero no evita el movimiento de gametos masculinos entre flores diferentes dentro de una misma planta (geitonogamia). Aunado a esto, las abejas visitan varias flores por planta, por lo que se presenta un segundo momento de desperdicio de polen (“pollen discounting”), el cual se pierde en visitas subsecuentes a otras flores de la misma planta en lugar de ser exportado a otra planta diferente (Holsinger, 1991; Johnston, 1998). Derivado de estos resultados se rechaza la hipótesis de este trabajo, en la cual se esperaba que el comportamiento del polinizador determinara el cambio de la función sexual a través de la remoción del polinario, constituyéndose como un mecanismo que evita la autopolinización y geitonogamia en Gongora galeata (Dressler, 1968a, b, 1993; Flores et al., 1995).
El cambio en la función sexual de las flores, desencadenado por la remoción del polinario, se ha citado como el mecanismo más efectivo y simple para evitar la autopolinización de la flor (Lloyd y Webb, 1986). No obstante, este dispositivo ha sido raramente observado en la naturaleza (Webb, 1985; Lloyd y Webb, 1986).
Para las flores hermafroditas, la separación del polen y el estigma de las flores a nivel temporal (dicogamia) o espacial (hercogamia) se configuran como rasgos florales comunes y ampliamente distribuidos en los distintos linajes de plantas que promueven el entrecruzamiento y/o disminuyen la interferencia sexual (Lloyd y Webb, 1986). Para sistemas altamente especializados en los cuales el polen es limitante, la autopolinización puede traducirse en una garantía reproductiva que evite que esas especies lleguen a un callejón sin salida en términos evolutivos (p. ej., ‘reproductive assurance’; Shivanna, 2015).











 nueva página del texto (beta)
nueva página del texto (beta)




