Introducción
Las cucurbitáceas tienen un alto valor económico en México debido a su consumo interno y exportación. La derrama económica que se genera por esta última es de más de 755.5 millones de dólares (SIAP, 2020). Los cultivos de cucurbitáceas son susceptibles a numerosas enfermedades que repercuten sobre su valor comercial y rendimiento. Una de las más comunes y severas es la cenicilla (Pérez-García et al., 2009; Lebeda et al., 2018); su agente causal es el hongo fitopatógeno Podosphaera xanthii (Castagne) U. Braun & Shishkoff (Erysiphaceae, Erysiphales, Ascomycota; Fig. 1), el cual predomina en las cucurbitáceas en México (Félix-Gastélum et al., 2005; Bojórquez-Ramos et al., 2012; León de la Rocha et al., 2020; Gregorio-Cipriano et al., 2022).

Figura 1: Cenicilla causada por Podosphaera xanthii (Castagne) U. Braun & Shishkoff infectando hojas de calabaza (Cucurbita pepo L.).
Podosphaera xanthii es un hongo heterotálico (McGrath, 1994; Pirondi et al., 2015), pero la fase sexual (teleomorfo), reconocida por la presencia de casmotecios, solo se ha observado esporádicamente en algunas regiones del mundo (McGrath, 1994; Vakalounakis y Klironomou, 1995; Bardin et al., 1997; Pirondi et al., 2015). En México, se ha registrado únicamente en ejemplares recolectados en cultivos de Cucurbita spp. y Cucumis sativus L. en el Valle del Fuerte y el Valle de Culiacán, Sinaloa (Félix-Gastélum et al., 2005; Bojórquez-Ramos et al., 2012) y en Tehuacán, Puebla (León-De la Rocha, 2020). En Sinaloa, se recolectaron muestras de P. xanthii infectando otras especies de Cucurbitaceae (Cucumis melo L. (melón), Cucurbita foetidissima Kunth (meloncillo silvestre), Citrullus lanatus (Thunb.) Matsum. & Nakai (sandía) y Lagenaria siceraria (Molina) Standl. (bule)), pero ninguna presentó el teleomorfo (Félix-Gastélum et al., 2005). De manera similar, se ha reportado la ausencia de casmotecios en 90 especímenes de P. xanthii recolectados en 13 especies de cucurbitáceas en tres regiones de México (Gregorio-Cipriano et al., 2022). La escasa reproducción sexual en P. xanthii se ha atribuido a la ausencia de uno de los dos tipos de compatibilidad (TC) necesarios para la reproducción sexual o a su proporción desigual (Brewer et al., 2011; Gadoury et al., 2010; Wolfenbarger et al., 2015).
La recombinación sexual en hongos fitopatógenos es importante para su adaptación y para la creación de nuevas combinaciones de alelos virulentos o resistentes a fungicidas, lo que representa un mayor riesgo para los cultivos (McGrath et al., 1996; McDonald y Linde, 2002). En algunos hongos, la estructura sexual puede ayudar a su supervivencia durante la ausencia del hospedante; especialmente en hongos patógenos biótrofos como P. xanthii (Wolfenbarger et al., 2015). En los Ascomycota filamentosos, como P. xanthii, la reproducción sexual está controlada por un solo locus regulador para el tipo de apareamiento o compatibilidad y es denominado MAT1 (Glass et al., 1990). Este locus consta de dos secuencias de ADN alternativas (MAT1-1 y MAT1-2) conocidas como idiomorfos en lugar de alelos, debido a que sus nucleótidos no están claramente relacionados por estructura o descendencia común (Metzenberg y Glass, 1990; Turgeon y Yoder, 2000). Estos idiomorfos se identifican por la presencia de dominios conservados que regularmente codifican dos factores de transcripción denominados MAT1-1-1 y MAT1-2-1 (Becker et al., 2015).
El locus MAT1 en Erysiphales se estudió por primera vez a partir de la secuencia genómica de un aislado de Blumeria graminis (DC.) Speer con el idiomorfo MAT1-2 (Spanu et al., 2010). Posteriormente, Brewer et al. (2011) describieron ambos idiomorfos (MAT1-1 y MAT1-2) para Erysiphe necator Schwein. y diseñaron oligonucleótidos degenerados para amplificar los genes de los factores de transcripción MAT1-1-1 y MAT1-2-1, lo cual ha facilitado la identificación de los TC en otras especies de Erysiphales.
Se han diseñado oligonucleótidos específicos para amplificar los dos idiomorfos de P. xanthii: los pares de oligonucleótidos aboxF2/aboxR2 amplifican el gen MAT1-1-1 y hmgF2/hmgR2 el gen MAT1-2-1 (Pirondi et al., 2015). El TC se determina con una PCR múltiple. Los productos generados se discriminan uno del otro en una electroforesis, debido a que son diferentes en tamaño: MAT1-1-1=167 pares de bases (pb) y MAT1-2-1=228 pb (Pirondi et al., 2015). Es una técnica sencilla para conocer la distribución de los TC en poblaciones de P. xanthii, la cual se utilizó en este estudio con el objetivo de corroborar si la ausencia de casmotecios en P. xanthii se debe a la falta o a una baja proporción de uno de los tipos de compatibilidad. Para abordar esta pregunta se determinó la distribución de los genes MAT1-1-1 y MAT1-2-1 en poblaciones infectando especies de cucurbitáceas (cultivadas y silvestres) en diferentes localidades de Veracruz, México.
Materiales y Métodos
Obtención de muestras
Durante abril de 2021 se realizó un muestreo dirigido para recolectar hojas con signos de cenicilla en tres parcelas con cultivos de calabaza zucchini (Cucurbita pepo L.) en el municipio Emiliano Zapata, Veracruz, México. De cada parcela se obtuvieron entre 10 y 20 hojas, con diferentes etapas de infección, tratando de cubrir todo el campo de cultivo (Fig. 2; Cuadro 1).

Figura 2: Localidades (municipios) de recolectas de especímenes de Podosphaera xanthii (Castagne) U. Braun & Shishkoff. Mapa elaborado por Aline G. Ruiz Cázares.
Cuadro 1: Muestras de ADN de Podosphaera xanthii (Castagne) U. Braun & Shishkoff provenientes de diferentes localidades de Veracruz, México, y las frecuencias detectadas en los genes MAT1-1-1, MAT1-2-1 o ambos. C. o. subsp. martinezii = Cucurbita okeechobeensis subsp. martinezii; P1, P2 y P3 = Parcela 1, 2 y 3.
| Hospedante | Municipio | Estación | Año | Muestras | MAT1-1-1 | MAT1-2-1 | Ambos |
| Cucumis sativus L. | Actopan | Invierno | 2018 | 4 | 0 | 0 | 4 |
| Cucurbita ficifolia Bouché | Yecuatla | Verano | 2020 | 3 | 0 | 0 | 3 |
| C. moschata Duchesne | Chiconquiaco | Verano | 2019 | 2 | 1 | 0 | 1 |
| C. moschata | Coacoatzintla | Invierno | 2020 | 2 | 2 | 0 | 0 |
| C. moschata | Coatepec | Verano | 2019 | 2 | 2 | 0 | 0 |
| C. moschata | Colipa | Verano | 2019 | 2 | 2 | 0 | 0 |
| C. moschata | Coscomatepec | Verano | 2019 | 2 | 2 | 0 | 0 |
| C. moschata | Huatusco | Verano | 2019 | 2 | 1 | 0 | 1 |
| C. moschata | Naolinco | Verano | 2019 | 2 | 1 | 0 | 1 |
| C. moschata | Naolinco | Invierno | 2020 | 2 | 2 | 0 | 0 |
| C. moschata | Tlaltetela | Verano | 2019 | 2 | 2 | 0 | 0 |
| C. moschata | Xalapa | Verano | 2018 | 2 | 0 | 1 | 1 |
| C. moschata | Xalapa | Otoño | 2018 | 4 | 0 | 3 | 1 |
| C. moschata | Yecuatla | Verano | 2019 | 2 | 1 | 0 | 1 |
| C. o. subsp. martinezii (L.H. Bailey) Walters & Deck.-Walt. | Coscomatepec | Verano | 2019 | 2 | 0 | 0 | 2 |
| C. o. subsp. martinezii | Huatusco | Verano | 2019 | 4 | 0 | 2 | 2 |
| C. o. subsp. martinezii | Xalapa | Verano | 2018 | 8 | 0 | 6 | 2 |
| C. o. subsp. martinezii | Xalapa | Otoño | 2018 | 4 | 0 | 4 | 0 |
| C. o. subsp. martinezii | Xalapa | Invierno | 2019 | 2 | 0 | 2 | 0 |
| C. o. subsp. martinezii | Jilotepec | Invierno | 2020 | 1 | 0 | 1 | 0 |
| Cucurbita pepo L. | Emiliano Zapata P1 | Primavera | 2021 | 22 | 0 | 2 | 20 |
| C. pepo | Emiliano Zapata P2 | Primavera | 2021 | 12 | 0 | 4 | 8 |
| C. pepo | Emiliano Zapata P3 | Primavera | 2021 | 14 | 0 | 6 | 8 |
| C. pepo | Xalapa | Verano | 2018 | 4 | 0 | 0 | 4 |
| C. pepo | Xalapa | otoño | 2019 | 1 | 0 | 1 | 0 |
| C. pepo | Xalapa | Invierno | 2020 | 3 | 0 | 2 | 1 |
| C. radicans Naudin | Coatepec | Verano | 2019 | 2 | 0 | 0 | 2 |
| Cucurbita sp. | Coatepec | Invierno | 2018 | 2 | 0 | 0 | 2 |
| Total | 114 | 16 | 34 | 64 |
Se hicieron preparaciones microscópicas (Zeiss, K7, Jena, Alemania) para identificar y confirmar que todas las hojas estuvieran infectadas por P. xanthii. Los datos morfológicos (Fig. 3) se compararon con las descripciones publicadas en el manual taxonómico de Erysiphaceae de Braun y Cook (2012). Además, se incluyeron 66 especímenes de P. xanthii previamente recolectados e identificados (Gregorio-Cipriano, 2022; Gregorio-Cipriano et al., 2022) que se detallan en el Cuadro 1.
Identificación de los tipos de compatibilidad
Extracción de ADN, amplificación por PCR y secuenciación
Se obtuvieron 114 muestras de ADN (Fig. 2; Cuadro 1). Sesenta y seis correspondieron a especímenes previamente recolectados (Gregorio-Cipriano, 2022; Gregorio-Cipriano et al., 2022) y 48 a las hojas provenientes de las tres parcelas muestreadas. De cada hoja se seleccionó una lesión de cenicilla (>1cm2) para la extracción de ADN. Cada lesión se cortó y se colocó en un tubo de microcentrífuga de 1.5 ml. Se agregaron 400 μl de buffer de extracción del kit comercial DNeasy® Plant Mini Kit (50) de QIAGEN (Düsseldorf, Alemania) y se agitaron en un vórtex Thermolyne (Dubuque, Iowa, EUA) durante 20 s para liberar micelio, conidióforos y conidios. Posteriormente, la suspensión se trasfirió a un tubo nuevo. La extracción se realizó siguiendo las especificaciones del proveedor. Para 11 muestras de las 66 recolectadas con anterioridad, el micelio, conidióforos y conidios se recuperaron haciendo un raspado con la ayuda de un pincel estéril para colocarse en un tubo con 400 μl del buffer de extracción y siguiendo el procedimiento anterior. Las 55 muestras de ADN restantes se obtuvieron siguiendo la metodología descrita por Gregorio-Cipriano et al. (2020).
Los idiomorfos de las 114 muestras de P. xanthii se identificaron con una PCR múltiple usando los oligonucleótidos específicos para los genes del factor de transcripción de cada idiomorfo: aboxF2/aboxR2 (gen MAT1-1-1, de 167 pb) y hmgF2/hmgR2 (gen MAT1-2-1, de 228 pb). Las reacciones de PCR se llevaron a cabo en un termociclador Eppendorf (Hamburgo, Alemania), en un volumen de 25 μl. Para la reacción se usaron los siguientes reactivos: 0.125 µl de Flexi Go Taq polimerasa Promega® (5U/µl), 5 µl de Go Taq® Flexi Buffer Promega (5×) (Madison, Wisconsin, EUA), 3 µl de MgCl2 (25mM), 0.5 µl dNTPs (10mM), 1 µl de cada oligo (10µg/ml), 5-30 ng de muestra de ADN. Las condiciones de PCR consistieron en una desnaturalización inicial de 95 °C por 3 min, seguido por 35 ciclos a 95 °C por 30 s, 52 °C por 30 s y 72 °C por 60 s, y una extensión final a 72 °C por 5 min (Pirondi et al., 2015). Los productos de PCR se separaron en gel de agarosa al 2.0% en 0.5 × TBE buffer, teñido con bromuro de etidio y se visualizaron bajo luz UV.
Para comprobar que las amplificaciones correspondían a los idiomorfos de P. xanthii, se seleccionaron y secuenciaron dos de los productos de PCR obtenidos de MAT1-1-1 y dos de MAT1-2-1. La secuenciación se realizó siguiendo los procedimientos previamente descritos por Gregorio-Cipriano et al. (2020, 2022). Se corroboró la afinidad de las secuencias obtenidas con las secuencias del MAT1-1-1 (KJ438825, HQ171903) y MAT1-2-1 (KJ438826, HQ171900) de P. xanthii disponibles en GenBank mediante el algoritmo BLASTn (NCBI, 2021).
Análisis estadísticos
La frecuencia de ambos TC se determinó por campo de cultivo, hospedante, época y año de colecta usando Excel (Microsoft, 2021). Para establecer si existen diferencias significativas en las frecuencias obtenidas de los genes MAT1-1-1 y MAT1-2-1 por parcela, hospedante y época o año, el análisis se realizó con la prueba Chi-Cuadrada (χ2) y Permutación de Monte Carlo (MCP), utilizando el software PAST v. 4.10 (Hammer et al., 2001).
Resultados
Identificación de tipos de compatibilidad
En las 114 preparaciones microscópicas de P. xanthii hubo ausencia de casmotecios. De las muestras de ADN, 64 amplificaron los dos genes; 34 únicamente MAT1-2-1 y 16 solo MAT1-1-1 (Fig. 4; Cuadro 1). En particular, de las 48 muestras obtenidas del municipio Emiliano Zapata con diferentes etapas de infección, 36 presentaron ambos genes y 12 solo MAT1-2-1 (Cuadro 1).
En las tres muestras de ADN provenientes del hospedante Cucurbita ficifolia Bouché (chilacayote) recolectadas en el municipio Yecuatla se observó una banda adicional no identificada de aproximadamente 800 pb (Fig. 4). Las secuencias obtenidas de los genes MAT1-1-1 y MAT1-2-1 resultaron idénticas entre ellas y con las secuencias disponibles en el GenBank (NCBI, 2021), con excepción de una mutación sinónima presente en las secuencias MAT1-2-1. Las secuencias generadas se depositaron en el GenBank con los números de acceso: ON379370, ON379371 para MAT1-1-1 y ON379372, ON379373 para MAT1-2-1.
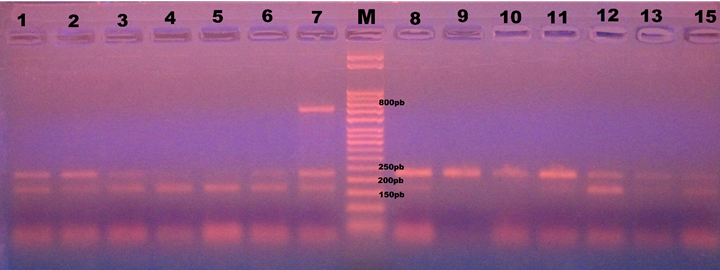
Figura 4: Idiomorfos amplificados con los oligos aboxF2/aboxR2 para el gen MAT1-1-1 (167 pb) y hmgF2/hmgR2 para MAT1-2-1 (228 pb). Amplificación de ambos genes (1-3, 6-8, 12-14); solo de MAT1-1-1 (4, 5), solo de MAT1-2-1 (9-11). En la muestra siete se observa una banda no identificada de aproximadamente 800 pb que presentaron todos los especímenes en Cucurbita ficifolia Bouché.
Análisis estadísticos
En 70% de las muestras de ADN analizadas se observó el gen correspondiente al MAT1-1-1 (80), mientras que el MAT1-2-1 se observó en 85% (98) de las muestras. El análisis χ2. de las frecuencias de MAT1-1-1 y MAT1-2-1 por parcela no detectó diferencias significativas (p=0.659). El radio de distribución de los TC fue cercana a la relación 1:1 en las tres parcelas del municipio Emiliano Zapata. En la Parcela 1, 90% de las muestras presentó MAT1-1-1 y 100% MAT1-2-1; en la Parcela 2, 66% MAT1-1-1 y 100% MAT1-2-1 y en la 3, MAT1-1-1 estuvo en 57% y MAT1-2-1 en 100% (Fig. 5A). Los análisis χ2 de las frecuencias de los TC por época (estación) y año de recolección mostraron que estos factores no influyeron en la frecuencia de un gen u otro (Figs. 5B, C). Por otro lado, el análisis por hospedante mostró que la frecuencia de uno u otro gen depende del hospedante (Fig. 5D). No obstante, esta relación solo fue significativa en Cucurbita moschata Duchesne (calabaza de castilla), la cual presentó una mayor proporción de MAT1-1-1 (p=0.002), mientras que en Cucurbita okeechobeensis subsp. martinezii (L.H. Bailey) Walters & Deck.-Walt. (calabacilla) se presentó una mayor proporción de MAT1-2-1 con un valor p=0.01.
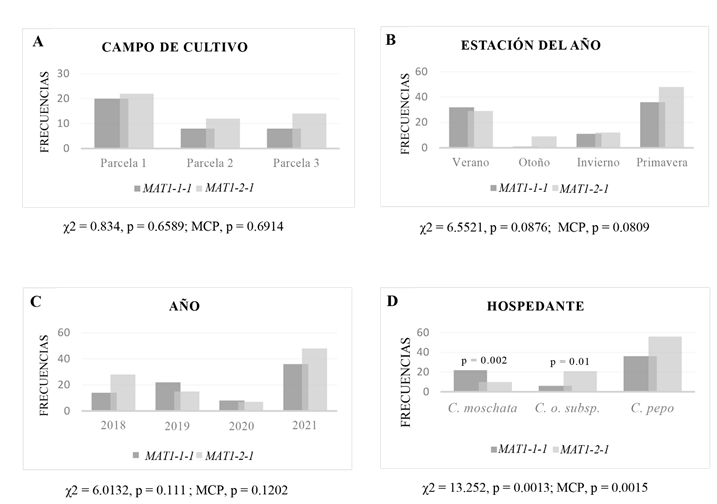
Figura 5: Frecuencias observadas del gen MAT1-1-1 y MAT1-2-1. A. por campo de cultivo en Emiliano Zapata; B. estación del año; C. año de coleta; D. hospedante (solo especies con más de 10 muestras). Debajo de cada gráfica, se indican los valores de significancia estadística (p) obtenidos con la prueba Chi-cuadrada (χ2) y la prueba de Permutación de Monte Carlo (MCP). Encima de las barras de frecuencia se indican solamente los valores estadísticos (p) que fueron significativos.
Discusión
Este estudio evidenció que los dos TC representados por los genes MAT1-1-1 y MAT1-2-1 están presentes en la mayoría de las poblaciones de P. xanthii infectando cucurbitáceas en Veracruz, México. Ambos se encuentran en una proporción cercana al 1:1, a excepción de las asociadas a C. moschata y C. okeechobeensis subsp. martinezii.
En contraste con lo que se ha observado para otras especies de cenicilla (Gadoury et al., 2010; Brewer et al., 2011; Wolfenbarger et al., 2015), la ausencia de casmotecios en los especímenes obtenidos durante este estudio podría no estar influenciada por la falta de uno de los TC. No obstante, en algunas especies de cucurbitáceas como C. moschata y C. okeechobeensis subsp. martinezii sí podría estar afectando, debido a que se encontró una mayor frecuencia de MAT1-1-1 y MAT1-2-1, respectivamente.
La presencia diferencial de los TC dependiendo del hospedante podría ser una explicación de lo que se observó en Sinaloa, pues en la misma región y época del año se encontraron casmotecios en los cultivos de calabaza (Cucurbita spp.) y pepino (Cucumis melo), pero no en bule (Lagenaria siceraria), melón (Cucumis melo), meloncillo (Cucurbita foetidissima) y sandía (Citrullus lanatus) (Félix-Gastélum et al., 2005). En este estudio solo se incluyeron muestras de las dos primeras (calabaza y pepino), y se observó un porcentaje de frecuencia similar de ambos TC. Sería necesario investigar la distribución de los TC en sandía, melón, bule y meloncillo para determinar si este es un factor que determina la ausencia de casmotecios en esos hospedantes en dicha región.
Con lo anterior, solo se podría explicar la ausencia de casmotecios en C. moschata y C. okeechobeensis subsp. martinezii en las localidades investigadas en Veracruz. En el caso de C. pepo, C. sativus y C. ficifolia, en donde los genes MAT1-1-1 y MAT1-2-1 se detectaron en una proporción similar, una explicación viable sería la atribuible a las condiciones ambientales (McGrath, 1994), pero puede deberse a algún otro factor que no se ha considerado y que requiere mayor escrutinio.
En nuestro estudio no se observaron casmotecios a pesar de la presencia de ambos TC en una sola hoja en 64 (56%) de las muestras inclusive en etapas tempranas de la infección, como ocurrió en las tres parcelas distribuidas en el municipio Emiliano Zapata. Esto contrasta con ensayos de cruzamientos in vitro entre ambos TC en P. xanthii que mostraron que en la presencia de ambos TC los casmotecios pueden formarse desde los ocho a nueve días después de la inoculación a 19/23 °C (noche/día) con 12 horas de fotoperiodo, sin necesidad de una estimulación especial de condiciones como temperaturas bajas o senescencia del tejido del hospedante (McGraght, 1994). Asimismo, Bojórquez-Ramos et al. (2012) observaron la formación de casmotecios de P. xanthii en hojas de pepino bajo las condiciones ambientales en invernaderos de Culiacán, Sinaloa, México. En diciembre, los casmotecios fueron abundantes, mientras que en mayo se observó una menor infección y solo en algunas variedades de plantas se formaron casmotecios. La reducción de casmotecios se atribuyó a las altas temperaturas del mes de abril, con máximos de hasta 45 °C, temperatura que superó los límites para el crecimiento de P. xanthii, pues la temperatura ideal para la germinación de los conidios de P. xanthii es 22-28 °C o 15-30 °C, mientras que la de germinación se interrumpe a temperaturas ≤8 °C o ≥35 °C (Trecate et al., 2019). En Norteamérica y Europa los casmotecios de P. xanthii se han observado frecuentemente durante otoño e invierno (McGrath et al., 1996), patrón que no se observó para las poblaciones de Veracruz, a pesar de que se recolectaron muestras durante diferentes estaciones del año.
Este es el primer trabajo en México en el que se exploran los TC de P. xanthii, y aunque se obtuvo evidencia de la presencia de los dos TC necesarios para su reproducción sexual en las poblaciones de Veracruz, en ninguna muestra se observaron casmotecios. Es necesario inspeccionar un número mayor de especímenes con síntomas y signos de cenicilla, y más poblaciones de hospedantes en diferentes épocas de siembra y etapas fenológicas del cultivo, para comprobar la ausencia de casmotecios y determinar el factor o factores que estén impidiendo la formación del estado sexual en esta región. Además, se requiere de un estudio integral en el que se determinen los TC a partir de cultivos monoconidiales; hacer ensayos de apareamiento de aislados con los idiomorfos MAT1-1 y MAT1-2 en diferentes hospedantes y condiciones de humedad relativa y temperatura, así como corroborar si existen diferencias en la tasa de crecimiento de aislados MAT1-1 y MAT2-1 en distintas cucurbitáceas. Estos estudios deberán incluir a la sandía y el melón, dos importantes cultivos en Veracruz que no se incluyeron en esta investigación.











 nueva página del texto (beta)
nueva página del texto (beta)




