Introducción
Las áreas boscosas representan una fuente de alimento, medicina y combustible; además, intervienen en la mitigación del cambio climático, protegen los suelos y el agua, y albergan tres cuartas partes de la biodiversidad terrestre mundial (FAO, 2018 ). Actualmente estos ecosistemas se encuentran amenazados por la intensa deforestación; se estima que tan solo en 2013 se perdieron 2.3 millones de km2 de bosque a nivel mundial (Hansen et al., 2013). En México, de 2005 a 2010 se perdieron 775,000 ha-1 de bosques y selvas (FAO, 2010) . A pesar de esto, el país posee una superficie arbolada de 64.8 millones de hectáreas; de estas, 52% se ubican en áreas templadas donde predominan especies de pinos (López-Hernández et al., 2017). Sin embargo, se estima que a nivel global la deforestación incrementó entre 10 y 20% los gases de efecto invernadero, afectando de forma negativa al planeta (Pacheco et al., 2012; Monjardín et al., 2017).
En México, las especies del género Pinus L. se encuentran ampliamente distribuidas y tienen una enorme importancia ecológica, sociocultural y económica, dado que poseen un alto valor como fuente de leña, pulpa, resina, semillas y madera (Aceves-Rangel et al., 2018). De hecho, son las especies comerciales maderables más utilizadas en el país (Aguilera-Rodríguez et al., 2016). Por ejemplo, de 1993 a 2017 constituyeron 90 y 95% del volumen total aprovechado de la producción forestal de los estados de Durango y Chihuahua, respectivamente (CONAFOR, 2020a, b; Barrera et al., 2021). México, con 72 taxa de Pinus registrados, constituye el segundo centro de diversificación de pinos en el mundo (Perry, 1991). Dentro de ellos destaca Pinus montezumae Lamb., el cual posee una amplia distribución geográfica, resistencia a sequía e incendios (Aceves-Rangel et al., 2018), y es la segunda especie más utilizada en los programas de reforestación y restauración de suelos degradados en los bosques templados mexicanos (Manzanilla-Quiñones et al., 2019).
Las raíces de algunas plantas, entre las que se encuentran los pinos, requieren del establecimiento de asociaciones con hongos mutualistas conocidos como ectomicorrízicos (Horton et al., 1998; Pérez-Moreno y Read, 2004), para poder sobrevivir. En la simbiosis ectomicorrízica, el componente fúngico es denominado micobionte y el componente vegetal, fitobionte. Actualmente se estima que existen de 20,000 a 25,000 especies de micobiontes, principalmente pertenecientes a las divisiones Basidiomycota y Ascomycota, que forman simbiosis ectomicorrízicas con alrededor de 6000 fitobiontes que incluyen angiospermas y gimnospermas (Tedersoo et al., 2010; Comandini et al., 2012). En esta interacción mutualista, el micelio de los hongos penetra los espacios intersticiales de las células corticales de las raíces formando lo que se conoce como red de Hartig (Petersen et al., 2004). En la parte externa de la raíz forma una capa de hifas conocida como manto fúngico y de ahí surge una red micelial externa. Esta red, debido a su tamaño y gran extensión, es capaz de explorar enormes espacios de suelo desde donde los hongos ectomicorrízicos transfieren nutrimentos y agua a sus plantas simbiontes asociadas (Pérez-Moreno y Read, 2004). Adicionalmente las plantas ectomicorrizadas tienen, mediante sus hongos simbiontes, acceso a fuentes orgánicas de nutrimentos inaccesibles para las raíces, a través de la producción de enzimas extracelulares y ácidos orgánicos (Read y Pérez-Moreno, 2003). A cambio, los hongos ectomicorrízicos reciben fuentes carbonadas producidas mediante la fotosíntesis de sus plantas huésped (Leake et al., 2004).
Además de una nutrición mejorada, los hongos ectomicorrízicos proporcionan a sus fitobiontes beneficios adicionales que incluyen protección contra patógenos y factores estresantes ambientales como sequía, baja fertilidad del suelo, incremento de temperatura y presencia de metales pesados o pesticidas (Smith y Read, 2008; Tedersoo, 2017). Por esa razón, las plantas ectomicorrizadas han demostrado un mayor crecimiento y eficiencia cuando son trasplantadas de vivero a campo, y su producción en vivero constituye una estrategia obligada tanto para minimizar el estrés originado por dicho trasplante como para incrementar su supervivencia y crecimiento durante los primeros años, la cual es la fase más crítica de adaptación (Sebastiana et al., 2020). Los hongos ectomicorrízicos inoculados originan efectos benéficos diferenciales en sus plantas simbiontes asociadas. Debido a esto se requiere de un proceso de selección de micobiontes. Adicional a los efectos benéficos en términos de crecimiento y transferencia nutrimental de los árboles hospederos, la comestibilidad de los micobiontes utilizados en la inoculación ectomicorrízica es uno de los criterios de selección antropocéntrica que ha cobrado enorme interés, dado que estos constituyen un recurso forestal no maderable de importancia económica, alimenticia y social, aprovechable en ambientes forestales (Sousa et al., 2015; Pérez-Moreno et al., 2021a, b).
En adición a los efectos benéficos originados por los hongos ectomicorrízicos comestibles en la producción en vivero, más recientemente se ha comprobado que existe un grupo de bacterias, la mayoría incluidas en las denominadas bacterias promotoras del crecimiento vegetal (PGPR, por sus siglas en inglés), que promueven directamente la micorrización o afectan positivamente el funcionamiento de la simbiosis ectomicorrízica a través de mecanismos tales como movilización nutrimental incrementada, mayor crecimiento, fijación de nitrógeno (N) y protección contra patógenos, por lo que se les ha denominado específicamente bacterias auxiliadoras de las micorrizas (MHB, por sus siglas en inglés) (Frey-Klett et al., 2007; Santoyo et al., 2021). Con el advenimiento de las ciencias genómicas, la comprensión de la relevancia de este grupo de bacterias ha sido documentada con mayor profundidad (p. ej., Tarkka et al., 2015; Deveau y Labbé, 2016; Gupta y Chakraborty, 2020; Fitriatin et al., 2021). Dentro de los efectos benéficos registrados por las bacterias auxiliadoras, incluyendo especies de Bacillus Cohn, Mesorhizobium Jarvis, Van Berkum, Chen, Nour, Fernandez, Cleyet-Marel & Gillis y Pseudomonas Migula, están la germinación estimulada de esporas, estimulación del crecimiento vegetal y translocación nutrimental, incremento de tolerancia al estrés, mayor ramificación del micelio o incremento de la micorrización (Marupakula et al., 2017; Reis et al., 2021).
En el presente trabajo se evaluó el efecto de la inoculación con el hongo ectomicorrízico comestible Laccaria laccata (Scop.) Cooke, exclusivamente, y la coinoculación simultánea con dicho hongo y con una de tres cepas bacterianas, una de Cohnella sp., y dos de Azospirillum brasilense Terrand Krieg & Dobereiner (una de ellas fijadora de nitrógeno y la otra solubilizadora de fosfatos), en el crecimiento, fisiología y contenido nutrimental de Pinus montezumae, una especie de gran importancia forestal en México. La hipótesis nula de la investigación fue que ninguna de las bacterias evaluadas originaría efectos benéficos en términos de crecimiento y nutrición de la planta hospedera P. montezumae, cuando fueran coinoculadas con el hongo ectomicorrízico.
Materiales y Métodos
Material biológico
Las semillas de Pinus montezumae utilizadas, provenían de Piedra Canteada, municipio Nanacamilpa, Tlaxcala, México. Los basidiomas del hongo comestible ectomicorrízico Laccaria laccata empleados para la obtención de inóculo provinieron de un bosque de pino del municipio Ozumba, Estado de México, México. Se utilizaron tres cepas bacterianas, una cepa de Cohnella sp. proporcionada por el Laboratorio de Microbiología del Colegio de Postgraduados y aislada de la rizosfera de P. montezumae, con capacidad para producir ácido indolacético y solubilizar fosfatos, y dos cepas de Azospirillum brasilense, proporcionadas por el Laboratorio de Microbiología de Suelos del Centro de Investigación en Ciencias Microbiológicas del Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla, una con capacidad de fijar N y otra con capacidad de solubilizar fosfatos. Las cepas fueron identificadas molecularmente en dichos laboratorios mediante secuenciación de ADNr 16S. La evaluación de las capacidades de producir ácido indolacético, solubilizar fosfatos y fijar N de las cepas utilizadas en este estudio ha sido previamente descrita en detalle (Carcaño Montiel et al., 2006; López-Reyes et al., 2017; Heredia-Acuña et al., 2018).
Diseño experimental y análisis estadísticos
El experimento se diseñó en bloques al azar con tratamientos: A) plantas sin inocular y B) plantas inoculadas con 1) L. laccata (L), 2) Cohnella sp.(C), 3) A. brasilense (FN), 4) A. brasilense (SF), 5) L+C, 6) L+FN y 7) L+SF. Cada tratamiento con siete réplicas, por lo que en total se tuvieron 56 unidades experimentales, cada una constituida por una planta. Los datos de las variables evaluadas se sometieron a un análisis de varianza y prueba de comparación de medias de Tukey (p≤0.05) con el paquete estadístico Statistical Analysis System v. 9.00 (SAS, 2004). Los valores de colonización micorrízica, expresados como porcentajes, se transformaron y se utilizó el logaritmo natural en los análisis de varianza.
Montaje del experimento
Se desinfectaron las semillas con H2O2 al 30% durante 20 minutos. Se obtuvo el inóculo de hongo ectomicorrízico a partir de píleos de L. laccata, los cuales se deshidrataron a 35 °C (deshidratador tipo charola Jersa, Cd. Mx., México). Posteriormente, los píleos se molieron en un molino eléctrico (Thomas Scientific, Modelo 4 Wiley Mill, Swedesboro, Nueva Jersey, EUA), a través de un tamiz de 1 mm de apertura, para obtener un tamaño de partícula homogéneo. El inóculo ectomicorrízico así obtenido se almacenó a 5 °C hasta su utilización. Las cepas bacterianas se cultivaron individualmente en caldo nutritivo Merck y se mantuvieron en movimiento constante a 28 °C hasta alcanzar una concentración de 108 UFC·ml-1. El cultivo bacteriano se centrifugó en una centrífuga (Sigma, Modelo 2-16KL, Osterode am Harz, Alemania) a 7000 rpm y se eliminó el sobrenadante. El concentrado se lavó con agua destilada estéril para eliminar los restos del medio de cultivo y se resuspendió en agua destilada estéril para dejarlo a la misma concentración de 108 UFC·ml-1. Diez días después de la segunda inoculación con el hongo ectomicorrízico, se efectuó una sola aplicación de 3 ml de la suspensión bacteriana a cada planta en las primeras horas del día.
Posteriormente, el experimento se mantuvo durante 420 días en un invernadero del Colegio de Postgraduados, Campus Montecillo, Texcoco, estado de México, México, cerrado sin filtración de aire, control de temperatura ni fertilización adicional. Durante la duración del experimento se regaron las plantas cada tercer día con agua destilada estéril. Las condiciones ambientales durante el transcurso del experimento fueron temperatura media anual 20 °C (9 y 31 °C, mínima y máxima, respectivamente), humedad media anual 47% (23 y 81% mínima y máxima, respectivamente) y fotoperiodo promedio anual de 11.9 h (10.9 y 13.1 h, mínimo y máximo, respectivamente).
El sustrato utilizado consistió en una mezcla de arena, corteza y suelo forestal en una proporción 2:2:1, el cual se esterilizó en tres ocasiones con vapor de agua a una presión de 1.3 kg·cm-2 a 125 °C durante 5 h. Las semillas se sembraron en tubetes de plástico negro de 125 cm3 que contenían el sustrato descrito. Se sembraron tres semillas por tubete forestal para asegurar tener al menos una planta por tubete y 30 días después de la siembra en los tubetes, en los cuales germinó más de una semilla, se dejó solo una planta por tubete. Cada planta se inoculó con una concentración de 107 a 108 esporas de L. laccata determinada con un hematocitómetro (Paul Marienfeld Gmbh & Co., Königshofen, Alemania). Se realizaron dos inoculaciones esporales del hongo: la primera simultáneamente con la siembra de las semillas y la segunda 90 días después de la siembra.
Diámetro y peso seco
Se midió el diámetro del tallo con un vernier digital (Truper, 14388 6 PuLG 15002100, Jilotepec, México) a los 30, 120 y 420 días después de la inoculación bacteriana (ddib) en todas las unidades experimentales. Se pesó la biomasa en siete plantas por tratamiento, seleccionadas al azar, para determinar el peso seco de la raíz, parte aérea y total, deshidratando cada componente por separado, durante tres días a 70 °C hasta lograr peso constante.
Tasa fotosintética
La tasa fotosintética se evaluó 180, 240, 300 y 360 ddib con un analizador de gases infrarrojo (IRGA, PP-Systems, modelo Ciras-3, Amesbury, EUA) y una cámara de asimilación de gases (PPSystems, accesorio original de Ciras-3 CPY-4, Amesbury, EUA) en el mismo invernadero donde se mantuvo el experimento (Colegio de Postgraduados, Campus Montecillo, Texcoco, estado de México, México). La razón por la cual no se efectuó una evaluación al final del experimento fue por limitantes prácticas relacionadas con las condiciones climatológicas. El contenido de clorofila a, b, total y carotenos se determinó 420 ddib por el método de acetona (Zhang, 1986), y la concentración de clorofilas y carotenos se obtuvo mediante las ecuaciones de Lichtenthaler (1987) .
Análisis nutrimental
Los nutrimentos se analizaron con los siguientes métodos: el nitrógeno (N) se determinó por el método de semimicro-Kjeldahl (Bremner, 1965); el fósforo total (P), según Allen et al. (1997) y el potasio (K), calcio (Ca) y Manganeso (Mn) mediante extracción con acetato de amonio por fotometría de llama en un fotómetro de llama (A.KRÜSS Optronic, FP8800, Hamburgo, Alemania). La colonización micorrízica se evaluó mediante las técnicas propuestas por Agerer (1994) y Martínez-Reyes et al. (2012) . Se identificaron con técnicas de microfotografía las estructuras características de la ectomicorriza, como el manto, red de Hartig y micelio externo, en un microscopio óptico (Leica, DM1000, Morrisville, North Carolina, EUA) y uno estereoscópico (Leica, S8APO, Morrisville, EUA). La persistencia del hongo ectomicorrízico L. laccata se comprobó mediante caracterización morfoanatómica de los morfotipos encontrados al final del experimento, característicos que forma este hongo en las raíces micorrizadas. Adicionalmente, se efectuó un re-aislamiento de las bacterias inoculadas en los tratamientos donde habían sido inoculadas y se comprobó su presencia utilizando los mismos métodos moleculares utilizados durante su inoculación.
Resultados
Crecimiento de plantas
Se registró un incremento en el diámetro del tallo de las plantas de P. montezumae coinoculadas con el hongo ectomicorrízico comestible L. laccata y la bacteria Azospirillum brasilense (L+FN) en comparación con las que no se inocularon, o con las inoculadas exclusivamente con el L. laccata (Tukey p≤0.05). Estos resultados fueron más evidentes a partir de los 120 días de la inoculación bacteriana (Fig. 1). En contraste, las plantas inoculadas exclusivamente con cualquiera de las tres bacterias, C, FN y SF, no presentaron diferencias significativas en comparación con aquellas sin inocular (Tukey p≤0.05), durante los tres periodos evaluados (Fig. 1). Adicionalmente, existió un incremento (Tukey p≤0.05) del peso seco total, de raíz y parte aérea en plantas inoculadas con el hongo ectomicorrízico L. laccata y en las coinoculadas con cualquiera de las tres bacterias L+C, L+FN y L+SF, en comparación con las plantas sin inocular. Los mayores incrementos en la parte radical se presentaron en las plantas coinoculadas con L+FN, con un incremento significativo de 7.68 veces más que las plantas sin inocular. El peso seco de las plantas inoculadas exclusivamente con las bacterias no presentó diferencias significativas comparadas con las no inoculadas (Tukey p≤0.05). Se observó un incremento y por lo tanto un efecto sinérgico, en términos de peso seco de parte aérea y total y diámetro del tallo, cuando se coinoculó con el hongo ectomicorrízico y la bacteria FN (Cuadro 1, Fig. 1 ,2A).
Cuadro 1: Peso seco (g) de plantas Pinus montezumae Lamb. inoculadas o coinoculadas con el hongo comestible ectomicorrízico Laccaria laccata (Scop.) Cooke=(L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal, Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner solubilizadora de fosfatos=(SF). Los datos son medias ± error estándar de la media, n=7. Los valores en la misma columna con la misma letra no son diferentes de acuerdo con la prueba de Tukey (p ≤0.05).
| Tratamientos | Raíz | Parte aérea | total |
|---|---|---|---|
| Plantas sin inocular | 0.22±0.02b | 0.26±0.02c | 0.48±0.04c |
| Plantas inoculadas con: | |||
| Laccaria laccata (Scop.) Cooke | 1.51±0.09a | 1.6±0.04b | 3.11±0.09b |
| Cohnella sp. | 0.38±0.05b | 0.34±0.02c | 0.72±0.07c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (FN) | 0.50±0.06b | 0.42±0.04c | 0.92±0.10c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (SF) | 0.44±0.06b | 0.38±0.02c | 0.81±0.07c |
| L+C | 1.53±0.12a | 1.62±0.01b | 3.15±0.12b |
| L+FN | 1.69±0.20a | 2.04±0.11a | 3.73±0.14a |
| L+SF | 1.48±0.12a | 1.71±0.02b | 3.19±0.13b |
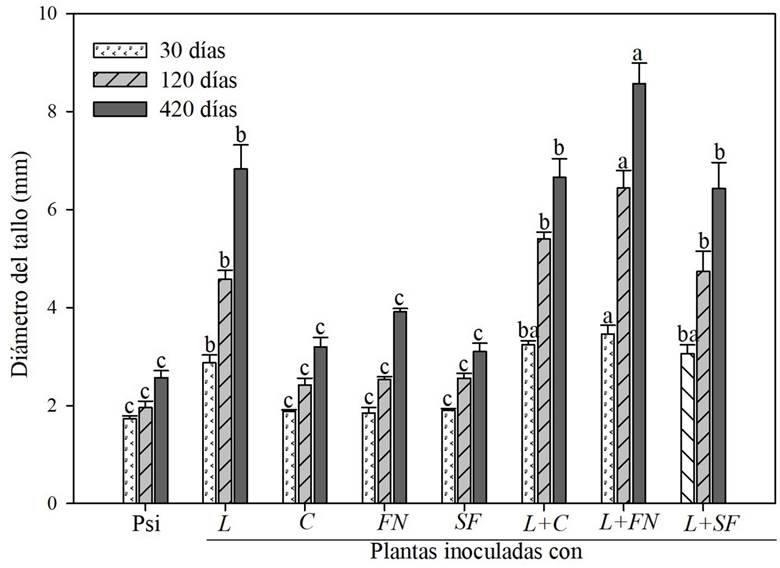
Figura 1: Diámetro de plantas Pinus montezumae Lamb. inoculadas o coinoculadas con el hongo comestible ectomicorrízico Laccaria laccata (Scop.) Cooke (L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal Azospirillum brasilense Terrand Krieg & Dobereiner, fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner, solubilizadora de fosfatos=(SF). Psi=Plantas sin inocular. Los datos son medias ± error estándar de la media, n=7. Los valores en la misma columna con la misma letra no son diferentes de acuerdo con la prueba de Tukey (p≤0.05).

Figura 2: Imágenes generales del experimento. A. efecto de la coinoculación de Pinus montezumae Lamb. con el hongo comestible ectomicorrízico Laccaria laccata (Scop.) Cooke (L) y la bacteria Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN), después de un año, plantas sin inocular y co-inoculadas; B. raíces micorrizadas de P. montezumae con L. laccata; C. morfotipo característico P. montezumae con L. laccata; D. corte transversal de raíz terciaria ectomicorrizada; E. estructuras diagnósticas de una raíz ectomicorrizada, rh=red de Hartig, m=manto, me=micelio externo.
Tasa fotosintética
Después de 180 días de la inoculación bacteriana se registraron diferencias significativas (Tukey p≤0.05) entre tratamientos en términos de la tasa fotosintética. Trescientos sesenta días después de la inoculación bacteriana hubo tendencias claras. Cuando se inoculó exclusivamente con el hongo ectomicorrízico o se coinoculó con cualquiera de las tres bacterias evaluadas (L+C, o L+SF), la tasa fotosintética fue mayor que en las plantas no inoculadas. Se registraron valores 12.9, 12.9 y 14.5 veces más elevados en los tratamientos L, L+C y L+SF, respectivamente, en comparación con las plantas sin inocular. En contraste, cuando se inoculó exclusivamente con cualquiera de las tres bacterias no existieron diferencias en comparación con las plantas sin inocular. Al igual que para el peso seco, se registró un efecto sinérgico cuando se inoculó con el hongo ectomicorrízico y la bacteria fijadora de nitrógeno (L+FN). En este último tratamiento la tasa fotosintética fue 1.85 veces superior en comparación con el tratamiento donde se inoculó exclusivamente con el hongo ectomicorrízico (Cuadro 2).
Cuadro 2: Tasa fotosintética de plantas de Pinus montezumae Lamb. inoculadas o coinoculadas con un hongo ectomicorrízico comestible Laccaria laccata (Scop.) Cooke=(L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal, Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner solubilizadora de fosfatos=(SF). ddib: días después de la inoculación bacteriana. Los datos son medias ± error estándar de la media, n=7. Valores en la misma columna con la misma letra no son diferentes de acuerdo con la prueba de Tukey (p≤0.05).
| Tratamientos | Tasa fotosintética (g CO2 m-2 h-1) | |||
|---|---|---|---|---|
| 180 ddib | 240 ddib | 300 ddib | 360 ddib | |
| Plantas sin inocular | 0.24±0.13b | 0.20±0.03b | 0.17±0.06c | 0.16±0.06c |
| Plantas inoculadas con: | ||||
| Laccaria laccata (Scop.) Cooke | 0.57±0.19b | 2.09±0.38a | 2.28±0.18ba | 2.07±0.08b |
| Cohnella sp. | 0.32±0.10b | 0.39±0.05b | 0.28±0.06c | 0.33±0.06c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (FN) | 0.24±0.06b | 0.43±0.05b | 0.21±0.02c | 0.40±0.06c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (SF) | 0.35±0.04b | 0.49±0.15b | 0.29±0.07c | 0.39±0.09c |
| L+C | 0.92±0.18ba | 1.63±0.08a | 2.13±0.19ba | 2.06±0.12b |
| L+FN | 1.64±0.38a | 2.16±0.16a | 3.66±1.01a | 3.83±0.36a |
| L+SF | 0.54±0.18b | 1.63±0.10a | 1.52±0.17bc | 2.32±0.07b |
Contenido de clorofilas y carotenos
Se observó un incremento significativo (Tukey p≤0.05) en el contenido de clorofila a, en las plantas inoculadas con Laccaria laccata y en las coinoculadas con L+FN, con aumentos de 1.47 y 1.62 veces más, respectivamente, que en las que no se inocularon. Para el caso de la clorofila b, las plantas que presentaron diferencias significativas (Tukey p≤0.05) fueron aquellas inoculadas con L, L+C, L+FN y L+SF, las cuales presentaron incrementos de 1.37, 1.35, 1.60 y 1.34 veces mayores, respectivamente, en comparación con las plantas sin inocular. Las clorofilas totales presentaron diferencias significativas (Tukey p≤0.05), tanto en las plantas inoculadas con L como en las coinoculadas con L+FN (Cuadro 3). En el caso del contenido de carotenos, los valores fueron mayores tanto en el tratamiento inoculado con el hongo ectomicorrízico, como en el coinoculado con L+C y L+FN. En contraste, las plantas inoculadas exclusivamente con cualquiera de las tres bacterias (C, FN y SF) no presentaron diferencias significativas, en términos de clorofilas o carotenos, al ser comparadas con las plantas sin inocular. Al igual que para las variables de crecimiento y de contenido de clorofila hubo un efecto sinérgico cuando se coinoculó con L+FN, siendo los valores 1.13 veces mayores que los reportados cuando se inoculó exclusivamente con el hongo ectomicorrízico.
Cuadro 3: Contenido de clorofila a, b, total y carotenos en plantas de Pinus montezumae Lamb. inoculadas o coinoculadas con un hongo ectomicorrízico comestible Laccaria laccata (Scop.) Cooke=(L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal, Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner solubilizadora de fosfatos=(SF). Los datos son medias ± error estándar de la media, n=7. Valores en la misma columna con la misma letra no son diferentes de acuerdo con la prueba de Tukey (p≤0.05).
| Tratamientos | Clorofila (mg g-1) | Carotenos (μg g-1) | ||
|---|---|---|---|---|
| a | b | Total | ||
| Plantas sin inocular | 30.23±1.60c | 31.9±1.03c | 62.1±2.63c | 11.4±0.08c |
| Plantas inoculadas con: | ||||
| Laccaria laccata (Scop.) Cooke | 44.6±1.32ba | 43.7±0.20ba | 88.3±1.55b | 14.3±0.30b |
| Cohnella sp. | 36.6±1.66bc | 34.9±0.94c | 71.7±2.60c | 11.3±0.57c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (FN) | 36.6±2.25bc | 38.5±2.41bc | 75.1±4.66c | 11.8±0.48c |
| Azospirillum brasilense Terrand Krieg & Dobereiner (SF) | 36.2±0.76bc | 37.3±0.79bc | 73.5±1.55c | 11.3±0.42c |
| L+C | 38.5±2.28bc | 43.0±0.61ba | 81.6±2.89bc | 14.1±0.10b |
| L+FN | 49.0±2.48a | 51.1±2.63a | 100.1±5.10a | 16.23±0.45a |
| L+SF | 39.6±1.48b | 42.7±0.42b | 82.3±2.26bc | 13.0±0.39bc |
Contenido de macronutrientes
El análisis nutrimental mostró efectos diferenciales de la inoculación y la coinoculación con el hongo ectomicorrízico y las bacterias benéficas. La inoculación con el hongo ectomicorrízico, exclusivamente, originó un mayor contenido nutrimental en todos los macronutrimentos evaluados, en comparación con las plantas no inoculadas. Los mayores efectos se observaron para el P, Ca y Mg. En contraste, las plantas inoculadas únicamente con cualquiera de las tres bacterias no presentaron diferencias respecto a aquellas sin inocular, independiente del macronutrimento evaluado. Todos los tratamientos coinoculados con el hongo ectomicorrízico y cualquiera de las tres bacterias evaluadas presentaron mayores contenidos de macronutrimentos comparados con las plantas no inoculadas. Sin embargo, el efecto más evidente se registró en el caso de las plantas coinoculadas con L+FN. En este tratamiento se observó un efecto sinérgico dado que los contenidos de N, P, K, Ca y Mg fueron 1.33, 1.20, 1.34, 1.28, 1.19 mayores, respectivamente, en los tratamientos coinoculados que en los inoculados solo con el hongo ectomicorrízico (Cuadro 4).
Cuadro 4: Contenido total de macronutrientes en raíz, parte aérea y raíz de plantas de Pinus montezumae Lamb. inoculadas o coinoculadas con un hongo ectomicorrízico comestible Laccaria laccata (Scop.) Cooke=(L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal, Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner solubilizadora de fosfatos=(SF). Los datos son medias ± error estándar de la media, n=7. Valores con la misma letra en la misma columna son iguales, según la prueba de Tukey (p≤0.05).
| N | P | K | Ca | Mg | |
|---|---|---|---|---|---|
| mg por planta | |||||
| Plantas sin inocular | |||||
| Parte aérea | 1.96±0.29c | 0.48±0.07c | 0.37±0.05c | 0.75±0.11c | 0.86±0.13b |
| Raíz | 1.4±0.20c | 0.37±0.05b | 0.23±0.03d | 1.16±0.17c | 0.97±0.14c |
| Total | 3.36±0.48d | 0.85±012c | 0.6±0.09d | 1.92±0.28c | 1.83±0.26b |
| Plantas inoculadas con: | |||||
| Laccaria laccata (Scop.) Cooke | |||||
| Parte aérea | 9.59±0.05b | 2.28±0.11ba | 5.17±0.024b | 3.73±0.17ba | 4.77±0.22a |
| Raíz | 9.43±0.40b | 2.53±0.11a | 1.88±0.08b | 6.26±0.26ba | 5.72±0.24ba |
| Total | 19.01±0.39b | 4.82±0.17ba | 7.05±0.27b | 9.99±0.35b | 10.49±0.37a |
| Cohnella sp. | |||||
| Parte aérea | 1.82±0.08c | 0.35±0.02c | 0.67±0.03c | 1.39±0.06c | 1.72±0.08b |
| Raíz | 2.65±0.29c | 0.53±0.06b | 0.82±0.09c | 1.68±0.19c | 1.62±0.18c |
| Total | 4.48±0.32d | 0.88±0.06c | 1.49±0.10dc | 3.07±0.21c | 3.34±0.21b |
| Azospirillum brasilense Terrand Krieg & Dobereiner (FN) | |||||
| Parte aérea | 2.08±0.29c | 0.56±0.08c | 1.48±0.21c | 1.47±0.20c | 1.89±0.26b |
| Raíz | 2.45±0.29c | 0.88±0.10b | 0.9±0.11c | 2.52±0.30c | 2.17±0.26c |
| Total | 4.53±0.57d | 1.44±0.18c | 2.38±0.31c | 3.99±0.49c | 4.06±0.51b |
| Azospirillum brasilense Terrand Krieg & Dobereiner (SF) | |||||
| Parte aérea | 2.14±0.19c | 0.57±0.05c | 0.90±0.08c | 1.26±0.11c | 1.54±0.14b |
| Raíz | 2.03±0.37c | 0.81±0.15b | 0.65±0.12dc | 2.16±0.39c | 1.87±0.34c |
| Total | 4.17±0.56d | 1.38±0.20c | 1.55±0.20dc | 3.42±0.51c | 3.41±0.48b |
| L+C | |||||
| Parte aérea | 7.16±0.99b | 2.36±0.32ba | 4.73±0.25b | 4.21±0.58ba | 5.66±0.78a |
| Raíz | 2.02±0.14b | 2.46±0.17a | 1.99±0.15ba | 5.35±0.37b | 5.26±0.36b |
| Total | 9.18±1.11c | 4.82±0.48ba | 6.72±0.34b | 9.56±0.92b | 10.92±1.11a |
| L+FN | |||||
| Parte aérea | 12.28±0.92a | 3.14±0.29a | 6.95±0.65a | 5.13±0.48a | 5.38±0.50a |
| Raíz | 12.94±0.96a | 2.66±0.20a | 2.53±0.19a | 7.64±0.57a | 7.06±0.53a |
| Total | 25.22±0.30a | 5.8±0.21a | 9.48±0.53a | 12.76±0.41a | 12.44±0.39a |
| L+SF | |||||
| Parte aérea | 8.57±0.50b | 2.14±0.13b | 3.80±0.22b | 3.43±0.20b | 4.38±0.26a |
| Raíz | 8.95±0.88b | 2.07±0.20a | 1.99±0.20ba | 5.48±0.57ba | 5.69±0.56ba |
| Total | 17.52±1.17b | 4.2±0.28b | 5.79±0.34b | 9.27±0.68b | 10.08±0.70a |
Porcentaje de micorrización
Los porcentajes de micorrización en las plantas inoculadas y en aquellas coinoculadas fueron de 55% cuando se inoculó exclusivamente con el hongo ectomicorrízico y de 53%, 59% y 61%, con L+SF, L+FN y L+C, respectivamente. El porcentaje de micorrización (Tukey p≤0.05) fue de 54% cuando se coinoculó con L+SF. Todos estos valores son superiores a la inoculación registrada en plantas no inoculadas o en plantas inoculadas exclusivamente con las bacterias, en donde los valores variaron 3%, 5%, 13% y 13% en los tratamientos de plantas sin inocular, SF, FN y C, respectivamente (Cuadro 5). Las raíces cortas terciarias ectomicorrizadas presentaron morfotipos característicos de Laccaria laccata, y sus estructuras diagnósticas como red de Hartig, manto y micelio externo fueron observadas con microscopia estereoscópica y óptica de campo claro. Las ectomicorrizas fueron simples o dicotómicas cubiertas en algunas ocasiones de abundante micelio externo gelatinoso, con ápices redondeados de tonos más claros que el resto de las puntas ectomicorrizadas, características de las especies del género Laccaria Berk. & Broome. Adicionalmente, se observó que las hifas penetran dos o tres capas de espacios instersticiales de las células corticales (Figs. 2B-E).
Cuadro 5: Porcentaje de raíces cortas micorrizadas, no micorrizadas, muertas y vivas de plantas de Pinus montezumae Lamb. inoculadas o no con un hongo ectomicorrízico comestible Laccaria laccata (Scop.) Cooke=(L), la bacteria auxiliadora de la micorrización Cohnella sp.=(C) y dos bacterias promotoras del crecimiento vegetal, Azospirillum brasilense Terrand Krieg & Dobereiner fijadora de nitrógeno=(FN) y Azospirillum brasilense Terrand Krieg & Dobereiner solubilizadora de fosfatos=(SF). Los datos son medias ± error estándar de la media, n=7. Valores con la misma letra en la misma columna son iguales, según la prueba de Tukey (p≤0.05).
| Raíces vivas (%) | Raíces muertas (%) | |||
|---|---|---|---|---|
| Tratamientos | Micorrizadas | No micorrizadas | Micorrizadas | No micorrizadas |
| Plantas sin inocular | 2.75±0.25b | 84.60±0.77a | 1.88±0.27b | 10.74±0.96ba |
| Plantas inoculadas con: | ||||
| Laccaria laccata (Scop.) Cooke | 54.54±2.49a | 12.08±2.59c | 24.33±3.57a | 7.52±2.41ba |
| Cohnella sp. | 12.89±7.85b | 66.8±6.27ba | 1.82±0.59b | 18.35±8.79ba |
| Azospirillum brasilense Terrand Krieg & Dobereiner (FN) | 12.95±5.37b | 71.2±5.95ba | 4.57±0.98b | 11.27±1.77ba |
| Azospirillum brasilense Terrand Krieg & Dobereiner (SF) | 5.27±1.29b | 58.58±4.31b | 5.19±1.37b | 27.47±5.19a |
| L+C | 60.79±0.48a | 5.87±0.88c | 26.51±1.96a | 5.94±1.11ba |
| L+FN | 59.1±3.23a | 12.4±21.89c | 20.5±4.34a | 8.06±1.72b |
| L+SF | 53.38±7.30a | 11.68±2.87c | 23.66±2.72a | 11.12±1.94ba |
Discusión
Interacciones entre hongos micorrízicos y bacterias auxiliadoras de las micorrizas
Las raíces de las plantas establecen interacciones simbióticas con hongos micorrízicos y bacterias benéficas que mejoran su crecimiento y contenido nutrimental (Duponnois y Plenchette, 2003; Smith y Read, 2008; Wu et al., 2012; Sousa et al., 2015). Deveau y Labbé (2016) sugirieron una diversidad de mecanismos mediante los cuales diversos grupos bacterianos benefician a las micorrizas e ilustran la complejidad del concepto de “bacterias auxiliadoras de las micorrizas”. Dentro de los mecanismos propuestos por estos autores se incluyen algunos directamente involucrados con los hongos y que coadyuvan al reconocimiento por las raíces de las plantas hospederas: incremento en la germinación de esporas, estimulación del crecimiento micelial y liberación de metabolitos. Sin embargo, también deben ser incluidos aspectos como sinergismos, en términos de crecimiento o mejoramiento en el contenido nutrimental de las plantas micorrizadas al efectuar coinoculación con hongos ectomicorrízicos y determinados grupos de bacterias. El papel de la coinoculación con hongos ectomicorrízicos y diversos grupos bacterianos, que tienen la capacidad de potencializar los beneficios de la simbiosis ectomicorrízica principalmente en el crecimiento de las plantas inoculadas, ha sido documentado previamente (Obase, 2019).
Crecimiento vegetal
En el presente trabajo se demostró que la inoculación con el hongo comestible ectomicorrízico Laccaria laccata tiene un efecto positivo en el crecimiento y contenido de macronutrimentos en P. montezumae. Adicionalmente, la coinoculación de Laccaria laccata con una de las tres cepas bacterianas evaluadas e identificada como A. brasilense con capacidad de fijar N, originó un mayor crecimiento de P. montezumae en términos de biomasa aérea y radical. Existen algunos reportes previos en donde se han registrado efectos similares en el crecimiento de árboles al coinocularlos con hongos ectomicorrízicos y bacterias benéficas. Wu et al. (2012) , al coinocular Pinus thunbergii Parl. con Boletus edulis Bull. y Bacilus cereus Frankland & Frankland cepas HB12 y HB59, registraron incrementos en su biomasa total (1.28 y 1.39, respectivamente), en comparación con plantas inoculadas exclusivamente con el hongo ectomicorrízico. De manera similar, Araujo et al. (2018) coinocularon Pinus pinea L. con la bacteria Bacillus subtilis (Ehrenberg) Cohn y el hongo ectomicorrízico Pisolithus tinctorius (Pers.) Coker & Couch y reportaron incrementos en su biomasa seca, tanto de tallo y de raíz, de hasta 1.42 y 1.65 veces más, respectivamente, que en las plántulas inoculadas exclusivamente con el hongo ectomicorrízico.
Adicionalmente, en el presente trabajo se encontró un efecto sinérgico cuando se coinoculó con el hongo comestible ectomicorrízico L. laccata y la bacteria A. brasilense con capacidad de fijar nitrógeno (FN), en términos de aumento en el diámetro del tallo de las plantas. Barragán-Soriano et al. (2018) reportaron que al inocular el hongo comestible ectomicorrízico Hebeloma mesophaeum (Pers.) Quél., o al coinocular dicho hongo con las bacterias Cohnella sp., o con Azospirillum brasilense, se incrementó el diámetro en plantas de Pinus montezumae. Dichos autores registraron este fenómeno en tres periodos de evaluación, 30, 120 y 420 días después de coinocular las bacterias. De manera similar a lo encontrado en la presente investigación, Xiao-Qin et al. (2012) reportaron que la coinoculación con el hongo ectomicorrizico Boletus edulis y dos cepas de bacterias auxiliadoras de la micorrización pertenecientes a Bacillus cereus HB12 y HB59 en plantas de Pinus thunbergii mostraron un incremento en el diámetro del tallo hasta 1.4 y 1.48 veces mayor, respectivamente, que las plantas sin inocular.
Estos resultados son indicadores de que cuando se coinoculan hongos ectomicorrízicos con diferentes cepas bacterianas existen efectos diferenciales en el crecimiento tanto intra como interespecíficos. Esto puede ser explicado por la enorme variación genética existente entre bacterias pertenecientes a diferentes especies, o a diferentes cepas dentro de la misma especie, lo que origina una variación para la codificación de metabolitos involucrados en las distintas fases de los procesos metabólicos, enzimáticos y efectos benéficos de la micorrización en sus plantas hospederas, lo cual ha sido ampliamente documentado (p.ej., Kuo et al., 2014; Hanage, 2016; Muszewska et al., 2021). Por ejemplo, Afkhami et al. (2020) reportaron que existen cepas bacterianas que presentan más afinidad con sus hospedadores genéticamente. Por ello, es importante resaltar que hay una enorme variabilidad en el efecto de la interacción entre los microorganismos, lo cual depende de la especificidad entre la relación tripartita planta hospedera-hongos ectomicorrízicos-bacterias benéficas. Adicionalmente, con el advenimiento de la metagenómica, se ha demostrado que las relaciones entre plantas hospederas, hongos ectomicorrízicos y sus microbiomas asociados, son mucho más complejas de lo que se había asumido previamente. Por lo anterior, la comprensión mecanística de las interacciones genéticas, fisiológicas, bioquímicas y evolutivas entre estos componentes se encuentra actualmente en su infancia (Aslani et al., 2020; Mangeot-Peter et al., 2020).
Fotosíntesis, clorofilas y carotenos
Particularmente el efecto de la coinoculación con hongos ectomicorrízicos y bacterias benéficas en las variables fisiológicas, como la tasa fotosintética y el contenido de clorofila a, b, totales y carotenos, a pesar de su importancia, han recibido escasa atención. Por ejemplo, Xiao-Qin et al. (2012) reportaron que al coinocular plantas de Pinus thunbergii con el hongo ectomicorrizico Boletus edulis y la bacteria Bacillus cereus HB12 o HB59 se incrementó la actividad fotosintética en relación con la inoculación solo con el hongo o el hongo con la bacteria. Shi et al. (2017) registraron que al coinocular tres hongos ectomicorrízicos, Cenococcum geophilum Fr., Laccaria amethystina (Scop.) Cooke (mencionada con el sinónimo L. amethystea (Bull.) Murrill) y Pisolithus sp., en Pinus thunbergii existió un incremento de hasta 3.8, 2.5, y 1.7 de la tasa fotosintética, respectivamente, en comparación con aquellas plantas que no fueron inoculadas. Wang et al. (2021) demostraron que la inoculación con hongos ectomicorrízicos incrementa la tolerancia al estrés por desecación crítica y estimula la fotosíntesis mediante el aumento de la producción de azúcares no estructurales, los cuales funcionan como buffer en la tolerancia a la desecación. Estos autores inocularon Pinus tabuliformis Carr. con el hongo ectomicorrízico Suillus variegatus (Sw.) Richon & Roze, en dos condiciones de desecación (40 y 20% de humedad) y registraron incrementos de la tasa fotosintética de 133 y 100%, respectivamente, al comparar con aquellos tratamientos sin inocular. Zhang et al. (2019) observaron diferencias en las tasas fotosintéticas solamente a partir de los 62 días posteriores a la inoculación de Pinus densiflora Siebold & Zucc., con cualquiera de los hongos ectomicorrízicos Laccaria japonica Popa & K. Nara, Cenococcum geophilum, Pisolithus sp. y Suillus luteus (L.) Roussel.
En cuanto al contenido de clorofilas y carotenos, en el presente trabajo se registró que la coinoculación con un hongo ectomicorrízico y las bacterias promotoras del crecimiento vegetal, incrementó el contenido de pigmentos fotosintéticos como clorofila a, b, clorofilas totales y carotenos en acículas de P. montezumae.
Szuba et al. (2019) inocularon plantas de Populus canescens (Aiton) Sm. con el hongo ectomicorrízico Paxillus involutus (Batsch) Fr. y reportaron incrementos de clorofila a y b en comparación con plantas sin inocular. En contraste Yin et al. (2020) registraron que, en comparación con aquellas plantas sin inocular, la inoculación de Pinus sylvestris L. var. mongolica Litv. con el hongo ectomicorrízico Suillus luteus en condiciones de estrés por salinidad disminuyó la concentración de esos pigmentos fotosintéticos en plantas micorrizadas.
El incremento registrado, tanto en la presente investigación como en estudios previos, de la tasa fotosintética y el contenido de clorofilas es relevante en la comprensión del efecto benéfico que tienen las ectomicorrizas y su microbioma asociado en el crecimiento de los árboles hospederos. Se ha demostrado que de 3 a 21% del carbono fijado por árboles es translocado al micelio externo ectomicorrízico; es conocido que dicha fijación es efectuada por la clorofila a, que es el principal pigmento involucrado en la fotosíntesis, mientras que la clorofila b es un pigmento accesorio cuya función es colectar la energía para transferirla hacia la clorofila a (Leake et al., 2004; Ricketti et al., 2022).
Contenido nutrimental
La mayoría de los nutrientes se encuentran presentes en formas orgánicas que son asimilables para la absorción de las plantas hasta después de la descomposición de la materia orgánica, proceso que involucra la participación de los hongos ectomicorrízicos y bacterias (Haas et al., 2018). Previamente se ha investigado y demostrado la importancia de la adquisición de N, P y K en plantas ectomicorrizadas (Smith y Read, 2008).
En esta investigación se registró un incremento del contenido de macronutrimentos cuando se inoculó exclusivamente con el hongo ectomicorrízico o se inoculó simultáneamente con dicho hongo y con tres bacterias benéficas, independientemente de la parte de la planta y del macronutrimento. Adicionalmente, se registró un efecto sinérgico cuando se inóculo con L. laccata y FN, en el caso de la parte aérea, la raíz y el contenido total de N y K de P. montezumae. Este registro constituye uno de los pocos que demuestra que la coinoculación con el hongo ectomicorrízico L. laccata y la bacteria A. brasilense origina un efecto sinérgico en la translocación de macronutrimentos en P. montezumae.
Por su parte, Barragán-Soriano et al. (2018) reportaron que la coinoculación de dicha especie arbórea con el hongo ectomicorrízico Hebeloma mesophaeum (Pers.) Quél. y Azospirillum brasilense originaron un mayor contenido de N en su parte área y contenido total. A pesar de que A. brasilense SF, una de las cepas evaluadas en el presente trabajo, tuvo la capacidad de solubilizar fosfatos, no mostró efectos sinérgicos cuando se coinoculó con L. laccata. Este efecto puede deberse a la especificidad planta hospedera-bacteria, por lo que estudios con otras cepas de bacterias solubilizadoras de fosfatos son altamente deseables en la búsqueda de incrementos del contenido de P en plantas de P. montezumae.
Wu et al. (2012) , al coinocular Pinus thunbergii con Boletus edulis y dos cepas de Bacillus cereus, no observaron incrementos en el contenido total de N, pero sí en el de P y K. Araujo et al. (2018) coinocularon Quercus suber L. con dos diferentes tipos de bio-inoculantes. El primero, denominado comercial, estaba constituido de dos hongos ectomicorrízicos (Pisolithus tinctorius y Scleroderma sp. Pers.) y seis especies de Bacillus y Streptomyces Waksman & Henrici, mientras que el segundo inoculante contenía el hongo ectomicorrízico Suillus granulatus (L.) Roussel y la bacteria Mesorhizobium sp. Dichos autores registraron un incremento en el contenido de N hasta 2.4 veces mayor que en las plantas no inoculadas.
Pohjanen et al. (2014) evaluaron la inoculación de Pinus sylvestris L. con dos hongos ectomicorrízicos (Pisolithus tinctorius (Pt) y Suillus variegatus) y la bacteria Methylobacterium extorquens DSM13060 (MB) Green & Ardley. Dichos autores reportaron un incremento en la concentración de P, tanto en la parte área como en la raíz, cuando se inocula exclusivamente Pt o cuando se coinoculó Pt+MB en comparación con plantas no inoculadas. Domínguez-Núñez et al. (2019) reportaron que al coinocular con el hongo ectomicorrízico Tuber melanosporum Vitt., conocido como trufa negra, o con Pseudomonas fluorescens Migula CECT 844 a la especie Pinus nigra J.F. Arnold, se incrementa la concentración de K y P en comparación con plantas no inoculadas. Rodríguez-Gutiérrez et al. (2019) registraron que la inoculación de Laccaria trichodermophora G.M. Muell. o de L. bicolor (Maire) P.D. Orton, solas o en coinoculación con Pseudomonas fluorescens originó mayor contenido de K total en plantas de Pinus montezumae en comparación con plantas no inoculadas. En contraste, este efecto no se observó cuando se inoculó con L. vinaceobrunnea G.M. Muell. o L. laccata.
Lo anterior demuestra que, al igual que en el caso del crecimiento, existen diferencias interespecíficas de los hongos ectomicorrízicos inoculados de los efectos benéficos en términos de los incrementos de contenidos nutrimentales debidos a la coinoculación hongos-bacterias.
Colonización ectomicorrízica
Finalmente, la colonización ectomicorrízica de las raíces de las plantas y su interacción con bacterias promotoras de la micorrización son componentes clave de los efectos benéficos sobre el desarrollo de las plantas (Noirot-Gros et al., 2018).
Shinde et al. (2019) registraron que la coinoculación con la bacteria Pseudomonas fluorescens y el hongo comestible ectomicorrízico Laccaria bicolor en Populus tremuloides Michx. incrementó la cantidad de raíces finas micorrizadas hasta 1.7 veces más que las plantas sin inocular. Araujo et al. (2018) registraron incrementos en el porcentaje de micorrización en Pinus pinea en aquellos tratamientos coinoculados con la bacteria Bacillus subtilis y el hongo ectomicorrízico Pisolithus tinctorius.
Esas investigaciones demuestran que las combinaciones evaluadas en estos estudios (plantas-hongos ectomicorrízicos-bacterias), incrementan los porcentajes de micorrización. En la presente investigación se encontraron porcentajes de micorrización de 55% en las plantas inoculadas exclusivamente con el hongo L. laccata y de 54% a 61% en plantas coinoculadas con el hongo ectomicorrízico y con cualquiera de las tres bacterias evaluadas. Estos porcentajes de colonización ectomicorrízica son un indicador del éxito del establecimiento del hongo ectomicorrízico evaluado en las raíces de sus plantas hospederas, que junto con la coinoculación bacteriana explica los efectos benéficos reportados.
Conclusiones
El presente trabajo demostró que la coinoculación de P. montezumae con L. laccata, hongo comestible ectomicorrízico, y con tres cepas bacterianas produjo incrementos de peso seco total (hasta ocho veces mayores), tasas fotosintéticas 24 veces más elevadas, e incrementos nutrimentales de N, P y K totales (7.5, 12 y 26 veces respectivamente), en comparación con las plantas sin inocular.
En contraste, la inoculación solo con las tres bacterias evaluadas no originó efectos benéficos en la planta hospedera. Particularmente, se registró un efecto sinérgico cuando se coinoculó simultáneamente con el hongo ectomicorrízico y la bacteria A. brasilense (FN), en términos de crecimiento vegetal, calidad fisiológica de las plantas y contenido de N y K, tanto en la parte área, raíz y total. En contraste, la coinoculación con las otras dos bacterias evaluadas no mostró dicho efecto sinérgico en ninguna de las variables evaluadas, demostrando una variación tanto inter como intraespecífica en las diferentes combinaciones hongo ectomicorrízico-cepas bacterianas inoculadas. En todos los tratamientos donde se aplicó inoculante ectomicorrízico de L. laccata se registraron valores de micorrización que variaron entre 53 y 61%, lo que demuestra la capacidad de establecimiento de dicho micobionte en las raíces de la planta hospedera independientemente de la coinoculación bacteriana evaluada.
Este trabajo demuestra el gran potencial de la coinoculación con el hongo comestible ectomicorrízico L. laccata y la bacteria A. brasilense (FN) como una alternativa recomendable en la producción de plantas en vivero de Pinus montezumae, la cual es una de las especies más utilizadas para la reforestación en México.











 nueva página del texto (beta)
nueva página del texto (beta)



