Introducción
El género Cortinarius (Pers.) Gray es un grupo de hongos terrestres, cosmopolitas, de hábito ectomicorrícico, caracterizado por un velo parcial típicamente a modo de “cortina” aracnoide, dejando una zona anular, delgada y fibrosa. La esporada es de color marrón óxido a marrón anaranjado ocráceo, y las basidiosporas son rugosas, arrugadas o verrugosas y sin poro apical (Bessette et al., 1997; Rinaldi et al., 2008; Tedersoo et al., 2010). El género pertenece a la familia Cortinariaceae dentro del Orden Agaricales de la clase Agaricomycetes del Phylum Basidiomycota (He et al., 2019) y está constituido por aproximadamente 2250 especies en todo el mundo (He et al., 2019; Wijayawardene et al., 2020; Index Fungorum, 2021); de estas, 500 especies ocurren en América del Norte (Bessette et al., 1997). En México se han registrado, hasta el momento, solo 26 especies del género Cortinarius en los siguientes estados: Aguascalientes, Baja California, Chiapas, Chihuahua, Coahuila, Durango, Jalisco, México, Michoacán, Nuevo León, Tamaulipas, Sonora y Veracruz (Díaz-Barriga et al., 1988; Pardave Díaz, 1996; Garza et al., 2002; García-Jiménez y Guevara-Guerrero, 2005; García y Valenzuela, 2005; Pérez-Silva et al., 2008; Frutis Molina y Valenzuela, 2009; Guzmán et al., 2009; Pérez-Silva et al., 2011; Burrola-Aguilar et al., 2012; García-Jiménez et al., 2014; Domínguez Romero et al., 2015; Padilla-Velarde et al., 2016; Baeza-Guzmán et al., 2017; Kong, et al., 2018; Rodríguez-Alcántar et al., 2018; Garza-Ocañas et al., 2019).
Cortinarius hesleri Ammirati, Niskanen, Liimat. & Matheny se ubica en el subgénero Telamonia (Fr.) Trog; se caracteriza principalmente porque sus basidiomas presentan una gama de colores que abarca tonos del rojo al anaranjado, como son el rojo marrón (rojo de Brasil), rojo cinabrio, rojo marrón (siena tostado), naranja marrón (naranja marte) o naranja rojizo a naranja marrón (naranja rufo o herrumbre a naranja de xantina) o más naranja a naranja profundo, y generalmente de color más pálido en el margen (Ammirati et al., 2013). La especie se distribuye en bosques mixtos de latifoliadas y coníferas en el este de América del Norte (Ammirati et al., 2013). Como parte de los estudios de la funga del norte de México, en los bosques de Quercus en el estado de Tamaulipas se recolectaron varios especímenes con las características de Cortinarius hesleri. El objetivo del presente estudio es describir por primera vez a Cortinarius hesleri para México, incluyendo una descripción macro y micromorfólogica de la especie, así como láminas con fotografías macroscópicas in situ, e ilustraciones y fotografías de sus estructuras microscópicas.
Materiales y Métodos
Se realizaron exploraciones micológicas en la temporada de lluvias durante los meses de agosto a octubre de 2019 y 2020. El sitio de muestreo se ubicó en el bosque de la localidad Sierra Madre, en el municipio Victoria en el estado de Tamaulipas, con coordenadas 23°37'20.10"N, 99°14'37.90"O y una altitud de 1650 m (Fig. 1). La vegetación dominante en los sitios de muestreo corresponde a bosque de Quercus y las especies que lo conforman son Quercus canbyi Trel., Q. clivicola Trel. & C.H. Müll., Q. graciliramis C.H. Mull., Q. obtusata Bonpl. Q. porphyrogenita Trel., Q. rysophylla Weath., Q. sartorii Liebm., Q. sebifera Trel. y Q. xalapensis Bonpl., además de algunos elementos entremezclados de Pinus teocote Schiede ex Schltdl. & Cham. y Carya ovata (Mill.) K. Koch var. mexicana (Engelm. ex Hemsl.) W.E. Manning (García-Morales et al., 2014a, b; García-Morales, 2016).
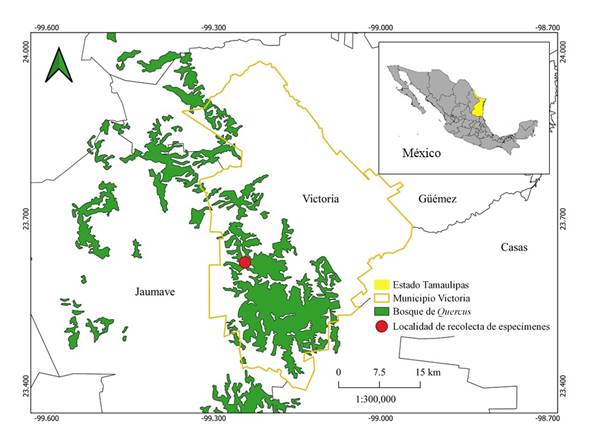
Figura 1: Localidad de recolecta de especímenes de Cortinarius hesleri Ammirati, Niskanen, Liimat. & Mathenyen, en Tamaulipas, México.
Se recolectaron y registraron ejemplares fúngicos frescos y se preservaron mediante su deshidratación siguiendo los métodos de muestreo para macromicetos propuestos por Lodge et al. (2004). El color de los ejemplares en fresco fue descrito según Kornerup y Wanscher (1978). Para el análisis microscópico de los especímenes se realizaron cortes histológicos hechos a mano de algunas secciones del basidioma deshidratado, con el fin de elaborar preparaciones usando KOH al 5% (hidróxido de potasio), NH4OH (hidróxido de amonio) y reactivo de Melzer. Las preparaciones se observaron en un microscopio óptico (Axiostar plus, Carl Zeiss, Jena, Alemania) (Largent et al., 1977). El tamaño de los microcaracteres, tales como basidios, cistidios y basidiosporas, se determinó midiendo 30 elementos de cada uno. Las abreviaturas utilizadas son: Q=relación longitud/ancho de las basidiosporas; L=longitud promedio; W=ancho promedio; N=total de esporas medidas.
Para la identificación de la especie se revisó literatura especializada (Ammirati, 1972; Ammirati et al., 2013), para indicar el estatus taxonómico de la especie estudiada se revisó el Index Fungorum (2021), mientras que para la autoría de las especies vegetales se revisó Plants of the World (2021). Todos los especímenes fueron herborizados y depositados en el herbario micológico "José Castillo Tovar" del Instituto Tecnológico de Ciudad Victoria (ITCV).
El mapa para la ubicación del sitio de muestreo se elaboró en el programa cumputacional QGIS v. 3.22.3 (QGIS Development Team, 2022). Las fotografías de los especímenes en fresco se realizaron con una cámara Sony (DSC-HX60V, Sony Corporation, Tokio, Japón). Las estructuras microscópicas se ilustraron a partir de dibujos realizados a mano alzada para su posterior digitalización.
Resultados
Cortinarius hesleriAmmirati, Niskanen, Liimat. & Matheny, Botany 91: 96. 2013. Figs. 2, 3, 4.

Figura 2: Cortinarius hesleri Ammirati, Niskanen, Liimat. & Matheny. A. basidiomas in situ; B. corte longitudinal de basidiomas y reacciones químicas color púrpura-violáceo con KOH al 5%; C. acercamiento a láminas; D. cortina a modo de restos membranosos del margen del píleo al estípite en basidiomas en desarrollo.

Figura 3: Cortinarius hesleri Ammirati, Niskanen, Liimat. & Matheny. Ilustración de estructuras microscópicas. A. basidiosporas; B. basidios; C. pileipellis, hifas terminales; D. estipitipellis, hifas terminales. Escala=10 µm.
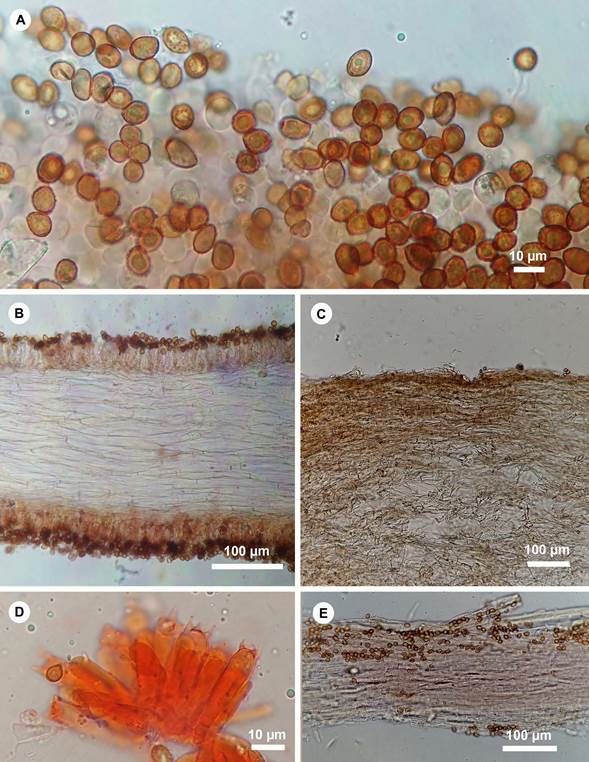
Figura 4: Cortinarius hesleri Ammirati, Niskanen, Liimat. & Matheny. Estructuras microscópicas. A. basidiosporas; B. trama himenoforal; C. pileipellis; D. basidios; E. estipitipellis.
TIPO: ESTADOS UNIDOS DE AMÉRICA. Michigan, Washtenaw, Gorman Lake, 19.VIII.1972, A. H. Smith 81565 (holotipo: MICH!).
Píleo 11-50 mm de diámetro, cónico, cónico campanulado, umbonado a convexo umbonado, superficie lisa, algo sedosa brillante, color anaranjado pálido (5A5) a anaranjado profundo (5A8) cuando joven, anaranjado marrón (5C5) al centro, anaranjado pálido al margen (5A3) en la madurez; margen enrollado cuando joven, luego entero-ondulado cuando maduro y agrietándose cuando viejo, al aplicar NH4OH y KOH al 5% se torna de violeta vívido (17A8) a violeta oscuro (17A7); láminas sinuadas a subadheridas, 5-10 mm de ancho, color rojo amarillento (8A8) anaranjado grisáceo a anaranjado (6B5-7) al borde, más o menos distantes (hasta 1 mm) y gruesas, borde ondulado, algo erosionado irregular, con lamélulas, se tornan violeta grisáceo (17D-5) con KOH al 5% y NH4OH; estípite 23-90 × 5-12 mm, subcilíndrico ensanchándose a la base, algo curvo, superficie longitudinalmente fibrilosa, color anaranjado brillante (5A5), con algunos finos restos membranosos a modo de velo o fibrillas longitudinales color anaranjado (5A7-6) o anaranjado profundo (6A8), más notable en ejemplares jóvenes, seco, sedoso, brillante, consistencia fibrosa, compacto; base con micelio anaranjado (5A6) el cual perdura en ejemplares herborizados, al aplicar NH4OH y KOH al 5% se torna violeta vívido (17A8) a violeta oscuro (17A7); contexto 2-9 mm de grosor; compacto; color blanquecino grisáceo con tonos anaranjados (5A2) en el estípite, anaranjado rojizo brillante (5A7) hacia la superficie (cutícula), se torna violeta vívido (17A8) al reaccionar con NH4OH y KOH al 5%; olor fúngico indistinguible; basidiosporas (7-)8-10(-12) × (5-)5.5-7 µm; Q=1.46-1.49; L'=8.72, W'=6.05, N=30, elipsoides, raramente ampliamente elipsoide o elongada (oblonga), amigdaloides, verrugosa a ligeramente verrugosas (ornamentación poco visible), color marrón a marrón amarillento en KOH al 5%, dextrinoides (marrón oscuro) en Melzer, pared delgada, apículo no visible; basidios 28-39 × 7-9.5 µm, clavados, hialinos en KOH al 5%, tetraspóricos, pared gruesa, gutulados, con fíbulas en la base; queilocistidios y pleurocistidios ausentes; subhimenio no diferenciado; trama himenoforal paralela regular, formada por hifas septadas, cilíndricas, 5-12 µm de diámetro, hialinas con algunos tonos marrón-rojizos en KOH al 5%, pared delgada; pileipellis formado por un cutis, con elementos terminales 22.5-72 × 6.5-11 µm, ápice redondeado a obtuso; hifas cilíndricas a ligeramente entrelazadas, hialinas en KOH al 5%, algunas con pigmentos marrón rojizo (8C7), pared delgada, en algunas se observa la presencia de fíbulas; estipitipellis con elementos terminales postrados 61-102 × 4.5-8 µm, ápice redondeado; hifas cilíndricas, hialinas a ligeramente amarillento en KOH al 5%, algunas con pigmentos marrón rojizo (8C7), pared delgada, en algunas se observa la presencia de fíbulas.
Hábito y hábitat: especie ectomicorrícica que crece de manera solitaria a gregaria en pequeños grupos, en ocasiones cespitoso, entre la hojarasca o en el suelo del bosque de Quercus-Pinus, a 1600 m s.n.m. Fructifica en los meses de agosto a octubre.
Distribución: Norteamérica, en Canadá y los Estados Unidos de América (Ammirati, 1972; Ammirati et al., 2013). Se cita por primera vez para México.
Material examinado: MÉXICO. Tamaulipas, municipio Victoria, ejido Sierra Madre, 1650 m, 23°37'20.10"N, 99°14'37.90"O, 24.IX.2019, F.Hernández 208 (ITCV); loc. cit., 10.X.2019, F. Hernández 267 (ITCV); loc. cit., 26.X.2019, F. Hernández 353 (ITCV); loc. cit., 26.VIII.2020, F. Hernández 488 (ITCV).
Notas taxonómicas: las características de los especímenes estudiados coinciden con las proporcionadas de Cortinarius hesleri en la descripción original de Ammirati et al. (2013). Esta especie se encuentra relacionada en América del Norte y dentro del subgénero Telamonia con Cortinarius californicus A.H. Sm., el cual se diferencia por tener esporas más angostas y ligeramente más cortas, 7.7-9.6(-10.2) × 4.8-5.5(-7) µm, Q=1.4-1.9, siendo elipsoides a elongadas u oblongas, mientras que C. hesleri presenta esporas más anchas y largas (7-)8-10(-12) × (5-)5.5-7 µm, Q=1.46-1.49, y forma amigdaloide a elipsoide. La reacción química violeta con KOH al 5%, que ocurre en el material fresco en cualquiera de sus tejidos, también se presenta en el material seco, observándose incluso a nivel microscópico donde se desprende un pigmento violeta (17A8) que luego se torna marrón rojizo (8C7).
Discusión
Dentro del subgénero Telamonia se encuentra Cortinarius hesleri junto a C. californicus, C. cinnabarinus Fr. y C. coccineus Reumaux, siendo todas estas especies muy afines principalmente por su aspecto de color naranja a rojo anaranjado. Cortinarius hesleri se había relacionado originalmente con C. cinnabarinus por sus similitudes macromorfológicas y la asociación con plantas del género Quercus L. y otras latifoliadas (Keller y Ammirati, 1983). Sin embargo, posteriormente estudios moleculares demostraron que ambas especies son diferentes y que C. hesleri está relacionada filogenéticamente de modo más estrecho con C. californicus que con C. cinnabarinus. Además, C. cinnabarinus y C. coccineus se distribuyen principalmente en bosques europeos (Ammirati et al., 2013).
Cortinarius californicus está reportada en asociación, principalmente, con bosques mixtos de Pinus L., Pseudotsuga Carrière, Thuja L., Arbutus L., Acer L. y Quercus garryana Douglas ex Hook., mientras que C. hesleri se reporta asociada a los bosques mixtos de Quercus-Pinus, Quercus y Carya Nutt. en Canadá y los Estados Unidos de América (Ammirati et al., 2013), lo cual coincide con el tipo de hábitat en el que se encuentra en México. Este se trata del bosque de Quercus mezclado con Pinus teocote y Carya ovata var. mexicana, donde también se presentan Quercus clivicola, Quercus graciliramis, Quercus sartorii y Pinus teocote, con quienes probablemente forma asociaciones ectomicorrícicas.
Cortinarius californicus se encuentra distribuido al oeste de los Estados Unidos de América y al oeste de la Columbia Británica en Vancouver, Canadá, mientras que C. hesleri ocurre en la mayor parte del este de América del Norte, desde el norte en Nueva York y Michigan, pasando por Illinois, Virginia, Carolina del Norte, Tennessee, Florida, hasta el sur en Texas (Ammirati, 1972; Keller y Ammirati, 1983; Ammirati et al., 2013). La distribución de C. hesleri ocurre por la zona este hacia el sur de Texas en los Estados Unidos de América y continúa en el noreste de México en el estado de Tamaulipas, siendo esta su distribución más meridional conocida por el momento en el continente americano. Esta distribución coincide con lo comentado por Ammirati et al. (2013), quienes sugieren que C. hesleri se encontraría probablemente distribuido de forma extensa en la parte este y sur de América del Norte.
Conclusiones
Hasta el momento C. hesleri cuenta con una distribución muy marcada hacia el oriente de Norteamérica y una asociación muy particular con bosques templados, donde se destacan principalmente por lo menos tres géneros de plantas ectomicorrícicas: Quercus, Pinus y Carya (Smith y Read, 2008; Ammirati et al., 2013). De acuerdo con lo anterior y reconociendo que el género Cortinarius comprende especies de hábito ectomicorrícico (Rinaldi et al., 2008), se sugiere que C. hesleri es una especie que se puede encontrar distribuida de manera extensa en otros sitios del noreste y la parte oriental hacia el sur de México, junto a los bosques y las especies forestales con las que se le ha ubicado anteriormente y con los cuales pudiera tener una asociación ectomicorrícica. Futuros muestreos podrían dilucidar más objetivamente la distribución de la especie. Estudios morfológicos y moleculares sobre la micorriza permitirían confirmar la relación simbiótica de C. hesleri con sus árboles hospederos.











 nueva página del texto (beta)
nueva página del texto (beta)



