Introducción
Gelidium americanum (W.R. Taylor) Santelices es una especie de alga roja (Rhodophyta) incluida dentro del orden Gelidiales y la familia Gelidiaceae. Fue descrita por Taylor (1943) como Pterocladia americana W.R. Taylor, con distribución en el Atlántico oriental y cuya localidad tipo es Port Antonio, Jamaica. La combinación G. americanum fue propuesta por Santelices (1976). En el Atlántico mexicano se le ha encontrado en localidades de Veracruz, Campeche, Quintana Roo (Mateo-Cid y Mendoza-González, 1991; Robledo et al., 2003; Galicia-García y Morales-García, 2007; Mendoza-González et al., 2007; Godínez-Ortega et al., 2009) y Tabasco. En este último estado la han registrado Ramírez (1996), Mendoza-González et al. (2017) y Quiroz-González et al. (2018) de tres localidades distintas (laguna La Machona, laguna Mecoacán y playa Paraíso), pero estos reportes estuvieron basados en las características morfológicas de los especímenes, sin haber confirmado su identidad molecular.
El empleo de marcadores moleculares, principalmente de plástidos y mitocondrias (rbcL, COI-5P), ha clarificado la situación taxonómica de algas del orden Gelidiales (p. ej., Boo et al., 2016a, b; Jamas et al., 2017; Boo y Hughey, 2019; Brunelli et al., 2019, b; Perrone et al., 2019; Boo y Kim, 2020; Quiroz-González et al., 2020). Sin embargo, estos marcadores no han sido aplicados a especies mexicanas, con excepción de lo recientemente publicado por Quiroz-González et al. (2020) para las costas del Pacífico tropical mexicano. En el caso de G. americanum, Perrone et al. (2019) secuenciaron material proveniente del holotipo después de obtener fragmentos cortos para los marcadores rbcL y COI-5P, confirmando su identidad taxonómica. Algunas muestras procedentes del Mediterráneo incluidas en su estudio se agruparon en el mismo clado donde se encuentran el holotipo y algunos especímenes brasileños.
El objetivo del presente trabajo fue confirmar la identidad taxonómica de los especímenes identificados como G. americanum recolectados previamente en la laguna costera de Mecoacán, Tabasco, México, con un enfoque morfológico y molecular.
Materiales y Métodos
Área de estudio
Este trabajo se desarrolló a partir de un estudio prospectivo ficológico en la laguna Mecoacán; cuerpo de agua que posee una extensión de 5168 ha y se ubica en la llanura costera de la cuenca del río Grijalva en el suroccidente del Golfo de México, en el estado de Tabasco, México (García-Cubas et al., 1990; Domínguez et al., 2003). El clima que predomina es de tipo Aw, cálido-húmedo con lluvias en verano y temperatura media anual de 26 °C (Hernández-Ojendi et al., 2020). Es una laguna somera (0.9-1.2 m de profundidad), que recibe la descarga de los ríos Seco, Cuxcuchapa y Escarbado permanentemente, con marcados incrementos en la temporada de lluvias, que abarca desde septiembre hasta febrero; algunas partes de la laguna están ocupadas por bancos de mejillón y ostión, el fondo restante se encuentra cubierto por substratos suaves sin vegetación (Contreras, 1985; García-Cubas et al., 1990; Domínguez et al., 2003). La laguna Mecoacán presenta fluctuaciones importantes de salinidad a lo largo del año, oscilan entre 5 y 29 ups; en la época de precipitaciones (agosto-octubre) los valores rondan los 5-19 ups, derivando en un ambiente estuarino durante dicha temporada (Domínguez et al., 2003; Campos- Campos et al., 2014). El sitio de muestreo está representado en un mapa (Fig. 1) que se elaboró utilizando el programa QGIS v. 2.18.28 (QGIS Development Team, 2009).
Colecta de material y análisis morfológico
Se recolectaron tres especímenes identificados morfológicamente como G. americanum, en un solo sitio en la zona sur de la laguna durante la época de lluvias. Las muestras se encontraron en una zona protegida por bloques de concreto donde el flujo de agua era escaso. Estas recibieron dos tratamientos: en el primero, secciones de cada talo se colocaron en silica gel para el análisis molecular, en el otro, los talos completos se preservaron en formaldehído (CH2O) al 4% en agua de mar. A partir de los ejemplares conservados en CH2O se elaboraron preparaciones semipermanentes que se tiñeron con cristal violeta, para fijarlas en gelatina glicerinada al 75%. Las secciones transversales y longitudinales del talo se cortaron manualmente, bajo un microscopio estereoscópico Nikon C-LEDS (Nikon, Konan, Minato-ku, Tokio, Japón), utilizando una hoja de afeitar. Las observaciones anatómicas se realizaron en un microscopio óptico Olympus CX23 (Olympus America Inc., Center Valley, Pennsylvania, EUA). Las fotografías de las características morfológicas se obtuvieron con una cámara Canon Eos Rebel T3 (Canon Inc., Tokio, Japón).
Análisis filogenético
La extracción de ADN de las muestras conservadas en silica gel se realizó utilizando el protocolo CTAB (Doyle y Doyle, 1990). Las reacciones de PCR se realizaron con el kit Thermoscientific Phire Plant Direct © (Thermo Fisher Scientific Inc., Waltham, MA, EUA). Los cebadores usados para la amplificación y secuenciación fueron: FrbcL-R753 y F57-R1381 (Freshwater y Rueness, 1994) para rbcL, y GHaIF-GazR (Saunders, 2005) para COI-5P. La amplificación de los marcadores se hizo en un termociclador Techne Flexi-gene (Bibby Scientific, Maryland, EUA), siguiendo el protocolo de Freshwater y Rueness (1994). Los productos de PCR fueron secuenciados por Macrogen Inc. (Humanizing Genomas Macrogen, Seúl, Corea del Sur). Las secuencias fueron editadas con el programa Bioedit v. 7.0.5.3 (Hall, 1999), mientras que el alineamiento se llevó a cabo en Clustal W v. 2.0.3 (Thompson et al., 1994).
Los alineamientos de rbcL consistieron en tres secuencias obtenidas en este trabajo y 27 de GenBank (2021); en el caso de COI-5P, tres son producto de este estudio y 28 adquiridas de GenBank (2021) (Cuadro 1). Ptilophora scalaramosa (Kraft) Norris, Gelidiophycus freshwateri Boo, Park & Boo y Capreolia implexa Guiry & Womersley fueron utilizados como grupos externos. Se empleó MEGA v. 7.0 (Kumar et al., 2016) para calcular distancias genéticas. El cálculo del mejor modelo de evolución de secuencias para cada conjunto de datos se realizó con el programa JModelTest v. 3.7 utilizando el Criterio de Información Akaike (Dariba et al., 2012), siendo GTR + G + I el más adecuado para ambos conjuntos de datos. Las filogenias de las secuencias de rbcL y COI-5P se infirieron utilizando Máxima verosimilitud (ML) e Inferencia Bayesiana (BI). El análisis de ML se realizó en RaxML v. 8.0.0X (Stamatakis, 2014), empleando el algoritmo de búsqueda heurística, se realizaron 100 réplicas de secuencias aleatorias y posteriormente, 100 réplicas de bootstrap. El análisis Bayesiano se hizo con MrBayes v. 3.2.1 (Ronquist et al., 2012) usando cuatro cadenas de Markov Monte Carlo comenzando con un árbol al azar y pre-definiendo un muestreo de los datos cada 200 generaciones durante 2,000,000 de generaciones, se utilizó un “burnin” de 25%. Los árboles resultantes de los dos análisis fueron visualizados y editados en FigTree (Rambaut, 2010).
Cuadro 1: Secuencias de rbcL y COI-5P generadas en el presente estudio y obtenidas de GenBank (2021). Con asterisco se indican las accesiones de las secuencias obtenidas en este trabajo.
| Especies | Localidad de muestreo | Gen Bank | |
|---|---|---|---|
| rbcL | COI-5P | ||
| Gelidium americanum (W.R. Taylor) Santelices | México: Mecoacán, Tabasco | *MW788675 | *MW760396 |
| *MW788676 | *MW788673 | ||
| *MW788677 | *MW788674 | ||
| Jamaica: Port Antonio | MK034311 | MK034308 | |
| Brasil | KX555615 | KX574741 | |
| Brasil | KX555614 | KX574740 | |
| G. calidum Jamas, Iha & Fujii | Brasil: Pernambuco | KT208120 | KT208040 |
| Brasil | KX555612 | KT574739 | |
| Brasil | - | KX574739 | |
| KX574737 | |||
| G. capense (S.G. Gmelin) P.C. Silva | Sudáfrica: Cape Peninsula, False Bay | L22461 | HM629858 |
| G. caulacantheum J. Agardh | Nueva Zelanda: Porirua Harbor | U00103 | HM629860 |
| G. carolinianum C. Perrone, D.W. Freshwater, A. | Estados Unidos de América: North Carolina, | MG272418 | MG800613 |
| Bottalico, G.H. Boo & S.M. Boo | Topsail Sound, Pender Co. | ||
| G. corneum (Hudson) J.V. Lamoroux | Marruecos | HM629821 | HM629861 |
| G. crinale (Hare ex Turner) Gaillon | Australia: Rottnest Island, Green Island / | HQ412493 | JX096542 |
| Reino Unido: Sidmouth | |||
| G. elegans Kützing | Corea del Sur: Seogeochado, Jindo | HM629829 | HM629869 |
| G. galapagense W.R. Taylor | Ecuador: Banks Bay, Isla Isabela, Galapagos | KX423476 | KX423473 |
| G. gabrielsonii Hughey & G.H. Boo | Estados Unidos de América: California, | MH780748 | MG922859 |
| Asilomar, Monterey County | |||
| G. hommersandii A.J.K. Millar & D.W. Freshwater | Australia: New South Wales | JX891625 | JX891599 |
| G. indonesianum K.M. Kim, G.S. Gerung & S.M. Boo | Indonesia: Pameungpeuk beach, Java | JF330216 | JF330215 |
| G. isabelae W.R. Taylor | Ecuador: Pt. Albemarle, Isla Isabela, | KX423477 | KX427231 |
| Galapagos | |||
| G. japonicum (Harvey) Okamura | Japón: Choshi, Chiba | HM629830 | HM629870 |
| G. jejuense K.M. Kim, I.K. Hwang, H.S. Yoon & S.M. | Corea: Jongdal, Jeju | JQ340407 | JQ340445 |
| Boo | |||
| G. kathyanniae G.H. Boo & Hughey | Estados Unidos de América: California, Point | MH780752 | MH780746 |
| Pinos, Pacific Grove, Monterey | |||
| G. longipes Agardh | Nueva Zelanda | AY648021 | - |
| G. pacificum Okamura | Japón: Marine Station, Chiba | HM629831 | HM629871 |
| G. purpurascens N.L. Gardner | Estados Unidos de América: California, San | U00979 | HM629873 |
| Juan Island; California, Agate Beach | |||
| G. pusillum (Stackhouse) Le Jolis | Reino Unido: Sidmouth | U00999 | JX096551 |
| G. sclerophyllum W.R. Taylor | Costa Rica: Guanacaste, Montezuma | KC192651 | KC288159 |
| Capreolia implexa Guiry & Womersley | Nueva Zelanda: Ringaringa Beach, Stewart | KM204080 | KM204044 |
| Island | |||
| Gelidiophycus freshwateri G.H. Boo, J.K. Park & S.M. | Corea: Daecheon, Boryeong | JX891603 | JX891571 |
| Boo | |||
| Ptilophora scalaramosa (Kraft) R.E. Norris | Filipinas: Sorsogon Province, Bulusan | KT920275 | KT920401 |
Resultados
Los especímenes analizados en el presente estudio coincidieron con la mayoría de las características morfológicas señaladas para G. americanum por otros autores (Cuadro 2). Las muestras se diferenciaron de los talos descritos en estudios previos por el intervalo en longitud y ancho, disposición de las células medulares y abundancia de los filamentos rizoidales internos.
Cuadro 2: Comparación de los caracteres morfológicos descritos por otros autores y en el presente estudio para Gelidium americanum (W.R. Taylor) Santelices.
| Caracteres | Taylor (1943),Santelices (1976);Perrone et al. (2019) | Este trabajo |
|---|---|---|
| Hábito | Erecto, parecido a un arbusto | Erecto, parecido a un arbusto |
| Forma del talo | Comprimido a aplanado, espatulado a | Comprimido a aplanado, ramas ligeramente atenuadas en la |
| lanceolado; ramas ligeramente atenuadas en | base | |
| la base | ||
| Patrón de ramificación | Irregular en la parte inferior, alterna a | Irregular en la parte inferior a alterna en la parte superior; sin |
| subpinnada en el tercio superior; sin un eje | un eje central dominante | |
| central dominante | ||
| Órdenes de ramificación | 2- 4 | 2-3 |
| Longitud | 0.5-6 cm | 2-4 cm |
| Ancho | 0.4-2 mm | 1-2 mm |
| Células medulares | Sin orden evidente | En tres hileras |
| Filamentos rizoidales internos | Escasos y dispersos en la médula | Abundantes en la médula |
Taxonomía
Gelidium americanum (W.R. Taylor) Santelices, Phycologia 15: 173. 1976. Fig. 2.

Figura 2: Características vegetativas de Gelidium americanum (W.R. Taylor) Santelices. A. talo completo, N. Quiroz CA280 (UJAT); B-C. detalle del talo. D. célula apical (CA). Escala = 100 µm. E. sección transversal. F. sección transversal, con células medulares indicadas (CM) y rizinas (R). Escalas; A = 0.2 mm; B = 100 µm; C = 100 µm; D = 100 µm; E = 40 µm; F = 25 µm.
TIPO: JAMAICA. Port Antonio, VII.1990. C. E. Pease y E. Butler s.n. (MICH 1306116).
≡ Pterocladia americana W.R. Taylor, Papers Michigan Acad. Sc. 28: 153. 1943.
Talos erectos con apariencia arbustiva, pardo-rojizos, 2-4 cm de altura, 1-2 mm de ancho; ramificación de segundo a tercer orden irregular en la parte inferior a alterna y subpinnada en la parte superior; talo comprimido a aplanado, ramas ligeramente atenuadas en la base; células medulares, 14-16.5 µm de diámetro, dispuestas en tres hileras, rodeadas de abundantes filamentos rizoidales; células corticales, 6.5-9.5 µm de diámetro, dispuestas en una hilera; estructuras reproductivas no observadas (Fig. 2).
Hábitat: creciendo sobre concreto y conchas de Crassostrea virginica (Gmelin, 1791). En una zona protegida, con muy poco movimiento, sitio sin exposición directa al sol.
Distribución: México: Campeche, Laguna de Términos (Ortega, 1995; Ortega et al., 2001; Mateo-Cid et al., 2013); Quintana Roo, Los Manchones, Puerto Morelos, Xcacel, San Juan Cozumel (Mateo-Cid y Mendoza-González, 1991; Mendoza-González y Mateo-Cid, 1992; Dreckmann et al., 1996; Ortega et al., 2001); Tabasco, laguna Mecoacán, La Machona, Playa Paraíso (Mendoza-González et al., 2017; Quiroz-González et al., 2018; este trabajo); Tamaulipas, La Carbonera San Fernando, Ciudad Madero, playa Lauro Villar, Matamoros (Ortega et al., 2001); Veracruz, Morro la Mancha (Ortega et al., 2001; De la Garza-Flores, 2003; Núñez-Reséndiz, 2009).
Material examinado: MÉXICO. Tabasco, laguna Mecoacán, 0 m, 6.IX.2017, N. Quiroz CA280 (UJAT), CA281 (UJAT), CA282 (UJAT 3).
Análisis filogenético
La filogenia molecular para el marcador rbcL consistió en el análisis de 30 secuencias (tres generadas en este estudio) con 1200 pb (pares de bases), de las cuales 410 pb eran variables. Mientras que para COI-5P incluyó 31 secuencias (tres producto de este trabajo) con 515 pb, de las cuales 223 pb eran variables. Los análisis de Máxima Verosimilitud e Inferencia Bayesiana produjeron árboles con topologías similares con ambos marcadores. Se generaron cladogramas consenso para los dos (Figs. 3, 4). Las tres secuencias de rbcL y COI-5P formaron clados con alta probabilidad posterior y valores de soporte de bootstrap (1 y 100, respectivamente).
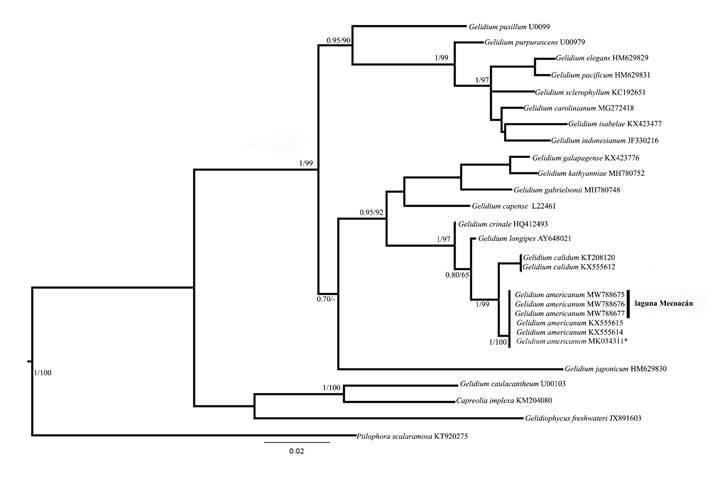
Figura 3: Árbol consenso inferido a partir de secuencias de rbcL para Gelidium J.V. Lamouroux. Los valores de probabilidad posterior y bootstrap se muestran en las ramas. *Holotipo de G. americanum (W.R. Taylor) Santelices.

Figura 4: Árbol consenso inferido a partir de secuencias de COI-5P para Gelidium J.V. Lamouroux. Los valores de probabilidad posterior y bootstrap se muestran en las ramas. *Holotipo de G. americanum (W.R. Taylor) Santelices.
Para ambos árboles filogenéticos los especímenes analizados en el presente estudio se agruparon en el mismo clado que las muestras de G. americanum confirmadas por Perrone et al. (2019), incluyendo el holotipo procedente de Jamaica y muestras brasileñas, Se ubicaron como grupo hermano de G. calidumJamas, Iha & Fujii (Figs. 3, 4), especie descrita por Jamas et al. (2017) para Pernambuco, Brasil. Las distancias genéticas intraespecíficas de los especímenes de Tabasco fueron 0-0.01% para rbcL y 0-0.02% en COI-5P. La distancia genética entre los especímenes de la laguna Mecoacán y los de G. americanum de GenBank fue de 0.6% con COI-5P y 0% para rbcL. Comparando con las muestras de G. calidum, la distancia fue 3.2-3.4% con COI-5P y 0.9% en el caso de rbcL. Con el resto de las especies de Gelidium los valores oscilaron entre 5.8 y 13.6% en COI-5P y 1.1-10% en rbcL.
Discusión
En el presente trabajo se confirma taxonómicamente la identidad de tres especímenes identificados previamente como G. americanum para las costas de Tabasco, México, empleando herramientas morfológicas y moleculares. Los especímenes analizados en este estudio presentan pocas diferencias con respecto a los caracteres morfológicos de los talos descritos por otros autores (Taylor, 1943; Santelices, 1976; Perrone et al., 2019). Las principales corresponden a los intervalos en longitud y ancho de los talos: en los ejemplares de Gelidium americanum estudiados tienen de 2-4 cm de longitud y 1-2 mm de ancho, mientras que en trabajos previos fueron de 0.5-6 cm de longitud y 0.4-2 mm de ancho (Taylor, 1943; Santelices, 1976; Perrone et al., 2019).
La distribución de las células medulares y la cantidad de filamentos rizoidales internos es otra diferencia; también el arreglo de las células medulares. En publicaciones previas se registraron células medulares sin un arreglo aparente, mientras que en el presente trabajo se observaron dispuestas en tres hileras. Además, los filamentos rizoidales internos se han reportado como escasos alrededor de la médula (Taylor, 1943; Perrone et al., 2019), pero en este estudio realizado fueron abundantes. Las diferencias morfológicas observadas en estos especímenes con respecto a las descritas anteriormente (Taylor, 1943; Santelices, 1976; Perrone et al., 2019) podrían relacionarse con la presencia de G. americanum en un ambiente con características distintas a aquellas en las que habitualmente se encuentra.
Con el presente estudio, además de confirmar la identidad taxonómica de los especímenes recolectados, que se ubicaron en el mismo clado que el holotipo de G. americanum, es posible demostrar su cercanía filogenética con G. crinale (Hare ex Turner) Gaillon y G. calidum tal como señalaron Perrone et al. (2019). Tanto G. calidum, como G. crinale se distribuyen, al igual que G. americanum, en el océano Atlántico (Jamas et al., 2017; Perrone et al., 2019) y hasta el momento únicamente los últimos dos taxones se han registrado en las costas del Golfo de México y Caribe mexicano. Gelidium calidum es una especie descrita recientemente, cuya distribución está restringida a Brasil (Jamas et al., 2017), no se descarta que se encuentre en el Atlántico mexicano, por lo que era de suma importancia conocer la relación filogenética entre los ejemplares analizados y G. calidum.
Los valores de divergencias de nucleótidos para ambos marcadores a nivel intra e interespecífico coinciden con los indicados previamente en Gelidiales y otras algas rojas (Boo et al., 2016a, b; Jamas et al., 2017; Boo y Hughey, 2019; Brunelli et al., 2019a, b; Perrone et al., 2019; Boo y Kim, 2020; Quiroz-González et al., 2020).
En el Golfo de México y Mar Caribe G. americanum ha sido registrada con frecuencia en localidades litorales, intermareales y lagunas costeras (Ramírez, 1996; Mendoza-González et al., 2017; Quiroz-González et al., 2018). Sin embargo, su condición tolerante a cambios de salinidad no se ha reconocido abiertamente como en otras especies de Gelidium: G. amansii (J.V. Lamouroux) J.V. Lamouroux, G. coulteri Harvey y G. floridanum W.R. Taylor. En ellas se ha evaluado el impacto de los cambios de salinidad en su fisiología y reproducción (Macler, 1988; Fralick et al., 1990; Filipin et al., 2016). La presencia de especímenes de G. americanum en época de lluvias en la laguna Mecoacán podría sugerir que es una especie eurihalina, ya que está sometida a cambios drásticos en los valores de salinidad a largo del año, fluctuaciones que han sido previamente registradas en este sitio (Domínguez et al., 2003). Por lo anterior, es importante plantear estudios futuros que evalúen el impacto real de los cambios de salinidad en la laguna Mecoacán para G. americanum. Además, las especies del género Gelidium se encuentran por lo general en sustrato rocoso, a menudo en costras coralinas, características ecológicas distintas a las que se observaron en el sitio donde se recolectaron los especímenes analizados, ya que estaban adheridos a bloques de concreto, sobre conchas de Crassostrea virginica y a escasa profundidad.
Otro factor que es muy importante para el desarrollo y crecimiento de Gelidium es el hidrodinamismo, pues los miembros de este género han sido asociados con movimiento rápido del agua y se han registrado en sitios expuestos, con cambios importantes en la marea (Santelices, 1988; 1991). Algunas excepciones son los especímenes localizados en zonas templadas, donde especies como G. pusillum (Stackhouse) Le Jolis y G. spinosum (S.G. Gmelin) P.C. Silva se han encontrado en sitios fangosos, protegidos y con movimiento de agua muy ligero (Santelices, 1988). Las muestras analizadas en el presente trabajo se encontraron en zonas sin flujo importante de agua, en sitios protegidos, lo que coincide con lo señalado anteriormente, pero a diferencia de lo que se indica para otras especies, las de este estudio están en una zona con clima tropical. La variación en talla con respecto a otros registros podría deberse a la falta de flujo en el agua, ya que como han señalado otros autores (Anderson y Charters, 1982; Pacheco-Ruíz y Zertuche-González, 1995), este factor influye directamente en el crecimiento del talo de Gelidium.
A pesar de encontrarse en condiciones ambientales distintas a las que se describen comúnmente para el crecimiento de Gelidium, es posible confirmar la presencia de G. americanum en la laguna Mecoacán, Tabasco, México, gracias a las evidencias morfológicas y moleculares aquí presentadas. Este trabajo contribuye además con las primeras secuencias de esta especie provenientes de material de poblaciones mexicanas. Resulta fundamental seguir trabajando en la identificación molecular y morfológica de especies mexicanas de Gelidium, sobre todo en ambientes tan particulares como las lagunas costeras.











 nueva página del texto (beta)
nueva página del texto (beta)




